Introducción
La enfermedad de Alzheimer (EA) es un desorden neurodegenerativo y la causa más común de demencia. Sus principales características patológicas son la presencia de placas extracelulares de péptidos amiloide-β (Aβ), formas intracelulares hiperfosforiladas de la proteína tau que integran marañas neurofibrilares, acompañadas de pérdida sináptica y neuronal.1
La mayor parte de los casos de la EA, entre 95 y 99 %, se presenta de forma esporádica, mientras que de 1 a 5 % es hereditario.2 Dada la frecuencia con que se presentan las dos formas, esta revisión se centra en la EA esporádica, la cual se desarrolla en adultos mayores de 65 años, aunque los principales procesos patológicos comienzan décadas antes de que sea posible determinarlos clínicamente.3,4 El diagnóstico definitivo de la EA se realiza post mortem, sin embargo, en los últimos años se ha avanzado en el descubrimiento de marcadores que se detectan mediante diversos recursos, que van desde la tomografía por emisión de positrones y resonancia magnética, hasta la identificación de moléculas asociadas a la patología a través de técnicas como el SIMOA™ (inmunoensayo similar a ELISA, pero de mayor sensibilidad), tanto en líquido cefalorraquídeo como en plasma, además de la aplicación de nuevas pruebas neuropsicológicas, que en conjunto buscan diagnosticar la enfermedad antes de que se presenten los síntomas característicos de las etapas tardías de la misma y así lograr una intervención terapéutica exitosa.
Finalmente, esta revisión busca analizar los próximos retos de la enfermedad y la manera de abordarlos como sociedad, tomando en consideración lo que actualmente se está haciendo en México.
Etiología y factores de riesgo
El análisis de las principales lesiones histopatológicas de la EA ha permitido conocer y estudiar tanto a la proteína tau como al péptido Aβ. Dicho análisis favoreció la generación de diversas hipótesis acerca de la etiología de la enfermedad, que postulan a estas moléculas como los actores principales. Sin embargo, en los últimos años se ha reportado la alteración de diversos procesos, que indican que las alteraciones de la proteína tau y del péptido Aβ constituyen consecuencias más que causas de la enfermedad. Algunas de estas hipótesis son la hipótesis de la cascada amiloide,5 de la hiperfosforilación de tau,6 de la cascada mitocondrial7,8 y de la EA.9 Como muchas otras patologías crónicas, la EA es multifactorial, es decir, no solo puede atribuirse a un factor de riesgo, sino que existen múltiples factores, la mayoría de los cuales corresponden al desarrollo de la EA esporádica. En la Tabla 1 se describen los factores de riesgos más relevantes en la actualidad para el desarrollo de la EA.
Tabla 1 Factores de riesgo de la enfermedad de Alzheimer, su relación, afectaciones y interacciones con el desarrollo de la patología
| Factor de riesgo | Relación con la EA | Afectaciones o interacciones con la EA |
|---|---|---|
| Genético | Las mutaciones en los genes APP, PSEN1 y PSEN2 favorecen la aparición temprana de la EA y los polimorfismos en el gen APOE (alelo e4) se pueden asociar a la aparición tardía de la EA. | La mayoría de las mutaciones en APP y PSEN1-2 provocan aumento de la relación Aβ42/Aβ40, que propicia la deposición temprana de Aβ. La presencia de e4 en heterocigosis aumenta tres veces el riesgo de desarrollar EA, mientras que el riesgo aumenta hasta 12 veces en homocigosis. |
| Envejecimiento | Principal factor de riesgo para desarrollar demencia tipo EA esporádica. | En el sistema nervioso central implica reducción en el volumen y peso del cerebro, pérdida de sinapsis y agrandamiento de los ventrículos. |
| Menor educación | El mayor grado educativo alcanzado durante la vida (reserva cognitiva) de un individuo reduce el riesgo de demencia. | Los individuos cuyos trabajos son más exigentes cognitivamente tienden a mostrar menor deterioro cognitivo (aumenta la reserva cognitiva), en comparación con individuos cuyos trabajos son de poca demanda cognitiva. |
| Enfermedades cerebrovasculares | Incrementan el riesgo de demencia. La presencia de enfermedad vascular parenquimatosa se puede encontrar como brotes hemorrágicos e infartos cerebrales en más de 50 % de los pacientes con EA. | Una lesión vascular conduce a una mayor expresión y procesamiento de APP, lo que resulta en aumento del péptido Aβ. El daño a la barrera hematoencefálica produce disminución en la eliminación del Aβ y favorece su acumulación en el sistema nervioso central. |
| Lesión cerebral traumática | Activa el procesamiento de APP y genera Aβ, que se deposita predominantemente en la corteza temporoparietal, el cuerpo calloso y el hipocampo. Una deposición excesiva de Aβ, acompañada de un exceso de marañas neurofibrilares, contribuye al desarrollo de la EA. | Causa aumento de los depósitos de elementos neurodegenerativos en las conexiones sinápticas, acelerado por la actividad proinflamatoria general específica de la depresión u otras condiciones somáticas asociadas al envejecimiento. |
| Hipertensión arterial | La hipertensión puede aumentar el riesgo de desarrollar EA cuando está presente durante la mediana edad e impacta negativamente al rendimiento cognitivo en edades avanzadas | Provoca cambios en las paredes vasculares que pueden conducir a hipoperfusión, isquemia e hipoxia cerebral, contribuyendo a desencadenar el desarrollo de la EA, así como a disfunción en la barrera hematoencefálica, asociada a la génesis de la EA. |
| Obesidad | Cursar con obesidad (aumento del índice de masa corporal) se asocia a riesgo de padecer demencia. | Una masa corporal mayor en edades tempranas al desarrollo de la enfermedad (etapa preclínica y prodrómica de la demencia) se asocia a mayor riesgo de padecerla. |
| Diabetes | Se asocia a mayor deterioro cognitivo. | La resistencia a la insulina está asociada a la presencia de placas neuríticas en los cerebros de los pacientes con EA. |
| Inactividad física | La actividad física habitual reduce el riesgo de demencia en adultos mayores. | Los niveles más altos de actividad física se asocian a una reducción de 14 a 21 % en el riesgo de padecer demencia. |
| Depresión | Asociada a la incidencia de demencia, con una variedad de posibles mecanismos psicológicos y fisiológicos. | Forma parte de la etapa prodrómica y de las primeras etapas de la demencia. |
| Aislamiento social | Un menor contacto social aumenta el riesgo de desarrollar demencia. | Puede ocurrir también como parte de la etapa prodrómica de la demencia. Aumento significativo de estrés y ansiedad. |
| Tabaquismo y alcoholismo | Los fumadores presentan mayor riesgo de desarrollar demencia que los no fumadores, y mayor riesgo de muerte prematura. El consumo en exceso de alcohol se ha relacionado con mayor riesgo de desarrollar demencia tipo EA. | La exposición pasiva al humo puede causar un mayor deterioro de la memoria. El consumo de alcohol en exceso puede dañar las neuronas, contribuyendo al desarrollo de la demencia tipo EA. |
| Infecciones (COVID-19) | Pueden provocar efectos negativos a largo plazo sobre la función cognitiva, especialmente después de un fuerte proceso inflamatorio sistémico. | La transferencia trans-sináptica y el movimiento axonal retrógrado o anterógrado de SARS-CoV-2 hacen posible que el virus se difunda por todo el cerebro, promoviendo inflamación, cronicidad y cambios neurodegenerativos meses y años después de la infección aguda, por lo que puede causar déficits cognitivos y síntomas neuropsiquiátricos. En Estados Unidos, las muertes por EA y demencia han aumentado en 16 % durante la pandemia de COVID-19 |
EA: enfermedad de Alzheimer.
Diagnóstico de la enfermedad y uso de biomarcadores
El diagnóstico es una de las partes cruciales de la EA, ya que no existe una prueba diagnóstica única, siendo la evaluación post mortem el único diagnóstico confirmatorio disponible.10 Dado lo anterior, resulta importante el diagnóstico temprano que permita a los pacientes realizar cambios en el estilo de vida (relacionados con los factores de riesgo) que les ayude a preservar su calidad de vida y su independencia por mayor tiempo.11
La EA ocurre a lo largo de un espectro de gravedad, por lo que se necesita estandarizar criterios clínicos y fisiológicos que reflejen la progresión de los síntomas, desde las formas más leves hasta las más graves de la enfermedad. Los biomarcadores que son parte de estos criterios pueden clasificarse de la siguiente forma (Figura 1):12
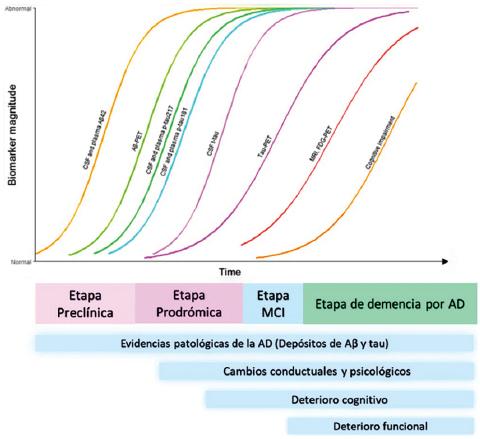
Figura 1 Asociación de la progresión clínica de la enfermedad de Alzheimer con los biomarcadores diagnósticos. La imagen original12 fue adaptada con permiso, siguiendo los lineamientos de la licencia Creative Commons que se declara en el artículo donde aparece la misma.
– Biomarcadores presentes en fluidos (Aβ1-42 y relación Aβ42/40, tau total, p-tau181, p-tau231 y p-tau217 y neurofilamento), todos detectados por ELISA-SIMOA.
– Marcadores de imagen, como resonancia magnética, tomografía por emisión de positrones con fluorodesoxiglucosa (FDG-PET, PET-Aβ, PET-tau).
– Marcadores cognitivos, determinados con Mini Examen del Estado Mental (MMSE), evaluación cognitiva de Montreal (MoCA), Examen Gerocognitivo Autoadministrado (SAGE), Batería de Detección Cognitiva Breve (BCSB) o Escala de Manifestaciones Relevantes para la Enfermedad de Alzheimer (ROSA).
Tratamientos emergentes contra la EA
No existe tratamiento que pueda curar la EA, por lo que las estrategias terapéuticas pretenden disminuir el ritmo con el que se desarrolla la demencia o evitar su aparición.
En la actualidad, se intenta un manejo multifactorial de la EA basado en los siguientes componentes: comunicación abierta entre el médico, el cuidador y el paciente, que ofrece una identificación oportuna de los síntomas, una evaluación y un diagnóstico exactos; así como orientación adecuada, con enfoque sobre el comportamiento, planificación oportuna de las decisiones y necesidades legales y médicas,13 terapia cognitiva-conductual,14,15 apoyo al cuidador-familiar y fomento al desarrollo de redes de apoyo para los cuidadores.13
Como parte del manejo se han propuesto fármacos que aún se encuentran en fase clínica, de los cuales la mayoría (82.5 %) se dirige a la biología subyacente de la EA con la intención de modificar la enfermedad (DMT, disease modifying treatments); 10.3 % son agentes potenciadores cognitivos putativos y 7.1 %, fármacos destinados a reducir los síntomas neuropsiquiátricos. De los DMT, 15.4 % tiene como objetivo principal el péptido Aβ y 10.6 %, la proteína tau. En todas las fases, los DMT comprenden 29.8 % de terapias biológicas y 70.2 % de terapias farmacológicas16 (Figura 2).17

Figura 2 A: características histopatológicas de la enfermedad de Alzheimer. Izquierda: representación esquemática de la acumulación patológica de la proteína tau en marañas neurofibrilares (NFT, neurofibrillary tangles) y de los péptidos Aβ en las placas extracelulares dentro del microambiente neuronal. Derecha: imagen de dos inmunofluorescencias con marcaje doble con anticuerpo ptau (verde) y tinción con rojo tiazina (rojo) a una placa neurítica clásica (arriba), en la que se asocia una placa fibrilar amiloide (Aβ), reconocida por el rojo de tiazina, con neuritas distróficas (flechas) y una maraña neurofibrilar (abajo) fuertemente marcada por el anticuerpo anti-ptau y colocalizada con dicho colorante. La imagen original de la publicación de Luna Muñoz J et al.17 fue adaptada con permiso, siguiendo los lineamientos de la licencia Creative Commons 3.0 declarada en la misma. B: dianas terapéuticas de los tratamientos en ensayos clínicos. Incluye el nombre del tratamiento y el número identificador de clinicatrials.gov del NIH. Imagen creada con BioRender.com.
Mención especial merece aducanumab (Aduhelm® de Biogen), un anticuerpo monoclonal dirigido contra el péptido Aβ. Su aprobación de emergencia fue condicionada a la realización de un cuarto ensayo clínico que evidenciara resultados sobre su efecto benéfico; dicha aprobación se “aceleró” por los resultados en la reducción de las placas amiloides observadas en pacientes tratados con el anticuerpo, además de la urgente necesidad de medicamentos con mecanismos modificadores de la EA.18,19 No obstante, dicha inmunoterapia ha mostrado un discreto efecto en evitar el declive cognitivo en los pacientes, lo que podría deberse a que los oligómeros solubles son más tóxicos que las placas extracelulares, además de causar neurodegeneración.20,21 Por otro lado, suprimir sin discreción a Aβ podría causar microhemorragias, ya que el Aβ también se encuentra en las células endoteliales, lo que puede dar lugar a encefalitis graves, de las cuales existen reportes durante los ensayos clínicos de este tipo de anticuerpos dirigidos a Aβ. Además, reducir el Aβ puede afectar la plasticidad sináptica y la memoria.22 Finalmente, la administración intravenosa del tratamiento puede afectar al Aβ generado fuera del sistema nervioso central, interfiriendo con otros procesos fisiológicos.23 Aún no está claro si este fármaco es realmente eficaz y representa un beneficio para los pacientes, pero la aprobación de aducanumab representa una ventana para probar la eficacia de terapias dirigidas contra otros blancos, como la reducción de acúmulos de la proteína tau hiperfosforilada, ya que el almacenamiento de proteína tau patológica tiene una mejor correlación con el deterioro cognitivo que el de Aβ.
Situación de la enfermedad de Alzheimer en México
Hasta 2020, se estimaba que había más de 50 millones de personas que vivían con demencia en el mundo. Se prevé que el número de personas afectadas se duplique cada 20 años, llegando a 82 millones en 2030 y 152 millones en 2050, con mayor incidencia en países de bajos y de medianos ingresos. El 60 % de las personas con demencia vive en estos países, pero para 2050 esta cifra aumentará a 71 %.24 Por otro lado, hay más de 10 millones de casos nuevos de demencia cada año en todo el mundo, lo que implica un caso nuevo cada 3.2 segundos;24 la EA representa entre 60 y 70 % de los casos.25 La incidencia de la EA en México en 2015 se estimaba en 860 000 casos, con un promedio de 25.55 por cada 1000 personas/año de individuos identificados, con una prevalencia de 7.3 %. Se espera que este número alcance los 3.5 millones de personas en los próximos 35 años.26
La tasa de mortalidad por causa de la demencia tipo EA también va en aumento; las muertes por la EA pasaron a 65.12 por cada 1000 mujeres y 43.66 por cada 1000 hombres en cinco años (2010-2014); el grupo de edad con mayor tasa de mortalidad por esta causa fueron los adultos mayores de 80 años, con 0.29 por cada 100 000 habitantes en el periodo 1980-1984 y 55.02 por cada 100 000 habitantes en el periodo 2010-2014.27 Sumado a lo anterior, debido a la pandemia por COVID-19 se prevé un aumento en el número de casos de demencia y muerte por EA, ya que es un factor de riesgo para desarrollarla. Al respecto, en Estados Unidos, las muertes por EA y demencia han aumentado en 16 % durante la pandemia de COVID-19.28
Referente a la investigación realizada en México respecto a la EA, 31 % de los artículos generados en instituciones, ya sea públicas o privadas, pertenece a la Universidad Nacional Autónoma de México, 25 % a los Institutos de Salud, 16 % a universidades estatales, 12 % al CINVESTAV-IPN y el resto (16 %) a diferentes instituciones ubicadas por todo el país.
Conclusiones
La EA es una patología neurodegenerativa multifactorial compleja de la cual aún no conocemos con certeza su etiología. Se han efectuado grandes avances a partir de la propuesta de diferentes teorías acerca de los mecanismos involucrados en su origen, sus posibles causas, información acerca del inicio de las etapas subclínicas y de la relación con otras enfermedades, que en conjunto contribuyen a entender con mayor precisión el proceso patológico; sin embargo, aún queda pendiente el desarrollo de métodos diagnósticos y tratamientos efectivos.
Respecto a Latinoamérica, se han estandarizado pruebas cognitivas con el fin de facilitar el diagnóstico.29-31 En este sentido, la región cuenta con una considerable proporción de población que está envejeciendo, existe desigualdad de ingresos, además de un déficit en el acceso a la salud, con una escasa disponibilidad de pruebas diagnósticas de imagenología o análisis de fluidos para lograr un diagnóstico certero de enfermedades neurodegenerativas como la EA, cuya prevalencia se estima crecerá en los próximos años.
Por lo anterior, se requieren herramientas diagnósticas de fácil acceso. Un ejemplo de ello serían los biomarcadores detectados en sangre periférica, ya que implican una toma de muestra poco invasiva y el procesamiento en instalaciones menos especializadas, además de que es posible mejorar su sensibilidad y especificidad al realizarse conjuntamente con pruebas cognitivas, lo cual abre la posibilidad de detectar a pacientes en estadios más tempranos, para posteriormente llevar a cabo un manejo que va desde aspectos cognitivo-conductuales hasta farmacológicos y de control de otras patologías, con lo que disminuiría el ritmo con el que se desarrolla la demencia o se evitaría su aparición.
Respecto al manejo de la EA, México tiene una guía de diagnóstico y tratamiento basada en las recomendaciones de la Asociación Internacional de Alzheimer. Además, existe un Plan de Acción Alzheimer y otras Demencias, cuyas directrices incluyen el seguimiento de los pacientes, actividades de prevención, capacitación para los cuidadores y concientización sobre la EA. Sin embargo, los esfuerzos por cumplir las directrices de este plan se quedan a nivel regional, por lo que es necesaria la unificación de los esfuerzos locales para abarcar el territorio nacional en beneficio de los pacientes diagnosticados y de quienes se encuentran en riesgo de desarrollar EA.
Referente al trabajo de investigación realizado en México sobre la EA, existen instituciones que trabajan tanto a nivel clínico como básico, sin embargo, son pocas y aisladas, por lo que la unificación entre el área básica y el área clínica es escasa, además de que la falta de comunicación y de una red de colaboración interinstitucional realmente fuerte impide satisfacer la necesidad del paciente, el cual es el principal afectado.
Actualmente se busca un diagnóstico temprano de la EA, así como tratamientos efectivos, por lo que proponemos trasladar esta perspectiva a la población mexicana, basándonos no solo en lo reportado en poblaciones caucásicas, si no en las necesidades y características de la población mexicana, lo que implica construir conocimiento propio y a partir de allí lograr un manejo de la enfermedad antes de que los sistemas de salud sean rebasados por el número de pacientes que pudieron ser atendidos a tiempo.











 nueva página del texto (beta)
nueva página del texto (beta)


