Introducción
El cáncer cervicouterino (CaCU) y sus lesiones precursoras constituyen un serio problema de salud pública en el mundo.1 En México, el CaCU sigue siendo letal; en 2020, se reportaron 9439 nuevos casos y cerca de 5000 muertes.2 Si bien hay decremento importante en su incidencia de una década a otra, es un problema que está lejos de solucionarse.
El factor de riesgo más importante para el desarrollo del CaCU es la infección persistente por los virus de papiloma humano (VPH) de alto poder oncogénico, como el VPH 16 y el VPH 18.3 Asimismo, la prevalencia de los diferentes genotipos de VPH varía dependiendo de la severidad de la lesión y región geográfica. Diversos análisis epidemiológicos en el mundo describen que entre las mujeres con citología normal, la prevalencia osciló entre 8 y 9 % en Asia y Europa y fue > 20 % en África, el continente americano y Oceanía.4
Por otro lado, en el noreste de México, los tipos 59, 52 y 16 son los más frecuentes; en el sureste, los tipos 16 y 18; y en el occidente, 16, 18 y 58.5-7 Así, el panorama del VPH en México es tan diverso como la población misma. Si bien hay regiones con prevalencia similar a la mundial, existen poblaciones en las que se encuentran genotipos no comunes,5-8 lo cual indica que México cuenta con un mosaico genotípico variado de VPH.
Con la intención de fortalecer la literatura nacional respecto a la prevalencia de VPH, en un estudio piloto en primer nivel de atención se investigó la genotipificación de VPH en lesiones cervicales de bajo y alto grado, y su correlación con los factores sociodemográficos en mujeres del Bajío mexicano con diagnóstico citológico de lesión.
Métodos
El presente es un estudio piloto exploratorio transversal de casos consecutivos durante 2015, el cual fue aprobado por el comité local de investigación del Hospital General León, Guanajuato, con número GTSSA002101-300. La toma de muestras se llevó a cabo en la Clínica de Displasias del hospital, después de la firma del consentimiento informado por parte de las pacientes. En total se colectaron 100 raspados cervicales realizados con un cepillo cervical, de pacientes que fueron referidas de su centro de salud con diagnóstico presuntivo de lesión de bajo grado (LBG) o lesiones de alto grado (LAG) para realización de colposcopia y confirmar el diagnóstico; al término se les aplicó un cuestionario sobre características sociodemográficas y factores de riesgo. Las muestras se colocaron en solución salina en hielo para su transporte. El diagnóstico histológico del patólogo se tomó en cuenta para analizar los datos.
Extracción y purificación del ADN
De los raspados cervicales se extrajo el ADN. Para comprobar la calidad, se realizó la amplificación por PCR en punto final de un fragmento de 110 pares de bases (pb) del gen betaglobina, utilizando los oligonucleótidos PCO3 (5’-ACA CAA CTG TGT TCA CTA GC-3’) y PCO4 (5´-CAA CTT CAT CCA CGT TCA CC-3´). Los casos positivos fueron sujetos a PCR para la amplificación de un fragmento de 150 pb del gen L1/VPH, para lo cual se utilizaron los oligonucleótidos GPs.9 Conforme a estos criterios, 10 muestras fueron eliminadas.
Genotipificación de VPH
Para la genotipificación de los VPH se utilizó el microarreglo CLART HPV2® (Genómica, Madrid, España) de baja densidad, para lo cual se empleó la hibridación por fragmentos de PCR de L1/VPH específicos de 35 genotipos, con sensibilidad analítica calibrada con copias conocidas de plásmidos clonados como controles internos.
Se utilizaron 200 ng de ADN purificado para la amplificación de PCR. Durante la amplificación, los fragmentos fueron marcados con dUTP-biotina. Para la hibridación sobre el microarreglo, los productos de PCR (10 sμL) se usaron siguiendo las especificaciones del productor. Para la visualización de las hibridaciones entre los blancos y sus sondas específicas sobre el microarreglo, se procedió al desarrollo de color agregando el conjugado de estreptavidina-peroxidasa, y su reacción con peróxido de hidrógeno/diaminobencidina tetrahidroclorada, lo que genera un precipitado insoluble. La señal del precipitado se analizó en el Clinical Array Reader (CAR®, Genómica, Madrid, España), el cual genera un reporte escrito. Los controles positivos y negativos presentes en el microarreglo se encuentran por duplicado y aseguran la correcta reacción de hibridación.
Análisis de los datos
Se calcularon los porcentajes y las frecuencias de los datos clínicos. Las tablas de contingencia de infecciones múltiples de VPH y su relación con las variables epidemiológicas se analizaron mediante la prueba de chi cuadrada y la prueba de Fisher, con intervalos de confianza de 95 %. Se consideró significativo un valor de p < 0.05.
Resultados
Las pacientes participantes pertenecen a la región del Bajío noroccidental, en el estado de Guanajuato (zona centro de México). Previo al análisis de las muestras, se eliminaron 10 por ser negativas para la amplificación del gen constitutivo de la betaglobina.
En la Tabla 1 se resumen las características demográficas y los factores de riesgo de las pacientes en estudio. Llamó la atención el inicio temprano de la vida sexual, las múltiples parejas sexuales y el número de embarazos; 62 % (56/90) presentó algún grado de lesión epitelial, 83 % con LBG (47/56) y 16 % con LAG y una paciente con diagnóstico de CaCU epidermoide.
Tabla 1 Frecuencia de factores de riesgo para cáncer cervicouterino según la Norma Oficial Mexicana10 de acuerdo con la presencia o ausencia de lesión, infección por virus de papiloma humano, infecciones únicas y múltiples
| Factor de riesgo | Sin lesión (n = 34) | Con lesión (n = 56) | VPH− (n = 36) | VPH+ (n = 54) | Infección única (n = 23) | Infección múltiple (n = 31) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |
| 25-64 años | 23 | 68 | 45 | 80.4 | 27 | 75 | 41 | 76 | 20 | 87 | 21 | 68 |
| Bajo nivel educativo | 33 | 97 | 54 | 96.4 | 34 | 94 | 53 | 98 | 22 | 96 | 31 | 100 |
| Ingreso < $2000 | 19 | 56 | 37 | 66.1 | 21 | 58 | 35 | 65 | 16 | 70 | 19 | 61 |
| Menarca temprana | 1 | 3 | 5 | 9 | 2 | 6 | 4 | 7 | 1 | 4 | 3 | 10 |
| IVSA < 18 años | 17 | 50 | 34 | 61 | 20 | 56 | 31 | 57 | 13 | 57 | 18 | 58 |
| MPS | 23 | 68 | 43 | 77 | 11 | 31 | 41 | 76 | 13 | 57 | 28 | 90 |
| ACO | 4 | 12 | 19 | 34 | 10 | 28 | 13 | 24 | 3 | 13 | 10 | 32 |
| Multiparidad | 25 | 74 | 43 | 77 | 8 | 22 | 40 | 74 | 22 | 96 | 18 | 58 |
| No pap previos | 13 | 38 | 24 | 43 | 24 | 67 | 29 | 54 | 12 | 52 | 13 | 42 |
| < 5 citologías | 25 | 74 | 44 | 79 | 25 | 70 | 44 | 82 | 21 | 91 | 23 | 74 |
| ITS previas | 1 | 3 | 2 | 4 | 1 | 9 | 2 | 4 | 0 | 0 | 2 | 7 |
| Tabaquismo | 19 | 56 | 319 | 4 | 18 | 50 | 20 | 37 | 7 | 30 | 13 | 42 |
| Cáncer familiar | 2 | 6 | 2 | 4 | 2 | 6 | 2 | 4 | 0 | 0 | 2 | 7 |
| Infección por VPH | 15 | 44 | 39 | 70 | 0 | 0 | 54 | 100 | 23 | 100 | 31 | 100 |
ACO: anticoncepción oral; pap: papanicolaou; ITS: infección de transmisión sexual; IVSA: inicio de vida sexual activa; MPS: múltiples parejas sexuales; VPH: virus del papiloma humano; VPH−: virus de papiloma humano negativo; VPH+: virus de papiloma humano positivo.
Detección de secuencias de VPH y genotipificación
Presentaron VPH, 54/90 (60 %) muestras; de estas, 15 (28 %) no presentaron lesión, 34 LBG y cuatro LAG.
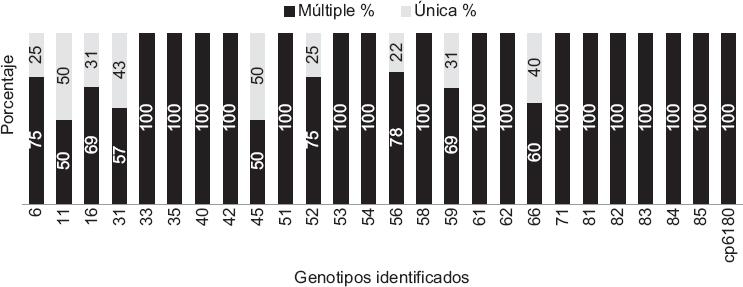
La Figura 1 muestra los genotipos virales identificados; se observó equitativamente VPH de bajo y alto poder (48 % versus 52 %), entre los cuales, el 59 fue el más frecuente, seguido por 31, 16 y 51 y escasa presencia de los genotipos 6 y 61. La paciente con CaCU presentó VPH 45. Interesantemente no se detectó VPH 18.
Con el objetivo de conocer la probabilidad para el desarrollo de lesiones de los diferentes genotipos de VPH más frecuentemente encontrados, se calcularon las razones de prevalencia.
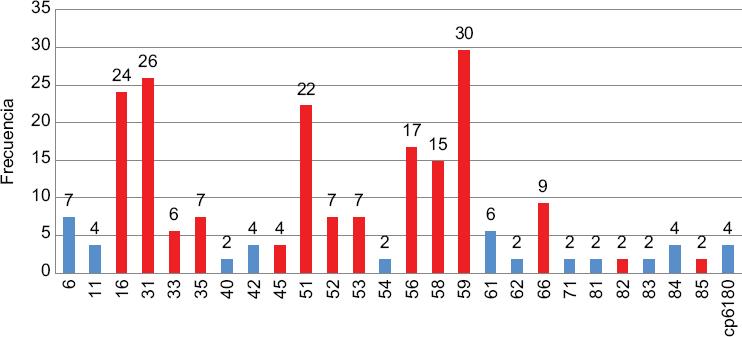
Figura 1 Frecuencias de genotipos del virus del papiloma humano (VPH) de bajo y alto poder oncogénico en mujeres de León, Guanajuato, México. Barras en color rojo los VPH de alto poder, las barras azules los VPH de bajo poder.
Se observó que el VPH 59 presentó PR = 1.01 para el desarrollo de una infección por VPH, y 0.73 para LBG, lo que sugiere una baja actividad transformante. Por el contrario, el VPH 51 presentó PR= 3.03 y PR = 1.98 y 1.87 para LBG y LAG, respectivamente, lo que sugiere que este genotipo tiene una actividad transformante mayor. En nuestra población, el VPH 31 mostró también mayor actividad oncogénica (PR = 7.89), aún mayor que el VPH 16 (PR = 0.97), como se describe en la Tabla 2.
Tabla 2 Prevalencia relativa de los virus de papiloma humano de alto poder oncogénico en muestras cervicales de mujeres del Bajío, Guanajuato
| VPH | Grupo alfa | Sin lesión | LBG | PR LBG/SL | LAG | PR LAG/SL | PR | Total | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | ||||||
| 16 | 9 | 5 | 33 | 6 | 18 | 0.52 | 2 | 50 | 1.5 | 1.06 | 13 |
| 31 | 9 | 1 | 6 | 11 | 32 | 4.85 | 2 | 50 | 7.5 | 8.66 | 14 |
| 33 | 9 | 2 | 13 | 1 | 3 | 0.22 | 0 | 0 | 0 | 0.33 | 3 |
| 35 | 9 | 2 | 13 | 1 | 3 | 0.22 | 1 | 20 | 1.87 | 0.66 | 4 |
| 45 | 7 | 1 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0.66 | 2 |
| 51 | 5 | 2 | 13 | 9 | 26 | 1.98 | 1 | 20 | 1.87 | 3.33 | 12 |
| 52 | 9 | 2 | 13 | 1 | 3 | 0.22 | 1 | 20 | 1.87 | 0.66 | 4 |
| 53 | 6 | 1 | 6 | 2 | 6 | 0.88 | 1 | 20 | 3.75 | 2.00 | 4 |
| 56 | 6 | 2 | 13 | 7 | 21 | 1.54 | 0 | 0 | 0 | 2.33 | 9 |
| 58 | 9 | 2 | 13 | 6 | 18 | 1.32 | 0 | 0 | 0 | 2.00 | 8 |
| 59 | 7 | 6 | 40 | 10 | 29 | 0.73 | 0 | 0 | 0 | 1.11 | 16 |
| 66 | 6 | 2 | 13 | 3 | 9 | 0.66 | 0 | 0 | 0 | 1.00 | 5 |
| 82 | 5 | 0 | 0 | 1 | 3 | 0 | 0 | 0 | 0 | 0 | 1 |
| 85 | 7 | 0 | 0 | 0 | 0 | 0 | 1 | 20 | 0 | 0 | 1 |
LAG: lesión intraepitelial de alto grado; LBG: lesión intraepitelial de bajo grado; PR: relación de prevalencia para el desarrollo de infección; SL: sin lesión. Intervalo de confianza a 95 %.
Infecciones múltiples de VPH
Durante el análisis se observaron infecciones múltiples en 57 % (31/54) de las muestras; de estas, 9/31 correspondieron a pacientes sin lesión, 19 a pacientes con LBG y dos a mujeres con LAG (Figura 2).
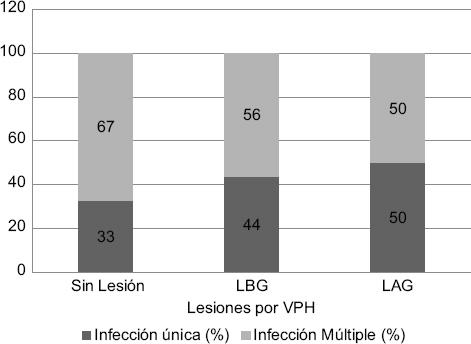
Figura 2 Distribución de los genotipos del virus del papiloma humano en infecciones únicas y múltiples. VPH: virus del papiloma humano; LBG: lesión escamosa intraepitelial de bajo grado; LAG: lesión escamosa intraepitelial de alto grado.
En general se observó una tendencia a que el VPH 51 (grupo filogenético α-5) y el VPH 59 (α-7) se asocien mayoritariamente a los VPH α-9 (VPH 16, 31, 33 y 58), y en menor porcentaje a α-6 (VPH 53 y 56). Un hecho interesante fue que el VPH 51 siempre estuvo presente en las infecciones múltiples. El VPH 59 se encontró en su mayoría en infecciones múltiples (11/16), con una frecuencia similar al VPH 16; en tanto, el VPH 31 se encontró en infecciones únicas y múltiples (7/13 versus 6/13). Además, se encontró que las infecciones múltiples se asocian nuevamente a múltiples parejas sexuales (p = 0.0040) y multiparidad (p = 0.0019), como se observa en la Figura 3 y la Tabla 3.
Tabla 3 Análisis de factores de riesgo en infecciones únicas y múltiples por virus del papiloma humano
| Factor de riesgo | Infección única (n = 23) | Infección múltiple (n = 31) | χ2 | p | PR (IC 95 %) |
|---|---|---|---|---|---|
| MPS | 13 | 28 | 8.253 | 0.004069* | 2.95 |
| ACO | 3 | 10 | 2.667 | 0.102451 | 1.5 |
| Menarca temprana | 1 | 3 | 0.546 | 0.495962 | 1.33 |
| Tabaquismo | 7 | 13 | 0.749 | 0.386251 | 1.22 |
| ITS previas | 1 | 2 | 0.111 | 0.735858 | 1.17 |
| Cáncer familiar | 1 | 2 | 0.111 | 0.735858 | 1.17 |
| Bajo nivel educativo | 22 | 30 | 0.047 | 0.829076 | 1.15 |
| IVSA antes 18 años | 13 | 18 | 0.013 | 0.909737 | 1.02 |
| Ingreso < $2000 | 16 | 19 | 0.396 | 0.528929 | 0.85 |
| No pap previos | 12 | 13 | 0.557 | 0.455981 | 0.83 |
| 25-64 años | 20 | 21 | 2.667 | 0.102451 | 0.66 |
| < 5 citologías previas | 21 | 23 | 2.562 | 0.109463 | 0.65 |
| Multiparidad | 22 | 18 | 9.713 | 0.001829* | 0.48 |
ACO: anticoncepción oral; ITS: infección de transmisión sexual; IVSA: inicio de vida sexual activa; MPS: múltiples parejas sexuales; pap: papanicolaou; PR: razón de prevalencia.
*Datos estadísticamente significativos.
Discusión
Durante años, el CaCU (así como sus lesiones precursoras y el VPH) ha persistido como una de las principales causas de morbimortalidad en la mujer mexicana, por lo que es indispensable la generación de conocimiento sobre este problema de salud, la optimización de herramientas óptimas de cribado y el impacto presente y futuro de las vacunas.
Se ha demostrado que la prevalencia de VPH difiere dependiendo de la severidad de la lesión y la región geográfica: en promedio asciende a 12 % en las citologías normales y a 89 % en CaCU.5 Estudios en México reportan que la incidencia de VPH varía de 11 a 16 % en mujeres sanas de la región central, es de 15 % en el caribe mexicano y de 33 a 40 % en el sureste.7,10-13 En el presente trabajo, uno de los primeros realizados en población del Bajío mexicano (región central-occidental), se reporta 28 % de positividad. Estos datos apoyan la gran variabilidad y heterogeneidad en diferentes regiones del país, y la necesidad de nuevos estudios al respecto. Llama la atención que el inicio de la vida sexual activa se presente en menores de edad, así como las múltiples parejas sexuales, lo que apoya los reportes publicados.12
Los datos en México indican que los VPH 16, 18, 31, 39, 51 y 58 son los más frecuentes, con variaciones en provincia.5,6,11,14,15 Este trabajo concuerda parcialmente con lo reportado en la literatura y sería el segundo estudio en el que se describe al VPH 59 como el más frecuente, además de los tipos 31, 16 y 51, lo que apoya resultados previos5,6,8,12,14 y contrasta con los hallazgos de otros informes.6,15 Esta heterogeneidad en el VPH torna aún más compleja la comparación y unificación de los datos. Por ejemplo, las infecciones múltiples son semejantes en población italiana (51 %)16 y del noreste de México,6 pero contrastantes con las de otros análisis,8,17 lo cual destaca dicha diversidad. Los resultados apoyan que los VPH α-9, α-6 y α-7 son los más prevalentes en combinaciones, pero también α-5, α-6, α-8 y α-10.16,17 Resaltan los datos de que el VPH 51 tiende a presentarse en infección múltiple.16 Esto sugeriría que su capacidad asociada a la transformación debe estar en sinergia con otros tipos de VPH. Son indispensable más investigaciones enfocadas a las múltiples infecciones en la transformación de la célula epitelial.
Tres vacunas anti-VPH disponen de licencia para su comercialización en el mundo: una bivalente (VPH 16 y 18), una cuadrivalente (los anteriores + VPH 6 y 11) y una nonavalente (los anteriores + VPH 31, 33, 45, 52 y 58).18,19 La gran heterogeneidad del VPH en México puede impactar en la eficacia de la vacunación como método de prevención primaria. Actualmente, la cobertura de vacunación en México es de 40 %;20 el objetivo es alcanzar una cobertura nacional superior a 70 %, en el que se incluyan niñas de 12 a 16 años.20 Con los genotipos cubiertos, en estos momentos se ofrece una protección aproximada de 30 %, proporción que se incrementaría obviamente con el uso de la vacuna nonavalente, opción poco viable debido a su costo. La meta parece difícil por la situación socioeconómica en la que se encuentra el país, dado que las dosis son de un costo elevado, a lo cual se adiciona la pandemia de COVID-19.
Por lo tanto, en la lucha contra el CaCU y el VPH es necesario fortalecer programas y recursos que favorezcan la implementación de medidas preventivas como la educación sexual y el acceso universal a métodos de cribado, gracias a la investigación biomédica, la innovación e implementación de nuevas técnicas menos invasivas, pruebas de medicina de precisión y acceso universal a la vacunación.
Conclusión
Se identificó pluralidad de los VPH en la población del Bajío mexicano afectada por LBG y LAG, representada principalmente por los tipos 59, 31, 16 y 51. Las infecciones múltiples de VPH en lesiones precursoras resultarían en un evento común con tendencia a su disminución en las LAG, lo que sugiriere la necesidad de medidas más precisas ajustadas al panorama epidemiológico de cada país.











 nueva página del texto (beta)
nueva página del texto (beta)