Introducción
Se han publicado varios estudios sobre la diabetes mellitus (DM) y la serotonina cerebral (5-hidroxitriptamina, 5-HT).1-4 Los resultados apuntan a una disminución de la biosíntesis de la serotonina cerebral, lo que se correlaciona negativamente con disminución de la fracción libre de L-triptófano en plasma5-8 y cerebro,3 junto con la inhibición crónica de la actividad total de la enzima triptófano-5-hidroxilasa (TPH).3,9 La disminución crónica de L-triptófano (L-Trp) en el cerebro y de la actividad de TPH en animales con DM, así como los cambios cinéticos de la TPH, consistentes en un aumento de Km para L-Trp, disminución de Vmáx. y menor capacidad de fosforilación, donde los diversos sistemas de fosforilación son los mecanismos implicados en la baja activación de esta vía metabólica cerebral a causa de la DM.9 La TPH es la enzima limitante de la velocidad de la vía biosintética de la serotonina,10-12 de la cual se han descrito dos isoformas:13,14
Sin embargo, en un estudio reciente, nuestro grupo reportó la presencia de TPH1 en el tallo cerebral de ratas con diabetes, junto con la isoforma TPH2; ambas mostraron una disminución en su expresión en el curso de la DM.20 Por otro lado, las ratas con diabetes sometidas a tratamiento con insulina mostraron recuperación completa del peso corporal, y el L-Trp cerebral también retornó a la normalidad. A pesar de la recuperación física y bioquímica, la actividad total de TPH y la expresión de las isoformas permanecieron disminuidas en el tallo cerebral, junto con una disminución de los niveles de 5-HT durante el estado diabético.20,21
Estos hallazgos tienden a confirmar que, en ratas con diabetes tratadas con insulina, el mecanismo de inhibición de la biosíntesis de la serotonina cerebral puede no deberse únicamente a un cambio relacionado con la concentración de L-Trp. Existe la posibilidad de que el resultado de las alteraciones en el sistema serotoninérgico cerebral durante el estado diabético se deba a cambios en el mecanismo de regulación molecular de la expresión y actividad enzimática secundarios a la diabetes, con la posible participación del sistema molecular regulatorio de Pet-1,22,23 con repercusiones negativas en la biosíntesis y funcionalidad de este importante neurotransmisor.
Considerando los resultados mencionados, la presente investigación se propuso en un intento de obtener más información sobre los mecanismos neurobiológicos implicados en la persistencia de la inhibición crónica de la biosíntesis de 5-HT en el cerebro de ratas con diabetes, e investigar si la expresión de TPH1 y TPH2 y de las neuronas serotoninérgicas permanece disminuida o se normaliza tras la administración de insulina.
Métodos
Se utilizaron 80 ratas macho Wistar, cada una con un peso corporal de 250 ± 10 g, las cuales se mantuvieron durante dos semanas en las siguientes condiciones ambientales: temperatura 22 ± 2 °C, ciclos de luz/oscuridad de 12/12 horas, con ruido y manejo mínimo. Durante dicho periodo de adaptación, los animales fueron alimentados con dieta para roedores (PMI Nutrition International, Brentwood, Missouri, Estados Unidos) y agua ad libitum. Tras este periodo, las ratas se dividieron en los siguientes grupos:
– Grupo con diabetes (D) inducida mediante la administración de 65 mg/kg de peso corporal por vía intramuscular de estreptozotocina (STZ, Sigma Chemical Co., St. Louis, Missouri, Estados Unidos), diluida en solución amortiguadora de citrato de 0.1 M, pH 4.5.
– Grupo control (C).
Además, algunas ratas del grupo C solo recibieron la solución amortiguadora y con ellas se integró el grupo control con el vehículo. Siete días después de la administración de STZ, las ratas con diabetes se dividieron en dos subgrupos:
– Grupo con diabetes tratado con insulina (DTI), de la cual recibieron 10 unidades/kg de peso corporal.
– Grupo que no recibió tratamiento.
Todos los animales siguieron recibiendo el mismo alimento y agua ad libitum. El día 14 después de la administración de STZ, varias ratas de cada grupo se anestesiaron con 40 mg de pentobarbital sódico/kg de peso corporal. A continuación, se perfundieron intracardiacamente con solución salina a 0.9 % y con paraformaldehído (4 %) en solución amortiguadora de fosfato de 0.1 M, pH 7.4. Posteriormente, las ratas fueron sacrificadas y sus tallos cerebrales fueron disecados y colocados en paraformaldehído para su análisis inmunohistoquímico. Además, se obtuvieron otras muestras de tallos cerebrales de ratas de cada grupo, las cuales se congelaron inmediatamente en metilbutano y se mantuvieron a −80 °C para los ensayos de Western blot de ambas isoformas de la TPH y para las determinaciones de L-Trp, 5-HT y actividad total de TPH.
Con el fin de disminuir las variaciones circadianas, la disección del tejido cerebral se realizó siempre entre las 09:00 y 11:00 horas. Las ratas Wistar fueron suministradas por el bioterio del CINVESTAV, Instituto Politécnico Nacional. Todos los experimentos se llevaron a cabo siguiendo los lineamientos internacionales y nacionales para el cuidado de animales de laboratorio. El protocolo fue aprobado con registro 2013-785-050 el 31 de julio de 2013 por los comités de investigación y ética de la Coordinación de Investigación en Salud del Instituto Mexicano del Seguro Social, Ciudad de México, México.
Ensayos bioquímicos
Se utilizó cromatografía líquida de alta resolución (HPLC) para la determinación de 5-HT y L-Trp, siguiendo el método de Peat y Gibb.24 La actividad total de TPH en el tallo cerebral se evaluó mediante la formación de 5-hidroxitriptofano/mg de proteína/hora con detección fluorométrica mediante HPLC.25
Inmunohistoquímica para TPH
Los tallos cerebrales se colocaron en una solución de paraformaldehído a 4 % durante una semana a 4 °C y luego se incluyeron en parafina para obtener secciones de 4 μm de espesor. Las secciones se colocaron en portaobjetos electrocargados; posteriormente, las secciones se desparafinaron y la exposición antigénica se llevó a cabo utilizando un amortiguador de citrato de 0.1 M, pH 6.0 (Declere™-Cell Marque, Rocklin, California, Estados Unidos) en un horno de microondas durante tres ciclos de dos minutos. La actividad de la peroxidasa endógena se inhibió inmediatamente con peróxido de hidrógeno a 5 %.
Después del lavado, las secciones se incubaron con TPH1 específico (anticuerpo monoclonal de conejo [EP1311Y], C-term (número de catálogo GTX 61516, GeneTex, Inc., Irvine, California, Estados Unidos) o TPH2 específico (anticuerpo monoclonal de conejo [EPR 19191], Abcam, Cambridge, Reino Unido), a una dilución de 1:500 en solución PBS (0.1 M, pH 7.4), Triton X-100 a 0.3 %, con suero de caballo a 3 % durante 18 horas a 4 °C. Al día siguiente, los cortes fueron lavados e incubados con el anticuerpo secundario (anticuerpo biotinilado anti-IgG de cabra), diluido en PBS y Triton X-100 a 0.3 % por 30 minutos; posteriormente, los tejidos fueron incubados con el complejo avidina-biotina por 15 minutos a temperatura ambiente y lavados.
La inmunorreactividad se determinó con un kit comercial (3,3’-diaminobencidina y peróxido de hidrógeno) conforme al protocolo de Vector Laboratories. Se tomaron fotomicrografías con una cámara digital (Infinity 1-Lumenera). El número de neuronas inmunorreactivas a TPH1 o TPH2 en el núcleo dorsal del rafe, para cada grupo y en cada día de tratamiento, se determinó en siete secciones de 4 μm de espesor, en un área de 83 μm2. Se tomó como referencia el acueducto de Silvio, con objetivos 10, 20 y 40×, empleando una cámara Infinity 1-Lumenera, con la ayuda de un microscopio Olympus.
Inmunotransferencia de TPH por Western blot
Los tallos cerebrales se homogeneizaron durante 30 segundos a 4 °C en 50 mM de solución Tris-HCl (pH 7.4), más inhibidores de proteasa (Protease Inhibitor Cocktail, Sigma-Aldrich, St. Louis, Missouri, Estados Unidos). A continuación, las muestras se centrifugaron a 29 000 g durante 15 minutos a 4 °C. La concentración de proteína se cuantificó por el método de Bradford. Posteriormente, se colocaron 50 μg de proteína en cada uno de los canales de 1 mm de espesor de un gel de poliacrilamida con SDS a 12 %.
La electroforesis se llevó a cabo a 100 V durante dos horas. Para la electrotransferencia de proteínas, el gel se montó en una membrana de nitrocelulosa (Bio-Rad, Estados Unidos) y la corrida se realizó a 10 V durante 90 minutos en una cámara semiseca. Las membranas con las proteínas transferidas se colocaron en una solución de bloqueo (Millipore Chemiluminescent Blocker, Millipore, Bedford, Massachusetts, Estados Unidos) durante 30 minutos.
Las membranas se incubaron durante la noche con un anticuerpo monoclonal primario específico para TPH1 (Rabbit monoclonal IgG, GeneTex, Inc., Irvine, California, Estados Unidos) o TPH2 (Rabbit polyclonal, Abcam, Cambridge, Reino Unidos), a una dilución de 1:500 en la misma solución de bloqueo. Al día siguiente, las membranas se incubaron con anticuerpo secundario anticonejo (Goat Anti-Rabbit, IgG [H+L]-HRP conjugate, Bio-Rad, Estados Unidos) a una dilución de 1:5.000 en la misma solución de bloqueo. Después de lavar las membranas con PBS, se revelaron con quimioluminiscencia con el sustrato Luminata Forte Western HRP (Millipore, Estados Unidos). Se utilizó gliceraldehído-3-fosfato deshidrogenasa como control interno. Las bandas obtenidas fueron analizadas y cuantificadas por densitometría.
Análisis estadístico
Para comparar los resultados de la actividad serotoninérgica (L-Trp, actividad total de TPH y concentración de 5-HT), el número de neuronas inmunorreactivas a TPH1 o TPH2 y las densidades ópticas relativas de las bandas de TPH1 y TPH2 en el tallo cerebral que se obtuvieron por Western blot. Primero se calcularon promedios y desviaciones estándar y posteriormente, los grupos fueron comparados con ANOVA y prueba de Tukey. Se aceptó un valor de p < 0.05 como estadísticamente significativo.
Resultados
A partir del día 7 de la administración de STZ, la glucemia aumentó significativamente en el grupo D (p < 0.001) y, como era de esperar, el aumento fue más importante a partir del día 14 de evolución de la DM (p < 0.001). Sin embargo, las ratas con diabetes tratadas con insulina volvieron a la glucemia normal el día 7 posterior al tratamiento con insulina (Tabla I). También se confirmó una disminución significativa en la concentración de L-Trp, actividad total de TPH y 5-HT en el tallo cerebral en las ratas diabéticas (p < 0.001), (Figura 1). En el grupo DTI, los niveles de L-Trp en el tallo cerebral volvieron a valores normales siete días después del tratamiento; sin embargo, a pesar del tratamiento con insulina, la actividad total de TPH y la concentración de 5-HT permanecieron significativamente disminuidas y no regresaron a los valores normales (p < 0.001), (Figura 1).
Tabla 1 Concentración de glucosa plasmática (mmol/L) en ratas con diabetes con y sin insulina y control
| DPAE | Control (X̅ ± DE) | CV (X̅ ± DE) | D (X̅ ± DE) | DTI (X̅ ± DE) |
|---|---|---|---|---|
| 1 | 5.20 ± 0.11 | 5.36 ± 0.15 | ||
| 7 | 5.50 ± 0.11 | 5.56 ± 0.15 | 18.10 ± 0.33* | 17.91 ± 0.13* |
| 14 | 5.66 ± 0.23 | 5.94 ± 0.22 | 33.00 ± 0.50** | 5.95 ± 0.20† |
Se presenta el promedio ± desviación estándar de 16 ratas en cada grupo. Todas las determinaciones se realizaron en muestras por duplicado. Las diferencias entre grupos se obtuvieron mediante ANOVA y prueba de Tukey (día 7, C versus D y C versus DTI,
*p < 0.001; día 14, C versus D,
**p < 0.001; y C versus DTI,
†no significativo. DPAE = días posterior a la administración de estreptozotocina; C: control; CV: control con vehículo; D: diabéticas no tratadas; DTI: diabéticas tratadas con insulina.

Figura 1 Actividad serotoninérgica en el tallo cerebral de ratas. Cada barra representa los valores promedio ± desviación estándar de 22 animales. Todas las determinaciones se realizaron por duplicado. La diferencia entre grupos se obtuvo mediante ANOVA y pruebas de Tukey: L-Trp, día 7, C versus D y DTI, *p < 0.001; día 14, C versus D, *p < 0.001; C versus DTI, no significativo. TPH, días 7 y 14, C versus D y DTI, *p < 0.001. 5-HT, días 7 y 14, C versus D y DTI, *p < 0.001. C: control; CV: control con vehículo; D: con diabetes; DTI: con diabetes tratada con insulina.
Las expresiones de TPH1 y TPH2 en el tallo cerebral se presentan en la Figura 2A. En las Figuras 2B y 2C se observan comparaciones de la expresión de ambas isoformas. El grupo D exhibió una disminución significativa en la expresión de TPH1 y TPH2 en comparación con los grupos control (p < 0.001); sin embargo, las expresiones de las isoformas en las ratas diabéticas tratadas con insulina no alcanzaron los valores de los grupos control (p < 0.001), (Figuras 2B y 2C).

Figura 2 Expresión de triptófano-5-hidroxilasa (TPH) 1 y 2 en el tallo cerebral de las ratas. A: inmunorreactividad detectada por electrotransferencia con anticuerpos específicos a cada una de las isoformas. Se observa una banda de 51 kDa, que corresponde a TPH1, otra de 56 kDa para TPH2 y una de 37 kDa para GADPH como control interno. B y C: unidades arbitrarias de densidad óptica de TPH1 y TPH2. Cada barra corresponde a los valores promedio ± desviación estándar de seis experimentos. La diferencia entre grupos se obtuvo mediante prueba de ANOVA y la prueba de Tukey: TPH1, días 7 y 14, C versus D y DTI, *p < 0.001; TPH2, días 7 y 14, C versus D y DTI, *p < 0.001. C: control; CV: control con vehículo; D: con diabetes; DTI: con diabetes tratada con insulina.
Las Figuras 3 y 4 presentan las neuronas inmunorreactivas a TPH1 y TPH2 en el núcleo dorsal del rafe de todos los grupos. El grupo diabético mostró una disminución significativa en el número de neuronas inmunorreactivas, así como en las expresiones de TPH1 y TPH2, en comparación con las de los grupos control (p < 0.001) (Figura 5). Sin embargo, resultó interesante que las ratas con diabetes tratadas con insulina demostraran un aumento en el número de neuronas inmunorreactivas que expresaban TPH1 y TPH2 siete días después del tratamiento, sin alcanzar los valores de los controles (Figura 5).

Figura 3 Microfotografías de corte coronal del núcleo del rafe dorsal del tallo cerebral, donde se observan neuronas serotoninérgicas inmunorreactivas a TPH1. Los cortes de tejido se incubaron con anticuerpo monoclonal específico y la inmunorreactividad se detectó con el anticuerpo monoclonal conjugado con peroxidasa y se reveló con 3, 3, diaminobencidina. Las flechas muestran la inmunorreactividad en cada grupo. Aq = acueducto de Silvio; C: control; CV: control con vehículo: D, con diabetes 14 días después de la administración de estreptozotocina (STZ); DIT: con diabetes tratado con insulina, siete días después de la administración de STZ y siete días con tratamiento con insulina. Escalas: A: 10×; B: 20×; C: 40×.
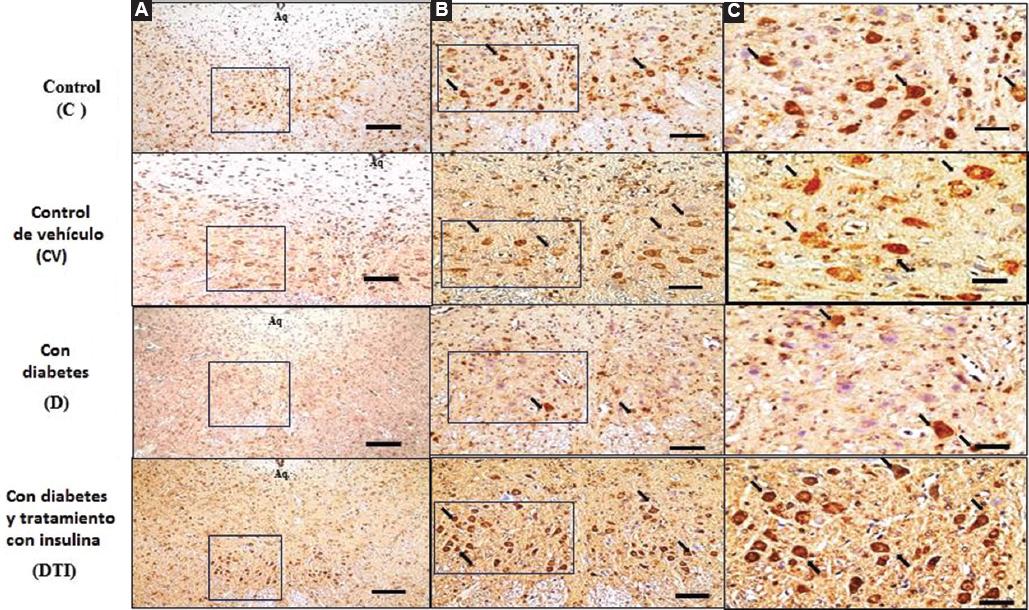
Figura 4 Microfotografías de corte coronal del núcleo del rafe dorsal del tallo cerebral, donde se observan neuronas serotoninérgicas inmunorreactivas a TPH2. Los cortes de tejido se incubaron con anticuerpo monoclonal específico y la inmunorreactividad se detectó con el anticuerpo monoclonal conjugado con peroxidasa y se reveló con 3, 3, diaminobencidina. Las flechas muestran la inmunorreactividad en cada grupo. Aq = acueducto de Silvio; C: control; CV, control con vehículo; D: con diabetes 14 días tras la administración de estreptozotocina (STZ); DIT: con diabetes tratado con insulina, siete días después de la administración de STZ y siete días con tratamiento con insulina. Escalas: A: 10×; B: 20×; C: 40×.

Figura 5 Número de neuronas serotoninérgicas inmunorreactivas a TPH1 y TPH2 en el núcleo del rafe dorsal del tallo cerebral. Cada barra corresponde a los valores promedio ± desviación estándar de siete ratas en cada grupo. La diferencia entre grupos se obtuvo mediante prueba de ANOVA y prueba de Tukey: TPH1, días 7 y 14, C versus D y DTI, *p < 0.05. TPH2, días 7 y 14, C versus D y DTI, *p < 0.05). C: control; CV, control con vehículo; D: con diabetes 14 días tras la administración de estreptozotocina (STZ); DIT: con diabetes tratado con insulina, siete días después de la administración de STZ y siete días con tratamiento con insulina.
Discusión
El presente trabajo confirma y amplía los resultados reportados sobre la diabetes mellitus, la cual induce importantes cambios neurobioquímicos en el sistema serotoninérgico cerebral en el curso del desarrollo de la enfermedad, consistentes en disminución de la biosíntesis de 5-HT a causa de la disminución de la fracción libre de L-Trp en plasma y cerebro, junto con inhibición crónica de la actividad total de TPH en el tallo cerebral, lo cual también afecta la función normal de las neuronas serotoninérgicas.3,4,9 Sin embargo, cuando las ratas con diabetes fueron tratadas con insulina, los niveles de L-Trp en el tallo cerebral volvieron a la normalidad. Pero, a pesar del tratamiento, la actividad total de TPH permaneció significativamente disminuida, acompañada de una disminución de la concentración de 5-HT en el tallo cerebral.20,21
En un artículo reciente, nuestro grupo también informó que ambas isoformas de TPH (1 y 2) se expresan en neuronas serotoninérgicas en el tallo cerebral en ratas con diabetes y en ratas de control.20 Cabe destacar que la intensidad de la inmunomarcación resultó significativamente inferior en las neuronas marcadas con el anticuerpo específico anti-TPH1 y anti-TPH2 correspondiente en ratas con diabetes en comparación con las ratas de control. No obstante, a pesar del tratamiento con insulina en las ratas con diabetes, las expresiones de ambas isoformas permanecieron significativamente disminuidas y no volvieron a los valores de los controles.
En conjunto, los resultados apoyan el hecho de que la diabetes mellitus provoca alteraciones significativas en el metabolismo de la serotonina en el cerebro y un posible cambio en el mecanismo de regulación molecular de la expresión y actividad de TPH.9,20 Sin embargo, se observó la presencia de un menor número de neuronas serotoninérgicas que expresaban TPH1 y TPH2 en las ratas con diabetes, lo cual concuerda con la disminución de la expresión proteica en cada isoforma, que no se normaliza con el tratamiento con insulina. Lo anterior sugiere que los cambios metabólicos que ocurren durante el estado diabético pueden dar lugar a un cambio epigenético, inhibiendo la expresión de la TPH, cuyos mecanismos no son claros hasta la fecha.
En resultados preliminares, observamos que la DM induce la apoptosis de las neuronas serotoninérgicas en el núcleo dorsal del rafe del tallo cerebral (datos no mostrados). Así, los presentes hallazgos permiten proponer que la diabetes mellitus puede influir profundamente en la biosíntesis de la 5-HT cerebral,3,4,9,16,21 a través de mecanismos dependientes de genes que codifican las proteínas enzimáticas y la apoptosis de las neuronas serotoninérgicas que, a su vez, son causados por el intenso estrés inducido por la diabetes mellitus, el cual puede influir en la biosíntesis de 5-HT cerebral.26,27 Alternativamente, otros mecanismos que también pudieran explicar la disminución de la expresión de las isoformas TPH1 y TPH2 en ratas diabéticas podrían ser la exposición de las enzimas a condiciones de oxidación,28 hiperglucemia,29 o disminución de las actividades de las proteína cinasas A y C,30,31 las cuales inducen cambios en la función catalítica de la TPH.
En conclusión, las presentes observaciones permiten confirmar que la diabetes mellitus produce cambios importantes en la síntesis cerebral de 5-HT mediante modificaciones en la expresión de las isoformas TPH1 y TPH2 y la disminución de las neuronas serotoninérgicas. Dichos cambios no se normalizaron en las ratas con diabetes tratadas con insulina, lo cual sugiere que estas modificaciones, producidas por el intenso cambio metabólico y molecular provocado por la diabetes mellitus, estarían relacionadas en mayor medida con cambios epigenéticos en los genes de la triptófano-5-hidroxilasa.











 nueva página del texto (beta)
nueva página del texto (beta)


