Introducción
La fibromialgia (FM) es un síndrome no degenerativo caracterizado por dolor no articular, crónico, musculoesquelético, con evolución de más de tres meses e hipersensibilidad en sitios anatómicos definidos.1 En 1992, la Organización Mundial de la Salud la reconoció como una enfermedad independiente.2 Su diagnóstico clínico se hace con base en los criterios del Colegio Americano de Reumatología.3,4 Se presenta en 2 a 5 % de la población mundial, con predominio en mujeres.5 En América Latina y México es causa frecuente de consulta reumatológica.6 Se acompaña de alteraciones del sueño, fatiga, ansiedad, depresión, parestesias, cefalea, colon irritable y cistitis.7
La etiología de la FM es desconocida, pero se sugiere que la capacidad disminuida para responder adecuadamente a estímulos (emociones, traumas físicos e infecciones) se asocia a anormalidades del sistema nervioso central.8,9
La FM comparte sintomatología con algunas condiciones autoinmunes y puede coexistir con lupus eritematoso sistémico (de 22 a 33 %), tiroiditis (30 %), esclerosis múltiple (17.3 %), síndrome de Sjögren (de 12 a 55 %) y artritis reumatoide (7.4 %).10 Estudios del perfil inmunológico en pacientes con FM reportan niveles anormales de citocinas proinflamatorias, principalmente de IL-6 e IL-8 y quimiocinas (por ejemplo, MCP-1, MIG, MDC, I-TAC, TARC y eotaxina), así como disminución en la expresión de moléculas de adhesión (por ejemplo, CD62L y CD11b/CD18) y respuesta inmune celular deficiente.11 Actualmente, no hay biomarcadores específicos para FM, pero se ha reportado la presencia de autoanticuerpos contra proteínas nucleares (por ejemplo, ANA, anti-68/48 kDa), proteínas tiroideas (por ejemplo, tiroperoxidasa y tiroglobulina), canales de potasio, anticuerpos antipolímero, 5-hidroxitriptamina, gangliósidos, fosfolípidos y antianexina V.12
En este estudio investigamos la existencia de anticuerpos antineurales en el suero de pacientes con FM.
Métodos
Se estudiaron 15 pacientes con FM, sin enfermedad autoinmune ni historia de reacciones alérgicas, manifestaciones de infección activa, cirugía reciente, hipertensión arterial, diabetes mellitus, embarazo, desórdenes antisociales o tratamiento con agentes inmunosupresores; y 14 voluntarios sanos (controles). Los pacientes fueron reclutados del Instituto Nacional de Psiquiatría “Ramón de la Fuente Muñiz” entre 2009 a 2011 y diagnosticados con base en los criterios del Colegio Americano de Reumatología.3,4 El Cuestionario de Impacto de la Fibromialgia (FIQ)13,14 y el Inventario de Depresión de Beck (BDI)15 se aplicaron a pacientes y controles. El estudio fue aprobado por los comités de investigación y ética del Instituto Nacional de Psiquiatría “Ramón de la Fuente Muñiz” (INPRFM-SC-2329) y todos los participantes firmaron el consentimiento informado.
Sueros
Por venopunción, de cada sujeto fueron recolectados en un tubo 8 mL de sangre para la separación del suero (Tubos BD Vacutainer SST, New Jersey, Estados Unidos); fueron incubados una hora a 37 °C para que se formara el coágulo y se centrifugaron a 1125× g a 4 °C durante 15 minutos. El suero fue separado en alícuotas y almacenado a −80 °C hasta su uso.
Perfusión de ratones, obtención y congelación de tejidos del sistema nervioso central
Ratones macho BALB/c de 20 g fueron anestesiados con ketamina (80 mg/kg vía intraperitoneal) y xilacina (10 mg/kg vía intraperitoneal). Bajo anestesia profunda, los animales se perfundieron secuencialmente con 15 mM de amortiguador de fosfatos y paraformaldehído a 4 %. Los cerebros perfundidos se extrajeron de los animales y se colocaron en paraformaldehído a 4 % por tres horas para fijarlos. Posteriormente se colocaron en sacarosa a 20 % durante toda la noche y se embebieron en resina (Tissue-Tek OCT, Sakura Finetek, California, Estados Unidos) para proteger el tejido cerebral y se congelaron en isopentano a −70 °C por 15 segundos. Se realizaron cortes sagitales de cinco micras de cerebro, cerebelo y tallo cerebral, que fueron montados en portaobjetos silanizados y fueron congelados a −20 °C hasta el momento de su uso. Los animales se manejaron con estricto apego a los estándares éticos internacionales.
Método de inmunofluorescencia indirecta
Cien microlitros de suero de pacientes con FM y controles se adsorbieron en polvo de hígado (Guinea Pig Liver, Rockland Immunochemical Inc., Pensilvania, Estados Unidos) por 24 horas para eliminar la tinción de fondo. Los sueros adsorbidos se separaron y diluyeron (1:50) con solución de bloqueo (solución salina amortiguadora de fosfatos 15 mM y adicionada con suero de cabra a 10 %) diluida 1:10. Los cortes se incubaron secuencialmente en la obscuridad durante una hora a temperatura ambiente, en 200 μL de suero de los pacientes con FM y de los sujetos control (dilución 1:50 en RB 1:10) y anticuerpos de cabra anti-IgG humana conjugados con isotiocianato de fluoresceína (Goat Anti-Human IgG Fluorescein Conjugate, Southern Biotech, Pensilvania, Estados Unidos), dilución 1:200 en RB 1:10. Entre cada incubación, los cortes se lavaron tres veces con solución PBS. Las preparaciones fueron adicionadas con medio de montaje (Vectashield, Vector Laboratories, California, Estados Unidos) y analizadas en microscopio de fluorescencia (Carl Zeiss, Axio Image D2 model).16
Extracto de proteínas de tronco encefálico de ratón
Diez ratones adultos BALB/c se anestesiaron con pentobarbital (50 mg/kg vía intraperitoneal). Los cerebros fueron extraídos y los tallos cerebrales disecados2 y homogenizados a 4 °C en amortiguador de lisis (amortiguador de ensayo de radioinmunoprecipitación: Tris-HCl 50 mM, pH 7.4, NaCl 150 mM, EDTA 2 mM, NaF 50 mM, PMSF 1 mM, SDS 0.1 %, desoxicolato de sodio 0.5 % e IGEPAL 1 %), suplementado con inhibidor de proteasa completo 1X (Sigma-Aldrich, St. Louis, Misuri, Estados Unidos), GeneTex Protocol. La suspensión fue centrifugada a 10 000× g durante 10 minutos a 4 °C. Se separó el sobrenadante y se determinó la concentración de proteínas mediante el método de Bradford (Sigma-Aldrich, St. Louis, Misuri, Estados Unidos) en curva de calibración de albúmina.17,18
Western blot19
– Electroforesis: se hizo en sistema discontinuo con gel de separación (SDS-PAGE: 12.5 % de acrilamida en una solución de Tris-HCl 1.5 M con 0.4 % de SDS, pH 8.8,) y gel de concentración (3 % de acrilamida en una solución de Tris-HCl 0.5 M con 0.4 % de SDS, pH 6.8). Treinta miligramos de extracto total de tronco encefálico se adicionaron con 2-mercaptoetanol 2X, vol.:vol. (Laemmli 2X Sample Buffer, Bio-Rad, California, Estados Unidos), con concentración final 1X de 355 mM. La muestra se hirvió durante cinco minutos y se colocó en el gel. La electroforesis se hizo con equipo Mini-protean de Bio-Rad a 180 V durante 45 minutos.
– Electrotransferencia: las proteínas separadas por SDS-PAGE fueron transferidas en las membranas de nitrocelulosa (Bio-Rad, California, Estados Unidos) durante dos horas a 100 V en una cámara de transferencia húmeda. Como marcador de peso molecular se empleó un estándar de doble color de proteínas de 10 a 250 kDa (Bio-Rad, California, Estados Unidos).
– Inmunoblot: las membranas de nitrocelulosa con las proteínas transferidas se lavaron tres veces con solución PBS-T: PBS 15 mM, pH 7.4-Tween 20 a 0.05 % (Sigma-Aldrich, St. Louis, Misuri, Estados Unidos). Se incubaron durante una hora con solución de bloqueo (leche semidescremada a 5 % en solución PBS 15 mM); se volvieron a lavar con PBS-T y se cortaron en tiras. Las tiras de membranas de nitrocelulosa se incubaron secuencialmente con suero de pacientes con FM y de sujetos control (dilución 1:100 en solución de bloqueo 1:3) y anticuerpos de cabra anti-IgG humana conjugados con peroxidasa de rábano (Goat Anti-human IgG H&L, HRP, Abcam, Massachusetts, Estados Unidos), dilución 1:5000 en RB 1:3, durante 18 horas a 4 °C. Entre cada incubación, las membranas de nitrocelulosa se lavaron tres veces con PBS-T. Finalmente, se les adicionó substrato de peroxidasa de rábano quimioluminiscente (Novex ECL, Invitrogen, California, Estados Unidos) y se obtuvieron las autorradiografías colocando las membranas de nitrocelulosa en contacto con películas radiográficas (BioMax Film, GE Healthcare, Amersham, California, Estados Unidos).
Resultados
Valores de las pruebas de FIQ y BDI
Los pacientes con FM tuvieron valores promedio de IFQ y de BDI significativamente mayores a los de los sujetos control (p < 0.0002 y p < 0.0001, respectivamente), los cuales se describen en la Tabla 1, que correspondieron a impacto severo de síntomas relacionados con FM y disfunción, así como a grado leve a moderado de depresión. Los valores de IFQ y BDI en los controles fueron normales.
Tabla 1 Características demográficas y valores de escalas clínicas en pacientes con FM y voluntarios sanos
| Voluntarios sanos (n = 14) | Pacientes con FM (n = 15) | ||||||
|---|---|---|---|---|---|---|---|
| Características demográficas | Valores de escalas clínicas | Características demográficas | Valores de escalas clínicas | ||||
| Edad (años) | Sexo masculino/femenino | FIQ | BDI | Edad (años) | Sexo masculino/femenino | FIQ | BDI |
| 41 ± 4 | 2/12 | 12 ± 12 | 4 ± 3 | 43 ± 8 | 1/15 | 70 ± 25** | 17 ± 11* |
FIQ: Cuestionario de Impacto de Fibromialgia; BD: Inventario de Depresión de Beck.
*p < 0.0001;
**p < 0.0002.
Inmunorreactividad antineural
Cinco de los 15 pacientes con FM presentaron inmunorreactividad sérica selectiva contra las neuronas del núcleo vestibular medial o núcleo magno, las cuales constituyen un grupo de neuronas productoras de serotonina que forman parte de los núcleos del rafé del tronco encefálico, implicadas en los procesos de inhibición del dolor, mantenimiento y regulación del estado de ánimo y control de ciertos comportamientos agresivos. Esta inmunorreactividad no se encontró en el suero de los sujetos control (Figura 1).
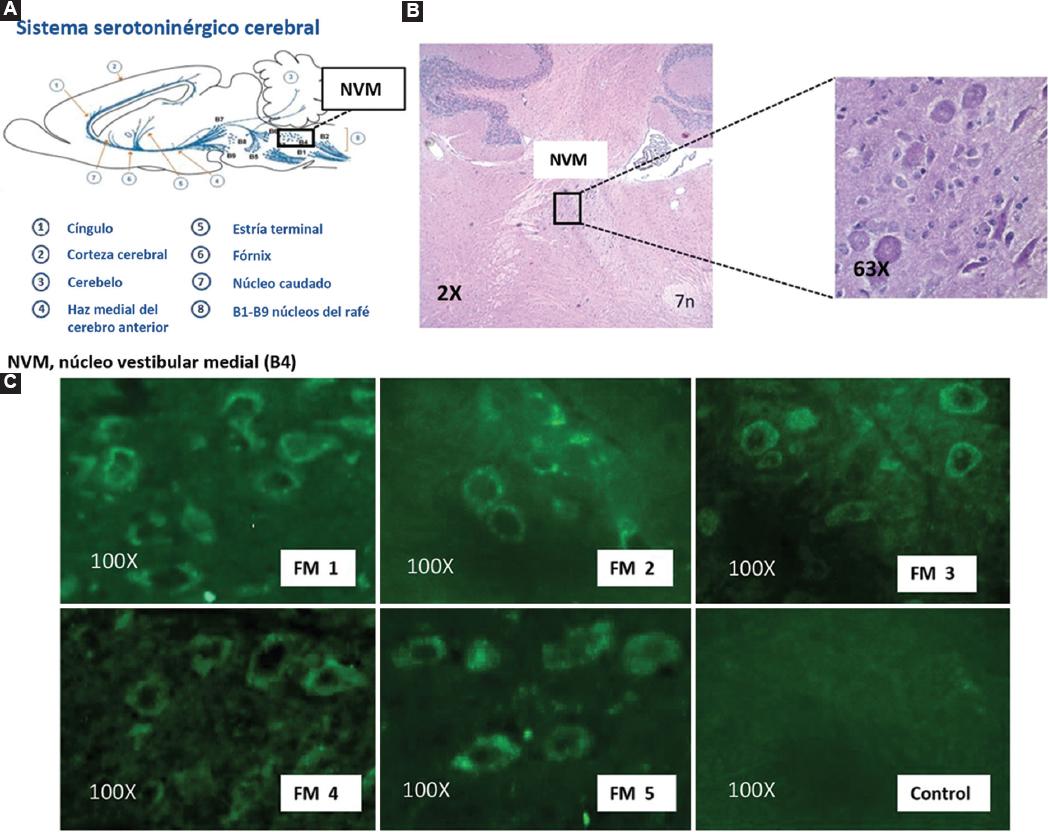
Figura 1 Sistema serotoninérgico cerebral e inmunorreactividad del suero de pacientes con fibromialgia comparado con las neuronas del núcleo vestibular medial de ratón, reveladas por inmunofluorescencia indirecta. A: representación esquemática del sistema serotoninérgico, que se origina en los núcleos del rafé del tronco encefálico. El recuadro muestra el núcleo vestibular medial (B4), que forma parte de los nueve núcleos del rafé (B1-B9). B: foto izquierda, imagen microscópica de corte sagital de tronco encefálico, teñido con hematoxilina y eosina (2×), en la que se observa la localización del núcleo vestibular medial (NVM) en relación con el séptimo nervio craneal (7n); foto derecha, amplificación del NVM (63×). C: imágenes microscópicas (100×) en las que se observa la fluorescencia de las neuronas del NVM del tronco encefálico de ratón al reaccionar con el suero de cinco pacientes con FM (FM1-FM5); y ausencia de tinción fluorescente del NVM cuando utilizó el suero de un individuo sano (control).
Western blot
Los sueros de los pacientes con FM con inmunorreactividad selectiva contra el núcleo vestibular medial reconocieron una proteína de 45 kDa, que no fue reconocida por los sueros de los sujetos control (Figura 2).
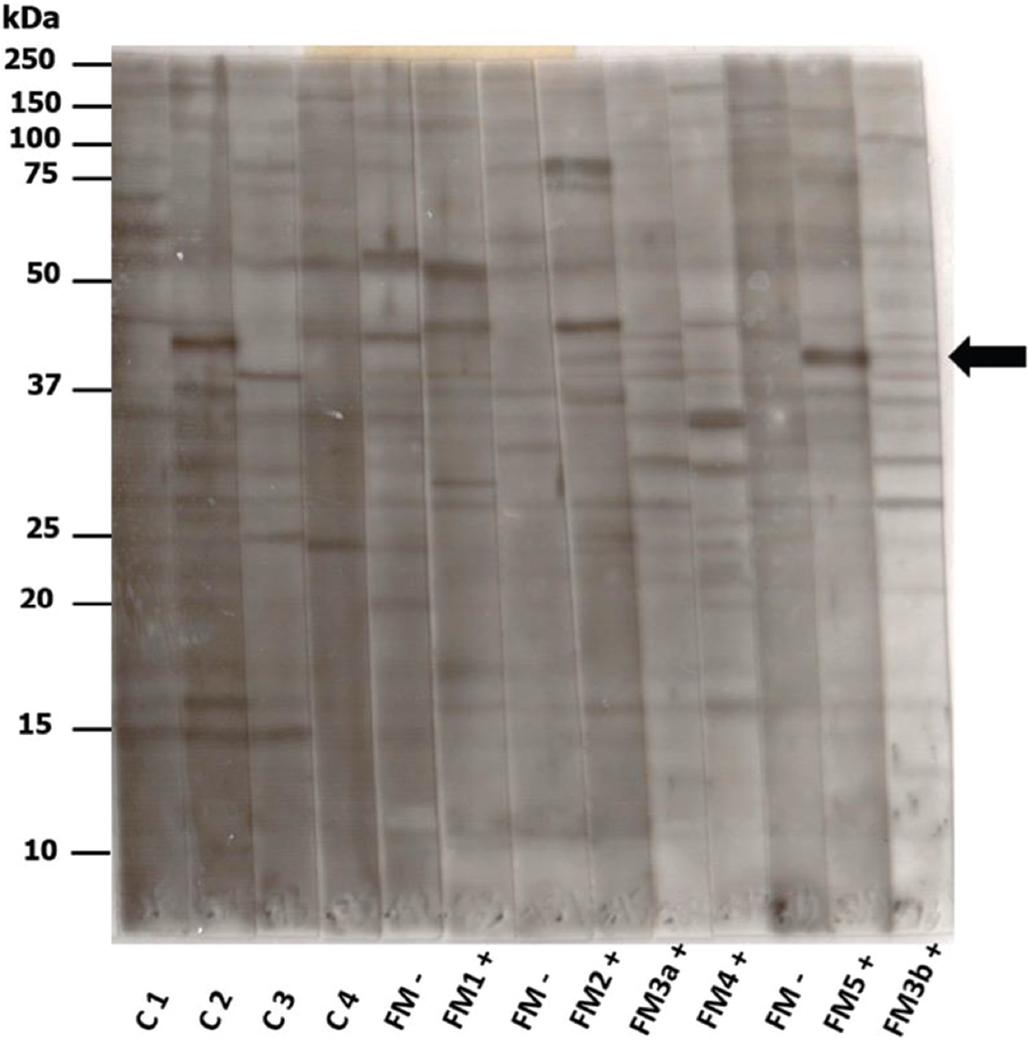
Figura 2 El suero de voluntarios sanos (C1-C4) y de cinco pacientes con fibromialgia y anticuerpos antinúcleo vestibular medial (FM+) o sin ellos (FM−), se incubaron con proteínas totales del tronco encefálico de ratón. FM3a+ y FM3b+ corresponden a dos muestras de suero diferentes del mismo paciente. A la izquierda se indica la migración de proteínas de peso molecular conocido de 10 a 250 kDa. La flecha apunta a la proteína de 45 kDa, revelada por los sueros con anticuerpos anticitoplasma de las neuronas del núcleo vestibular medial.
Discusión
Los pacientes con FM tuvieron un impacto severo en su calidad de vida y capacidad funcional, así como depresión de leve a moderada, que no presentaron los controles. Estos resultados son similares a los reportados en otras investigaciones.20
Este es el primer estudio que reporta anticuerpos antinúcleo vestibular medial en pacientes con FM sin enfermedad autoinmune asociada, los cuales pudieran estar relacionados con el desarrollo de algunos síntomas neurológicos tales como ansiedad, depresión y sueño no reparador.21
Las neuronas del núcleo vestibular medial del tallo cerebral forman parte de los núcleos del rafé que integran el sistema serotoninérgico, encargado de regular emociones, estados de ánimo, conductas agresivas y sexuales, sueño e información nociceptiva, a través de proyecciones que descienden a la médula espinal o ascienden al cerebro anterior.22
La FM es una enfermedad polifacética idiopática en la que participan mecanismos de autoinmunidad, neuroinflamación y neuropatía de fibras pequeñas.23 Los hechos que hacen pensar en la participación de un componente autoinmune en la FM incluyen los antecedentes comunes de trauma o infección, que pueden desencadenar autoinmunidad; predominio en las mujeres, lo cual coincide con lo encontrado en otras condiciones autoinmunes; hallazgo de autoanticuerpos contra diferentes blancos, estados inflamatorios que podrían favorecer un componente autoinmune y expresión de perfiles genéticos de firmas típicas de enfermedad autoinmune (Th-17 e interferón tipo I).24,25
Así, los autoanticuerpos contra el núcleo vestibular medial podrían interferir en el funcionamiento del sistema serotoninérgico y repercutir en la fisiopatología de la FM.
En 2021, Goebel et al. reportaron que ratones tratados con IgG de pacientes con FM presentaron sensibilidad aumentada a estímulos mecánicos o al frío, que no mostraron los animales tratados con sueros de pacientes con FM depletados de IgG o sueros con IgG de sujetos control sanos, lo cual indica posible participación de los anticuerpos antineurales en el desarrollo de síntomas de FM, lo cual se relaciona con lo informado en esta investigación.26
Conclusiones
Los pacientes con FM tienen alteraciones que repercuten en sus actividades diarias y cursan con un grado de depresión.
Los resultados de este estudio evidencian por primera vez inmunorreactividad contra el núcleo vestibular medial del tronco encefálico en 33 % de los pacientes con FM, lo cual indica la participación de un componente autoinmune en la fisiopatología de la FM. Será necesario estudiar un mayor número de pacientes para confirmar la relevancia clínica de este hallazgo y esclarecer la repercusión funcional de los resultados obtenidos, así como clonar la proteína de 45 kDa de las neuronas del núcleo vestibular medial y determinar cuál es su función.











 nueva página del texto (beta)
nueva página del texto (beta)


