Introducción
Millones de mujeres utilizan estrógenos, solos o en combinación con progestágenos como anticonceptivos orales o en terapias de reemplazo hormonal1. Sin embargo, diferentes estudios no muestran beneficio para prevención secundaria de la enfermedad coronaria en mujeres2,3.
Los estrógenos exógenos no confieren una protección cardiovascular y se asocian a un incremento en el riesgo de desarrollar trombosis venosa y/o arterial, principalmente durante el primer año de tratamiento en mujeres con factores de riesgo asociados, como una mutación en el gen de protrombina G20210A4 y factor V Leiden5.
Los estrógenos alteran varios de los mecanismos hemostásicos, generando un estado protrombótico6.
Las plaquetas activadas concentran sobre los fosfolípidos negativos de su membrana al factor tisular (FT) y los factores de la coagulación circulantes, de esta manera facilitan las interacciones entre ellos generando trombina.
Hasta hace unas décadas se asumía que la función de las plaquetas concluía después de activarse, actualmente se tiene evidencia de que después de la activación y/o de la apoptosis, las plaquetas y otras células forman microvesículas (MV); son fragmentos de membranas que carecen de simetría y una característica importante es que exponen fosfatidilserina y FT sobre su superficie. El fragmento de membrana adopta una forma circular, tienen un tamaño que puede variar entre 100 y 1,000 nm, guardan características de las células de las cuales se forman y por la circulación pueden alcanzar territorios que, en algunos casos, podrían ser inaccesibles para las células que las generan. Recientemente se señala la participación de las MV en muchos estados patológicos, incluyendo las trombosis tanto arteriales como venosas.
Entre las particularidades de las MV destaca su posibilidad de transportar entre la célula que le da origen y otras células miARN, ARNm, ADN, proteínas e iniciar respuestas en los tejidos a los que acceden como es la fosforilación de Akt y expresión de óxido nítrico sintasa endotelial (eNOS).
Las MV se encuentran en un punto angular en el equilibrio fisiológico de la hemostasia. Su actividad puede ser protrombótica si en su estructura portan FT7 y/o profibrinolítica8 si en su estructura portan activadores de plasminógeno. Ambos mecanismos explican el concepto del FT y la plasmina que se forman en la sangre y que han dado un giro a los conceptos tradicionales de coagulación y fibrinólisis.
Las MV de monocitos pueden transportar FT y ser una fuente alterna de este9.
Por otro lado, las MV pueden ofrecer activadores del plasminógeno y ser una fuente de plasmina.
Este escenario muestra la importancia de las MV, su presencia se asocia con las enfermedades trombóticas arteriales y venosas que cursan con deterioro del endotelio vascular y que culminan con la formación de un trombo, así como de estados crónicos metabólicos y autoinmunes que los favorecen como son, entre otras, las enfermedades cardiovasculares y cerebrovasculares.
Nuestro grupo ha desarrollado estrógenos sustituidos en la posición 17 beta del anillo estrogénico, que en grado variable disminuyen la coagulación, la actividad de las plaquetas y la síntesis de NO, lo que favorece una vasodilatación sostenida que evita la trombosis10. Mismo se sintetizaron compuestos diméricos buame y bisebudia (compuesto dimérico de buame), que mostraron un efecto inhibidor de la agregación plaquetaria y disminución de la liberación de trifosfato de adenosina (ATP) por las plaquetas11.
Todos estos efectos inmediatos sobre la actividad de las plaquetas orientan a reconocer un efecto no genómico de estos estrógenos, sobre las membranas biológicas tanto de los organelos celulares como de la membrana celular. Este efecto se pone de manifiesto al verificar que el ATP que se libera de la agregación plaquetaria disminuye con el efecto de los aminoestrógenos, apoyando el mecanismo que disminuye la formación de MV y exosomas, ya que el ATP se encuentra dentro de los gránulos densos de las plaquetas.
También es posible reconocer una interacción principalmente en el receptor estrogénico beta de los aminoestrógenos12.
Con la intención de aportar nuevos compuestos aminoestrógenos, con actividad anticoagulante, antiagregante plaquetaria y estudiar su efecto sobre la producción de MV, sintetizamos un nuevo compuesto, tyrame, cuya estructura de alcohol amina incluye a la tiramina dentro de su molécula.
Material y métodos
Reactivos
Estrona, tiramina, tolueno anhidro, etanol absoluto, metanol absoluto, deuterocloroformo (CDCl3), dimetilsulfóxido-d6 (DMSO-d6) y borohidruro de sodio se adquirieron en Sigma-Aldrich Chemical Co. ADP, epinefrina y colágena Chrono-Par.
Todos los demás reactivos empleados fueron de la máxima pureza posible.
Síntesis de tyrame
Se obtuvo13 en el Instituto de Química de la Universidad Nacional Autónoma de México (UNAM). Como se describió previamente, se empleó como disolvente tolueno anhidro, seguido de una reacción de reducción con borohidruro de sodio en metanol. Su caracterización y pureza química se determinó mediante los métodos analíticos y espectroscópicos habituales. La figura 1 muestra la síntesis de tyrame.

Figura 1 Síntesis de tyrame, una mezcla de estrona (540 mg, 2 mM) y tiramina (300 mg) en 350 ml de tolueno anhidro se calentó a reflujo, con agitación, durante 48 horas, usando una trampa Dean-Stark. La mezcla de reacción se concentró hasta sequedad con vacío y el sólido resultante se enfrió a temperatura ambiente. El producto sólido vítreo se disolvió con metanol anhidro caliente (350 ml) y la solución se enfrió a temperatura ambiente. Posteriormente, se adicionó borohidruro de sodio (400 mg). Después, la mezcla se calentó a reflujo a durante 20 minutos. La solución se vertió en agua con hielo y se obtuvieron cristales blancos, los cuales se filtraron y secaron. Se recristalizaron en metanol-agua y alcanzó un rendimiento de 209 mg del producto blanco puro.
Efecto anticoagulante de tyrame
Los experimentos que a continuación se detallan se sometieron para su aprobación a la Comisión de Investigación y Ética de la Facultad de Medicina de la UNAM, con el protocolo número O44-2011. Se siguieron los lineamientos de empleo de animales vivos de laboratorio publicados en Guide for the Care and Use of Laboratory Animals.
El efecto anticoagulante del tyrame se determinó en sangre total empleando ratones machos cepa CD1, que se mantuvieron bajo periodos controlados de luz y obscuridad, temperatura controlada y con alimento y agua ad libidum.
Los animales se asignaron a los diferentes grupos haciendo una distribución equilibrada por su peso y el grupo al que se administró DMSO se consideró el grupo control. El tyrame se disolvió en DMSO y se administró por vía subcutánea, 0, 1 y 2 mg/100 g de peso, con el fin de elaborar una curvas dosis-respuesta transcurridas 24 h de su administración.
El efecto anticoagulante en sangre total se determinó como se describe en González, et al., 201010.
Efecto antiagregante plaquetario
Se emplearon plaquetas de donadores de Banco de Sangre del Instituto Nacional de Cardiología Ignacio Chávez. En cada determinación, se empleó 9 ml de sangre de 4 donadores. Los donadores cumplieron con los requisitos del Banco de Sangre, se recibió la sangre en tubos Vacutainer que contenían citrato de sodio 0.129 M como anticoagulante. Las plaquetas se aislaron por centrifugación a 100 x g durante 1 min, se separaron del paquete globular, y se obtuvo el plasma rico en plaquetas (PRP). El remanente de sangre se centrifugó a 250,000 x g durante 15 min. Las plaquetas se ajustaron a 250,000/ml.
La actividad antiagregante plaquetaria se determinó como se describe en González, et al., 201010.
Disminución de la formación de microvesículas
Para determinar la concentración circulante de MV, se empleó la sangre de los ratones tratados con 4 g/100 g del experimento de efecto anticoagulante en sangre total. La muestra se obtuvo bajo anestesia con ketamina (50 mg/kg), intramuscular, como inductor y fenobarbital (10 mg/kg) como anestésico de efecto prolongado. La muestra de sangre se obtuvo de la aorta abdominal, 2 ml, se colocó en un tubo con citrato de sodio (0.105 M). Los ratones se sacrificaron con una sobredosis de fenobarbital.
Resultados
Caracterización de tyrame
La figura 2 muestra la estructura de rayos X de hidrato de tyrame y los datos de los espectros masas, resonancia magnética nuclear e infrarrojo.

Figura 2 Tyrame [N-(3-hidroxi-1:3:5(10)-estratrien-17β-il)-4-hidroxi-fenetilamina], rendimiento del 35%, cristales blancos; punto de fusión 171 °C. Análisis elemental en porcentaje (C, 80.51; H, 9.50; N, 4.60). Calculado para C26H31NO2 (C: 80.49; H: 9.46; N: 4.69). El espectro de masas (m/z): M+ 391 (pico base 284); IR (en pastilla de KBr, en cm-1) n-O-H 3485. Resonancia magnética nuclear 1H (CDCl3-DMSO-d6 en ppm), 0.70 (s, 3H, 18CH3), 1.16-2.25 (m), 6.46 (d, 3H, J = 5 Hz, H4, H22, H26), 6.58 (dd, 4H, J = 5 Hz y J = 17 Hz, H2, H4, H25, H23), 7.04 (d, 3H, J = 17 Hz, H1,H22, H26), 8.78 (s, 2H, O1 y O2). Muestra el ion molecular esperado [M] + a 391 m/z. El pico base está en 284 m/z. El espectro infrarrojo mostró una banda de vibración, n-O-H que comienza alrededor de 3,500 cm-1, pero debido a la fuerte unión de hidrógeno, la banda es muy ancha. También están presentes las bandas correspondientes a n-C alifático-H y n-C aromático-H. Hay una banda de alrededor de 1,607 cm-1, que se asigna a las vibraciones aromáticas C-C-C. La estructura de rayos X presenta efectos de dispersión anómala. En estado cristalino presenta varios enlaces de H provenientes de moléculas de agua entre O(1)-H(1A) del grupo H2O con el átomo de nitrógeno N(1)#1 de la molécula vecina. Existen también contactos entre H con O(1) (2.626Å); H(19)-C(2) (2.889Å); C(2)-H(16) (2.889 Å) y H(20)-H(4) (2.374 Å) de una molécula vecina. Debido al carácter aromático del anillo A, C(1), C(2), C(3), C(4), C(10), C(9), C(5), C(8) y O(1) deben ser coplanares. Sin embargo, el ángulo entre los planos C(1)-C(2)-C(3)-O(1)-C(4)-C(10)-C(9) y C(8)-C(9)-C(10)-C(5) es de 3.19(0.17)°. El anillo B tiene una conformación de media silla. El anillo C muestra una conformación en silla con sustituyentes en C(17) y en C(13) en posición axial. El anillo D muestra una conformación 13-b en sobre (ángulo de torsión C(17)-C(13)-C(14)-C(15) = 45.76 (0.21)°). La geometría del anillo D con la cadena lateral es trans a C(13) and gauche a C(16). Las longitudes de los enlaces y los ángulos son como los reportados para otros compuestos con características similares. Los elipsoides se calculan con un 50% de probabilidad.
Efecto anticoagulante en sangre total de tyrame
La tabla 1 muestra los resultados de los tiempos de coagulación en sangre total.
Tabla 1 Los compuestos se disolvieron en dimetilsulfóxido (DMSO) y se calcularon para 100 g de peso de ratón; se administraron por vía subcutánea. A las 24 h se determinó el tiempo de coagulación en sangre total, se dilató la vena dorsal del ratón (colocando la cola en baño maría, a 37 °C, durante 3 min). Posteriormente, se hizo un corte trasversal para obtener ± 25 µl de sangre total, la cual fue colectada en un capilar previamente marcado en dos extremos. Se permite desplazar la sangre entre las dos marcas en un equipo que limita el movimiento a 60°. Cuando inicia el llenado del capilar se activa un cronómetro, cuando se detiene el desplazamiento de la sangre se detiene el cronómetro y registra, en segundos
| Compuesto | Dosis | Tiempo en s |
|---|---|---|
| Tyrame | DMSO | 124.3 ± 19 |
| 1 mg/100 g | 162.7 ± 11.6 | |
| 2 mg/100 g | 191.0 ± 8.4* |
*p ≤ 0.05 se considera estadísticamente significativo, ANOVA con post hocDunnett, SPSS v21.0.
Efecto antiagregante plaquetario de tyrame
La tabla 2 muestra el efecto inhibitorio de la agregación plaquetaria.
Tabla 2 En cada determinación se colocaron 500 µl de plasma rico en plaquetas en un tubo de agregación plaquetaria, se incubaron durante 5 min a 37 °C, posteriormente se adicionaron 10 µl de tyrame a diferentes concentraciones (5-500 mM) e inmediatamente después el agente agonista, ADP 10 µM , epinefrina 10 µM o colágena 2 g/ml. Equipo Lumi-Aggregometer (Model 560 CA acoplado a un programa Model 810 AGGRO/LINK Chrono-log, Havertown, PA, EE.UU.). El agente agonista activa a las plaquetas induciendo un cambio de forma que inmediatamente impide brevemente el paso de luz, a medida que la respuesta se vuelve irreversible el trazo se modifica hasta alcanzar una meseta. El porcentaje de agregación plaquetaria alcanzado por el dimetilsulfóxido (DMSO) se considera un 100% y los resultados se expresan en porcentaje con respecto al grupo control. Los resultados se expresan en promedio ± desviación estándar. Los resultados de agregación plaquetaria que se obtienen empleando el disolvente DMSO (grupo control) y el agente inductor se consideran como el 100% de agregación y 0% de inhibición. Los resultados obtenidos con las diferentes concentraciones de tyrame de cada agente agonista se calcularon mediante el porcentaje de agregación con respecto al control y se obtiene el porcentaje de inhibición. Por ejemplo, para un porcentaje de inhibición del 78.4% significa que el porcentaje de agregación fue del 21.6%. Los agentes inductores se preparan según las indicaciones del fabricante Sigma
| Compuesto | Concentración (µM) | Inhibición de la agregación plaquetaria (%) | ||
|---|---|---|---|---|
| ADP 10 µM | Epinefrina 10 µM | Colágena 1 mg/ml | ||
| Tyrame | 5 | 8.9 ± 10.5 | 10 ± 16.0 | 3 ± 7.5 |
| 50 | 30.6 ± 11.9* | 86 ± 6.5* | 8 ± 15.3 | |
| 500 | 78.4 ± 14.6* | 97.5 ± 6.2* | 96.9 ± 5.4* | |
*p < 0.05 se considera estadísticamente significativo, ANOVA con post hocDunnett, SPSS v21.0.
Efecto inhibidor de la formación de MV
La figura 3 muestra que el efecto inhibidor de la formación de MV de tyrame.
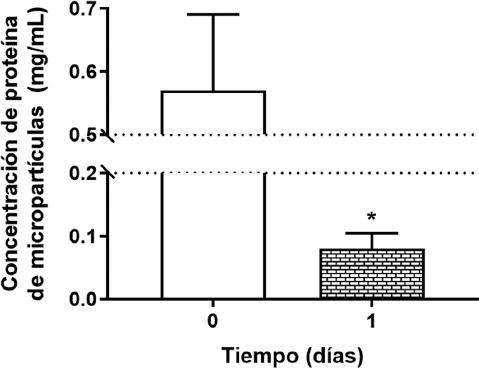
Figura 3 Las MV se aislaron mediante centrifugación diferencial, la muestra sanguínea citratada (0.105 M), se centrifugó dos veces (1,500 x g por 15 min y 13,000 x g por 2 min) para obtener el plasma pobre en plaquetas. 500 ml de muestra se centrifugaron (20,000 x g por 90 min a 4 °C), las MV fueron lavadas y resuspendidas con amortiguador HEPES (10 mM NaCl, 140 mM HEPES; pH 7.4). Las MV se rompieron mediante choque térmico y la concentración de proteína se determinó a 280 nm en un espectrofotómetro. Los resultados se expresan como concentración de proteína. La concentración de MV disminuyó seis veces a las 24 h de tratamiento (4 g/100 mg), el resultado se expresa en mg de proteína/ml, lectura en un espectrofotómetro a 280 nm. Se considera que al formarse las MV se organizan en su estructura los receptores, proteínas, ADN, ARN miARN y otras moléculas presentes en la célula original.
Conclusiones
Los resultados muestran que el tyrame tiene un discreto efecto anticoagulante a las 24 h de su administración, se observa un comportamiento similar a los mostrados por otros aminoestrógenos. Sin embargo, su efecto antiagregante plaquetario es superior sobre todo cuando se emplea colágena como agente inductor.
Este efecto antiagregante plaquetario se refleja en la marcada disminución de MV circulantes.
Este efecto resalta y pone en posible ventaja el uso de tyrame como un estrógeno sin riesgo trombótico por disminuir la formación de MV, lo que sería de utilidad terapéutica en diferentes tipos de cáncer14, trastornos cardiovasculares15 y enfermedades autoinmunes16 en donde las MV tienen un papel importante en su fisiopatología.











 nueva página del texto (beta)
nueva página del texto (beta)


