Introducción
La resistencia a la insulina (RI) se caracteriza por una disminución en la sensibilidad de los tejidos a la insulina. Está asociado con la diabetes tipo 2 (DT2), la obesidad y el síndrome metabólico; este parámetro contribuye al riesgo cardiovascular (CV) asociado a estas enfermedades1-3. Los mecanismos fisiopatológicos involucrados en la relación entre la RI y la morbimortalidad CV no son bien conocidos4. Algunos investigadores han explorado una asociación entre la RI y la rigidez arterial central-aórtica (RACA)5.
El sistema arterial mantiene un flujo sanguíneo adecuado y funciona como un amortiguador6. Esto depende de la elasticidad de las arterias. Las arterias pueden perder su distensibilidad vascular con la edad y con la hipertensión arterial, enfermedad renal crónica, DT2 y aterosclerosis7. La RACA es un factor de riesgo CV independiente8,9. Cuando una arteria es rígida, la onda de pulso hacia adelante es más rápida y se refleja de la periferia más rápidamente, llegando al corazón durante la sístole temprano, produciendo un aumento en la presión arterial sistólica; al mismo tiempo, la presión diastólica se reduce y existe una reducción en la perfusión coronaria diastólica10, además de la transmisión de más energía pulsátil hacia las arterias pequeñas, produciendo daño microvascular.
El estándar de oro para medir la sensibilidad a la insulina es la pinza euglucémica-hiperinsulinémica11. Este método no es útil en la práctica clínica por ser laborioso, invasivo y caro12. Un índice subrogado ampliamente utilizado para estimar la RI es el HOMA2-IR (Homeostatic Model Assessment for Insulin Resistance). Otros índices como el QUICKI (Quantitative Insulin Check Index), y subrogados que utilizan parámetros metabólicos y antropométricos en sus fórmulas (p. ej., METS-IR [Metabolic score for IR], QUICKI [Quantitative Insulin Sensitivity Check Index], TyG [ratio triglicéridos/glucosa], TyG*IMC [TyG*índice de masa corporal] y TG/HDL [ratio TG/lipoproteínas de alta densidad])13-15 también tienen una buena correlación con el método de pinza.
La velocidad de onda del pulso carotídeo-femoral (VOPcf) es el estándar de oro para la evaluación no invasiva de la RACA16,17. El papel que juega la RI en promover un aumento RACA no ha sido esclarecido. Además, esta relación puede estar sesgada a la suma de alteraciones metabólicas vistas en pacientes con DT2. El objetivo de este estudio es evaluar la asociación entre la RI y la RACA (VOPcf) en una población mexicana sin diabetes.
Metodología
Diseño y población de estudio
Se realizó un estudio transversal reclutando sujetos entre enero 2017 y diciembre 2020 en la Unidad de Investigación de Enfermedades Metabólicas del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. La edad de los participantes estuvo entre 18 y 70 años, y no tenían diagnóstico previo de DT2. Se incluyeron pacientes con diagnósticos previos de prediabetes (glucosa en ayuno 100-125 mg/dl o hemoglobina glucosilada [HbA1c] 5.7-6.4%), hipertensión arterial sistémica (diagnostico por presión arterial ≥ 140/80 mmHg y/o con tratamiento con antihipertensivos), obesidad (IMC ≥ 30 kg/m2) y sujetos con alto riesgo CV (p. ej., dislipidemia primaria aterogénica). Se excluyeron personas con enfermedad CV, enfermedad renal crónica y expectativa de vida a menos de un año. El estudio se llevó de acuerdo con los estatutos de la Declaración de Helsinki. Todos los participantes firmaron consentimiento informado previo a la participación del estudio. El Comité de Ética del Instituto Nacional de Ciencias Médicas Salvador Zubirán aprobó la realización de este estudio.
Evaluación bioquímica, antropométrica
Se obtuvieron muestras sanguíneas venosas después de un ayuno de 8 a 12 horas. El análisis de glucosa plasmática se realizó mediante un analizador automatizado (Yellow Springs Instruments, Yellow Springs, OH, EE.UU.), las concentraciones de insulina fueron medidas mediante inmunoensayo de quimioluminiscencia (Beckman Coulter Access 2), las concentraciones de HbA1C fueron medidas mediante cromatografía (Variant II Turbo, BIORAD) y las concentraciones del perfil de lípidos fueron medidas mediante ensayos de colorimetría (Unicel DxC 600 Synchron Clinical System Beckman Coulter). El colesterol vinculado a lipoproteínas de baja densidad (c-LDL) fue calculado de acuerdo con la fórmula de Martín18. Todos los sujetos fueron pesados utilizando básculas calibradas SECA mBCA 514 y medidos mediante estadiómetros SECA. La circunferencia de cintura fue medida mediante una cinta no elástica entre el punto medio que se intersecta del reborde costal y el borde superior de la costilla. El IMC fue calculado dividiendo el peso en kilogramos entre la estatura en metros al cuadrado. Se utilizó el índice HOMA2-IR como el estándar para evaluar la RI. Posteriormente, se replicó la asociación mediante los subrogados QUICKI, TG/HDL, TyG, TyG*IMC y METS-IR. En la tabla 1 se muestran las fórmulas de los subrogados de estimación de RI.
Tabla 1 Formulas de índices subrogados para estimar resistencia a la insulina. Las unidades de glucosa, TG y HDL se utilizaron en mg/dl. Las unidades de insulina fueron UI/ml
| Índice | Formula |
|---|---|
| HOMA2-IR | https://www.dtu.ox.ac.uk/homacalculator/ |
| METS-IR | 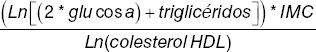 |
| QUICKI |  |
| TyG | 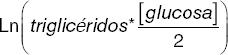 |
| TyG*IMC | (TyG)*(IMC) |
| TG/HDL | (Triglicéridos) / (ColesterolHDL) |
HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; METS-IR: Metabolic score for IR; QUICKI: Quantitative Insulin Sensitivity Check Index; TyG: ratio triglicéridos/glucosa; TyG
*IMC: TyG*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
Evaluación de análisis de onda carotídea
Se les pidió a los sujetos no consumir cafeína y mantenerse sin fumar las 48 horas previas. El análisis de onda carotídea fue realizado utilizando un dispositivo semiautomático (SphygmoCore XCEL, AtCor Medical Pty Ltd, EE.UU.). Al momento de la evaluación de los participantes, se les recostó en decúbito supino por 10 minutos. Se colocó un esfigmomanómetro entre el tercio proximal de la pierna derecha del paciente para registrar la onda femoral. La VOPcf y el índice de aumentación normalizado a 75 latidos por minuto (AI-75) (para reducir el efecto atribuible a la frecuencia cardiaca) fueron medidos mediante tonometría aplanadora utilizando el tiempo corregido de retardo de la onda carotídea a la onda arterial femoral19. El índice de aumentación estima el reflejo de la onda de la periferia; un regreso más temprano ocurre con la velocidad de pulso aumentado. Se definió rigidez arterial como aquellos sujetos con VOPcf arriba del percentil 90 (p ≥ 90) (> 7.77 mm/s).
Análisis estadístico
Las variables cualitativas en forma de conteo absoluto y porcentaje. Las variables cuantitativas como media (desviación estándar) o mediana (rango intercuartil [RIQ]) según su distribución normal. Se aplicaron transformaciones logarítmicas. Se compararon los sujetos con rigidez arterial contra aquellos sin rigidez arterial utilizando las pruebas estadísticas de t de Student o U de Mann-Whitney.
Correlación entre subrogados de resistencia a la insulina
Se evaluó la correlación de HOMA2-IR y los otros subrogados con VOPcf y el AI-75. Se ajustaron las correlaciones por edad, sexo, hipertensión arterial, tabaquismo, HbA1c, cintura y dislipidemia. Para evaluar diferencias entre sujetos con RI por nuestros subrogados, se utilizaron los puntos de corte previamente publicados por Almeda-Valdez, et al.20. Se compararon los parámetros de VOPcf entre sujetos con RI utilizando la prueba t de Student.
Evaluación de puntos de corte para identificar rigidez arterial
Se calcularon los puntos de corte para identificar rigidez arterial. Se estimó la sensibilidad, especificidad, valor predictivo positivo y negativo de cada subrogado de RI. Se obtuvo el área bajo la curva (ABC) de cada subrogado. El análisis estadístico fue realizado con el lenguaje de programación R (Versión 3.6.1).
Resultados
Se incluyeron 358 sujetos, 260 (72.6%) mujeres con una mediana de edad de 50 (RIQ: 39-57) años. Las características de la población se presentan en la tabla 2. Los sujetos con mayor rigidez arterial fueron hombres de mayor edad, con mayor peso, perímetro de cintura y con una concentración mayor de glucosa en ayuno, TG y HbA1c y con menores concentraciones de c-HDL. El valor promedio de la VOPcf y del AI-75 en esta población fueron 6.52 (± 1.34) mm/s y 34.9 (± 13.22) %, respectivamente. Con respeto a los índices subrogados (Tabla 1), los valores promedios/medianos fueron: HOMA2-IR 1.2 (RIQ: 0.8-1.7), METS-IR 45.6 (± 9.47), QUICKI 0.344 (± 0.03), TyG 8.78 (± 0.58), TyG*IMC 259.8 (± 49.4) y TG/HDL 2.99 (RIQ: 1.8-4.6). Solo los índices METS-IR y TG/HDL fueron significativamente relacionados con mayor rigidez arterial
Tabla 2 Características generales de la población de estudio
| Parámetro | Población total (n = 358) | Sin rigidez arterial (n = 323) | Con rigidez arterial (n = 35) | Valor p |
|---|---|---|---|---|
| Sexo femenino (%) | 260 (72.6%) | 238 (75.1) | 18 (51.4) | 0.001 |
| Edad (años) | 50 (39-57) | 46.6 (12.7) | 53 (7.65) | < 0.001 |
| Prediabetes (%) | 254 (70.9) | 223 (70.3) | 26 (74.3) | 0.627 |
| Peso (kg) | 76.2 (± 14.9) | 75.7 (± 14.9) | 81.7 (± 15.8) | 0.005 |
| Cintura (cm) | 95.5 (± 12.1) | 93.6 (± 11.7) | 98.8 (± 11.3) | 0.003 |
| IMC (kg/m2) | 28.9 (26.4-32.2) | 28 (26-32) | 29.2 (26.6-35) | 0.065 |
| Glucosa (mg/dl) | 96.3 (± 12.8) | 95.6 (± 11.1) | 102.2 (± 22.6) | 0.004 |
| Triglicéridos (mg/dl) | 137 (95-187) | 133 (92-182) | 159 (108-197) | 0.093 |
| Colesterol total (mg/dl) | 197 (± 43.1) | 194 (± 42) | 188 (± 45.8) | 0.239 |
| Colesterol HDL (mg/dl) | 46.3 (± 12.2) | 46.7 (± 12) | 41.9 (± 12) | 0.027 |
| Colesterol LDL (mg/dl) | 123 (± 35.5) | 121 (± 35) | 116 (± 35.7) | 0.320 |
| Insulina (UI/dl) | 8.9 (6-12.9) | 8.7 (5.7-11.9) | 9.9 (6.8-14.9) | 0.313 |
| HbA1c (%) | 5.8 (± 0.75) | 5.8 (± 0.60) | 6.3 (± 1.18) | < 0.001 |
| Acido úrico (mg/dl) | 5.4 (± 1.3) | 5.3 (± 1.29) | 5.6 (± 1.36) | 0.343 |
| Creatinina (mg/dl) | 0.87 (± 1.9) | 0.86 (± 2.45) | 0.81 (± 0.21) | 0.712 |
| AST (mg/dl) | 28.2 (± 16.2) | 28.3 (± 17) | 27.8 (± 8.2) | 0.879 |
| ALT (mg/dl) | 28.3 (± 19.9) | 28.3 (± 17) | 30.1 (± 15.9) | 0.534 |
| GGT (mg/dl) | 26.4 (± 26.2) | 25.9 (± 26.8) | 28.9 (± 21.7) | 0.550 |
| APO B (mg/dl) | 112.25 (± 28.4) | 109 (± 27.7) | 102 (± 29.5) | 0.321 |
| VOPcf (mm/s) | 6.52 (± 1.34) | 5.92 (± 0.84) | 8.58 (± 0.65) | < 0.001 |
| AI-75 (%) | 34.97 (± 13.22) | 34.3 (± 13.9) | 33.7 (± 9.71) | 0.604 |
| HOMA2-IR | 1.2 (0.8-1.7) | 1.2 (0.8-1.6) | 1.3 (0.9-2.0) | 0.144 |
| METS-IR | 45.6 (± 9.47) | 45.1 (± 9.25) | 48.8 (± 10.5) | 0.026 |
| QUICKI | 0.344 (± 0.033) | 0.346 (± 0.033) | 0.335 (± 0.033) | 0.079 |
| TyG | 8.78 (± 0.58) | 8.73 (± 0.58) | 8.99 (± 0.57) | 0.075 |
| TyG*IMC | 259.8 (± 49.4) | 257.4 (± 47.63) | 273.9 (± 54.4) | 0.057 |
| TG/HDL | 2.99 (1.8-4.6) | 2.8 (1.7-4.5) | 3.8 (2.4-5.8) | 0.017 |
IMC: índice de masa corporal; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; HbA1c: hemoglobina glucosilada; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; GGT: gamma-glutamil transferasa; APO b: apolipoproteína B; VOPcf: velocidad de pulso carotídea; AI-75: índice de aumentación normalizado; HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; METS-IR: Metabolic score for IR; QUICKI: Quantitative Insulin Sensitivity Check Index; TyG: ratio triglicéridos/glucosa; TyG*IMC: TyG
*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
Correlación de velocidad de pulso carotídeo con subrogados de resistencia a la insulina
En el análisis de correlación bivariante, se observó una correlación con HOMA2-IR y la VOPcf (r: 0.220; intervalo de confianza del 95% [IC 95%]: 0.114-0.320) que se mantuvo al ajustar por covariables (r: 0.128; IC 95%: 0.018-0.234). La asociación se replicó con el resto de los subrogados. La mayor correlación se observó para el índice METS-IR (r: 0.309; IC 95%: 0.212-0.402) y el índice TyG*IMC (r: 0.279; IC 95%: 0.189-0.373) (Fig. 1). Para AI-75, el índice TyG*IMC tuvo el mayor grado de correlación (r: 0.131; IC 95%: 0.027-0.231). Sin embargo, al ajustar por covariables el índice HOMA2-IR mantuvo la mayor asociación con AI-75 (r: 0.168; IC 95%: 0.060-0.272) (Tabla 3). Finalmente, los pacientes con RI tuvieron un aumento de los valores de VOPcf evaluada por todos los subrogados (Fig. 2). Explorando los valores de VOPcf en aquellos con prediabetes, se confirmó que esta población tuvo mayor rigidez arterial comparada con aquellos sin prediabetes (Fig. 3).
Tabla 3 Correlación de Pearson entre subrogados de resistencia a la insulina y estimación de rigidez arterial. Las variables de ajuste son: edad, sexo, tabaquismo activo, hipertensión arterial sistémica, hemoglobina glucosilada y cintura
| Subrogados | VOPcf | AI-75 | ||
|---|---|---|---|---|
| Bivariante | Ajustado | Bivariante | Ajustado | |
| HOMA2–IR | 0.220 (0.114, 0.320) | 0.128 (0.018, 0.234) | 0.033 (–0.074, 0.141) | 0.168 (0.060, 0.272) |
| METS–IR | 0.309 (0.212, 0.402) | 0.171 (0.063, 0.275) | 0.099 (0.018, 0.178) | 0.164 (0.082–0.241) |
| QUICKI | –0.244 (–0.343, –0.139) | –0.119 (–0.226, –0.01) | –0.063 (–0.145, 0.019) | –0.144 (–0.225, –0.062) |
| TyG | 0.279 (0.189, 0.373) | 0.081 (–0.027, 0.189) | 0.021 (–0.083, 0.124) | 0.126 (0.018, 0.232) |
| TyG*IMC | 0.303 (0.205, 0.395) | 0.183 (0.053, 0.286) | 0.131 (0.027, 0.231) | 0.164 (0.059, 0.269) |
| TG/HDL | 0.266 (0.166, 0.360) | 0.085 (–0.024, 0.193) | –0.042 (–0.145,0.062) | 0.118 (0.009, 0.223) |
VOPcf: velocidad de pulso carotídea; AI-75: índice de aumentación normalizado; HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; METS-IR: Metabolic score for IR; QUICKI: Quantitative Insulin Sensitivity Check Index; TyG: ratio triglicéridos/glucosa; TyG
*IMC: TyG*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
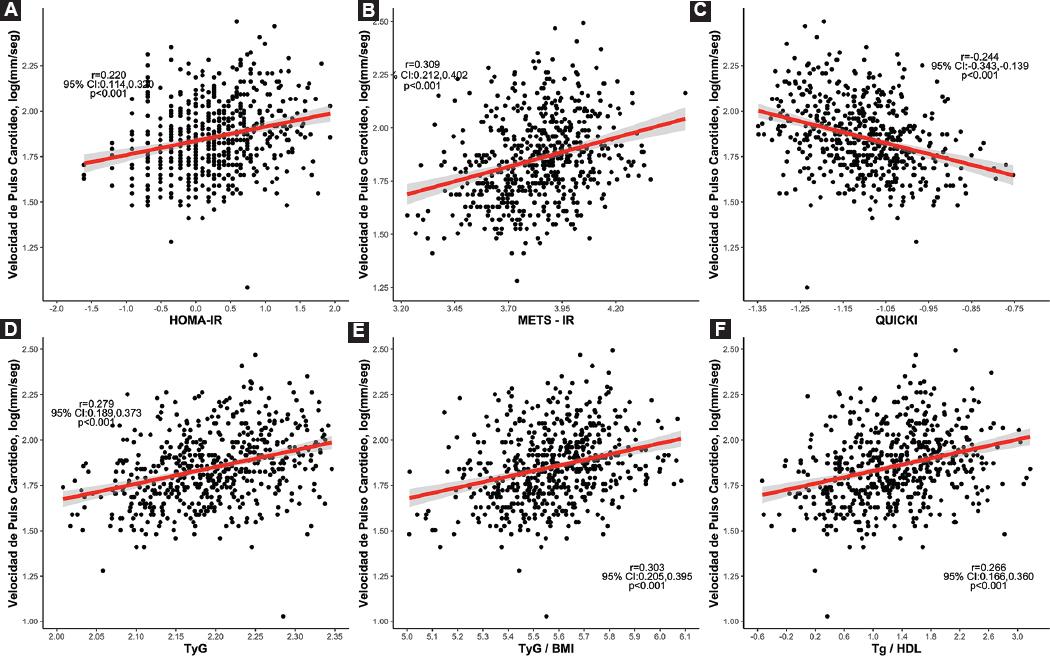
Figura 1 Correlación de subrogados de resistencia a la insulina con velocidad de pulso carotídea. Las variables fueron transformadas a su logaritmo para alcanzar distribución paramétrica.IC 95%: índice de confianza del 95%; HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; METS-IR: Metabolic score for IR; QUICKI: Quantitative Insulin Sensitivity Check Index; TyG: ratio triglicéridos/glucosa; TyG*IMC: TyG*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
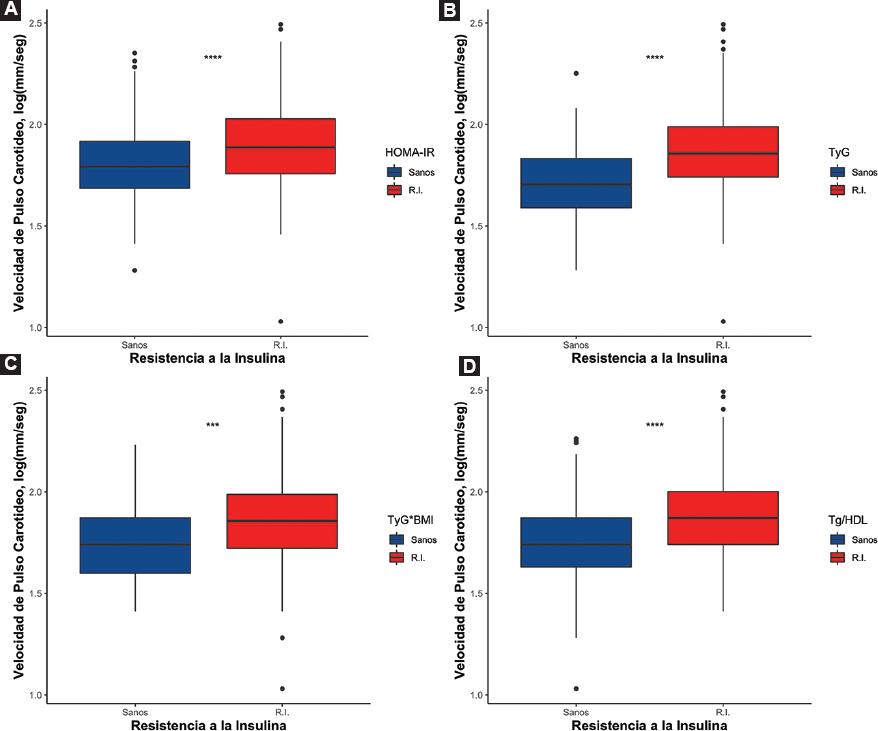
Figura 2 Diferencias de velocidad de pulso carotídeo entre sujetos con resistencia a la insulina evaluado por subrogado.* p < 0.05.†p < 0.001.‡p < 0.0001.RI: resistencia a la insulina; HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; TyG: ratio triglicéridos/glucosa; TyG*IMC: TyG*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
Puntos de corte para identificar rigidez arterial
Para cada subrogado se determinó el mejor punto de corte para detectar rigidez arterial. El índice HOMA2-IR mostró un adecuado rendimiento predictivo. Esta asociación fue replicada para el resto de los subrogados a RI. Los índices con mejor ABC fueron el índice METS-IR (ABC: 0.61; IC 95%: 0.51-0.71) y el índice TyG (ABC: 0.61; IC 95%: 0.51-0.69). El subrogado con mayor sensibilidad, con una ABC significativa, fue el índice TyG (S: 0.94; IC 95%: 0.81-0.99), mientras que el índice TyG*IMC tuvo la mejor especificidad (E: 0.84; IC 95%: 0.79-0.88) con una ABC significativa (Tabla 4).
Tabla 4 Puntos de corte para identificar rigidez arterial (VOPcf p ≥ 90) en sujetos sanos. Rigidez arterial se definió como aquellos sujetos con VOPcf encima del percentil 90 (p ≥ 90) con un valor de 7.77
| Variables | Punto de corte | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | ABC |
|---|---|---|---|---|---|---|
| HOMA2-IR | 1.7 | 0.43 (0.26-0.62) | 0.76 (0.71-0.81) | 0.17 (0.14-0.30) | 0.92 (0.85-0.94) | 0.59 (0.48-0.69) |
| METS-IR | 41.6 | 0.82 (0.66-0.93) | 0.39 (0.33-0.48) | 0.13 (0.11-0.31) | 0.95 (0.89-0.96) | 0.61 (0.51- 0.71) |
| QUICKI | 0.39 | 0.13 (0.04-0.29) | 0.91 (0.88-0.94) | 0.14 (0.10-0.32) | 0.91 (0.71-0.94) | 0.40 (0.29-0.51) |
| TyG | 8.4 | 0.94 (0.81-0.99) | 0.27 (0.22-0.32) | 0.27 (0.10-0.55) | 0.98 (0.92-0.98) | 0.61 (0.51-0.70) |
| TyG*IMC | 301.9 | 0.34 (0.19-0.52) | 0.84 (0.79-0.88) | 0.19 (0.15-0.33) | 0.92 (0.84-0.94) | 0.59 (0.48-0.69) |
| TG/HDL | 3.05 | 0.69 (0.51-0.83) | 0.52 (0.47-0.58) | 0.14 (0.11-0.27) | 0.94 (0.88-0.95) | 0.60 (0.51-0.70) |
VOPcf: velocidad de pulso carotídea; VPP: valor predictivo positivo; VPN: valor predictivo negativo; ABC: área bajo la curva; HOMA2-IR: Homeostatic Model Assessment 2-Insulin Resistance; METS-IR: Metabolic score for IR; QUICKI: Quantitative Insulin Sensitivity Check Index; TyG: ratio triglicéridos/glucosa; TyG
*IMC: TyG*índice de masa corporal; TG/HDL: ratio TG/lipoproteínas de alta densidad.
Discusión
Se evaluó la asociación entre la RI y la velocidad de la onda del pulso en una población mexicana sin DT2. Los pacientes con RI, evaluada por subrogados, tuvieron un aumento en los valores de VOPcf independiente de factores de riesgo. Los índices con mayor grado de asociación fueron METS-IR y TyG*IMC, y los con mejor ABC para detectar rigidez arterial fueron METS-IR y TyG. Los sujetos con prediabetes tuvieron una mayor rigidez arterial comparada con aquellos sin prediabetes.
Se ha mostrado una relación directa entre la VOPcf y la aterosclerosis, y en estudios longitudinales este parámetro es un marcador de riesgo CV independiente21. Un aumento en la rigidez arterial puede ser uno de los mecanismos que explica la asociación entre el riesgo CV y la RI. Estudios epidemiológicos han mostrado que la RI es un factor independiente para el desarrollo de la rigidez arterial. En el estudio ARIC, las personas con DT2 o intolerancia a los carbohidratos tuvieron arterias más rígidas que personas con normoglucemia22. Se especuló que el efecto de glucosa, insulina y TG en conjunto juegan un papel en el desarrollo de la rigidez arterial. Se han mostrado diferencias significativas en la VOPcf entre sujetos con y sin síndrome metabólico23. Los mecanismos específicos involucrados no son claros, pero sabemos que la RI tiene efectos directos e indirectos sobre la vasculatura. La hiperinsulinem`ia puede aumentar el tono simpático, activar el sistema renina-angiotensina, estimular inflamación vascular y reducir la vasodilatación dependiente del endotelio mediado por flujo. El resultado final es disfunción endotelial y una respuesta vasomotora inadecuada al endotelio proinflamatorio y procoagulante, aumentado el riesgo para rigidez arterial24.
Varios autores han evaluado la asociación entre los subrogados de la RI y la rigidez arterial. En personas sin enfermedad CV, se ha confirmado una asociación significativa entre TyG y VOPcf 25. El HOMA2-IR fue independientemente asociado con VOPcf en personas sin diabetes o con prediabetes26,27. Webb, et al. evaluaron la VOPcf en personas con normoglucemia, regulación de glucosa anormal (glucosa en ayuno anormal y/o intolerancia a los carbohidratos) y DT228. En los últimos dos grupos hubo una asociación significativa con la rigidez arterial. La intolerancia a la glucosa y HOMA2-IR fueron los predictores independientes más importantes para la rigidez arterial.
Este estudio tiene algunas limitaciones. Se utilizaron subrogados para RI en plazo del estándar de oro. La población fue heterogénea y puede ser no representativa de la población general. La mayoría fueron mujeres, representando un potencial sesgo de selección. No se obtuvieron datos sobre ejercicio y de medicamentos que podrían influir el proceso de aterosclerosis y la RI.
Conclusiones
Es el primer estudio en población mexicana que confirma la relación entre la RI y la rigidez arterial en personas sin diabetes. Se corrobora que la relación entre la RI y la rigidez arterial está presente desde etapas no-diabéticas; esta asociación puede conllevar mayor riesgo CV en el futuro. El índice HOMA2-IR mostró una asociación que se replicó con los diversos subrogados de RI. El mejor desempeño para detectar la rigidez arterial fue con los índices METS-IR y TyG. Estos son parámetros sencillos para calcular y pueden ser incluidos en la evaluación del riesgo CV.











 nueva página del texto (beta)
nueva página del texto (beta)



