Streptococcus agalactiae o Streptococcus del grupo B (SGB) es un coco grampositivo colonizador frecuente del tracto digestivo inferior.
Fry, en 1938, describió su capacidad como patógeno humano1. Desde la década de 1970 hubo un aumento de las infecciones perinatales por este microorganismo en países desarrollados y en la década de 1980 se consideró la causa más común de sepsis y meningitis neonatal2-5. El SGB es uno de los principales agentes etiológicos en las infecciones perinatales, destacando la corioamnionitis, los abortos espontáneos y las infecciones posparto6.
Una madre con colonización genital o rectal por SGB podría transmitir este microorganismo a su recién nacido (RN) por vía hematógena-transplacentaria, por vía ascendente o durante el paso por el canal cervicovaginal7. En los países desarrollados se han implementado diferentes medidas de prevención para prevenir la transmisión vertical, incluida la profilaxis antibiótica intraparto8,9. Para implementar estas medidas se requiere conocer la frecuencia de colonización materna por región específica para inferir el riesgo perinatal local.
La mayoría de los estudios sobre colonización e infección por SGB se han realizado en países desarrollados, en México la información es limitada en número de estudios y de regiones evaluadas10-15.
En este estudio se determinó la frecuencia de colonización cervicovaginal y rectal por SGB en una muestra de mujeres embarazadas atendidas en un hospital de ginecología-obstetricia de la Ciudad de México (CDMX).
Pacientes y métodos
Diseño y pacientes
Se realizó un estudio observacional, prospectivo, transversal y analítico durante 24 meses en mujeres embarazadas. Se incluyeron las embarazadas admitidas para atención del trabajo de parto (TP), se eligieron aquellas con ≥ 36 semanas de embarazo y las de 35-36 semanas con TP activo y sin respuesta a la inhibición del TP. Se excluyeron las que habían recibido antibióticos (penicilinas, cefalosporinas, trimetoprima-sulfametoxazol y/o eritromicina) en el último trimestre del embarazo y aquellas con contraindicación médica (placenta previa, parto prematuro, desprendimiento de placenta). Los embarazos se clasificaron en riesgo normal o alto según la clasificación de Coopland16.
Muestreo
Un grupo de enfermeras capacitadas, en la primera revisión en la sala de partos o en el quirófano, colocó a cada paciente en posición ginecológica. Usando guantes estériles, se insertó en la vagina un hisopo de plástico de 15 cm con punta de algodón, se giró y se movió lateralmente; la muestra se colocó en un tubo con caldo Todd-Hewitt (TH) (Becton-Dickinson) con ácido nalidíxico (15 mg/ml) y gentamicina (8 mg/ml). En la misma posición se tomó una muestra de recto introduciendo 2 cm el hisopo en la ampolla rectal, girándolo sobre su propio eje y colocándolo en otro tubo con TH. Los tubos permanecieron en el área de parto a temperatura ambiente (25 °C) de 18 a 24 horas y todas las mañanas se trasladaron al laboratorio.
Identificación bacteriana
Los tubos de TH que presentaban turbidez se inocularon en placas de agar sangre de carnero al 5% (ASC5%), los que no tenían turbidez se incubaron durante 48 h más, los que tuvieron turbidez se inocularon en ASC5%. Las placas se incubaron durante 24 horas a 37 °C, se aislaron colonias b-hemolíticas, grampositivo, prueba de catalasa negativa, hidrólisis de hipurato positiva y CAMP positiva. La identificación de antígenos de grupo y solubles para los serotipos I, II y III se realizó con prueba de aglutinación de látex (Pastorex B Streptococci®, Sanofi Diagnostic Pasteur, Francia). En ausencia de aglutinación, el aislado se consideró no tipificable (NT).
El estudio fue aprobado por el Comité de Ética e Investigación del Hospital de Gineco-Obstetricia Tlatelolco (registro n.° 98-701-0010). Se obtuvo el consentimiento informado por escrito de todas las participantes.
Análisis estadístico
Se utilizó estadística descriptiva para las características generales de la muestra. Se utilizó la prueba de chi cuadrada (c2) para comparar la prevalencia de colonización por SGB entre mujeres con embarazos habituales y de alto riesgo. Se consideró significativo un valor de p < 0.05.
Resultados
Durante un periodo de 24 meses se incluyeron 3,347 mujeres embarazadas; 2,213 tenían embarazo de riesgo habitual (66%) y 1,134 embarazo de alto riesgo (34%). La edad media fue de 25.6 ± 5.3 años (rango: 14-43 años), el 95.5% tenía control prenatal. Se realizó cesárea en 1,370 (41%), siendo mayor en el grupo de embarazo de alto riesgo (62 vs. 32%, p < 0.001). El 27.5% presentó infección urinaria, el 15.5% ruptura prematura de membranas (RPM), preeclampsia en el 10.8% y anemia en el 1.6%. Hubo diferencias significativas en algunas características: edad, diabetes, preeclampsia, obesidad, fiebre y RPM > 12 horas. El resto de características se presenta en la tabla 1.
Tabla 1 Características de 3,347 embarazadas atendidas en un hospital de gineco-obstetricia de la Ciudad de México
| Riesgo del embarazo | p | ||
|---|---|---|---|
| Habitual | Alto | ||
| Edad (años) (media ± DE) | 24.9 ± 4.9 | 26.9 ± 5.7 | 0.0001† |
| Estado civil | |||
| Soltero | 178 (8%) | 57 (5%) | 0.003* |
| Casado | 2,036 (92%) | 1,076 (95%) | |
| Número de embarazos | 0.0001* | ||
| ≤ 2 | 1,703 (76.9%) | 775 (68.3%) | |
| ≥ 3 | 510 (23%) | 357 (31.4%) | |
| Control prenatal | 2,110 (95%) | 1,085 (96%) | 0.28 |
| Diabetes | 1 (0.04%) | 7 (0.6%) | 0.003* |
| Obesidad | 317 (14%) | 467 (41%) | 0.0001* |
| Preeclampsia | 46 (2%) | 316 (28%) | 0.0001* |
| Fiebre | 3 (0.1%) | 11 (1%) | 0.001* |
| Infección de vías urinarias | 8 (0.4%) | 8 (0.7%) | 0.13 |
| Corioamnionitis | 0 | 4 (0.4%) | 0.013* |
| RPM > 12 h | 18 (0.8%) | 60 (5.3%) | 0.0001* |
| Cesárea | 681 (32%) | 689 (62%) | 0.0001* |
| Cultivo positivo SGB | 77 (3.47%) | 68 (5.99%) | 0.001* |
| Total | 2,213 (66%) | 1,134 (34%) | |
*Prueba exacta de Fisher.
†Prueba t de Student.
DE: desviación estándar; RPM: ruptura prematura de membranas; SGB: Streptococcus del grupo B.
Colonización materna
En las 3,347 embarazadas se obtuvieron cultivos vaginales y rectales, aislándose SGB en uno o ambos sitios en 145, para una tasa de colonización del 4.3%. Esta tasa fue mayor en mujeres entre 30 y 34 años (6.8%) con una diferencia significativa con las menores de 19 años (3.6 vs. 6.8%, p = 0.033) y las menores de 25 y 30 años (Tabla 2). El SGB se aisló solo de la vagina en 85/145 (59%), del recto en 36/145 (25%) y de ambos sitios en 24/145 (17%); esto corresponde a 60/145 (42%) colonizados a nivel rectal y 109/145 (75%) a nivel vaginal (Fig. 1). La colonización por SGB fue mayor en el grupo de embarazo de alto riesgo que en el grupo de riesgo habitual (5.9 vs. 3.4%, p = 0.001) y en mujeres casadas, con fiebre y antecedentes de infección urinaria. La frecuencia de RPM fue mayor en mujeres embarazadas no colonizadas. No hubo diferencia significativa en ninguna de las otras características evaluadas (Tabla 3).
Tabla 2 Colonización por Streptococcus del grupo B en embarazadas de un hospital de gineco-obstetricia de la Ciudad de México
| Edad (años) | Mujeres embarazadas colonizadas | Total de mujeres embarazadas | p |
|---|---|---|---|
| ≤ 19* | 16 (3.6%) | 442 | |
| 20-24 | 33 (3.1%) | 1,052 | 0.64 |
| 25-29 | 51 (4.7%) | 1,093 | 0.007† |
| 30-34 | 38 (6.8%) | 556 | 0.033‡ |
| > 35 | 7 (3.4%) | 204 | 0.026§ |
| Total | 145 (4.3%) | 3,347 |
*Se tomó como referencia el primer estrato.
†Prueba exacta de Fisher, cuando se contrastan < 25 años vs. > 25 años.
‡Prueba exacta de Fisher, cuando se contrastan 30-34 vs. ≤ 19 años.
§Prueba exacta de Fisher, cuando se contrastan > 35 años vs. < 30 años.
Tabla 3 Características de embarazadas colonizadas y no colonizadas por Streptococcus del grupo B (SGB)
| Cultivo SGB | p | ||
|---|---|---|---|
| Positivo n (%) | Negativo n (%) | ||
| Edad (años) (Media ± DE) | 26.6 ± 5 | 25.5 ± 5.2 | 0.01* |
| Estado civil | |||
| Soltero | 5 (3.4%) | 232 (7.2%) | 0.047† |
| Casado | 138 (95.1%) | 2,920 (91.2%) | |
| Desconocido | 2 (1.4%) | 50 (1.5%) | |
| Número de embarazos | |||
| < 3 | 105 (72.4%) | 2,374 (74.1%) | 0.35† |
| ≥ 3 | 40 (27.6%) | 828 (25.9%) | |
| Edad gestacional (semanas) | |||
| ≤ 36 | 2 (1.3%) | 132 (4.1%) | 0.06‡ |
| ≥ 37 | 143 (98.6%) | 3,070 (95.9%) | |
| Obesidad | 40 (28%) | 745 (23%) | 0.13† |
| Diabetes | 0 | 8 (0.2%) | 0.7† |
| RPM | 15 (10.3%) | 505 (16%) | 0.04† |
| Preeclampsia | 16 (11%) | 346 (11%) | 0.50† |
| Fiebre | 2 (1.3%) | 11 (0.3%) | 0.02† |
| Infección urinaria reciente | 2 (1.3%) | 14 (0.4%) | 0.15† |
| Infección urinaria pasada | 50 (34.4%) | 870 (27%) | 0.03† |
| Corioamnionitis | 1 (0.7%) | 3 (0.1%) | 0.16† |
| Total | 145 (100%) | 3,202 (100%) | |
*Prueba t de Student.
†Prueba c2.
‡Prueba exacta de Fisher.
DE: desviación estándar; RPM: ruptura prematura de membranas
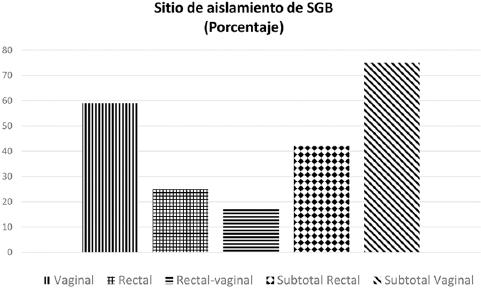
Figura 1 Sitio de aislamiento de Streptococcus del grupo B (SGB) en 145 gestantes atendidas en un hospital de gineco-obstetricia de la Ciudad de México.
Serotipos
El serotipo I (58%) fue el más frecuente en ambos grupos. Aunque se observó una mayor identificación del serotipo III en el grupo de alto riesgo (24 vs. 21%) con menor frecuencia de serotipo II (9 vs. 16%), no hubo diferencias significativas (p = 0.42) (Tabla 4).
Tabla 4 Serotipos de Streptococcus del grupo B (SGB) en mujeres con embarazo habitual y de alto riesgo
| Serotipo | Riesgo del embarazo | Total | |
|---|---|---|---|
| Habitual n (%) | Alto n (%) | ||
| I | 42 (55%) | 42 (62%) | 84 (58%) |
| II | 12 (16%) | 6 (9%) | 18 (13%) |
| III | 16 (21%) | 17 (25%) | 33 (22%) |
| NT | 7 (9%) | 3 (5%) | 10 (7%) |
| Cultivo SGB positivo | 77 (100) | 68 (100) | 145 |
NT: no tipificable
Discusión
El SGB se considera microbiota normal del intestino, la vagina y el recto, sin embargo, se le identifica como un patógeno importante del RN y la mujer embarazada. Aproximadamente una de cada cinco mujeres embarazadas en todo el mundo están colonizadas17, factor de riesgo conocido para enfermedad neonatal invasiva temprana18,19; la frecuencia varía según el sitio colonizado, la edad gestacional, la ruta de nacimiento, así como las diferencias intrínsecas y la ubicación geográfica de las poblaciones estudiadas.
No existe un estándar internacional establecido para el muestreo de colonización materna por SGB, lo que genera variaciones al comparar estudios de diferentes países. Estas variaciones pueden deberse al método y momento del muestreo, sitios anatómicos muestreados y técnicas de laboratorio utilizadas para transportar y cultivar muestras20,21.
En el presente estudio la frecuencia de colonización (4.3%) fue menor que la reportada en el mundo (17.9%, intervalo de confianza del 95% [IC 95%]: 16.2-19.7%)22, con un rango del 11.1% (IC 95%: 6.8-15.3%) en el sudeste asiático al 22.4% en África (IC 95%: 18.1-26.7%). Algunos países como Brasil (14%), China (14%), Nigeria (19.5%) y Arabia Saudita (19%) tienen una frecuencia alta22-27. En México también hay diferencias con estudios previos realizados: Collado, et al. en 1981 encontraron un 4% de colonización10, sin embargo, en un centro de atención de tercer nivel en la CDMX se reportó un 10.3%, en una población rural del sur del país encontraron un 8.6%12 y en un hospital de segundo nivel en el occidente de México un 13%13. La colonización en la población de alto riesgo del presente estudio fue menor a la encontrada en 1989 en la CDMX (6 vs. 10.3%)11. Quizá las diferencias el presente estudio podría explicarse por el tamaño de muestra y que el muestreo fue en mujeres embarazadas que estaban en TP, recién ingresadas y la mayoría con embarazos a término. La colonización por SGB fue mayor en mujeres con embarazo de alto riesgo, esta frecuencia aumenta a mayor edad, sin embargo, esta frecuencia es menor que la observada en otras poblaciones del mundo22-27.
Se ha sugerido que se deben realizar cultivos vaginales y rectales simultáneamente; en este estudio, el 25% de los aislamientos se obtuvieron solo del recto, por lo que, si solo se hubieran tomado cultivos vaginales, se hubiera escapado un porcentaje significativo de mujeres colonizadas. Lo anterior apoya el tomar muestras en ambos sitios28.
A nivel mundial, cinco serotipos de SGB (Ia, Ib, II, III y V) representan el 98% de los serotipos predominantes17. En nuestro estudio predominó el serotipo I, como se informó anteriormente en México11-14 y en otras regiones del mundo17. El serotipo V no se buscó en este estudio porque se consideró de muy baja frecuencia en México según estudios previos11-14.
Debido a la frecuencia de colonización e infecciones perinatales por SGB, en EE.UU. y otros países desarrollados se recomienda buscarlo de manera sistemática en todas las mujeres embarazadas entre las 35 y 37 semanas de gestación, y administrar profilaxis antibiótica a las mujeres colonizadas desde cuatro horas antes del parto. Esta estrategia ha logrado una disminución drástica en la incidencia de la enfermedad neonatal de aparición temprana, sin modificar la incidencia de infecciones de aparición tardía29. En otros países, esta política no se ha adoptado, por la falta de información sobre colonización y transmisión al RN. En los países subdesarrollados hay limitaciones para contar con datos epidemiológicos por la falta de pruebas fáciles, rápidas y de bajo costo. La realización de cultivos es una práctica costosa y que requiere mucho tiempo. Un escrutinio basado en el riesgo materno no ha ofrecido buenos resultados28.
En la población de mujeres mexicanas la colonización cervicovaginal y rectal por SGB es baja en comparación con otros países, por tanto, la realización de cultivos en todas las embarazadas no parece justificado en México, considerando el alto costo de esta práctica y la baja probabilidad de detectar mujeres colonizadas. Por ahora, la información disponible es insuficiente para establecer un programa de profilaxis antimicrobiana intraparto.
Una debilidad de este estudio es que solo se incluyeron mujeres embarazadas de la Ciudad de México, sin embargo, la información disponible de otros Estados del país sugiere que este bajo porcentaje de colonización es real12,13. Los factores que pueden estar condicionando esta baja tasa de colonización en la población mexicana aún se desconocen y, por lo tanto, constituyen un campo que requiere futuras investigaciones.











 nueva página del texto (beta)
nueva página del texto (beta)


