Antecedentes
La enfermedad por coronavirus 2019 (COVID-19) es una enfermedad respiratoria causada por el nuevo coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), virus de ARN más contagioso e infeccioso que el SARS-CoV (2002) y el coronavirus causante del síndrome respiratorio de Oriente Medio (MERS-CoV) (2012)1-4.
Infecta células epiteliales a través de la enzima convertidora de angiotensina 2 (ACE2), empleando proteína Spike5-7. Genera síntomas como fiebre (83-98%), tos (46-82%), mialgia o fatiga (11-44%), disnea (31%), gastropatías (10%), hipotensión (60%)6, linfopenia, leucopenia, trombocitopenia, incremento de citocinas inflamatorias, biomarcadores cardiacos elevados y disminución de albúmina6. Aunque las enfermedades respiratorias por COVID-19 son foco de atención, existen estudios que reportan lesiones oculares7, alteraciones testiculares8, ACE2 en ovario9, alteraciones de sistema nervioso10,11, trombosis12, alteraciones placentarias13 y complicaciones en embarazo14,15.
Por lo anterior, analizamos una serie de casos de embarazadas con COVID-19 asintomáticas, con el objetivo de analizar datos histopatológicos placentarios, para evaluar efectos y riesgos fetales en último trimestre del embarazo, aunado a revisión de literatura reciente.
Material y método
Estudio retrospectivo, observacional y transversal, que incluye a 29 pacientes que acudieron en 2020 a la clínica PRONATAL (Hospital Bíte Médica, CDMX) para atención obstétrica. Los datos clínicos se tomaron del expediente electrónico, previo consentimiento informado.
Las pacientes fueron hospitalizadas en la sala de labor para atención obstétrica, siguiendo protocolo implementado por pandemia de COVID-19. Incluyó presentación de prueba COVID-19, no mayor a una semana antes de realizarse el ingreso de paciente o en caso contrario al ingreso, si presentaban complicaciones como amenaza de parto prematuro. El personal de salud portaba material de seguridad para evitar contagios (cubrebocas, caretas, gorros, guantes, etc.) y el quirófano se desinfectaba antes y después de su utilización16. Se formaron 2 grupos: 1) control, las que nunca adquirieron COVID-19 y 2) COVID-19, las asintomáticas con COVID-19 en tercer trimestre de gestación.
Las pruebas de COVID-19 se enviaron al Centro de Diagnóstico Celular (Genes and Care, Ciudad de México), reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR), kit de detección: Logix Smart TM Coronavirus Disease 2019 (COVID19), Validación InDRE oficio DGE-DSAT-03863-2020. Permiso InDRE oficio DGE-DDYR-08355-2020.
Las placentas se procesaron por el Departamento de Patología Bíte Médica. Las secciones típicas se fijaron en formalina, se procesaron en parafina y tiñeron con hematoxilina/eosina.
La recolección de datos se realizó por enfermería, médicos e investigador de PRONATAL (datos generales, resultados COVID-19 e histopatología placentaria). Protegiendo el anonimato, sin referenciar origen de información y solo mostrando datos numéricos. Criterios de inclusión: mujeres asintomáticas positivas a COVID-19, embarazos a término y pretérmino. Criterios de exclusión: no aceptaron inclusión, niveles altos de natural killer, factor de necrosis tumoral y con enfermedades autoinmunes.
Las características clínicas de la gestante (edad, peso, talla, temperatura, saturación de O2, presión sanguínea [mmHg], frecuencia cardiaca y respiratoria) y datos del recién nacido (edad gestacional, peso y talla), se reportan con media ± desviación estándar (DE) y se analizaron empleando la t de Student; por otra parte, las trombofilias, cesáreas, partos y abortos espontáneos se reportan en porcentajes y se analizaron empleando chi cuadrada, utilizando el paquete estadístico SPSS versión 25.
Resultados
Se incluyeron 29 mujeres para atención obstétrica, de las cuales 9 se incorporaron en grupo COVID-19 y 20 en grupo CONTROL. Comparando grupos, no se observó diferencia en datos generales y signos clínicos de embarazadas (peso, talla, índice de masa corporal, temperatura, saturación de O2, presión sanguínea, frecuencia cardiaca y respiratoria) (Tabla 1).
Tabla 1 Datos generales y signos maternos en día de parto
| Control (x ̄ ± DE) | COVID-19 (x ̄ ± DE) | p ≤ 0.05 | |
|---|---|---|---|
| N | 20 | 9 | - |
| Peso (kg) | 72.9 ± 11.1 | 74.5 ± 9.3 | - |
| Talla (cm) | 1.62 ± 0.04 | 1.61 ± 0.04 | - |
| IMC | 27.6 ± 3.3 | 28.5 ± 2.5 | - |
| Edad (años) | 35.8 ± 5 | 35.4 ± 4.6 | - |
| Temperatura (°C) | 36.4 ± 0.3 | 36.5 ± 0.5 | - |
| Saturación de O2 | 95.1 ± 0.7 | 95.9 ± 0.8 | - |
| Presión sanguínea (mmHg) | 1.5 ± 0.1 | 1.5 ± 0.1 | - |
| Frecuencia cardiaca | 81.8 ± 13.6 | 86.4 ± 8.9 | - |
| Frecuencia respiratoria | 19.7 ± 1.3 | 18.7 ± 8.4 | - |
DE: desviación estándar; IMC: índice de masa corporal.
Con respecto al grupo COVID-19, el día del parto las pacientes 2, 4, 5, 6, 8 y 9 se encontraban entre día 0 y 10.5 de la infección, después de dar positivas por técnica de RT-PCR y únicamente las pacientes 1, 3 y 7 habían superado la fase de resguardo recomendada para esta infección (14 días) (Fig. 1).
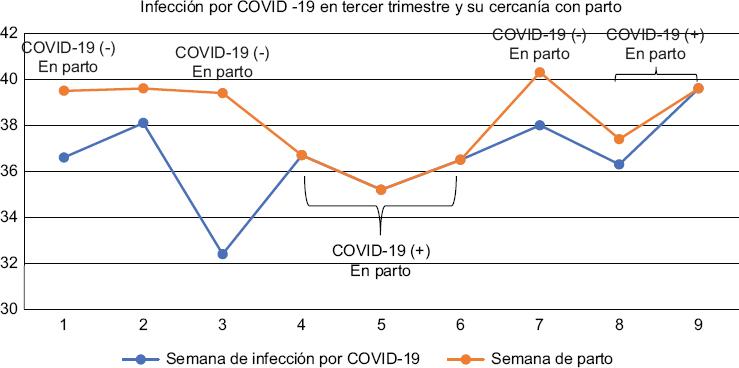
Figura 1 Muestra, semanas de gestación y parto en relación con el estado positivo o negativo de COVID-19.COVID-19: enfermedad por coronavirus 2019.
En cuanto al tipo de parto, hubo mayor prevalencia de COVID-19 en cesáreas vs. control (77.7 vs. 30%) (Tablas 2 y 3). Se encontraron complicaciones en COVID-19 como parto pretérmino (33.3%), desprendimiento prematuro de placenta (20%), hipertensión (11.1%), proteinuria (11.1%), preeclampsia leve (11.1%), oligohidramnios e hipomotilidad fetal (11.1%); y en el grupo control de desprendimiento de placenta (5%) y ruptura prematura de membranas (5%) (Tablas 2 y 3). En control, las cesáreas fueron petición de la paciente (10%) debido a segmento uterino delgado, inminencia de ruptura uterina y desprendimiento de placenta. Adicionalmente, la prevalencia de partos fue menor en el grupo COVID-19 vs. control (22.2 vs. 70%) (Tablas 2 y 3). Ningún grupo presentó complicaciones en puerperio.
Tabla 2 Características de parto (grupo COVID-19)
| N | Edad (años) | Historial de nacimientos | SDG | Tipo de alumbramiento | Características y complicaciones |
|---|---|---|---|---|---|
| 1 | 38 | G2P1C1 | 39.5 | Vaginal | Sin complicaciones |
| 2 | 35 | G0 | 36.6 | Vaginal | Sin complicaciones |
| 3 | 36 | G0 | 39.4 | Cesárea | Desprendimiento de placenta |
| 4 | 41 | G2A2 | 36.7 | Cesárea | Parto pretérmino |
| 5 | 39 | G11A3P8 | 35.2 | Cesárea | Parto pretérmino |
| 6 | 32 | G8A6C2 | 36.5 | Cesárea | Parto pretérmino |
| 7 | 34 | G2C2 | 40.3 | Cesárea | Desprendimiento de placenta |
| 8 | 44 | G2A2 (electivas) | 37.4 | Cesárea | Hipertensión, proteinuria, preeclampsia leve |
| 9 | 27 | G3A3 | 39.6 | Cesárea | Oligohidramnios y hipomotilidad de bebe |
| Total | 35.8 ± 5 (x ̄ ± DE) | - | 37.8 ± 1.8 (x ̄ ± DE) | 77.7% cesárea | 22.2% sin complicaciones, 33.3% parto pretérmino, 22.2% desprendimiento de placenta, 11.1% oligohidramnios, 11.1% hipomotilidad, 11.1% hipertensión, 11.1% proteinuria y 11.1% preeclampsia leve |
COVID-19: enfermedad por coronavirus 2019; SDG: semanas de gestación; DE: desviación estándar.
Tabla 3 Características de parto (control)
| N | Edad (años) | Historial de nacimientos | SDG | Tipo de alumbramiento | Características y complicaciones |
|---|---|---|---|---|---|
| 1 | 34 | G3P3 | 37.3 | Vaginal | Sin complicaciones |
| 2 | 44 | G1A1 | 38.3 | Cesárea | Electivo, sin complicaciones |
| 3 | 42 | G0 | 39.3 | Vaginal | Sin complicaciones |
| 4 | 31 | G0 | 40.2 | Vaginal | Sin complicaciones |
| 5 | 39 | G1P1 | 38.5 | Vaginal | Sin complicaciones |
| 6 | 36 | G1A1 | 40.3 | Vaginal | Sin complicaciones |
| 7 | 32 | G0 | 38.6 | Cesárea | Desprendimiento de placenta |
| 8 | 36 | G1C1 | 38.2 | Cesárea | Electivo, sin complicaciones |
| 9 | 31 | G1P1 | 38.5 | Vaginal | Sin complicaciones |
| 10 | 35 | G0 | 40.2 | Vaginal | Sin complicaciones |
| 11 | 39 | G1C1 | 39.5 | Cesárea | Segmento uterino delgado y sin complicaciones |
| 12 | 37 | G1P1 | 38.6 | Vaginal | Sin complicaciones |
| 13 | 38 | G2C1A1 | 39.5 | Cesárea | Segmento uterino delgado y ruptura prematura de membranas |
| 14 | 36 | G0 | 39.4 | Vaginal | Sin complicaciones |
| 15 | 43 | G3A3 | 39.1 | Cesárea | Segmento uterino delgado y sin complicaciones |
| 16 | 40 | G0 | 39.2 | Vaginal | Sin complicaciones |
| 17 | 34 | G0 | 38.2 | Vaginal | Sin complicaciones |
| 18 | 29 | G0 | 40.2 | Vaginal | Sin complicaciones |
| 19 | 32 | G0 | 39.4 | Vaginal | Sin complicaciones |
| 20 | 27 | G1P1 | 39.2 | Vaginal | Sin complicaciones |
| Total | 35.4 ± 4.6 (x ̄ ± DE) | - | 39 ± 0.8 (x ̄ ± DE) | 30% cesáreas | 90% sin complicaciones, 5% desprendimiento de placenta y 5% desprendimiento de membrana |
SDG: semanas de gestación; DE: desviación estándar.
De acuerdo con los antecedentes obstétricos de cada paciente, el grupo COVID-19 presentó prevalencia de pérdida gestacional recurrente del 44.4%, una paciente refirió dos abortos inducidos (11.1%); en cuanto al control, la prevalencia de pérdida gestacional recurrente fue del 10% (Tablas 2 y 3).
Los datos perinatales mostraron disminución estadística de semanas de gestación en COVID-19 comparando con control (37.8 ± 1.8 vs. 39 ± 0.8; p ≤ 0.05); con resultados similares en ambos grupos respecto al peso del recién nacido (2,915 ± 535.4 vs. 3,013 ± 518.8 gramos) y la talla (48.1 ± 2 vs. 48.5 ± 3.3 cm) (Fig. 2).

Figura 2 Datos perinatales de recién nacidos de madres infectadas por COVID-19 durante el último trimestre de embarazo. A: semanas de gestación. B: peso del recién nacido. C: talla de recién nacido.*Diferencia estadística de semanas de gestación (control vs. COVID-19, p ≤ 0.05), t de Student.COVID-19: enfermedad por coronavirus 2019; DE: desviación estándar.
En reportes histopatológicos placentarios, encontramos que COVID-19 vs. control presentó mayor prevalencia de trombos organizados en vellosidades placentarias (55.5 vs. 0%); además, de trombo laminado en una arteria (11.1 vs. 0%), hemorragia perivascular (33.3 vs. 0.0%), hemorragia en vellosidades (55.5 vs. 42.1%), hemorragia subcorial (11.1 vs. 5.2%), hematoma retroplacentario (22.5 vs. 15.7%) y edema estromal (44.4 vs. 31.5%) (Fig. 3); en control fueron mayores los cambios isquémicos de vellosidades (84.2 vs. 55.5%) y presencia de fibrina en espacios intervellosos (68.4 vs. 11.1%) (Fig. 3). Se presentan los datos histopatológicos de las alteraciones en las 9 placentas (Fig. 4).
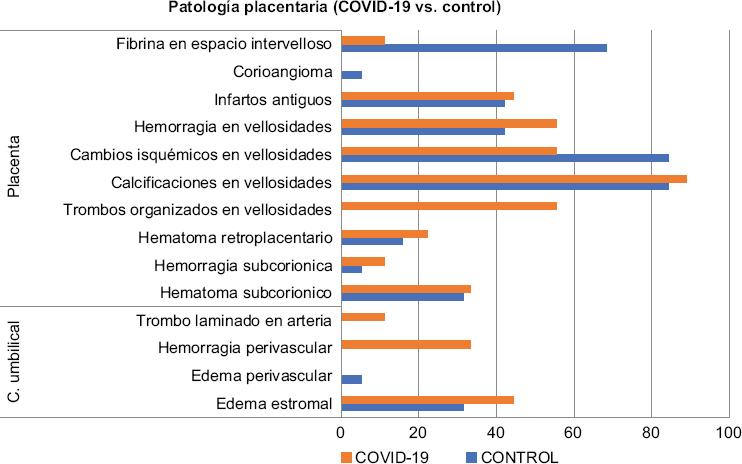
Figura 3 Diferencia estadística de fibrina en espacio intervelloso (COVID-19 vs. control, p ≤ 0.05), chi cuadrada.

Figura 4 A: descripción macroscópica: placenta de 405 g, áreas hemáticas con hematoma de 5 cm. B y C: descripción microscópica: hematoma retroplacentario marginal de 5 cm, trombos organizados no laminados, vellosidades coriónicas del tercer trimestre con calcificaciones en el 5% de la superficie y cambios isquémicos en el 10%. Similares a las otras 8 placentas estudiadas.
Discusión
Antecedentes de algunos patógenos virales (citomegalovirus, virus de la varicela zóster, etc.), generan inquietud de probables efectos del SARS-CoV-2 en embarazadas y el desarrollo del bebé17,18.
En relación con el SARS-CoV y MERS, se ha reportado incremento de aborto de primer trimestre, parto pretérmino, ruptura prematura de membranas, restricción de crecimiento intrauterino y tasa de cesárea19-23, con histopatología placentaria que reporta gran cantidad de fibrina (intervellosa y subcoriónica), calcificaciones en vellosidades, infartos, hipotrofia placentaria y vasculopatía trombótica en algunas vellosidades24-32. SARS-CoV-2, SARS-CoV y MERS-CoV tienen mecanismos equivalentes de infección, lo que quizás resulte en alteraciones materno/fetales similares33.
Por su parte, no existe evidencia concluyente de transmisión vertical intrauterina del SARS-CoV-2 y las complicaciones maternas/fetales reportadas han incluido sufrimiento fetal intrauterino (14%) y ruptura prematura de membranas (8%) y en los recién nacidos, dificultad respiratoria (6%), síntomas gastrointestinales (4%) y fiebre (3%)34. En este estudio, las pacientes positivas a COVID-19 no desarrollaron síndrome respiratorio agudo severo, manteniendo estado latente y quizás compensado inmunitariamente35. Se observaron complicaciones durante el alumbramiento, como: alta tasa de cesárea (77%), parto pretérmino (33.3%), desprendimiento de placenta (22.2%), preeclamsia leve (11.1%) y asociación de oligohidramnios e hipomotilidad fetal (11.1%), coincidiendo con publicaciones de embarazos con COVID-19 severa, los cuales presentaron altas tasas de cesárea, de hasta el 92%, y parto pretérmino del 11 al 42%35-37, que presentaron comorbilidades o complicaciones como preeclampsia, diabetes gestacional, hipotiroidismo, placenta previa y cirugías uterinas previas38. A su vez, la COVID-19 se ha localizado predominantemente en células del sincitiotrofoblasto en la interfaz maternofetal de la placenta38. Además, en placentas de semana 27 y 39 obtenidas de mujeres infectadas por SARS-CoV-2 severo se ha encontrado incremento de factores que predisponen a alteraciones placentarias, como trombosis, infartos y remodelación de la pared vascular en vellosidades coriónicas39.
En nuestros datos perinatales se observa que embarazadas asintomáticas con COVID-19 en tercer trimestre presentan disminución de semanas de gestación en comparación con control (37.8 ± 1.8 vs. 39 ± 0.8; p = 0.05). De igual forma, Metz (2021), Flores (2021) y Martínez (2020) encontraron en pacientes con síntomas severos disminución de semanas de gestación y bajo peso al nacer40-42.
A su vez, este trabajo muestra incremento de trombos organizados en vellosidades (33.3 vs. 0%) y hemorragia perivascular (55.5 vs. 0%) en COVID-19 vs. control, similar a estudios que reportan infartos de vellosidades (20 vs. 2%), necrosis fibrinoide (20 vs. 0%), hipertrofia mural de membranas (33 vs. 4%), corangiosis (27 vs. 5%), edema velloso (27 vs. 9%), trombos intravellosos (40 vs. 8%), fibrina (52 vs. 6%), microcalcificaciones (60 vs. 4%), pequeñas vellosidades fibróticas (28 vs. 0%), aglutinación de vellosidades (18 vs. 0%) y aumento de nudos sincitiales (40 vs. 2%)38,42.
El estado de hipercoagulación que se presenta durante el embarazo podría favorecer estas alteraciones, aunado a la alta prevalencia de trombofilias heredadas que presenta la población mexicana43,44, donde se ha observado un estado protrombótico inducido por el incremento en sangre periférica del dímero D, del 36 al 43% en pacientes con COVID-1945.
El estado protrombótico por COVID-19 en embarazadas quizás sea generado de forma similar a los eventos reportados de trombosis venosa profunda, embolia pulmonar, infarto de miocardio y accidente cerebrovascular isquémico, en pacientes con COVID-1946,47.
En este estudio reportamos pocos casos de mujeres asintomáticas que presentaron la prueba de COVID-19 positiva, al final del embarazo; lo cual indica que puede existir ya riesgo perinatal, por medio del estudio histopatológico de la placenta, en mujeres que no desarrollaron el síndrome respiratorio agudo severo; se requiere mayor investigación conforme se presenten más casos de embarazo con COVID-19 para identificar qué pacientes asintomáticas positivas realmente tienen riesgo perinatal.
La salud de las mujeres embarazadas, independientemente de que presenten síntomas leves con mayor frecuencia, incluso cursen asintomáticas, como fueron nuestras pacientes; requiere vigilancia estrecha durante esta pandemia y asistencia crítica oportuna en casos severos.
Limitaciones
El tamaño pequeño de la muestra, que por sí solo no es significativo, pero aunado a estudios que se han desarrollado hasta la fecha puede dar información que nos ayude a detectar alteraciones que pudieran ser generadas en el parto por la COVID-19.
Conclusiones
La infección asintomática por COVID-19 en el tercer trimestre del embarazo puede potenciar un perfil protrombótico preexistente, incrementando el riesgo de trombosis; principalmente si se desarrolla el síndrome respiratorio agudo severo, generando alteraciones como desprendimiento de placenta, preeclampsia, hemorragias e incremento de partos pretérmino.











 nueva página del texto (beta)
nueva página del texto (beta)


