Introducción
La micosis fungoide (MF) es el linfoma cutáneo de células T más frecuente junto con el síndrome de Sezary; representa 50 % de los casos y se caracteriza por proliferación de linfocitos T atípicos con epidermotropismo.1 Maurelli et al.2 reportaron una incidencia anual de linfomas cutáneos en Europa de 10 por millón de habitantes; 71 % correspondió a linfomas cutáneos de células T y de 50 a 73 %, a MF.
Los linfomas cutáneos primarios son un grupo heterogéneo de linfomas extraganglionares no Hodgkin con un tropismo particular hacia la piel; se dividen de acuerdo con su estirpe celular, se consideran de bajo potencial de malignidad y su pronóstico es diferente al de los linfomas sistémicos. Solo 1 a 2 % de los casos puede presentar diseminación sistémica, estadio de la enfermedad en el que la supervivencia es pobre y el desenlace es fatal.3
La etiopatogenia de los linfomas cutáneos primarios sigue siendo estudiada, aunque la teoría de estimulación antigénica a largo plazo es la más reconocida. La respuesta inflamatoria ante estímulos persistentes provoca expansión clonal continua de células T y la activación de vías dependientes de citocinas, lo que puede explicar inicialmente el infiltrado de linfocitos atípicos. También se han considerado las infecciones virales como desencadenantes, especialmente por virus de Epstein-Barr, variantes del parvovirus (B19, LaL1/K1,V9), herpes virus tipo 7 (HHV-7) y algunos poliomavirus humanos (HPyVs6, HPyVs7).4
La Organización Mundial de la Salud y la Organización Europea para la Investigación y Tratamiento del Cáncer reconocen la MF clásica, la piel laxa granulomatosa, la reticulosis pagetoide y la variedad foliculotrópica en el listado de clasificación de linfomas cutáneos.5
La evolución clásica, descrita por Alibert-Bazin, se caracteriza por la progresión desde una fase macular eritematosa a la aparición de placas infiltradas para terminar en neoformaciones en la fase tumoral. Sin embargo, existen numerosos reportes de casos de variedades clínicas no registradas en el listado anterior.6
Aunque la MF representa una entidad poco prevalente, es importante conocer las variantes de expresión clínica para la detección y tratamiento oportuno. Agar et al.7 realizaron el estudio más extenso, con 1502 pacientes de quienes describieron algunas características demográficas y el pronóstico de la enfermedad. Asimismo, Peña-Romero et al.8 reseñaron los hallazgos en una cohorte de pacientes con MF hipopigmentada en el Hospital General de México.
El objetivo del presente estudio fue identificar las características sociodemográficas de una cohorte de pacientes con diagnóstico de MF en un periodo de 11 años en un centro de referencia nacional para atención al paciente con problemas de piel.
Métodos
Se realizó un estudio de cohorte retrospectivo en pacientes con diagnóstico de MF del Centro Dermatológico Dr. Ladislao de la Pascua. El protocolo de investigación fue revisado y aprobado por los comités institucionales de investigación y de ética en investigación. Se revisaron los expedientes electrónicos de los pacientes con diagnóstico de MF, clasificados con la clave CIE-10 C.84, del 1 de enero de 2007 al 31 de diciembre de 2018. Se excluyeron los expedientes en los que no se dispusiera del reporte histológico confirmatorio.
Los datos que se obtuvieron de cada expediente incluyeron características sociodemográficas, curso clínico de la MF, estado clínico del paciente al momento de la última cita médica y tiempo de respuesta al tratamiento. El estado clínico del paciente al término del seguimiento se clasificó como remisión, persistencia y progresión con base en el grado de infiltración cutánea y de superficie corporal afectada:
Remisión, si en la última visita médica documentada en el expediente electrónico el médico tratante indicó que el paciente se encontraba sin lesiones compatibles con MF ni infiltración cutánea.
Persistencia, si el estadio TNM era menor al inicial.
Progresión, si el estadio TNM era mayor al inicial.
La superficie corporal afectada estaba documentada en el expediente electrónico con el registro fotográfico estandarizado del cuerpo completo con el que se cuenta en el centro donde se realizó la investigación. Se definió como tiempo de respuesta al tratamiento al tiempo transcurrido desde que el médico comunicó al paciente el resultado del estudio histológico y se inició el tratamiento (fecha de visita médica posterior al registro electrónico del resultado de la biopsia) y la fecha de la visita médica en la cual se registró la remisión de las lesiones de MF por parte del médico tratante y que se corroboró la suspensión del tratamiento.
Para el análisis estadístico se utilizó el programa IBM SPSS versión 19. La descripción de las variables cualitativas se llevó a cabo mediante proporciones, mientras que las variables cuantitativas con distribución normal se describieron mediante medias y desviación estándar. Para la descripción del tiempo de respuesta al tratamiento se utilizó la mediana y el rango intercuartilar. El análisis de variables se realizó con la prueba de chi cuadrada, comparando los resultados.
Resultados
Se identificaron 335 expedientes clínicos electrónicos con diagnóstico de MF, de los cuales solo 290 contaban con resultado histológico confirmatorio; 168 correspondieron a mujeres (57.9 %) y 122, a hombres (42.1 %), con una relación de 1.3:1. La media de edad fue de 43 años, el paciente con menor edad tuvo cinco años y el de mayor edad, 90 años. El grupo de edad más frecuente fue el de 31 a 45 años, que representó 29 % de la población, seguido por el de 46 a 60 años (23.8 %). La mediana de la enfermedad fue de seis años.
Características clínicas
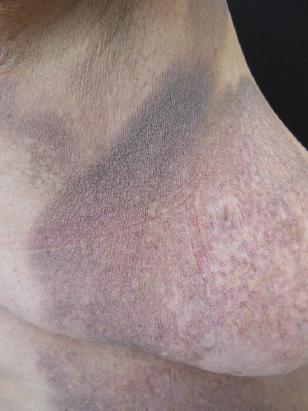
La variedad clásica se presentó en 134 pacientes, de los cuales 128 (44.1 %) se encontraron en fase de placa (Figura 1), seis en fase de mancha (1.7 %) y uno en fase tumoral (0.3 %). Las discromías se presentaron en 102 pacientes (35.2) y se clasificaron en hipopigmentadas e hiperpigmentadas. La variedad hipopigmentada (Figura 2) fue la segunda más frecuente en nuestro estudio, afectó a 51 pacientes (17.6 %). En cuanto a las hiperpigmentadas (Figura 3), se categorizaron en las que se presentaron en pliegues (7.9 %) y las que se ubicaron en otros sitios (9.7 %). La variedad poiquilodérmica (Figura 4) fue la tercera variedad más frecuente: se observó en 12 pacientes (4.1 %). La variedad foliculotrópica (Figura 5) se registró en nueve pacientes (3.1 %), la papular en seis (2.1 %), la eritrodérmica en cuatro (1.4 %), la de placa única en tres (1 %), la granulomatosa en dos (0.7 %) y la piel laxa granulomatosa, siringotrópica e ictiosiforme en un paciente cada una. La distribución detallada por sexo se muestra en la Tabla 1.
Tabla 1 Variedades clínicas de micosis fungoide en pacientes adultos y pediátricos
| Tipo | Adultos | Niños | % del total | p | ||
|---|---|---|---|---|---|---|
| Sexo | n | Sexo | n | |||
| Clásica: fase de mancha | F | 2 | F | 1 | 1.7 | 0.79 |
| M | 1 | M | 1 | |||
| Clásica: fase de placa | F | 63 | F | 3 | 44.1 | 0.001 |
| M | 56 | M | 5 | |||
| Clásica: fase tumoral | F | 0 | F | 0 | 0.3 | 0.69 |
| M | 1 | M | 0 | |||
| Hiperpigmentada | F | 18 | F | 1 | 9.7 | 0.47 |
| M | 5 | M | 4 | |||
| Hipopigmentada | F | 22 | F | 10 | 17.6 | < 0.001 |
| M | 10 | M | 9 | |||
| Foliculotrópica | F | 3 | F | 1 | 3.1 | < 0.84 |
| M | 5 | M | 0 | |||
| Siringotrópica | F | 1 | F | 0 | 0.3 | < 0.69 |
| M | 0 | M | 0 | |||
| Pliegues | F | 16 | F | 0 | 7.9 | < 0.18 |
| M | 6 | M | 1 | |||
| Granulomatosa | F | 1 | F | 0 | 0.7 | < 0.58 |
| M | 1 | M | 0 | |||
| Piel laxa granulomatosa | F | 1 | F | 0 | 0.3 | < 0.69 |
| M | 0 | M | 0 | |||
| Placa única | F | 1 | F | 0 | 1 | < 0.49 |
| M | 2 | M | 0 | |||
| Papular | F | 4 | F | 2 | 2.1 | < 0.15 |
| M | 0 | M | 0 | |||
| Poiquilodérmica | F | 12 | F | 0 | 4.1 | < 0.16 |
| M | 0 | M | 0 | |||
| Polimorfa | F | 5 | F | 0 | 5.2 | < 0.43 |
| M | 9 | M | 1 | |||
| Ictiosiforme | F | 1 | F | 0 | 0.3 | < 0.69 |
| M | 0 | M | 0 | |||
| Eritrodérmica | F | 1 | F | 0 | 1.4 | < 0.43 |
| M | 3 | M | 0 | |||
| Urticariforme | F | 1 | F | 0 | 0.3 | < 0.69 |
| M | 0 | M | 0 | |||
En 5.2 % de los pacientes se encontraron diferentes formas clínicas coexistentes, las cuales se catalogaron como polimorfas; la combinación más frecuente fue la variedad en placas con poiquilodermia, hiperpigmentación e hipopigmentación (Figura 6). En más de 50 % de los pacientes, la micosis fungoide fue diseminada y los sitios más afectado fueron el tronco (86 %) y las extremidades superiores e inferiores (77 y 74 %, respectivamente); el cuello se afectó en 29 % de los pacientes y la cabeza en 23 %.
Respuesta al tratamiento
Las modalidades terapéutcias fueron manejo conservador, fototerapia, inhibidores de calcineurina, inmunosupresores, esteroides y retinoides tópicos o sistémicos, de acuerdo con el caso. De ellas, la fototerapia fue utilizada en 157 pacientes (54 %), de los cuales 109 (69.4 %) recibieron PUVA (psoraleno por vía oral y exposición posterior a radiación ultravioleta A) en cabina vertical y 48 (30.6 %) PUVA-sol. En 36 pacientes se utilizaron ambas modalidades. En relación con la respuesta al tratamiento, 219 presentaron remisión (75.5 %), 68 (22.6 %) remisión total y 151 (52 %), remisión parcial con disminución de las lesiones. Los 70 pacientes restantes presentaron persistencia de las lesiones, 52 dejaron de asistir por razones ajenas al tratamiento, incluyendo cambio de domicilio o de servicio médico, 10 pacientes continuaban en vigilancia y se encontraban en terapia con radiación ultravioleta A en cabina vertical y seis fueron derivados a tercer nivel de atención.
Discusión
La expresividad clínica de la micosis fungoide es heterogénea; en nuestra población, el comportamiento en adultos fue distinto al de los pacientes pediátricos. La variedad clásica en fase de placa se presentó más en los adultos que en los niños, en quienes la variedad hipopigmentada fue la más frecuente (p = 0.001 y p < 0.001, respectivamente). A diferencia de 60 % de la población de Reino Unido reportada por Agar et al., 44 % de la población presentó la variedad clásica en fase de placa. La variedad hipopigmentada se observó en 17 % de la población, en la misma proporción encontrada por Peña Romero et al., quienes realizaron un reporte en pacientes en el Hospital General de México. En la literatura, la incidencia es mayor en hombres con una edad media de 50 años, con un índice comparativo de 2:1 respecto a las mujeres.9 En nuestro estudio, las mujeres fueron las más afectadas (57.9 %), con un índice comparativo con los hombres de 1.3:1. Atribuimos las diferencias clínicas a las características de la población mexicana, en la cual los fototipos son mayores que en los caucásicos.
La micosis fungoide puede imitar clínica e histopatológicamente diversas dermatosis de pronóstico variable, por lo que emitir el díagnóstico representa un reto para el dermatólogo y dermatopatólogo. Skov et al.10 realizaron un estudio retrospectivo en el Hospital de Copenhague, donde estudiaron el retraso del diagnóstico de micosis fungoide; reportaron la revisión de 157 pacientes con diagnóstico histopatológico de micosis fungoide, de los cuales 25 % fue catalogado desde la primera biopsia y la media de tiempo para emitir el diagnóstico fue de 2.3 años. En nuestro centro, la media fue de cuatro años.
Diversas teorías pretenden explicar la pérdida de pigmento. En 1982, Breathnach et al.11 postularon al infiltrado linfocitario como el desencadenante de la degeneración de melanocitos con subsecuente alteración en la melanogénesis como una respuesta al proceso inflamatorio. Goldberg et al.12 demostraron que no existían cambios en los melanocitos y sugirieron que el defecto se encontraba en la transferencia de melanosomas. Flaxman et al.13 observaron disminución en el receptor de tirosina cinasa CD117, por lo que postularon la teoría del efecto citotóxico de los linfocitos TCD8 Th-1, que resulta en inestabilidad y disfunción del receptor con pobre respuesta a factores de transcripción.14
La variedad hiperpigmentada se observó en 17.6 % de la población estudiada. Se dispone de pocos reportes de casos, el de Boulos et al. incluye la población más grande:15 una cohorte de 34 pacientes estadounidenses, en la cual 29 % tuvo esta variedad, caracterizada por manchas hiperpigmentadas sin poiquilodermia, más frecuente en fototipos altos y en sujetos menores de 35 años.
Se desconoce el mecanismo por el cual se presenta la hiperpigmentación, algunas de las teorías que pretenden explicarla son la degeneración hidrópica de la capa basal con formación de melanófagos, el efecto citotóxico e inmunosupresor de los linfocitos TCD8 sobre los queratinocitos y las células basales. En 2016, Kondo et al. reportaron el incremento en el número de mastocitos con trasformación a células grandes, lo cual puede desencadenar mayor secreción de melanina.16
Las lesiones poiquilodérmicas se han considerado como una variedad clínica de la micosis fungoide clásica en fase de placa. Clínicamente se observan pápulas eritematosas confluentes con patrón reticular que semejan al liquen rojo plano y que típicamente afectan pliegues y tronco; la presencia de lesiones poiquilodérmicas en áreas fotoexpuestas debe hacer sospechar micosis fungoide, hasta no comprobar lo contrario.15 Se describe un patrón de pigmentación moteado que alterna con áreas de hipo e hiperpigmentación, atrofia y telangiectasias que recuerdan el papel para cigarro. Se refiere que son asintomáticas y que se presentan con más frecuencia en hombres de 40 a 44 años, aunque en nuestro estudio 100 % de los casos fue del sexo femenino.17
La variedad foliculotropa es una de las variedades clínicas más reportadas en la literatura. Clínicamente se caracteriza por pápulas foliculares agrupadas que forman placas induradas asociadas a alopecia y prurito, el cual representan un parámetro de actividad de la enfermedad y que preferentemente afecta cara y cuello.18 Los hallazgos histopatológicos son células del infiltrado con disposición folicular, donde se visualiza degeneración mucinosa del folículo piloso. Se presenta habitualmente en varones, si bien se han descrito algunos casos en niños y adolescentes.19 Kovačič reportó a la micosis fungoide foliculotrópica como la variante más frecuente en adultos, a pesar de solamente abarcar el 10 % de los casos.20
La respuesta a tratamiento fue favorable en 75 % de los pacientes con mejoría total o parcial. La modalidad terapéutica más utilizada fue la fototerapia en cabina vertical con radiación ultravioleta A, considerada de primera línea de tratamiento de la micosis fungoide.21-23
Consideramos una limitante del estudio la pérdida de datos derivada de la falta de información en los expedientes clínicos, aunque el seguimiento estrecho en la clínica de fototerapia y el registro iconográfico aportaron información relevante.
En conclusión, nuestro estudio presenta una cohorte de pacientes mexicanos y proporciona un panorama acerca de las variedades clínicas de la MF; será conveniente realizar estudios para conocer la frecuencia de presentación, el curso clínico y el pronóstico de la enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)