-
Para entender el camino hay que andarlo, para hacerlo propio hay que recorrerlo una y otra vez.
DICHO POPULAR
Introducción
En la historia natural de la enfermedad podemosidentificar distintos componentes como el sujeto, el ambiente, las maniobras preventivas y la enfermedad. Al curso clínico habría que agregar las maniobras terapéuticas y las secuelas, muerte o curación, todos ellos coexistiendo en el tiempo. Este fenómeno clínico fue descrito por el doctor Alvan R. Feinstein bajo el concepto arquitectura de la investigación clínica, que en su modelo de causalidad incluye tres componentes en una secuencia de tiempo: estado basal, maniobra y desenlace. Feinstein desarrolló su modelo a partir de una meticulosa descripción de la atención médica utilizando el método científico, lo que conocemos como juicio clínico (Figura 1).1-3

Figura 1 Curso clínico de la enfermedad (arquitectura de la investigación clínica). El estado basal evalúa quién es el paciente, de dónde proviene, condiciones generales, diagnóstico, estadio y agresividad de la patología, complicaciones, tratamientos previos, nivel socioeconómico y cultural, hábitos, indicaciones o contraindicaciones terapéuticas y evolución esperada. La maniobra evalúa factores de riesgo, factores pronóstico, tratamiento específico, sintomático y medidas generales. El desenlace incluye la evolución temprana y tardía y determina las causas de pérdida de seguimiento. Prever la evolución del paciente al reconocer su condición, enfermedad y efecto esperado de las decisiones terapéuticas permite actuar anticipadamente. Esperar las manifestaciones del proceso evolutivo de la enfermedad resulta en detrimento del paciente.
En este artículo mostraremos la congruencia entre la práctica clínica y el modelo de arquitectura de la investigación clínica, y cómo ambos se corresponden con un artículo o protocolo de investigación.
Causa de consulta (estado basal): demarcación diagnóstica y pronóstica
Durante el quehacer clínico, el primer reto es la traducción de las manifestaciones referidas por el paciente en una agrupación conceptual inicial que permita tomar decisiones (diagnóstico sintomático, sindromático o etiológico). Este conjunto de manifestaciones subjetivas (síntomas) y objetivas (signos físicos, de laboratorio o gabinete) se obtiene durante la elaboración de la historia clínica, mediante el procedimiento denominado semiología clínica.4 Además de esta agrupación inicial, durante la elaboración de la historia clínica se recaba información que permite comprender a la persona con la que se trata. De esta forma, se estructura el estado basal del paciente al determinar quién es la persona (sus datos demográficos, antecedentes y hábitos) y la razón por la que asiste a consulta,5 es decir, su padecimiento.
De tal forma, en el estado basal (que se caracteriza por la evaluación inicial del paciente) se busca identificar quién es el paciente (sexo, edad, origen y comunidad donde habita y trabaja, su estrato socioeconómico y cultural, estilo de vida, hábitos y antecedentes hereditarios), sus condiciones generales (constitución y condición física, así como estado de ánimo), su diagnóstico (qué manifestaciones refiere y cómo se integran), el estadio, la agresividad de la patología, las complicaciones generadas por dicha patología, la comorbilidad que acompaña a la patología en estudio (con relación directa o no) o que ya presentaba previamente el paciente, así como los tratamientos previos a causa de la entidad clínica en estudio, por sus complicaciones o comorbilidad. Con esta historia clínica se decide el procedimiento diagnóstico-terapéutico, siempre considerando la expectativa de evolución de la enfermedad y las expectativas del paciente. Es decir, las decisiones se toman con el conocimiento del curso clínico de la enfermedad y las expectativas del paciente.
Al elaborar la historia clínica se puede identificar las características descritas en el modelo arquitectónico de la investigación, que en el estado basal incluyen lo que conocemos como demarcación diagnóstica y estratificación pronóstica.
En un proyecto de investigación, la demarcación diagnóstica (Figura 1, Tabla 1a)6 tiene inicialmente como objetivo promover la inclusión de una muestra que permita evaluar el efecto de la maniobra en la condición inicial y, de esta forma, evitar un ensamble inadecuado. Para lo anterior se requiere contar con cuatro requisitos:
Población con moderada a alta incidencia del desenlace de interés. Es importante recordar que las bajas incidencias requieren grandes muestras o tiempos muy prolongados de seguimiento, lo que dificulta formular una explicación causal de la maniobra.
Clara definición de la condición de base, con criterios específicos que establezcan el estado de salud o de enfermedad, según corresponda.
Que la población esté libre del desenlace en el momento de ser incluida y que exista la posibilidad de que este ocurra.
Que no exista indicación ni contraindicación previa para la maniobra por evaluar.
Tabla 1a Causa de consulta (estado basal): demarcación diagnóstica
| Práctica clínica | Diseño arquitectónico, demarcación diagnóstica | Métodos de un artículo/proyecto de investigación | Razonamiento común para la investigación y la clínica | Ejemplo en un artículo de investigación Day et al.6 realizaron un ensayo clínico para determinar si la combinación de anfotericina + flucitosina o altas dosis de fluconazol o anfotericina mejoraban la supervivencia de los pacientes con meningitis por criptococo** |
| Comunidad donde habita el paciente | Selección de la población | Universo de trabajo | Identifica a una población susceptible del desenlace de interés; localización geográfica donde es común el fenómeno, o de moderada a alta prevalencia de factores de riesgo o pronóstico | El universo de trabajo fueron pacientes con infección por virus de la inmunodeficiencia humana con diagnóstico de meningitis por criptococo, atendidos en el Hospital de Enfermedades Tropicales en Vietnam. La población seleccionada es susceptible de presentar el desenlace, con una mortalidad anual mayor a 60 % |
| Porque nos consulta el paciente. Qué tiene y cómo se hizo el diagnóstico (qué enfermedad padece) | Definición del diagnóstico | Criterios diagnósticos específicos de la condición en estudio | Identifica el diagnóstico y los criterios con los cuales se realizó. (ejemplo, diabetes mellitus tipo 2 determinada por hemoglobina glucosilada, glucosa en ayunas o prueba de tolerancia a la glucosa) | El diagnóstico de meningitis por criptococo fue
realizado en quienes presentaron signos y síntomas de meningitis por
criptococo y, además, cumplían con alguna de las siguientes
condiciones: 1. Tinción con tinta china positiva en líquido cefalorraquídeo. 2. Antígeno para criptococo positivo en líquido cefalorraquídeo. 3. Cultivo de líquido cefalorraquídeo positivo para Cryptococcus neoformans. 4. Hemocultivo positivo para Cryptococcus neoformans (título > 1:10). |
| Condición del paciente y características de la enfermedad que indican o contraindican un tratamiento específico | Criterios de selección* | Criterios de selección. Diagrama de flujo de los pacientes finalmente seleccionados | Garantiza la presencia de sujetos con posibilidad de presentar el desenlace y protege de no incluir a quienes ya tienen indicación o contraindicación de alguna de las maniobras | Como criterios de no inclusión absolutos se consideraron creatinina elevada, falla renal o hepática, embarazo y/o administración de rifampicina, que contraindican la asignación de la maniobra. No se incluyó a quienes ya tenían indicación de la maniobra con anterioridad, como el antecedente de tratamiento antifúngico por más de tres días, que podría influir en el desenlace |
*Los criterios de selección dan continuidad al diagnóstico de la condición basal y definen quién es candidato para participar en un proyecto específico. Pueden ser absolutos o relativos. Los criterios absolutos son ineludibles y están relacionados con la exposición a la maniobra o a la posible ocurrencia del desenlace. Los relacionados con el desenlace se refieren a quienes no deben entrar al estudio porque ya existe el desenlace o por imposibilidad para presentarlo, y los relacionados con la maniobra se refieren a quienes no deben entrar porque existe la indicación o contraindicación previa de esta. Los criterios relativos son evitables y en general se consideran para reducir el tamaño de muestra, tiempo y recursos. Sin embargo, en ocasiones no se limita la entrada y estos criterios relativos deben ser considerados para estratificar a la población por el mayor o menor riesgo de sufrir el desenlace (demarcación pronóstica) o para realizar el ajuste en el análisis.
**Si bien no se consideró la gravedad del cuadro clínico (criterio relativo) como criterio de inclusión, debe ser tomada en cuenta al analizar los resultados y debe ser incluida en los parámetros de la estratificación pronóstica.
Por su parte, la demarcación pronóstica (Figura 1, Tabla 1b)7 tiene como objetivo la identificación de la población con mayor probabilidad premaniobra de sufrir el desenlace y, en consecuencia, la decisión de las consideraciones terapéuticas específicas; además, desde el punto de vista metodológico se pueden realizar las estrategias pertinentes para evitar una percepción inadecuada del verdadero efecto de la maniobra principal y así evitar el sesgo de susceptibilidad. Estas estrategias son la e stratificación de la población en su estado basal y el ajuste multivariado durante el análisis. Es necesario recordar que este sesgo no se evita con la aleatorización propia de los ensayos clínicos, ni aun cuando queden homogéneamente distribuidas todas las características entre las maniobras.
Tabla 1b Causa de consulta (estado basal): demarcación pronóstica
| Práctica clínica | Diseño arquitectónico Demarcación pronóstica | Proyecto de investigación/artículo | Razón | Ejemplo en un artículo de investigación Sun et al.7 realizaron un estudio cuyo objetivo fue evaluar la asociación entre el nivel de ingesta de vitamina D y el desarrollo de enfermedad cardiovascular* |
| − Quién es el paciente (sexo, edad, estrato
socioeconómico y cultural, estilo de vida y hábitos).
−Condiciones generales del paciente (constitución y condición física, estado de ánimo). −Estadio y agresividad de la patología. −Complicaciones generadas por la patología. −Comorbilidad que acompaña a la patología o previamente presente en el paciente. −Tratamientos previos a causa de la patología en estudio o por comorbilidad previa. |
Estratificación: −Demografía. −Cronometría. −Estado. −Condición clínica. −Morfología. −Complicaciones. −Comorbilidades. − Tratamientos previos. −Nivel socioeconómico y cultural. −Estilo de vida y hábitos. − Antecedentes heredofamiliares |
Descripción operativa y conceptual de las variables de confusión o modificadoras, presentes en el estado basal | Controlar el efecto de variables ajenas a la principal o ya presentes desde el estado basal, de tal manera que se pueda aislar el efecto real de la misma | Al evaluar las características del estado basal se
identifican los siguientes elementos de la estratificación
pronóstica: −Datos demográficos: sexo, lugar de residencia con exposición solar. − Cronometría: edad. − Estado: estado nutricional, índice de masa corporal. − Estratificación clínica y morfológica: eran sujetos sanos. − Tratamiento previo: uso de aspirina o tratamiento multivitamínico. − Comorbilidad: antecedente de diabetes, hipertensión y dislipidemia. − Estilo de vida y hábitos: tabaquismo, alcoholismo, ingesta calórica total y actividad física. − Estratificación por herencia: antecedente familiar de enfermedad cardiovascular. |
*Al analizar las características del estado basal de acuerdo con la maniobra es posible identificar que los pacientes con mayores ingestas de vitamina D tuvieron mejor estilo de vida (presentaron menor frecuencia de tabaquismo, tuvieron menos ingesta de alcohol y realizaban más actividad física). Para evitar un sesgo de susceptibilidad pronóstica es necesario identificar tales condiciones del estado basal que condicionen mayor probabilidad premaniobra de presentar el desenlace y al realizar el análisis estadístico se debe ajustar por estas variables confusoras o modificadoras del estado basal, de tal manera que se pueda aislar el efecto real de la maniobra principal.
De igual forma, se debe reconocer que el efecto observado de la maniobra es el efecto promedio en la población predominante; por ejemplo, si en un estudio de pacientes con cáncer de mama tienen cabida pacientes con todos los estadios de la enfermedad, pero en estadios avanzados solo hay 5 % de la población, el resultado se deberá a los pacientes en estadios iniciales, aun cuando en teoría en los criterios de selección se incluyó cualquier estadio de la enfermedad. Lo anterior se ha malinterpretado asumiendo que una maniobra es aplicable a quienes cubran los criterios de selección del estudio original, sin embargo, no es así, en realidad solo refleja el efecto en la población predominante.8 De igual forma, el ajuste durante el análisis solo muestra cuál es el resultado en una población promedio, es decir, cuando se controla o ajusta por una o más variables se realiza un procedimiento estadístico multivariado para mostrar el efecto de la maniobra principal, asumiendo que el resto de las características del paciente y de la enfermedad son constantes y que corresponden al promedio de dichas características en la población en estudio. En ambos casos, el resultado siempre estará mostrando lo que ocurre en la población predominante en la que se realizó el estudio.
Decisiones terapéuticas o identificación de factores de riesgo o indicadores pronóstico: maniobra principal y periféricas
Una vez caracterizado el paciente en el estado basal y con el conocimiento de la historia o curso clínico de la enfermedad debe tomarse una serie de decisiones. Inicialmente implica decisiones terapéuticas respecto a la patología en estudio; por un lado, puede ser un tratamiento específico dirigido a resolver el problema, es decir, un tratamiento con intención curativa; por otro lado, puede ser un tratamiento sintomático que busca mitigar las molestias del paciente; y, finalmente, medidas generales que dan soporte al paciente para enfrentar la enfermedad y las terapias junto con sus eventos adversos. Desde luego se agregan decisiones terapéuticas para el manejo específico de eventos adversos, complicaciones propias de la enfermedad o entidades clínicas independientes a esta, pero que presenta el paciente durante el curso clínico de la enfermedad. En todos estos caso se debe considerar y calcular el pronóstico del paciente y, aun cuando esté libre de la enfermedad, cuál o cuáles son los factores de riesgo para desarrollarla.
Identificar las decisiones terapéuticas como acciones que modifican el estado basal del paciente es habitual, sin embargo, existen acciones realizadas por el paciente o por la naturaleza que de igual manera lo modifican, las cuales identificamos como factores de riesgo cuando ocurren antes de la enfermedad o como indicadores pronósticos cuando siguen a la enfermedad (por ejemplo, por acción de la naturaleza [edad], acciones propias del paciente [tabaquismo] o acciones por otras indicaciones terapéuticas ajenas a la patología actual del paciente, pero que de igual forma pueden impactar en el desenlace).
Todas estas decisiones u acciones se encuentran referidas en el modelo arquitectónico de la investigación, en el apartado de maniobras, las cuales pueden estratificarse como maniobra principal y maniobras periféricas (Figura 1, Tabla 3). La maniobra principal se refiere a la acción que representa el principal interés en la pregunta de investigación, de la cual debe hacerse una descripción de su correcta ejecución que permita medir la calidad, incluyendo el grado de adherencia. Aunado a esto se deben identificar todas las maniobras periféricas, es decir, las acciones o cambios de condición que se presentan entre el estado basal y el desenlace que pueden afectar a este último. El cuidado de estas dos características permite evitar o medir la magnitud del sesgo de ejecución, y señalar las diferencias generadas por distintos niveles de calidad entre las maniobras que se van a comparar o por la utilización desigual de maniobras adicionales entre los grupos.3 Al respecto, es preocupante que numerosos ensayos clínicos atribuyan el desenlace solo a la maniobra principal, incluso en casos con una distancia de 10 años entre la maniobra y el desenlace, ignorando el conjunto de maniobras periféricas.9,10
Tabla 2 Decisiones terapéuticas o identificación de factores de riesgo o indicadores pronóstico: maniobras principal y periféricas
| Práctica clínica | Diseño arquitectónico | Proyecto de investigación/artículo | Razón | Ejemplo en un artículo de investigación Aggarwal et al.10 publicaron un ensayo clínico aleatorizado ciego sencillo. cuyo objetivo fue evaluar la eficacia, seguridad y tolerabilidad de 2000 mg diarios de metformina XR una vez al día versus metformina IR dos veces al día en pacientes con diabetes mellitus tipo 2 vírgenes a tratamiento farmacológico** |
| Tratamiento específico. Factor de riesgo/pronóstico | La maniobra puede ser un tratamiento, pero también un factor de riesgo o factor pronóstico.* Se evalúa la calidad de la maniobra principal (intensidad, frecuencia, continuidad [adherencia], forma de aplicación) | Maniobra de interés, también conocida como variable principal o variable independiente | Ofrece los parámetros que miden la exposición a la maniobra principal; calidad de la maniobra | Los participantes fueron aleatorizados a una de las dos
maneras de recibir 2000 mg de metformina: 1) 2000 mg de metformina XR una vez al día junto con los alimentos de la tarde. 2) 1000 mg de metformina IR dos veces al día, en la mañana y en la tarde junto con los alimentos. Ambos tratamientos por 24 semanas |
| Tratamiento sintomático y de medidas generales, así como todas aquellas otras maniobras para tratar eventos adversos, y complicaciones que se presenten durante el curso de la enfermedad, estén o no relacionadas con esta, o bien, todo suceso que ocurra durante el periodo de seguimiento y que pueda impactar en la evolución del paciente | Maniobras periféricas. Todo suceso que ocurre alrededor o acompañando a la maniobra principal y que puede influir en el desenlace | Variables de confusión (relacionadas con el desenlace y la maniobra principal) o modificadoras (relacionadas solo con el desenlace). Estas siguen siendo variables independientes | Acompañando a la maniobra principal existe una serie de acciones que de igual forma pueden influir en el desenlace y confundir respecto al efecto de la maniobra principal. En consecuencia, deben ser consideradas para aislar el efecto real de la maniobra principal | Los participantes, adicionalmente al tratamiento farmacológico, recibían asesoría sobre estilo de vida y alimentación |
*Maniobra, acción que se espera modifique la condición basal: a) Experimental, maniobra asignada con fines de investigación. b) Observacional, maniobra presente por causas ajenas a la investigación (por ejemplo, por acción de la naturaleza [edad], autoseleccionada [tabaquismo], por otras indicaciones [atención médica]). Identificar la calidad de la maniobra permite realizar el análisis por intención a tratamiento (IT) y el análisis por protocolo (PP). A mayor apego, mayor la probabilidad de ver el efecto real de la maniobra. Recordemos que el análisis IT se refiere al análisis de todos los pacientes en el grupo asignado, hayan recibido o no la maniobra en forma adecuada. El análisis PP se refiere al análisis solo de pacientes cuya maniobra fue ejecutada en forma adecuada.
**Aun cuando ambos grupos están recibiendo la misma dosis del fármaco y se ajustan por múltiples interacciones y valores basales de hemoglobina glucosilada, no se toma en consideración durante el análisis multivariado la dieta y otras variables del estilo de vida que han mostrado tener un efecto relevante en el control glucémico de los pacientes con diabetes mellitus tipo 2.
Evolución del paciente: el desenlace
Todo paciente sometido a maniobras terapéuticas debe contar con evaluaciones repetidas durante el seguimiento, que permitan medir la respuesta inicial (un regulador intermedio por lo general), la respuesta final (desenlace) y la seguridad del paciente (previsión y medición de eventos adversos). Durante el seguimiento, cada vez que un paciente deja de asistir a sus evaluaciones preocupa cuál es su estado de salud, si ya se resolvió el problema o si habrá empeorado y por eso dejo de asistir, o si simplemente lo olvidó o decidió buscar atención médica en otro lugar; en estos casos una llamada telefónica puede ayudar a identificar la causa. Todas estas mediciones están consideradas en el desenlace del modelo arquitectónico, bajo el concepto de medición ideal estandarizada del desenlace y eventos adversos y registro de pérdidas durante el seguimiento.
La medición ideal estandarizada del desenlace implica que se realice la evaluación de todos los pacientes bajo los mismos criterios, de preferencia los aceptados en forma internacional, y al mismo tiempo que el seguimiento, con el objetivo de evitar que una evaluación diferencial afecte el resultado y genere lo que conocemos como sesgo de detección (Figura 1, Tabla 3a).11,12 Siempre es indispensable la identificación de los eventos adversos; prácticamente no hay acción que solo tenga beneficios, de tal manera que siempre habrá que considerar el impacto adverso de la acción e, incluso, restar el valor del beneficio cuando el evento adverso sea equivalente o de mayor relevancia clínica.13
Tabla 3a Evolución del paciente: desenlace primario, secundario y eventos adversos
| Práctica clínica | Diseño arquitectónico | Proyecto de investigación/artículo | Razón | Ejemplo en un artículo de investigación March et al.11 publicaron en 2004 un ensayo clínico denominado Treatment for Adolescents with Depression Study (TADS), el cual tuvo como objetivo evaluar la efectividad de cuatro modalidades de tratamiento para niños y adolescentes con trastorno depresivo mayor* |
| Seguimiento estandarizado al paciente de acuerdo con el curso clínico de la enfermedad (evaluación de desenlaces intermedios y la aparición o no del desenlace primario y en ocasiones los secundarios). Estas evaluaciones permiten modificar la terapia de ser necesario | Se trata de la medición del desenlace primario con evaluaciones iguales y con el estándar diagnóstico, preferentemente evaluaciones a ciegas | Se trata de la medición del desenlace primario, o variable dependiente. También se puede considerar la medición de otros desenlaces secundarios, pero estos siempre serán exploratorios | Se requiere definir el desenlace de la forma más precisa posible y a tiempos específicos. La medición inapropiada y fuera de tiempo puede sub o sobre diagnosticar y generar diferencias artificiales entre los grupos. A mayor número de visitas en alguno de los grupos, mayor probabilidad de detectar el desenlace generando sesgos (el mayor número de visitas puede ser generado por mayores eventos adversos, ajuste de dosis o sospecha diagnóstica, entre otros) | Los desenlaces primario y secundario evaluaron la
mejoría de los síntomas de depresión e ideación suicida a través de
las siguientes escalas: − CDRS, Children´s Depression Rating Scale Revised. − CGI, Clinical Global Impressions. −RADS, Reynolds Adolescent Depression Scale, instrumento de autorreporte. − SIQ-Jr, Suicidal Ideation Questionnaire-Junior High School Version. Las evaluaciones del desenlace se llevaron a cabo a las seis y 12 semanas en cada uno de los grupos de tratamiento |
| Se vigilan datos de alarma que pueden representar un riesgo a la vida del paciente o la necesidad de ajuste al tratamiento | Se miden siempre los eventos adversos* propios del tratamiento, de la enfermedad de base e, incluso, ajenos a estos. Constituye una medida de seguridad dirigida a cuidar al paciente de cualquier eventualidad, esperada o no, que represente un riesgo para la vida. Esta medida se requiere metodológicamente para sopesar el beneficio real de la maniobra principal | Eventos adversos | La vigilancia y medición de los eventos adversos o complicaciones es un dato de alarma que permite mejorar el cuidado del paciente y que obliga a restar beneficio a la maniobra principal cuando dichos eventos ponen en riesgo la vida del paciente, o cuando el daño es superior al beneficio esperado | Entre los eventos adversos evaluados se encontró presencia de manía, hipomanía, irritabilidad, agitación, ansiedad, fatiga, sedación, conducta suicida y autolesiones |
*La conducta suicida y las autolesiones si bien existían en un porcentaje de pacientes desde el inicio del estudio y se midió su reducción como un desenlace secundario, también hay que considerar la posibilidad de que aparezcan, por lo que resulta difícil distinguir si son parte de la historia natural de la enfermedad o del curso clínico al iniciar el tratamiento antidepresivo; en ocasiones pueden considerarse como un evento adverso, de ser así se observa una clara reducción con el tratamiento. Entre otros aspectos, la medición del desenlace fue a las seis y 12 semanas, lo cual es congruente con el tiempo necesario para observar respuesta en niños y adolescentes, a diferencia de los adultos en quienes ocurre en forma más temprana.
De igual forma, en la medición del desenlace debe considerarse el número y la razón de los pacientes perdidos durante el seguimiento. Las pérdidas no debidas al azar, sino por razones propias al tratamiento y a la enfermedad se asocian a la presencia del sesgo de transferencia, común en los estudios cuya pesquisa de la población es discordante con el estado basal estudios de casos, controles y encuesta transversal y series de casos, que frecuentemente se confunden con supuestas cohortes, debido a que cuando se inicia el estudio solo se cuenta con sobrevivientes y no hay forma de medir la magnitud del error; mientras mayor sea el número de pacientes perdidos durante el seguimiento, mayor será la posibilidad y magnitud del error. En los estudios en los que la pesquisa coincide con el ensamble, como el ensayo clínico y la cohorte, es posible medir la magnitud del error dado que se conocen las pérdidas y el momento en que se presentaron (Figura 1, Tabla 3b).14,15
Tabla 3b Evolución del paciente: pérdida de seguimiento
| Práctica clínica | Diseño arquitectónico | Proyecto de investigación/artículo | Razón | Ejemplo en un artículo de investigación Miguel et al.., en 2018,14 publicaron los resultados de un estudio que tuvo el objetivo de evaluar la efectividad de un algoritmo de tratamiento para trastorno bipolar (TBP), usando las alternativas terapéuticas disponibles en el sistema de salud brasileño* |
| Cada vez que se pierde el seguimiento de un paciente, debe considerarse la posibilidad de que se trate de falla terapéutica, complicación o evento adverso. Aunque también puede ser por resolución del problema o búsqueda de atención en otro lugar | Pérdida de seguimiento. Identificar la causa permite estimar la posibilidad de tener un desvío en el resultado a favor de alguno de los grupos | Diagrama de flujo de los pacientes perdidos durante el seguimiento. Suele estar integrado al diagrama inicial que acompaña a la selección de los pacientes | Documentar las pérdidas es indispensable para identificar el verdadero éxito de las acciones médicas, y para evitar sobreestimar o subestimar el resultado de estas | El estudio incluyó de forma inicial a 107 pacientes. A la semana 8 de seguimiento asistieron solo 88 participantes y a la semana 16 solo 84 participantes, lo que representó una pérdida de seguimiento de 21 % del total de participantes. Entre las causas de pérdida del seguimiento se encontraron el abandono y la presencia de eventos adversos al tratamiento |
*Un suceso común es encontrar en los artículos solo los datos de los pacientes que permanecieron hasta el final del estudio; de hecho, en muchos artículos no se menciona cuál era el tamaño inicial de la población. En este trabajo, la muestra original fue de 107 pacientes, de lo cuales solo 84 permanecieron hasta las 16 semanas. En cada tabla del análisis del curso clínico/historia natural de la enfermedad debe mostrarse el total de pacientes existentes hasta ese momento. Deben realizarse comparaciones que muestren si los pacientes perdidos en sus últimas mediciones se parecen a los que continúan, lo que permitiría estimar la magnitud del sesgo de transferencia.
Tiempos en la historia natural o curso clínico de la enfermedad: cronograma de actividades
El conocimiento de la historia natural y del curso clínico de la enfermedad ofrece una estimación de la evolución esperada del paciente (Figura 2). A partir de este conocimiento se toman las distintas decisiones en forma anticipada, tanto diagnósticas como terapéuticas, previendo la posible evolución del paciente; no se espera a que un suceso progrese, momento en el cual las acciones pueden tener menor beneficio. El conocimiento del curso clínico en un proyecto de investigación o artículo publicado se refleja en el cronograma de actividades, el cual permite planear y registrar la secuencia temporal con la que se presentan los diferentes componentes del fenómeno de causalidad.
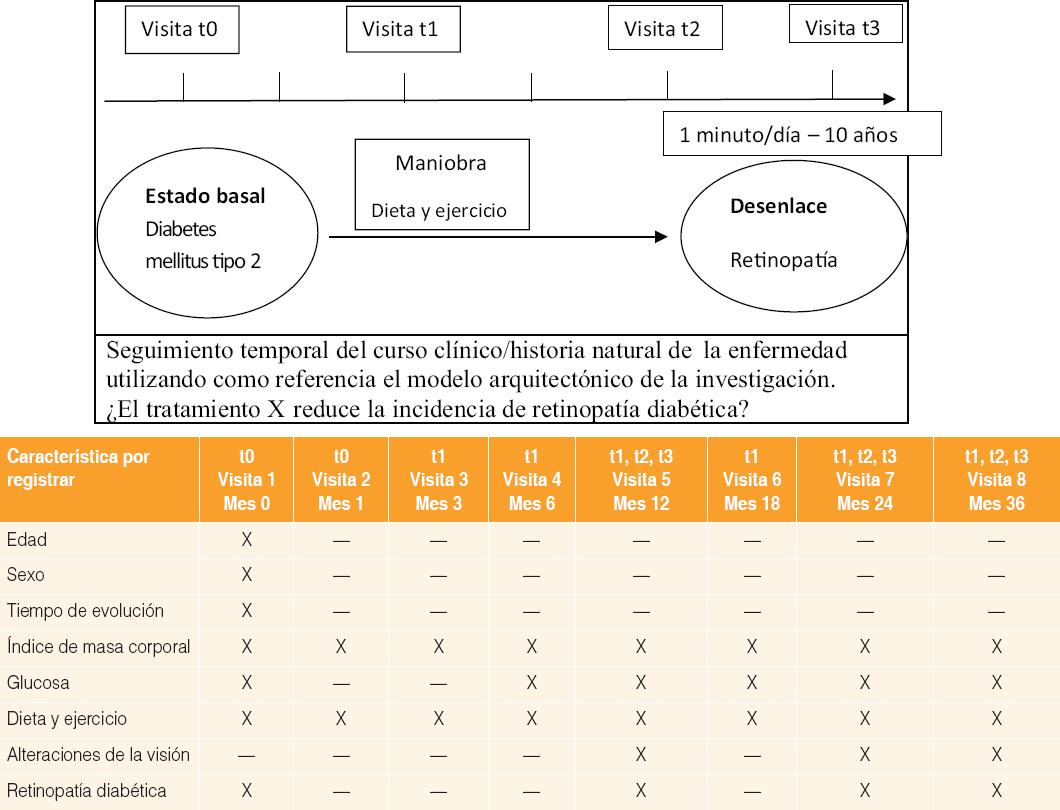
Figura 2 Cronograma de actividades (conforme la arquitectura de la investigación clínica). Las visitas t0, t1, t2 y t3 están relacionadas con el modelo arquitectónico; t0 = estado basal, t1 = maniobra, t2 = respuesta temprana a la maniobra y posibles eventualidades, t3 = desenlace. Las mediciones en los tiempos 1, 2 y 3 se pueden sobreponer durante el seguimiento y realizarse múltiples veces 1.1, 2.1, 3.1, 1.2, 2.2, 3.2
Comentario final
Podemos terminar destacando que la información contenida en los artículos de investigación refleja el quehacer clínico; su lectura nos ofrece un recorrido por la historia natural o el curso clínico de una enfermedad. La aplicación del modelo arquitectónico de la investigación en la lectura crítica de estos textos permite examinar el fenómeno de causalidad en sus diferentes componentes, identificar la temporalidad en la que aparecen, la contribución de cada uno y reconocer cuáles son factibles de ser modificados. La reflexión consciente de este conocimiento cada vez que se enfrentan las dolencias de los pacientes permite tomar decisiones objetivas; prever la evolución del paciente a partir de reconocer su condición, su enfermedad y las consecuencias de las decisiones diagnóstico-terapéuticas permite actuar anticipadamente y reducir el daño en el paciente. Esperar a responder hasta que los distintos sucesos ocurran resultará en detrimento de la salud del paciente.
Cada vez que leemos un artículo o diseñamos y ejecutamos un proyecto de investigación estamos recreando el fenómeno de causalidad con el que convivimos día a día en la práctica clínica. Integrar a nuestra atención médica el entendimiento y quehacer de la investigación incrementa nuestra experiencia para comprender este fenómeno y acorta el tiempo para ser un experto en un área cualquiera. No debemos desperdiciar el aprendizaje a partir de la experiencia de otros; depender solo de nuestra experiencia nos llevará muchos años antes de actuar de la mejor forma posible. Si bien nunca dominaremos por completo el tema clínico de nuestro interés (por ejemplo, diabetes mellitus tipo 2, epilepsia, esclerosis múltiple, etcétera), acortaremos el camino al dominio del tema al adjuntar a nuestro quehacer clínico la lectura estructurada, el entendimiento y la participación en el proceso de investigación.
Finalmente, debemos retomar la expresión del doctor Alvan R. Feinstein, quien refiere que en el modelo arquitectónico no hay nada que un médico sensato no sepa o no pueda entender.16 Para entender el camino hay que andarlo, para hacerlo propio hay que recorrerlo una y otra vez.











 nueva página del texto (beta)
nueva página del texto (beta)


