Introducción
La incidencia del cáncer en México se ha estimado en 126 casos/millón/año.1,2 Informes realizados por la Organización Mundial de la Salud demuestran que la incidencia de cáncer en menores de 15 años ha aumentado en más de 200 % en los países en desarrollo, con predominio de las leucemias y los linfomas.3-5 Además del incremento de la incidencia mundial de cáncer, los tratamientos han mejorado, logrando incrementar la supervivencia, pero también se han incrementado las reacciones adversas asociadas a los tratamientos.6 Respecto a las antraciclinas,7 se han reportado eventos adversos, tanto durante la administración de la terapia como a largo plazo.
Los pacientes pediátricos sobrevivientes de cáncer tienen ocho veces mayor probabilidad de morir por enfermedades cardiacas y 15 veces mayor probabilidad de sufrir insuficiencia cardiaca que sus hermanos que no tuvieron cáncer.8,9 La cardiotoxicidad (CTX) es la principal causa no cancerosa de complicaciones graves y el riesgo persiste hasta 45 años después de finalizar el tratamiento; además de constituir la segunda causa de muerte, después del cáncer secundario.10
Los pacientes sobrevivientes de cáncer infantil tratados con antraciclinas cursan con disfunción cardiaca subclínica hasta seis años después de completar el tratamiento.1 Asimismo, la CTX se puede desarrollar a largo plazo y ocurrir entre los cuatro y 20 años después de finalizar el tratamiento.11 Algunos estudios reportan que la prevalencia de esta complicación llega a 57 %.12 En México no se conoce la incidencia de CTX en los niños supervivientes de cáncer.
La CTX aguda se puede manifestar desde cambios leves en el electrocardiograma hasta arritmias potencialmente mortales.13 Se ha descrito que los efectos cardiotóxicos a largo plazo dependen de las dosis de los fármacos14 y son clínicamente más importantes que los agudos.
Si bien se han descrito algunos factores asociados a la CTX aguda, pocos estudios se abocan a los factores que se asocian al desarrollo de CTX a largo plazo. El objetivo del presente estudio fue evaluar los factores asociados al desarrollo de CTX a largo plazo en niños supervivientes de cáncer tratados con antraciclinas.
Método
Estudio de cohorte retroprolectiva de pacientes sobrevivientes de cáncer atendidos en el Servicio de Oncología del Hospital de Pediatría "Dr. Silvestre Frenk Freund" entre 2013 y 2018. Se incluyeron pacientes < 16 años sobrevivientes de cáncer (periodo libre de enfermedad ≥ 5 años), que recibieron tratamiento con antraciclinas, sin evidencia de enfermedad cardiaca previa corroborada por ecocardiografía. Todos los participantes debían contar con un ecocardiograma basal obtenido en el primer mes de iniciado el tratamiento con antraciclinas, en el Servicio de Cardiología por los médicos de base. Se excluyeron los pacientes con anemia clínica, corroborada por biometría hemática (hemoglobina < 7 mg/dL), o con repercusión hemodinámica. En el Servicio de Cardiología Pediátrica del hospital se realizó una determinación de fracción de expulsión antes del tratamiento (FEVi0) y a los 12 meses de iniciado el mismo (FEVi1). Del expediente se obtuvo la información de las características demográficas y del tratamiento. Se definió como CTX a la disminución de 10 % de la FEVi1 respecto al valor basal, conforme a las guías para tratamientos contra el cáncer y toxicidad cardiovascular de la Sociedad Europea de Cardiología.15
Se calculó el tamaño de la muestra con la fórmula de diferencia de proporciones, asumiendo un alfa = 0.05 y 1-beta = 0.20. Se utilizó el programa Epi Info. Se estimó 8 % de sujetos con CTX anterior a la quimioterapia y 40 % a un año del tratamiento. La muestra mínima quedó definida en 60 pacientes, tamaño que aseguró la estabilidad de los modelos de regresión logística múltiple (RLM) ajustados por seis variables.
En la estadística descriptiva se resumieron las siguientes variables cuantitativas: edad, peso, talla, FEVi0, FEVi1. Para corroborar el tipo de distribución se llevaron a cabo métodos inferenciales; si las variables no mostraban distribución normal con este procedimiento, se realizaron pruebas de normalidad de Kolmogórov-Smirnoff. Las variables que tuvieron distribución normal fueron registradas con media y desviación estándar y las variables de libre distribución, con mediana y rangos intercuartílicos 25-75 (RIC). Las variables nominales (sexo, edad dicotómica, tipo de tumor) se registraron con frecuencias y porcentajes.
Para determinar los factores de riesgo se analizaron las variables nominales mediante χ2 de Pearson. Para evaluar la relevancia clínica se calcularon riesgos relativos (RR) con intervalo de confianza de 95 % (IC 95 %). Las variables cuantitativas con distribución normal se analizaron con t de Student o U de Mann-Whitney. Las variables que resultaron estadísticamente significativas en el modelo bivariado fueron seleccionadas para ser incluidas en el modelo de RLM, el cual se realizó por pasos descendentes, con el objetivo de encontrar las variables independientes de mayor asociación. Para evaluar la dosis de mayor riesgo para CTX se realizó una curva ROC, a fin de encontrar el punto de mayor razón de verosimilitud positiva (RVP).
Para el análisis estadístico se utilizó el programa SPSS versión 25. Un valor de p < 0.05 se determinó como estadísticamente significativo en todos los casos.
El presente estudio se realizó siguiendo los lineamientos éticos de la investigación en seres humanos16 indicados en la Declaración de Helsinki, el Código de Núremberg, el Informe Belmont, las Normas CIOMS y las Buenas Prácticas Clínicas para las Américas, así como de acuerdo con el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud, en particular el artículo 13 concerniente al respeto, dignidad y protección de los derechos del paciente pediátrico; el artículo 17, respecto al cual se consideró una investigación de riesgo mínimo; y el 20 y 21, que regulan el consentimiento y asentimiento informados. La investigación también se circunscribió a las indicaciones de la Norma oficial mexicana NOM 012-SS3-2012 para la ejecución de proyectos de investigación para la salud en seres humanos. Se invitó a participar a todos los pacientes que recibieron antraciclinas y que se encontraban en la cohorte de supervivientes de cáncer (selección equitativa de los sujetos). Todos los padres de los pacientes que aceptaron participar en el protocolo firmaron una carta de consentimiento previa información de los objetivos de la investigación. Los niños mayores de ocho años firmaron cartas de asentimiento informado.
Como parte del protocolo de seguimiento, todos los pacientes recibieron dexrazoxano como cardioprotector. Aquellos en quienes se detectó CTX fueron enviados al Servicio de Cardiología para recibir un esquema de inhibidores de la enzima convertidora de angiotensina y se les hizo seguimiento (balance de riesgo-beneficio).
El estudio tiene valor social debido a que en la actualidad los supervivientes de cáncer no son evaluados de modo sistemático en la práctica pediátrica. Se contactará a los padres de los participantes para informarles de los resultados de la investigación.
La investigación fue revisada y aceptada por la Comisión Nacional de Investigación Científica del Instituto Mexicano del Seguro Social con el número R-2013-785-040.
Resultados
Se reclutaron 65 pacientes que cumplieron con los criterios de inclusión. Las características basales de la población se resumen en la Tabla 1. El 36.9 % de los participantes fue del sexo femenino. En cuanto a la edad, 60 % de los participantes fue mayor de cinco años al momento del diagnóstico. Las neoplasias sólidas representaron 56.8 % de los tumores. El peso basal de los participantes fue de 15.5 kg (RIC = 11.5-24.7 kg), la talla inicial fue de 107 ± 26.6 cm. La dosis acumulada de antraciclinas (epirrubicina, doxorrubicina o daunorrubicina) tuvo una mediana de 320 mg/m2 de superficie corporal (RIC = 165-485). La FEVi0 de los participantes tuvo una media de 74.8 ± 7.3 %.
Tabla 1 Características basales de 65 niños supervivientes de cáncer
| Variable | n | % |
|---|---|---|
| Sexo | ||
| Femenino | 24 | 36.9 |
| Edad al diagnóstico | ||
| ≤ 5 años | 26 | 40.0 |
| > 5 años | 39 | 52.3 |
| Tipo de tumor | ||
| Hematolinfoide | 26 | 40.0 |
| Sólido | 39 | 60.0 |
| Peso inicial en kg (RIC) | 15.5 (11.5-24.7) | |
| Dosis acumulada en mg (RIC)* | 320 (165-485)* | |
| Talla inicial en cm | 107 ± 27 | |
| FEVi0 en % (media) | 74.79 ± 7.3 | |
| FEVi1 en % (media) | 67.96 ± 6.7 | |
*Dosis acumulada de los tres grupos de antraciclinas.
RIC = rango intercuartílico, FEVi0 = fracción de expulsión del ventrículo izquierdo antes de la quimioterapia, FEVi1 = fracción de expulsión del ventrículo izquierdo después de la quimioterapia.
Treinta y nueve pacientes (60 %) desarrollaron CTX temprana. Al analizar los factores de riesgo encontramos que el sexo masculino tuvo un RR = 2.09 (IC 95 % = 0.7-6.13) para desarrollo de cardiotoxicidad. De los tres tipos de antraciclinas utilizadas en el estudio, la epirrubicina presentó un RR = 2.35 (IC 95 % = 0.7-7.61). El tipo de tumor hematolinfoide presentó un RR = 1.75 (IC 95 % = 0.96-3.15). El resto de los RR están resumidos en la Tabla 2. Los RR están representados en la Figura 1.
Tabla 2 Factores de riesgo asociados al desarrollo de cardiotoxicidad
| Variable | Cardiotoxicidad | Riesgo relativo | IC 95 % | |
|---|---|---|---|---|
| Sí (n = 26) | No (n = 39) | |||
| Masculino | 19 | 22 | 1.6 | 0.78-3.21 |
| Doxorrubicina versus | 3 | 6 | Referencia | |
| Epirrubicina | 21 | 25 | 1.4 | 0.51-3.63 |
| Daunorrubicina | 4 | 11 | 0.81 | 0.22-2.78 |
| Tumor hematolinfoide | 15 | 12 | 1.8 | 1.01-3.22 |
| Tumor sólido | 12 | 27 | ||
| Edad > 5 años | 16 | 18 | 1.4 | 0.72-2.57 |
| Radioterapia | 5 | 9 | 0.9 | 0.39-1.88 |
RR = riesgo relativo, IC 95 % = intervalo de confianza de 95 %
Se compararon las medias de las FEVi0 y FEVi1 con prueba t de Student, en la que se encontró una diferencia de medias de 10 % (p = 0.001), que puede observarse en la Figura 2.
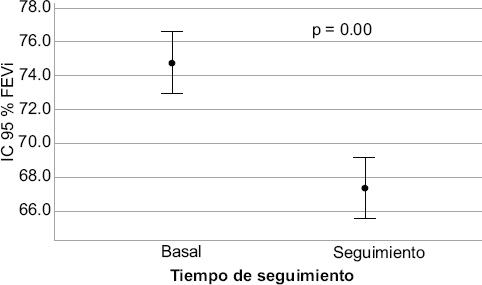
Figura 2 Comparación de las medias de fracción de expulsión basal versus fracción de expulsión a los 12 meses. FEVi = fracción de eyección.
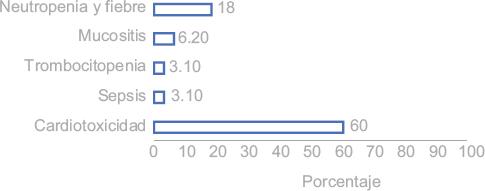
La prevalencia de la CTX en nuestra población fue de 60 %. El resto de las complicaciones asociadas a antraciclinas fueron neutropenia y fiebre (18 %), mucositis (6.2 %), trombocitopenia y sepsis (3.1 %).
Se calculó un modelo de regresión logística en el que la variable dependiente fue la CTX, ajustada por la edad y la dosis acumulada, las principales variables de confusión (Tabla 3).
Tabla 3 Modelo de regresión logística para el desarrollo de cardiotoxicidad asociada al uso de antraciclinas
| Variables | B | RM | IC 95 % para RM | ||
|---|---|---|---|---|---|
| Inferior | Superior | ||||
| Paso 1 (p = 0.116) | |||||
| r2= 0.215 | Sexo | 0.04 | 1.04 | 0.17 | 6.46 |
| Epirrubicina | 1.93 | 6.88 | 0.81 | 58.4 | |
| Diagnóstico* | 0.379 | 1.461 | 0.264 | 8.077 | |
| Edad** | −0.726 | 0.484 | 0.056 | 4.202 | |
| Dosis acumulada | 0.003 | 1.003 | 1 | 1.007 | |
| Paso 2(p = 0.062) | |||||
| r2= 0.215 | Epirrubicina | 1.926 | 6.859 | 0.815 | 57.709 |
| Diagnóstico* | 0.38 | 1.462 | 0.265 | 8.083 | |
| Edad** | −0.704 | 0.494 | 0.071 | 3.427 | |
| Dosis acumulada | 0.003 | 1.003 | 1 | 1.007 | |
| Paso 3 (p = 0.029) | |||||
| r2= 0.213 | Epirrubicina | 1.784 | 5.955 | 0.795 | 44.586 |
| Edad** | −0.752 | 0.471 | 0.069 | 3.237 | |
| Dosis acumulada | 0.003 | 1.003 | 1 | 1.007 | |
| Paso 4 (p =0.013) | |||||
| r2= 0.203 | Epirrubicina | 1.546 | 4.692 | 0.758 | 29.035 |
| Dosis acumulada | 0.004 | 1.004 | 1.001 | 1.007 | |
*Diagnóstico hematolinfoide versus sólido.
**Edad > 5 años.
Se utilizó el método de regresión logística por pasos descendentes para que en el modelo quedarán las principales variables asociadas al desarrollo de cardiotoxicidad. En el paso 4 del modelo, la variable epirrubicina tuvo una razón de momios (RM) = 4.69 (IC 95 % = 0.75-29.03), la dosis acumulada presentó una RM = 1.004 (IC 95 % = 1.001-1.007).
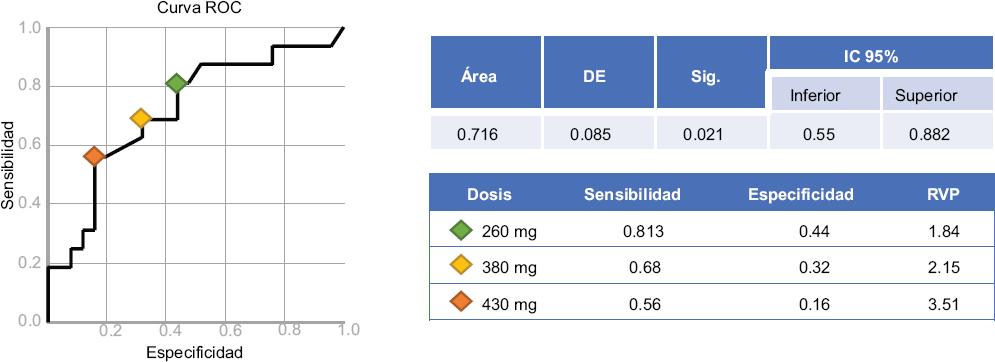
Debido a que la dosis acumulada fue la única variable asociada a CTX, se realizó una curva ROC (Figura 3), en la cual se encontró un área bajo la curva de 0.716 (IC 95 % = 0.55-0.882). La dosis de 260 mg tuvo una RVP de 1.84; la de 380 mg, de 2.15; y la de 430 mg, de 3.51 (Figura 4).
Discusión
Se han identificado algunos factores de riesgo asociados a la CTX por antraciclinas, los cuales son potencialmente modificables, como la dosis acumulada, la velocidad de aplicación, los tratamientos concomitantes o la actividad física. Sin embargo, existen pocos estudios con seguimiento a largo plazo en los que se ajusten estos posibles factores de riesgo de conformidad con los posibles factores confusores. Hasta donde es de nuestro conocimiento, este es el primer estudio en México en el que se evalúan los factores de riesgo con modelos multivariados para el desarrollo de CTX.
El presente estudio se centró en los pacientes supervivientes de cáncer, es decir, en quienes desarrollaron la CTX después del tratamiento, lo cual descarta a los pacientes que experimentaron toxicidad aguda, como lo describimos en otras investigaciones.17
Los reportes internacionales señalan que la prevalencia de la CTX en pacientes que reciben antraciclinas es de aproximadamente 40 %; sin embargo, en nuestro análisis fue de 60 %, lo cual puede ser atribuido a que en nuestra población la incidencia de tumores hematolinfoides es mayor que en otras poblaciones.
En el modelo bivariado, el tumor hematolinfoide presentó un RR = 1.75, que no fue significativo, probablemente por un tamaño de muestra insuficiente, ya que el límite inferior del intervalo de 0.97 indica una tendencia al riesgo. Se observó una situación similar con el sexo masculino y la epirrubicina; puede ser que estos factores sean significativos si se aumenta el tamaño de la muestra, como se indica en otros estudios.15
Si bien la evaluación cardiaca ha evolucionado, la reducción de la fracción de expulsión y la insuficiencia cardiaca congestiva sintomática (actuales desenlaces de la CTX)18 generalmente ocurren después de semanas o años de finalizado el tratamiento.19 La medición de la fracción de expulsión continúa empleándose en la práctica clínica por su fácil acceso y gran utilidad para determinar el inicio de los tratamientos de protección cardiaca.20
El mecanismo principal de la CTX inducida por las antraciclinas parece implicar la generación de radicales de oxigeno altamente reactivos, los cuales promueven la peroxidación lipídica que daña la membrana celular.21 Los efectos tóxicos de las antraciclinas en los miocardiocitos llevan al adelgazamiento de la pared del ventrío izquierdo, lo que incrementa la poscarga y disminuye la contractilidad, origen de la insuficiencia cardiaca congestiva.22 Las guías europeas recomiendan la vigilancia de los pacientes con alto riesgo clínico, aun cuando no están bien descritos los factores de riesgo en los pacientes pediátricos.23
En la práctica clínica, el seguimiento de la remisión completa del cáncer es de un año después de terminar la quimioterapia, con lo cual se podría subestimar la incidencia de este fenómeno, en especial en los niños, con quienes se puede perder contacto.
En el modelo multivariado se realizó el ajuste de acuerdo con las principales variables confusoras: edad, sexo, tipo de tumor y dosis acumulada. El tamaño de la muestra limitó el número de variables en el modelo, sin embargo, en la dosis acumulada se obtuvo una RM = 1.004, que resultó ser estadísticamente significativa. Lo anterior tiene implicaciones importantes: al parecer es la dosis total y no el tipo de antraciclina la que se asocia a las complicaciones cardiacas en los niños, a diferencia de lo que ocurre en los adultos.
Podemos relacionar este hallazgo con el hecho de que en el modelo bivariado los tumores hematolinfoides fueron el factor de riesgo principal, debido a que los pacientes con este tipo de tumores reciben las dosis más altas de quimioterapia y por un periodo más largo.
La importancia de hacer estos análisis en cada país radica en las variantes genéticas que modifican la farmacología de la quimioterapia.24
El estudio que presentamos es parte del seguimiento de una cohorte de supervivientes pediátricos de cáncer, el cual ha permitido detectar otros eventos adversos como pérdida auditiva,25 nefrotoxicidad,26,27 neutropenia y fiebre,28,29 de ahí la relevancia de los estudios de seguimiento30 y de los ensayos clínicos que permitan tratar de forma adecuada las consecuencias de la toxicidad por la quimioterapia.31 No basta con la curación, se requiere continuar con los esfuerzos para limitar los eventos adversos reversibles y no mortales y los irreversibles.32,33
En esta investigación proponemos que las dosis altas de las antraciclinas (sin importar su tipo) constituyen el principal factor de riesgo. De tal suerte, los clínicos podrán ofrecer tratamientos protectores a los niños que requieran dosis altas de antraciclinas, lo cual podrá, en teoría, disminuir una de las complicaciones más catastróficas.











 nueva página del texto (beta)
nueva página del texto (beta)