Introducción
Las inmunodeficiencias primarias (IDP) son padecimientos genéticos que derivan en susceptibilidad a infecciones por gérmenes que por lo general son poco virulentos. Las IDP pueden ser heredadas o adquirirse por mutaciones de novo durante el desarrollo embrionario.1 En México se carece de estadísticas confiables respecto a la magnitud del problema debido a que las IDP no son diagnosticadas en la mayoría de los casos por falta de métodos apropiados. En el mundo se han identificado más de 180 padecimientos gracias al desarrollo de herramientas de análisis de alto impacto, como la citometría de flujo, la cual se combina con el diagnóstico molecular.2 En la clasificación de las IDP aceptada por la Unión Internacional de Sociedades de Inmunología se reconocen diversos padecimientos, entre ellos, los defectos en la producción de anticuerpos son los más frecuentes.2 En estadísticas de la Sociedad Europea de Inmunodeficiencias3 y en diversas publicaciones de Estados Unidos, se indica que los defectos en la producción de anticuerpos comprenden aproximadamente la mitad de los casos diagnosticados. México ocupa el tercer lugar en Latinoamérica en casos registrados de IDP; de acuerdo con los datos de la Sociedad Latinoamericana de Inmunodeficiencias, al menos uno de cada 200 a 500 niños tiene una IDP de anticuerpos.4 No obstante la información anterior, todavía se está lejos de disponer de estadísticas reales en la región.4
Las deficiencias de anticuerpos abarcan un amplio espectro de patologías, desde insuficiencia severa en la producción de todos los isotipos de inmunoglobulinas y la ausencia total de linfocitos B maduros, hasta la falta selectiva de un isotipo (Tabla 1).5 Los pacientes con estas deficiencias no muestran signos de enfermedad durante los primeros meses de vida, debido a los anticuerpos que reciben de la madre, sin embargo, el número y la gravedad de las infecciones se incrementa cuando esos anticuerpos disminuyen. La administración regular de gammaglobulina humana puede evitar el deterioro progresivo y permite que los pacientes lleven una vida casi normal, siempre y cuando las intervenciones terapéuticas se realicen a temprana edad, por lo que el diagnóstico precoz es esencial.6 Con la citometría de flujo es posible efectuar diagnósticos tempranos con un nivel de confianza elevado y, en muchos casos, investigar los genes con posibles defectos.7
Tabla 1 Clasificación de las inmunodeficiencias predominantemente de anticuerpos*
| Enfermedad | Ig en suero | Características | Tipo de herencia | Defectos genéticos |
|---|---|---|---|---|
| Agammaglobulinemia ligada a cromosoma X | Todos los isotipos disminuidos | Infecciones bacterianas graves. Ausencia o disminución muy significativa de células B maduras | Ligada al cromosoma X | Mutaciones en BTK |
| Agammaglobulinemia autosómica recesiva | Todos los isotipos disminuidos | Infecciones bacterianas graves. Ausencia o disminución muy significativa de células B maduras | Autosómica recesiva | Mutaciones en la cadena pesada µ, en I5, Iga, Igb y BLNK |
| Inmunodeficiencia común variable | IgG, IgA y/o IgM disminuidas | Infecciones bacterianas recurrentes, algunos pacientes presentan autoinmunidad, linfoproliferación o enfermedad granulomatosa | Variable | La mayoría se desconoce; en algunos casos, mutaciones en ICOS, CD19, TACI, BAFF-R |
| Síndrome de hiper-IgM | IgM normal o elevada con IgA e IgG disminuidas | Infecciones oportunistas, neutropenia, enfermedades autoinmunes | Ligada al cromosoma X (CD154) o autosómica recesiva | Mutaciones en CD154, CD40, AICDA, UNG |
| Deficiencias de isotipo con números normales de células B | Una o más subclases de IgG y/o IgA e IgE disminuidas | En algunos casos asintomática o pueden presentar infecciones bacterianas y virales recurrentes | Variable | Mutaciones o deleciones en el cromosoma 14q32 o en la cadena ligera l |
| Deficiencia específica de anticuerpos con concentraciones normales de Ig y células B | Normales | Incapacidad de producir anticuerpos contra algunos antígenos específicos. | Variable | Desconocida |
| Hipogammaglobulinemia transitoria de la infancia | IgG e IgA disminuidas | Infecciones bacterianas moderadas a recurrentes | Variable | Desconocida |
*Clasificación modificada de International Union of Immunological Societies Expert Committee on Primary Immunodeficiencies. Notarangelo LD, Fischer A, Geha RS, Casanova JL, Chapel H, et al. Primary immunodeficiencies: 2009 update. J Allergy Clin Immunol. 2009;124(6):1161-1178.
BTK = tirosina cinasa de Bruton.
En este trabajo mostramos la evaluación de pacientes con defectos en la producción de anticuerpos mediante el uso de tinciones sencillas y rápidas; la comparación se estableció con individuos sanos (grupo control).
Método
Estudio prospectivo, descriptivo, transversal. Se incluyeron niños previamente diagnosticados en el Instituto Nacional de Pediatría o en el Centro Médico Nacional La Raza del Instituto Mexicano del Seguro Social, Ciudad de México, con agammaglobulinemia ligada al cromosoma X (ALX), síndrome de hiperinmunoglobulinemia M (síndrome de hiper-IgM) o inmunodeficiencia común variable (IDCV), según los criterios establecidos para las IDP.8 Los padres o tutores otorgaron su consentimiento previa información de los objetivos y procedimientos de la investigación (conforme los principios éticos establecidos en la Declaración de Helsinki). Se excluyeron los pacientes con causas secundarias de hipo o agammaglobulinemia8 y fueron eliminados los pacientes con muestras insuficientes o que decidieron retirarse de la investigación.
Se obtuvieron 3 a 10 mL de sangre periférica, con tubos heparinizados Vacutainer® (Becton Dickinson, San José, CA, Estados Unidos); 1 mL se utilizó para determinar las poblaciones leucocitarias y el resto se empleó para obtener células mononucleares mediante centrifugación en Histopaque® (Sigma, Chemical Co., St. Louis, MO, Estados Unidos).
Mediante tinciones se determinaron los porcentajes de las diferentes poblaciones celulares. Se utilizaron 30 mL de sangre periférica sin activar y se incubaron durante 20 minutos con 5 mL de las siguientes mezclas de anticuerpos monoclonales:
–. Anti-CD45-FITC/anti-CD14-PE.
–. Anti-CD3 FITC/anti-CD19 PE/anti-CD45 PerCP.
–. Anti-CD4 FITC/anti-CD8 PE/anti-CD3 PerCP.
–. Anti-CD3 FITC/anti-CD16+56 PE/anti-CD45 PerCP.
Como anticuerpos control de isotipos se utilizó anti-CD45 PerCP/g1 FITC/g1 PE. La mayoría de los anticuerpos usados fueron de Becton Dickinson y cuando no fue así se indica el laboratorio. Las muestras fueron incubadas 20 minutos a temperatura ambiente, en la oscuridad. Después de la incubación, los eritrocitos fueron lisados con 500 mL de solución de lisis FACS® (Becton, Dickinson, San José, CA, Estados Unidos), se incubaron durante 10 minutos más y posteriormente se lavaron con PBS-A, una combinación de solución salina tamponada con fosfato (phosphate buffered saline, PBS) y 1 % de albúmina sérica humana. Las células se fijaron con 1 % de formaldehído en PBS. La adquisición y análisis se describe más adelante.
Las subpoblaciones de células B se determinaron a partir de células mononucleares, las cuales se tiñeron con las mezclas anti-CD27 PE/anti-CD19 APC/anti-IgD FITC y anti-CD24 PE/anti-CD38 APC/anti-CD19 FITC; la incubación, lavado y fijación se efectuaron como se describió y se omitió la lisis de eritrocitos.
Determinación de la expresión de tirosina cinasa de Bruton
Un millón de células mononucleares se fijaron con formaldehído a 1 % en PBS durante 10 minutos. Las células mononucleares se lavaron con PBS-A, 300 × g durante cinco minutos y se permeabilizaron durante 10 minutos con saponina a 0.1 % en PBS (PBS-S). La marcación se realizó con 30 mL del anticuerpo monoclonal anti-Btk (tirosina cinasa de Bruton, Pharmingen, San Diego, California, Estados Unidos), seguida por 30 minutos de incubación y dos lavados con PBS-S. La tinción se llevó a cabo con 30 mL de anti-IgG2a PE (Upstate Biotechnology, Lake Placid, NY, Estados Unidos) y la incubación se realizó durante 30 minutos en la oscuridad. Las células se lavaron con PBS-S, se tiñeron con 5 mL de anti-CD14 FITC y se incubaron durante 15 minutos en la oscuridad; finalmente fueron lavadas y fijadas con 300 mL de formaldehído a 1 % en PBS.
Determinación de la expresión de CD40 y TACI
Las células mononucleares se incubaron con anti-CD40 PE y anti-CD19 APC para identificar su expresión en células B, y con anti-CD40 PE y anti-CD14 PerCP para identificar su expresión en monocitos. En otro tubo, las células mononucleares se incubaron con anti-TACI PE y anti-CD22 PECy5. La incubación, el lavado y la fijación se realizaron conforme a los procedimientos descritos.
Determinación de la expresión de CD154 y de ICOS
Para la determinación de CD154, dos millones de células mononucleares fueron cultivadas durante 12 horas a 37 °C, en condiciones de 5 % de CO2, en medio RPMI 1640 (Gibco-BRL®, Gaithersburg, MO, Estados Unidos) complementado con 10 % de suero fetal bovino (PharmAust, Bentley, Western Australia), 1 mM de L-glutamina, 100 unidades/mL de penicilina y 10 mg/mL de estreptomicina (Gibco). Se activaron con 100 ng/mL de forbol 12-miristrato 13-acetato (Gibco) y 1 mg/mL de ionomicina (Sigma). Las células mononucleares se tiñeron con anti-CD3 PerCP (anti-CD154 PE o anti-ICOS PE) y anti-CD69 FITC. La incubación, lavado y fijación se realizaron conforme se ha descrito.
Se usaron células sin activar como controles negativos y la expresión de CD69 como control positivo. El análisis se describe más adelante.
Adquisición y análisis
Se observaron 10 000 células para el análisis de las poblaciones leucocitarias en sangre periférica y 100 000 para las tinciones de las células mononucleares. Las muestras fueron leídas en FACScalibur®. Los datos se examinaron con el software FlowJo 10.0.07.
Análisis estadístico
Los datos demográficos, clínicos y de laboratorio se indican en mediana y rango o media y desviación estándar, dependiendo del tipo de distribución; las variables categóricas, con frecuencias y porcentajes. El fenotipo de los pacientes se describe con frecuencias y porcentajes. Las comparaciones de los dos grupos se realizaron mediante prueba de Mann-Whitney. Los resultados se expresan con media; los valores con p < 0.05 se consideraron significativos. Los análisis estadísticos se realizaron utilizando GraphPad Prism versión 5.0.
Resultados
En la Tabla 2 se resumen los hallazgos clínicos y de laboratorio de 10 pacientes con diagnóstico de ALX; se pueden apreciar los valores residuales de las inmunoglobulinas séricas y los datos clínicos, tanto del número de hospitalizaciones como de infecciones. Los valores de las inmunoglobulinas séricas se correlacionaron con la reducción de linfocitos B.
Tabla 2 Datos clínicos y de laboratorio de pacientes con agammaglobulinemia ligada al cromosoma X
| Paciente | Ingresos al hospital (n) | Neumonías (n) | Sinusitis (n) | Otitis media (n) | Diarreas (n) | IgG | IgM | IgA | % células B |
|---|---|---|---|---|---|---|---|---|---|
| (486-1211 mg/dL) | (45-211 mg/dL) | (30-182 mg/dL) | (19 ± 8) | ||||||
| P1 | 6 | 6 | 2 | 10 | 0 | 6.2 | 14.2 | 0.5 | 0 |
| P2 | 4 | 0 | 0 | 0 | 0 | 28 | 6 | 11 | 0.12 |
| P3 | 6 | 0 | 20 | 1 | 0 | 27 | 12 | 0.3 | 0 |
| P4 | 2 | 0 | 0 | 0 | Varias | 6.6 | 16.8 | 22.1 | 0.1 |
| P5 | 1 | 1 | 0 | 0 | 0 | 6.7 | 17 | 23.4 | 0 |
| P6 | 1 | 0 | 0 | 0 | 0 | 33.3 | 4.1 | 6.6 | 0 |
| P7 | 1 | 6 | 0 | 0 | 0 | 6.6 | 17 | 1.5 | 0 |
| P8 | 2 | 1 | 4 | 1 | 1 | 0 | 6 | 0 | 0 |
| P9 | 1 | 1 | 0 | 0 | 0 | 41 | 8.6 | 6.7 | 0.3 |
| P10 | 2 | 1 | 0 | 0 | 1 | 47.7 | 24.1 | 11.5 | 0 |
En la Figura 1 se muestra los resultados representativos de un paciente con ALX, quien presentó disminución severa de linfocitos B CD19+. Para asegurar que esta población celular se encontraba ausente se empleó marcación con anti-CD20, la cual confirmó el resultado. Para corroborar el defecto se analizó la expresión de BTK; en ningún paciente se pudo identificar esta proteína (datos no mostrados).
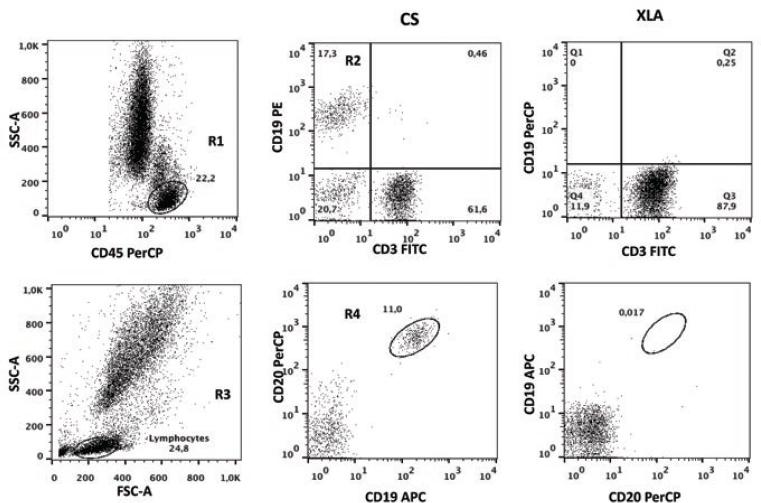
Figura 1 Resultados de la citometría de flujo en pacientes con agammaglobulinemia ligada al cromosoma X (ALX). Las células B fueron identificadas con CD45+ (R1) y CD19+ (R2). En la región de los linfocitos totales se observa la expresión de CD20+ (R3) y CD19+ (R4).
En la Figura 2 se muestra los resultados de la tinción de linfocitos B CD19+, complementada con tinción de IgD y CD27. Ambos marcadores permiten definir tres subpoblaciones: los linfocitos B naive (IgD+ CD27-), las células B de memoria sin cambio de isotipo (IgD+ CD27+) y las células B con cambio de isotipo (IgD- CD27+). En los pacientes con síndrome de hiper-IgM se observó que, si bien los valores de linfocitos B son normales, existe disminución importante de los linfocitos B de memoria (con y sin cambio de isotipo); el diagnóstico se puede corroborar con la ausencia de CD154 en los linfocitos T activados y con la activación eficiente en células T mediante la expresión de CD69. En las gráficas del lado derecho se muestran los resultados globales de siete pacientes con síndrome de hiper-IgM, comparados con los obtenidos en los sujetos control.
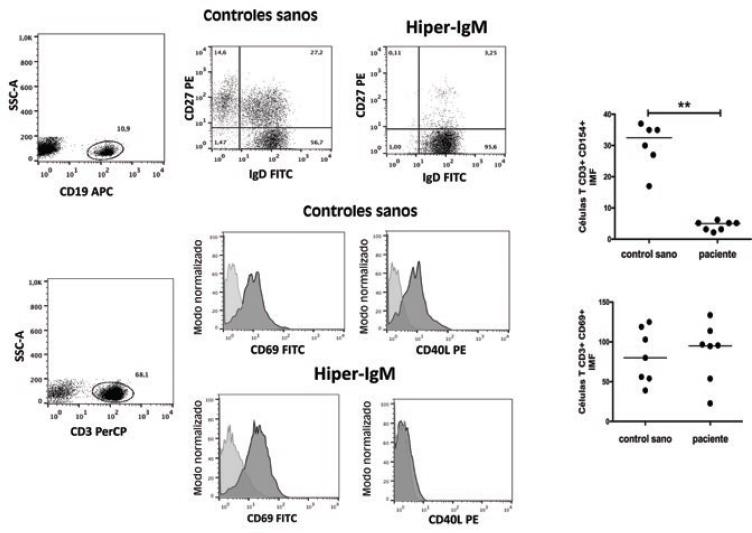
Figura 2 Análisis de pacientes con síndrome de hiper-IgM. Las subpoblaciones de células B se identificaron con anticuerpos contra CD19, CD27 e IgD, y la expresión de CD154 y CD69 en la región de células T CD3+. El histograma gris claro representa las células T no estimuladas y el histograma gris oscuro, las células estimuladas durante 12 horas con ionomicina y forbol 12-miristrato 13-acetato. Es posible observar la expresión de CD154 (CD40L) y CD69 (control de activación) de siete controles sanos y siete pacientes con síndrome de hiper-IgM, y sus valores respectivos en intensidad media de fluorescencia (IMF). La barra horizontal muestra la mediana y los asteriscos, las diferencias significativas usando la prueba estadística U de Mann-Whitney. ***Muy significativo, p < 0.01.
En la Figura 3 se muestra la tinción de las subpoblaciones de linfocitos B, la cual permitió clasificar a los pacientes con IDCV. Ningún paciente presentó agammaglobulinemia y la expresión de CD40 y CD154 fue normal. Para las células B naive, con y sin cambio de isotipo, se empleó tinción de IgD+ CD27. También se identificaron subpoblaciones con baja expresión de CD21 (CD19+ CD21− CD38−).
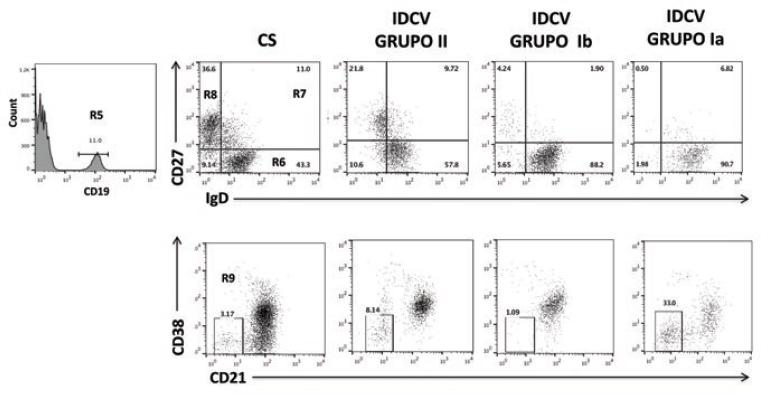
Figura 3 Análisis de pacientes con inmunodeficiencia común variable (IDCV). Las células B se identifican con CD19+ (R5) y luego se subdividen de la siguiente forma: B naive se identifican con CD19+ CD27− IgD+ (R6); B sin cambio de isotipo o zona marginal, con CD19+ CD27+ IgD+ (R7); B con cambio de isotipo, con CD19+ CD27+ IgD− (R8); B CD21bajo, con CD19+ CD21− CD38− (R9). Los pacientes se estratificaron en los grupos Ia, Ib y II según la clasificación de Friburgo.
Los pacientes se estratificaron conforme a la clasificación de Friburgo:
–. Grupo I, pacientes con valores reducidos (< 0.4 %) de linfocitos B de memoria con cambio de isotipo; este grupo se subdivide en pacientes con porcentaje incrementado (> 20 %) de células B CD21bajo (grupo 1a) y pacientes con expresión normal de células CD21bajo (grupo 1b).
–. Grupo II, pacientes con valores normales de linfocitos B de memoria con cambio de isotipo.
Como se detalla en la Tabla 3, los pacientes del grupo II presentaron características moderadas de la enfermedad. En el grupo I se observó una clara separación cuando se analizó la presencia de enfermedades autoinmunes y linfadenopatías en los pacientes con expresión reducida de CD21.
Tabla 3 Datos clínicos y de laboratorio de pacientes con inmunodeficiencia común variable, agrupados conforme a la clasificación de Friburgo
| Característica | Grupo Ia (n = 10) | Grupo Ib (n = 10) | Grupo II (n = 4) | |||
|---|---|---|---|---|---|---|
| Sexo femenino/masculino | 7/3 | 7/3 | 3/1 | |||
| Media | Media | Media | ||||
| Edad (años) | 14.3 | 15.2 | 10.2 | |||
| IgG (mg/dL) | 210 | 213 | 243 | |||
| IgA (mg/dL) | 27 | 18 | 27 | |||
| IgM (mg/dL) | 52 | 23 | 71 | |||
| Células B (%) | 9 | 11 | 17 | |||
| n | % | n | % | n | % | |
| Neumonía | 5 | 50 | 6 | 60 | 2 | 50 |
| Sinusitis | 6 | 60 | 5 | 50 | 1 | 25 |
| Otitis media | 5 | 50 | 5 | 50 | 1 | 25 |
| Diarrea crónica | 2 | 20 | 3 | 30 | 0 | 0 |
| Gastroenteritis infecciosa aguda | 5 | 50 | 5 | 50 | 0 | 0 |
| Enfermedades autoinmunes | 5 | 50 | 2 | 20 | 0 | 0 |
| Bronquiectasias | 5 | 50 | 4 | 40 | 1 | 25 |
| Esplenomegalia | 2 | 20 | 1 | 10 | 0 | 0 |
| Linfadenopatías | 4 | 40 | 1 | 10 | 0 | 0 |
Discusión
La ALX es el resultado de mutaciones en el gen de la BTK, la cual es fundamental en el desarrollo de las células B.9 La BTK también se expresa en monocitos de sangre periférica; su búsqueda por citometría arrojó resultados negativos en todos los pacientes con ALX (datos no mostrados). Al parecer, los pacientes con ALX presentan respuestas inflamatorias exacerbadas. Nuestro grupo ha propuesto que la BTK regula la respuesta inflamatoria de monocitos, macrófagos y polimorfonucleares.10
Los pacientes con síndrome de hiper-IgM son susceptibles a gérmenes oportunistas, cursan con neutropenia y algunos pueden desarrollar enfermedades autoinmunes y cáncer.11 Las células B de estos pacientes son incapaces de formar centros germinales y de cambiar de isotipo. Los pacientes manifiestan disminución o franca ausencia de células B de memoria,11 afectación que fue comprobada en todos los pacientes de esta cohorte. El defecto más común fue la ausencia de CD154 en células T activadas,12 resultado obtenido en los siete pacientes con síndrome de hiper-IgM de esta cohorte.
Desde la descripción de la IDCV en 1953,13 se hizo relevante su complejidad. Los pacientes tienen manifestaciones clínicas muy diversas, cuya gravedad es variada. Las mutaciones que causan los fenotipos de la IDCV se observan en menos de 20 % de los pacientes. Varios grupos de investigación han estratificado a los pacientes con IDCV.14-16 En este trabajo utilizamos la clasificación de Friburgo. Los pacientes del grupo Ia son los que tienen la menor expresión de células B totales en sangre periférica, además de presentar las manifestaciones clínicas más graves.
Mediante el uso de la citometría de flujo fue posible el diagnóstico de ALX, síndrome de hiper-IgM e IDCV, padecimientos que implican la disminución o la ausencia de la producción de anticuerpos. El diagnóstico se consiguió con un nivel de confianza elevado y podrá orientar la pesquisa de genes candidato con posibles defectos.











 nueva página del texto (beta)
nueva página del texto (beta)


