Introducción
El manejo terapéutico, ya sea paliativo o correctivo, de los neonatos con cardiopatía congénita compleja (CCC) es un reto por la alta mortalidad y las secuelas neurológicas.1,2 Las últimas se atribuyen a eventos hipóxico-isquémicos asociados con variaciones en el flujo sanguíneo cerebral. Si bien el daño neurológico pudiera iniciarse desde la vida fetal,3,4 el mayor riesgo suele presentarse después del nacimiento, antes o durante procedimientos correctivos o paliativos de la cardiopatía.5 Previo a este momento, el daño neurológico puede ser causado por hipoxia crónica propia de la CCC, eventos recurrentes o persistentes de hipercapnia o medicamentos preoperatorios;6-9 durante la cirugía cardiovascular puede ser ocasionado por el uso de circulación extracorpórea.10,11
Un determinante contra el daño hipóxico-isquémico es la conservación del flujo sanguíneo cerebral por autorregulación de las demandas metabólicas neuronales.12 La hipoxia prequirúrgica y las variaciones del volumen sanguíneo durante una cirugía pueden estropear estos mecanismos y facilitar daño neurológico.13 Un indicador indirecto de la funcionalidad de la autorregulación del flujo sanguíneo cerebral es el índice de resistencia vascular (IR),14 el cual es medido por ultrasonido Doppler transfontanelar en arterias cerebrales; de estas, la arteria basilar proporciona más información y permite evaluar el efecto de la perfusión en las áreas básicas de supervivencia.15
Se espera que un neonato con CCC sin repercusión hemodinámica grave mantenga IR entre 0.63 y 0.73,16 lo que no sucede si la malformación no es compensatoria. En neonatos con antecedentes de asfixia moderada o severa al nacer, el IR alterado ha sido asociado a daño neurológico. En neonatos con IR < 0.55 entre las 36 y 72 horas después del nacimiento se ha observado mayor deterioro neurológico posterior.14 Lo anterior no ha sido analizado en neonatos con CCC sometidos a cirugía cardiovascular. El objetivo de este trabajo fue evaluar el efecto de la cirugía cardiovascular en el IR, así como analizar si estos cambios afectan la funcionalidad neurológica temprana a cinco días del posoperatorio.
Método
Previa aprobación del Comité de Investigación y Ética local con registro R 2015-3603-32 y consentimiento informado de los padres de los niños, se reclutó a 34 pacientes atendidos de octubre de 2015 a mayo de 2016 en el Hospital de Pediatría del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, Ciudad de México. Se incluyeron neonatos (< 28 días de vida) con CCC programados para cirugía cardiovascular paliativa o correctiva. Se excluyó a portadores de malformaciones múltiples extracardiacas, niños programados para cateterismo terapéutico o sin registro ultrasonográfico previo a la cirugía. Se eliminó del análisis final a los niños fallecidos durante la cirugía.
Los tratamientos médicos prequirúrgicos y la cirugía programada fueron decididos por un grupo de neonatólogos, cardiólogos y cirujanos cardiovasculares, si bien la decisión quirúrgica final fue determinada conforme los hallazgos transoperatorios. El manejo posquirúrgico fue independiente del resultado de los estudios ultrasonográficos y se basó en el consenso de los médicos responsables del niño.
Con ecografía Doppler pulsátil (Hewlett Packard modelo Sonos 5500® con transductor de 8 MHz) se realizaron cortes coronales cerebrales en la fontanela anterior hasta localizar el flujo de la arteria basilar. El IR se obtuvo con la fórmula (sístole − diástole)/sístole, para lo cual se midió la onda de pulso más aceptable y se obtuvo la velocidad del pico sistólico máximo y la velocidad del pico diastólico final. El valor final consistió en el promedio de tres mediciones realizadas en 30 segundos. Las mediciones siempre fueron llevadas a cabo por un solo evaluador capacitado y en un periodo no mayor a 45 minutos antes del inicio de la cirugía. Se efectuaron dos mediciones posteriores, la primera al finalizar la cirugía y con al menos 30 minutos de estabilidad hemodinámica durante la estancia en terapia intensiva; la segunda, a las 18 horas. Además, en cada momento se determinó la presión arterial de oxígeno (pO2), la presión arterial de dióxido de carbono (pCO2) y el lactato sérico (mmol/L).
De cada paciente se obtuvo edad gestacional, peso al nacimiento, tipo de cardiopatía, edad al procedimiento, peso prequirúrgico, puntuación RASCH-1,17 uso de analgesia o sedación precarga, asistencia ventilatoria y alimentación enteral. En cuanto al procedimiento realizado se registró tiempo de circulación extracorpórea, tiempo de pinzamiento vascular y cierre diferido o no diferido del esternón.18
Para evaluar la condición funcional neurológica posterior a la cirugía, se registró si esta permitió o no el retiro de la asistencia ventilatoria y/o el inicio de la alimentación durante los cinco días posteriores a la cirugía. La decisión del retiro de la ventilación asistida e inicio de la alimentación fueron determinadas por el equipo médico con base en criterios clínicos (automatismo respiratorio, equilibrio ácido-base, abdomen blando con peristalsis y evidencia de tránsito intestinal), independientemente del reporte del IR y de los investigadores. Finalmente, se determinó la supervivencia a este internamiento.
Los pacientes fueron agrupados conforme el IR prequirúrgico: normal, 0.63 a 0.73; bajo, < 0.63; alto, > 0.73. Se obtuvieron frecuencias simples y porcentajes para variables categóricas y medianas con rangos intercuartílicos para las variables cuantitativas, dada su distribución anormal. Para determinar diferencias en los resultados en los tres momentos considerados se utilizó prueba no paramétrica de Wilcoxon o chi cuadrada. Todos los análisis se realizaron con el programa estadístico SPSS versión 24. Un valor de p < 0.05 se consideró con significación estadística.
Resultados
Como se muestra en la Figura 1, fueron admitidos 115 pacientes con CCC, de los cuales 51 (42.8 %) cumplieron los criterios de selección; de estos, en 34 se obtuvieron mediciones prequirúrgicas y solo en 28 se lograron las tres.

Figura 1 Flujograma de la selección de los neonatos con cardiopatía congénita compleja incluidos en el estudio.
Características demográficas y clínicas precirugía
Los datos se resumen en la Tabla 1. La mayoría de los neonatos fue del sexo masculino y a término, con una mediana de peso de 2900 g y 10 días de edad a la cirugía. La cardiopatía más frecuente consistió en transposición de grandes arterias, seguida de conexión anómala de los vasos pulmonares. En nueve, la cirugía fue paliativa y en el resto, correctiva; el cambio arterial (switch arterial) fue la más común (12/34; 35.2 %); 75 % de los neonatos recibió ventilación asistida, 50 % medicación sedativa y 67 % estaba en ayuno. El riesgo quirúrgico ajustado (RASCH-1) varió de 1 a 6, 61.7 % calificó con una puntuación de 3.
Tabla 1 Datos clínicos y demográficos de 34 neonatos con cardiopatía congénita compleja
| Variable | Mediana | Cuartiles 1, 3 |
|---|---|---|
| Edad a la cirugía (días) | 10 | 2, 44 |
| Mediana | Min.-máx. | |
| Peso en gramos a la cirugía | 2900 | 1430-3835 |
| n | % | |
| Sexo masculino | 22 | 64.7 |
| Edad gestacional al nacimiento | ||
| < 37 semanas | 4 | 11.8 |
| ≥ 37 semanas | 30 | 88.3 |
| Tipo de anomalía cardiovascular | ||
| Transposición de grandes arterias | 11 | 32.4 |
| TGA + coartación aórtica/hipoplasia | 2 | 5.9 |
| Conexión anómala de venas pulmonares | 9 | 26.5 |
| Interrupción aórtica/coartación | 3 | 8.8 |
| Síndrome de ventrículo izquierdo hipoplásico | 3 | 8.8 |
| Atresia pulmonar | 3 | 8.8 |
| Aurícula y ventrículo únicos | 1 | 2.9 |
| Anomalía de Ebstein | 1 | 2.9 |
| Canal auriculoventricular | 1 | 2.9 |
| Manejo prequirúrgico | ||
| Analgesia | 8 | 23.5 |
| Sedación | 17 | 50.0 |
| Asistencia ventilatoria | 25 | 73.5 |
| Alimentación enteral | 12 | 35.3 |
| Cirugías realizadas | ||
| Switch arterial | 12 | 35.3 |
| Fístula sistémica pulmonar | 8 | 23.5 |
| Reparación total de vasos pulmonares | 7 | 20.5 |
| Plastia aórtica | 2 | 5.9 |
| Operación de Norwood | 2 | 5.9 |
| Vendaje arteria pulmonar + reparación aórtica | 1 | 2.9 |
| Vendaje arteria pulmonar | 1 | 2.9 |
| RTVP + RPA | 1 | 2.9 |
| Puntuación RASCH-1 | ||
| 1 | 1 | 2.9 |
| 3 | 21 | 61.8 |
| 4 | 10 | 29.4 |
| 6 | 2 | 5.9 |
| Tiempo de circulación extracorpórea | ||
| < 90 minutos | 3 | 8.0 |
| ≥ 90 minutos | 18 | 52.9 |
| Tiempo de pinzamiento | ||
| < 60 minutos | 8 | 23.5 |
| ≥ 60 minutos | 13 | 38.2 |
| Cierre esternal diferido | 21 | 61.8 |
TGA = transposición de grandes arterias, RTVP = reparación total de vasos pulmonares, RPA = reparación aórtica.
De acuerdo con el IR prequirúrgico, siete pacientes (20.5 %) presentaron cifras normales, ocho (23.5 %) bajas y 19 (55.8 %) altas.
Evolución poscirugía
Debido a su defunción, seis pacientes no fueron medidos en los tres momentos programados: cuatro (11.7 %) fallecieron durante la circulación extracorpórea (dos con IR alto, uno con IR normal y uno con IR bajo) y dos (5.8 %) en el posoperatorio inmediato, ambos con IR bajo, durante la primera hora de salida de la circulación extracorpórea.
Requirieron cierre diferido del esternón 21 (61 %) pacientes supervivientes al procedimiento quirúrgico (Tabla 1). Dos pacientes fueron operados en dos ocasiones: en uno se realizó cerclaje de la arterial pulmonar inicial y switch arterial correctivo y en el otro, plastia de la aorta inicial y switch arterial posterior (Figura 1).
Evolución del índice de resistencia poscirugía
En la Figura 2 se muestra el IR posquirúrgico por grupos. En los pacientes con IR normal no se registraron diferencias entre sus valores iniciales (30 minutos) y 18 horas después (p = 0.223), además, en todo momento las cifras se mantuvieron entre 0.63 y 0.73. En los niños con IR prequirúrgico bajo, este se normalizó en el posoperatorio: 0.65 a los 30 minutos y 0.68 a las 18 horas (prueba de Wilcoxon p = 0.09). En los neonatos con IR prequirúrgico alto, este se mantuvo elevado: 0.82 a los 30 minutos y 0.81 a las 18 horas, p = 0.204.
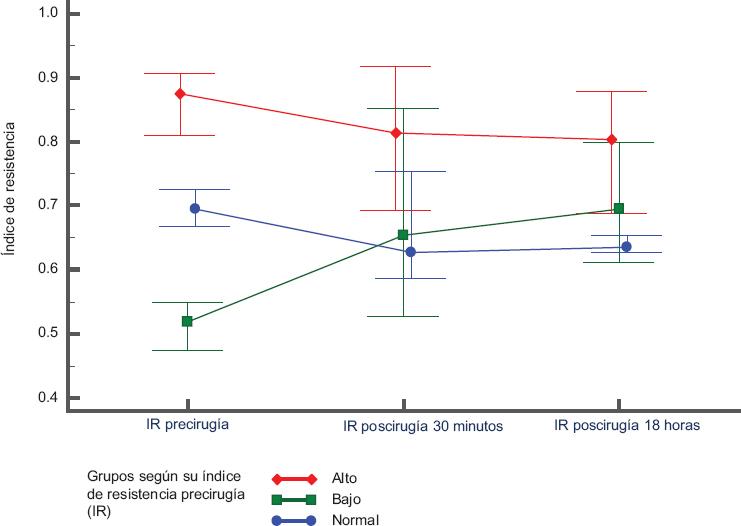
Figura 2 Cambios en los índices de resistencia (IR) después de la cirugía (30 minutos y 18 horas) según los valores prequirúrgicos (IR normal, n = 5; IR bajo, n = 6; IR alto, n = 17). Los cuadrados, círculos y diamantes corresponden a las medianas y los bigotes, al rango intercuartílico 1-3. Con la prueba de Wilcoxon se obtuvo p = 0.091 para IR bajo, p = 0.223 para IR normal y p = 0.204 para IR alto.
Modificaciones en el O2, CO2 y lactato sérico en el periodo posqúirgico
En todos los niños se observó incremento de la saturación de oxígeno después de la cirugía cardiovascular. El incremento fue más notorio y constante en el grupo con IR prequirúrgico bajo: 35, 45 y 65 mm Hg en las mediciones basal, a los 30 minutos y a las 18 horas (p = 0.007). El cambio fue mínimo en los neonatos con IR normal: 40, 61 y 57 mm Hg en esas mismas mediciones (p = 0.738), al igual que en aquellos con IR alto: 30, 46 y 50 mm Hg (p = 0.014) (Figura 3).

Figura 3 Niveles de presión arterial de oxígeno antes y después del procedimiento quirúrgico, según el índice de resistencia: normal, n = 5; bajo, n = 6; alto, n = 17. Los cuadrados, círculos y diamantes corresponden a las medianas y los bigotes, al rango intercuartílico 1-3. Con la prueba de Wilcoxon se obtuvo p = 0.007 para IR bajo, p = 0.74 para IR normal y p = 0.01 para IR alto.
La presión parcial de dióxido de carbono en los neonatos con IR bajo y alto se redujo a los 30 minutos después de la cirugía y se normalizó a las 18 horas: en los niños con IR bajo, las mediciones basal, a los 30 minutos y a las 18 horas fueron de 36, 32 y 35 mm Hg (p = 0.692); en aquellos con IR alto, de 36, 32 y 36 mm Hg, respectivamente (p = 0.19). El grupo con IR normal no mostró cambios: basal de 36 mm Hg y a los 30 minutos y 18 horas de 41 mm Hg (p = 0.26) (Figura 4).

Figura 4 Niveles de presión arterial de dióxido de carbono antes y después del procedimiento quirúrgico, según el índice de resistencia (normal, n = 5; bajo, n = 6; alto, n = 17). Los cuadrados, círculos y diamantes corresponden a las medianas y los bigotes al rango intercuartílico 1-3. Con la prueba de Wilcoxon se obtuvo p = 0.69 para IR bajo, p = 0.26 para IR normal y p = 0.13 para IR alto.
El lactato sérico estuvo elevado desde la medición prequirúrgica en todos los pacientes. En aquellos con IR normal no cambió durante el posoperatorio: 3 mmol/L en las mediciones prequirúrgica y a los 30 minutos y 2.5 mmol/L a las 18 horas (p = 0.554). En los pacientes con IR bajo se incrementó a los 30 minutos (2 a 4 mmol/L), para mantenerse elevado a las 18 horas (4 mmol/L, p = 0.247). En el grupo con IR alto se incrementó de 2.5 a 5.5 mmol/L a los 30 minutos; a las 18 horas bajó a valores cercanos a los prequirúrgicos (3.5 mmol/L, p < 0.0001).
Evolución clínica poscirugía
La funcionalidad neurológica posquirúrgica fue evaluada en 28 pacientes (82.3 %). En 60.7 % (17/28) fue desfavorable y no permitió iniciar la alimentación enteral ni el retiro de la ventilación asistida en los primeros cinco días posquirúrgicos (Tabla 2). No se pudo demostrar una diferencia estadísticamente significativa entre los grupos. Solo cuatro pacientes del grupo con IR alto (23.5 %) lograron funcionalidad neurológica completa.
Tabla 2 Capacidades neurológicas poscirugía según el índice de resistencia prequirúrgica en 28 neonatos con cardiopatía congénita compleja
| Capacidad neurológica | IR normal (n = 6) | IR bajo (n = 5) | IR alto (n = 17) | Total (n = 28) | p* | |||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | ||
| No permitió iniciar la alimentación enteral ni la respiración espontánea | 4 | 57.1 | 4 | 50 | 9 | 47.3 | 17 | 0.35 |
| Solo se logró alimentación enteral o respiración espontánea | 2 | 33.3 | 1 | 20 | 4 | 23.5 | 7 | |
| Se logró alimentación enteral y respiración espontánea | 0 | 0 | 0 | 0 | 4 | 23.5 | 4 | |
| Muerte | 2 | 28.5 | 4 | 50 | 5 | 26.3 | 11 | |
IR = índice de resistencia vascular. IR normal, 0.63-0.73; IR bajo, ≤ 0.63; IR alto, ≥ 0.73.
*Prueba de Pearson, coeficiente de contingencia = 0.34.
Discusión
Un primer hallazgo fue el IR bajo o alto en la mayoría de los pacientes (79 %) antes de la cirugía, lo que implica alta frecuencia de neonatos con flujo sanguíneo cerebral alterado posiblemente por cambios hemodinámicos desde la etapa fetal y relacionados con las cardiopatías.19 Es posible que con la cirugía cardiovascular se redistribuyan los flujos y con ello el IR, como sucedió en la mayoría de los pacientes, cambie a niveles normales en las 18 horas posteriores a la cirugía. Cuando el flujo sanguíneo cerebral no se normaliza, potencialmente puede haber daño neurológico.20
Por otro lado, debido a la disposición de tres grupos diferentes según el IR prequirúrgico, fue posible evaluar patrones diferenciales en el comportamiento vasculocerebral secundario al reto hemodinámico que implica una cirugía compleja. En los neonatos con IR prequirúrgico normal se observó respuesta vasomotora cerebral conservada, con discreto aumento en el IR al final de la intervención quirúrgica, posiblemente por cambios de volumen por la reperfusión posterior al retiro de la circulación extracorpórea,11 pero que retornó al valor normal una vez estabilizado el paciente a las 18 horas.
En el grupo con un IR prequirúrgico alto, ocho de los 19 pacientes tenían trasposición de grandes arterias o falla cardiaca derecha e hipóxica crónica, condiciones inductoras de incremento del IR; en esos pacientes, a pesar de una corrección del defecto con incremento de la presión parcial de oxígeno, no hubo vasodilatación consecuente con reducción sustancial del IR, lo cual puede explicarse por alteraciones en la saturación regional de oxígeno.20
Contrario a nuestra hipótesis de que el posoperatorio inmediato sería favorable en los niños con normalización del IR, esto solo sucedió en un paciente con IR previamente alto. Otros tres neonatos con IR alto precirugía también tuvieron un posoperatorio favorable, pero las cifras del IR continuaron siendo altas. En el resto se dificultó la decanulación o el inicio de la vía enteral o ambos.
Por el reducido número de pacientes y la interacción de múliples factores, principalmente los tipos de cardiopatía, fue difícil analizar las condiciones que afectaron la evolución neurológica. Particularmente en los neonatos con IR bajo, aunque se incrementaron los valores durante el posoperatorio, la evolución posterior fue muy mala: tres fallecieron y los otros no lograron autonomía respiratoria y enteral. Estos hallazgos son compatibles con los observados por Ilves21 en pacientes con asfixia severa y explicados como daño por vasoparálisis secundaria a hiperperfusión retrasada. Quizás en los pacientes con IR alto, la autorregulación cerebral mantenía una mejor compensación a los cambios en la presión de la perfusión cerebral.15 Cuando esta autorregulación se daña, la eficacia depende exclusivamente de factores externos como la presión arterial y el volumen sanguíneo, entre otros. No dudamos que estos mecanismos se hubieran extinguido en los pacientes, a lo que contribuyeron las condiciones del tratamiento quirúrgico y anestésico.22
Otro factor adyuvante en varios pacientes fue el cierre diferido de esternón. Durante la espera, los pacientes estuvieron bajo sedación, analgesia e intubación, condiciones de alto riesgo para nuevos episodios hipóxico-isquémicos.
Deben ser consideradas dos limitaciones importantes de este estudio, una es el tamaño de muestra y la segunda, el tiempo de seguimiento. Si bien es difícil reproducir el estudio por las características de los pacientes, será necesario un estudio multicéntrico. Asimismo, se ha sugerido la resonancia magnética nuclear vascular como otra opción para la valoración periquirúrgica23 y analizar otros factores involucrados.24
Conclusiones
Una alta proporción de pacientes con CCC muestra alteración del IR cerebral antes del procedimiento cardiovascular y aunque la cirugía cardiovascular parece favorecer la normalización del IR, la repercusión neurológica pudiera ya estar determinada. En la mayoría de los pacientes fue difícil retirar la asistencia ventilatoria o iniciar la alimentación enteral debido al inadecuado control neurológico central.











 nueva página del texto (beta)
nueva página del texto (beta)


