Introducción
La valoración del paciente que será sometido a un procedimiento quirúrgico es un arte complejo que forma parte de las responsabilidades del médico internista, pero el desenlace es [ ] producto de un esfuerzo de la colaboración entre las distintas áreas de la medicina hospitalaria.1
La valoración preoperatoria no debe limitarse a la prevención de eventos cardiovasculares, dado que existen múltiples patologías que pudieran convertirse en dificultades durante el periodo perioperatorio.2-4 La cirugía de urgencia no debe retrasarse por una valoración, pero el médico internista debe estar al tanto para manejar al paciente durante el periodo perioperatorio.
El objetivo de esta revisión es revisar paso por paso la valoración preoperatoria en cirugía no cardiaca desde la perspectiva del médico internista, con el fin de ayudar a prevenir eventos adversos y mejorar el desenlace general (Tabla 1).
Tabla 1 Valoración preoperatoria en cirugía no cardiaca
| Pasos |
| 1. Diagnóstico quirúrgico. |
| 2. Operación programada. |
| 3. Anestesia programada. |
| 4. Clasificación de riesgo quirúrgico. |
| 5. Recomendaciones. |
| Desglose |
| 1. Historia clínica general dirigida a obtener la información necesaria para realizar todos los cálculos de riesgo cardiaco, pulmonar, trombótico e infeccioso. Solicitar estudios de laboratorio y gabinete dirigidos. |
| 2. Aplicar escalas de riesgo y anotar en el análisis los siguientes resultados: |
| a) Riesgo según el tipo de cirugía. |
| b) Cardiovascular: capacidad funcional, ASA, Gupta, Lee. |
| c) Pulmonar: ARISCAT/Canet, Gupta para falla respiratoria, Gupta para neumonía y tamizaje STOP -BANG. |
| d) Trombótico: Caprini IMPROVE. |
| 3. Recomendaciones |
| a) Recomendaciones prequirúrgicas: suspensión de tabaquismo, alcoholismo, toxicomanías y medicamentos. Tiempo de ayuno. Dosis, posología y momento de administración de profilaxis antibiótica para infección de herida quirúrgica. Necesidad de estudios prequirúrgicos adicionales con base en riesgo e interrogatorio (ejemplo, ecocardiografía, pruebas de función respiratoria). |
| b) Recomendaciones posquirúrgicas: necesidad de área de cuidados críticos para vigilancia posoperatoria con monitorización según riesgo cardiovascular o pulmonar. Rehabilitación pulmonar o necesidad de presión positiva durante el posquirúrgico con base en el riesgo. Tromboprofilaxis conforme a riesgo. Medicamentos a evitar según características del paciente y riesgo de complicaciones. |
| c) Conciliación de medicamentos: establecer qué medicamentos debe suspender el paciente y cuándo, cuáles debe continuar, cuándo se deben reiniciar y si es necesario empezar algún otro. |
Historia clínica
Debe hacerse una historia clínica general y hacer hincapié en la valoración funcional, tiempo de ayuno (en pacientes hospitalizados), antecedentes médicos y lista completa de medicamentos con su respectiva posología, antecedentes quirúrgicos y complicaciones y reacciones alérgicas, así como un extenso cuestionario por aparatos y sistemas en busca de factores de riesgo cardiovascular, pulmonar y la información suficiente para calcular las escalas de riesgo. Además, a toda mujer en edad reproductiva se le debe preguntar si está embarazada o existe la posibilidad de embarazo.5
Valoración funcional
La valoración funcional se ha asociado con mortalidad perioperatoria.6 Se puede usar la estimación de los MET (Metabolic Equivalent of Task o equivalente metabólico de actividad).7 Los MET pueden calcularse con exactitud mediante una prueba de esfuerzo en banda, pero para efectos de la valoración preoperatoria hay que hacer la siguiente pregunta: ¿puede el paciente subir un piso de escaleras o caminar dos cuadras sin fatigarse? Si la respuesta es afirmativa tiene más de 4 MET y si es negativa tiene menos. Lo anterior determina la necesidad de estudios complementarios cardiovasculares.
Consumo de alcohol y ayuno
Se puede utilizar la escala de tamizaje de consumo de alcohol de AUDIT-c durante el último año; un resultado ≥ 9 se vincula con aumento en la estancia hospitalaria, mayor tasa de infecciones y mayor estancia en cuidados intensivos.8 Además, los pacientes con consumo de alcohol importante pueden presentar síndrome de abstinencia durante la cirugía;9 si es el caso, se puede monitorizar al paciente con el cuestionario de CIWA-Ar (Clinical Institute Withdrawal Assessment Scale for Alcohol, revised) y dar profilaxis de acuerdo con los resultados.10
El tiempo de ayuno es importante para reducir riesgo de broncoaspiración. Actualmente se recomienda un ayuno mínimo de dos horas para líquidos claros (incluido café sin leche), de seis horas para una comida ligera (incluida la leche) y de ocho horas para una comida copiosa. No se recomienda el uso de procinéticos ni supresores de ácido gástrico de forma rutinaria. La medición ultrasonográfica del contenido gástrico antes de la inducción de la anestesia, particularmente en pacientes que no han seguido las indicaciones de ayuno, pudiera ser de utilidad, pero no es una práctica estandarizada.11
Valoración pulmonar y tabaquismo
Un índice tabáquico elevado (que puede ser por tabaquismo indirecto) se asocia con enfermedad pulmonar obstructiva crónica (EPOC), viscosidad de la sangre, disminución en la cicatrización e infección del sitio quirúrgico.12 Suspender el cigarro al menos cuatro semanas antes disminuye complicaciones respiratorias, infecciosas y de la cicatrización; suspenderlo dos semanas antes disminuye las complicaciones respiratorias.13 Se pueden usar suplementos de nicotina como auxiliar en la abstinencia del tabaco.14
Las complicaciones pulmonares pueden deberse a factores del paciente (EPOC, tabaquismo, edad, hipertensión pulmonar, síndrome de apnea hipopnea obstructiva del sueño [SAHOS]) o tipo de cirugía y anestesia general. Los exámenes paraclínicos que se asocian con morbilidad pulmonar son albúmina < 3.5 mg/dL, hemoglobina baja y nitrógeno de urea sanguínea ≥ 30 mg/dL.2 Las siguientes cuatro escalas son de utilidad para valorar el riesgo pulmonar:
La escala de ARISCAT o Canet predice complicaciones posquirúrgicas pulmonares (infecciones con necesidad de uso de antibiótico, insuficiencia respiratoria, derrame pleural, atelectasias, neumotórax, broncoespasmo o pneumonitis por aspiración).3
Existen dos escalas de Gupta para complicaciones pulmonares, la primera sirve para predecir insuficiencia respiratoria15 y la segunda para predecir neumonía en los 30 días del posoperatorio.4 Se pueden descargar de forma gratuita por internet (http://www.surgicalriskcalculator.com).
Durante la valoración preoperatoria se debe optimizar el tratamiento de la EPOC y el asma. Cuando hay riesgos elevados debería reconsiderarse la indicación quirúrgica.2 También se pueden aplicar protocolos estandarizados que han demostrado reducción de riesgo pulmonar (ERAS o ERAS+17 que se suma al protocolo ICOUGH18) y que incluyen disminuir uso de opioides intravenosos, manejo de líquidos intravenosos, fisioterapia pulmonar con inspirómetro incentivo, higiene bucal, deambulación temprana posoperatoria y elevación de la cabecera de la cama.17,18
El SAHOS se asocia con insuficiencia respiratoria y mortalidad cardiovascular perioperatoria. Se puede usar el STOP BANG, una escala sencilla para hacer tamizaje.19 Una puntuación de STOP BANG ≥ 3 se considera riesgo de padecer SAHOS moderado a severo.19 Si se cuenta con el recurso, en el paciente ambulatorio debe hacerse un estudio de polisomnografía para confirmar o descartar el diagnóstico e instaurar tratamiento adecuado. Si el paciente no es capaz de utilizar su presión positiva continua en la vía aérea en el posquirúrgico o tiene comorbilidades cardiovasculares importantes, se beneficia de la vigilancia posoperatoria en la unidad de cuidados intermedios o intensivos, incluso si el procedimiento planeado era ambulatorio.20 En pacientes de cirugía ambulatoria con sospecha de SAHOS en quienes se están utilizando opioides parenterales o los que presentan eventos respiratorios recurrentes en sala de recuperación, se recomienda vigilancia con oximetría continua e, incluso, terapia de presión positiva en unidades monitorizadas.21 En SAHOS debe tenerse cautela con el uso de medicamentos que induzcan depresión respiratoria (benzodiacepinas y opiáceos), ya que pueden ocasionar paro respiratorio en un paciente de difícil intubación orotraqueal.
Escalas de riesgo cardiovascular y riesgo según el tipo de cirugía
La valoración cardiovascular se apoya de escalas que predicen la probabilidad de complicaciones durante el periodo perioperatorio. La primera fue creada por la Sociedad Americana de Anestesiología (ASA, American Society of Anesthesiologists) en 1941,22 seguida de las creadas por Goldman en 1977,23 por Detsky en 1986,24 por Lee en 199925 y Gupta en 2011.26
La escala de ASA es de gran utilidad, pero su uso se recomienda en conjunto con otras,22 ya que involucra juicio subjetivo. Tiene la ventaja de ser sencilla y alcanza un suficiente grado de generalización para que pueda ser utilizada como lenguaje de comunicación casi universal.
El índice de Goldman sirve para descartar enfermedad arterial coronaria, no tanto para detectarla (valor predictivo negativo de 96.8 %, valor predictivo positivo de 21.6 %).27 Su uso junto con la escala de ASA aumenta su certeza diagnóstica.28
El índice de Lee o riesgo cardiaco revisado tiene mejor sensibilidad y especificidad para morbilidad cardiovascular.7,29
Gupta et al. validaron una escala de riesgo de complicaciones cardiovasculares durante los primeros 30 días del periodo posoperatorio en 200 hospitales y 200 000 pacientes.30 Las ventajas de esta escala estriban en que consideró población más reciente y nuevas técnicas quirúrgicas; ha demostrado superioridad para predecir eventos no deseados comparada con escalas previas30 (Tabla 2).
Tabla 2 Comparación de variables utilizadas por las diversas escalas de riesgo cardiovascular
| Variable | Gupta^ | Lee& | Goldman& |
|---|---|---|---|
| Edad | Sí | No | Sí |
| Cirugía de urgencia | No | No | Sí |
| Tipo de procedimiento (alto riesgo) | Sí | Sí | Sí |
| Enfermedad arterial coronaria | No | Sí | Sí (IAM) |
| Estenosis aórtica significativa | No | No | Sí |
| Arritmias | No | No | Sí |
| Insuficiencia cardiaca congestiva | No | Sí | Sí (S3 o ingurgitación yugular) |
| Diabetes mellitus en manejo con insulina | No | Sí | No |
| Creatinina (mg/dL) | ≥ 1.5 | > 2 | ≥ 3 |
| Antecedente de EVC | No | Sí | No |
| Clasificación ASA | Sí | No | No |
| Estatus funcional preoperatorio | Sí | No | Mal estado general* |
^El cálculo del riesgo se hace por medio de una calculadora, no se puede hacer manual.
&El cálculo del riesgo puede hacerse manualmente.
*Uno de los siguientes parámetros: presión parcial de oxígeno < 60, presión parcial de dióxido de carbono > 50, potasio < 30, concentración de bicarbonato < 20, nitrógeno ureico en sangre > 50, creatinina > 3, elevación de aspartato aminotransferasa, falla hepática, postración en cama.
IAM = infarto agudo al miocardio, EVC = enfermedad cerebro vascular, ASA = American Society of Anestesiology
Cada escala utiliza su propia puntuación para otorgar un porcentaje de riesgo y se encuentra disponible en calculadoras gratuitas en internet.
Gupta: cada variable tiene una puntuación diferente y el resultado se da en porcentaje del riesgo de infarto o paro cardiaco perioperatorio (https://qxmd.com/calculate/calculator_245/gupta -perioperative -cardiac -risk).
Lee: son seis determinantes que se van sumando, posteriormente dependiendo del número de variables se dividen en cuatro grupos, donde cada uno otorga un riesgo de complicaciones (https://qxmd.com/calculate/calculator_195/revised -cardiac -risk -index -lee -criteria).
Goldman: cada variable aporta una puntuación diferente, con un máximo de 53. Se dividen en cuatro clases dependiendo de la puntuación y se otorga riesgos de complicaciones mayores y muerte cardiaca según su clase (https://reference.medscape.com/calculator/cardiac -risk -noncardiac -surgery -goldman).
El tipo de cirugía per se está relacionado con una diferente probabilidad de eventos cardiovasculares como infarto al miocardio o muerte31 (Figura 1).
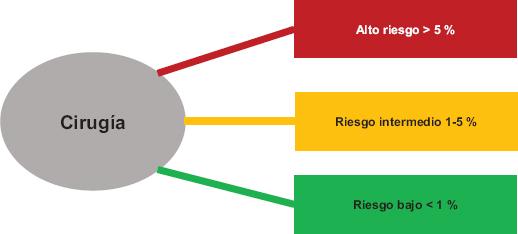
Figura 1 Ejemplos de riesgo quirúrgico según el tipo de cirugía. Riesgo alto = cirugía aórtica y vascular mayor, pancreato-doudenal, ducto biliar o hepática, adrenal, esofagectomía, neumectomía, reparación de perforación intestinal. Riesgo intermedio = esplenectomía, colecistectomía, carotídea sintomática, angioplastia arterial periférica, aneurisma endovascular, cabeza y cuello, trasplante renal, urológico y ginecológico mayor. Riesgo bajo = cirugía de mama, dental, tiroides, ojo, reconstructiva, carotidea asintomática, ginecológico menor, ortopédico menor, transuretral de próstata. Adaptado de Glance et al.31
Con base en los resultados de las escalas de riesgo quirúrgico cardiaco, el tipo de cirugía y la valoración funcional del paciente pueden decidirse los estudios complementarios que se requieren (electrocardiograma, ecocardiograma en reposo o pruebas de esfuerzo con o sin fármacos en banda, bicicleta ergométrica, ECOTT dobutamina, medicina nuclear, resonancia magnética)7,32 (Tabla 3). Cuando un paciente tiene una prueba de esfuerzo negativa para isquemia miocárdica o la isquemia es leve a moderada se puede proceder a la cirugía; si es extensa, se debe revalorar la indicación quirúrgica, valorar la utilidad de la revascularización miocárdica, tomando en cuenta que posterior a esta el paciente requerirá antiplaquetarios por un largo periodo, lo cual a su vez afecta la realización del procedimiento quirúrgico.29 El cateterismo cardiaco rutinario como método de tamizaje es incierto en pacientes con baja capacidad funcional y factores de riesgo cardiovascular (Lee ≥ 2, MET < 4) y que serán sometidos a cirugía de riesgo intermedio o alto o a cirugía vascular. En esos casos sería preferible iniciar con métodos no invasivos como pruebas de estrés miocárdico.33
Tabla 3 Indicaciones para exámenes prequirúrgicos de laboratorio y gabinete según riesgo quirúrgico7,29,32,57-60
| Prueba diagnóstica | Factores del procedimiento | Factores del paciente |
|---|---|---|
| Radiografía de tórax | Riesgo intermedio a alto (aunado a factores del paciente) | ASA ≥ 3, sospecha clínica de patología torácica, antecedente de enfermedad pulmonar, disnea de origen no determinado. |
| Electrocardiograma | Cirugía de riesgo intermedio -alto (mayor valor si existe algún factor del paciente, pero se puede hacer sin síntomas) | Índice de Lee ≥ 1. Sospecha clínica de enfermedad cardiaca o arritmia, evaluación de disnea de origen no determinado. |
| ECOTT | Cirugía de riesgo intermedio o alto (con factores de riesgo y baja capacidad funcional) | Pacientes con MET < 4 y Lee ≥ 1 que serán sometidos a cirugía de alto riesgo, con falla cardiaca que ha empeorado clínicamente o a quienes no se les ha realizado el estudio en el último año; pacientes con daño miocárdico estructural con sospecha de progresión, evaluación de disnea de origen no determinado. |
| Estudios de estrés miocárdico | Cirugía de riesgo intermedio a alto (con factores de riesgo) | Pacientes con índice de Lee ≥ 2 y MET < 4 y a quienes se les realizará cirugía de riesgo intermedio a alto, particularmente con Lee ≥ 3 y en cirugía de alto riesgo. |
| Troponina | Cirugía de riesgo intermedio a alto (aunado a factores del paciente) | Pueden ser de utilidad en pacientes con MET ≤ 4 o índice de Lee > 1 para cirugía vascular o > 2 para cirugía no vascular. |
| Biometría hemática | Cirugía de riesgo intermedio | Pacientes con enfermedad cardiovascular o renal . |
| Cirugía riesgo alto | Todos | |
| Pruebas de función renal | Cirugía de riesgo intermedio | Pacientes ASA 3 o 4 y pacientes ASA 2 con riesgo de falla renal aguda. |
| Cirugía riesgo alto | Todos | |
| Pruebas de coagulación | Cirugía de riesgo intermedio | Pacientes anticoagulados o con enfermedad hepática |
| Cirugía riesgo alto | Todos | |
| Electrolitos séricos | Cirugía de bajo riesgo | No |
| Cirugía de riesgo intermedio o alto | Pacientes con falla renal o uso crónico de medicamentos que modifiquen electrolitos séricos (diuréticos, inhibidores enzima convertidora angiotensina/antagonistas de los receptores de la angiotensina II). | |
| Examen general de orina | Cirugía urológica con instrumentación | Si hay síntomas de infección solicitar con urocultivo y si el tamizaje cambiara el manejo. |
| Prueba de embarazo | Cualquiera | Ofrecer a mujeres en edad reproductiva con posibilidad de embarazo. |
ASA = Sociedad Americana de Anestesiología, MET = equivalente metabólico de actividad, ECOTT = ecocardiograma transtorácico.
Riesgo de trombosis y sangrado
El riesgo de sangrado se puede evaluar utilizando la escala IMPROVE (https://www.outcomes-umassmed.org/improve/risk_score/bleeding/index.html). Las complicaciones trombóticas pueden ser prevenibles si se identifican a tiempo. El principal factor de riesgo aislado para un evento tromboembólico es la cirugía de riesgo alto, la cirugía oncológica y los reemplazos articulares de cadera o de rodilla.34 Con la escala de Caprini se clasifica el riesgo de trombosis (https://venousdisease.com/dvt-risk-assessment-online/), respecto al cual se emiten las siguientes recomendaciones:34
Muy bajo (< 0.5 %): deambulación temprana.
Bajo (1.5 %): medias de compresión neumática o profilaxis farmacológica durante la hospitalización.
Moderado (3 %): profilaxis farmacológica y mecánica durante la hospitalización.
Alto (6 %): profilaxis farmacológica y mecánica por siete a 10 días (por ejemplo, artroplastia de rodilla).
Riesgo muy alto (6-18 %): profilaxis farmacológica y mecánica por 30 días (por ejemplo, artroplastia de cadera).
La mejor opción para la profilaxis mecánica es la compresión neumática intermitente.35 La profilaxis farmacológica típicamente consiste en la administración de 40 mg subcutáneos de heparina de bajo peso molecular cada 24 horas, que se debe ajustar en ciertos casos, como ante tasa de filtración glomerular < 30 mL/minuto36 o IMC ≥ 40 kg/m2. Se debe suspender al menos 12 horas antes del procedimiento quirúrgico y reiniciarse a las 24 horas, ponderando el riesgo de sangrado con el de trombosis.37 Es posible que los nuevos anticoagulantes orales de acción directa aumenten el riesgo de sangrado posoperatorio.38
Estudios de laboratorio y gabinete
El uso indiscriminado de estudios de laboratorios en la valoración preoperatoria es un hábito común que no favorece el pronóstico.1,39-41 En pacientes sanos en quienes se realizará una cirugía de riesgo bajo (por ejemplo, cirugía de cataratas), se sugiere omitir la toma de estudios de laboratorio y gabinete y en cirugías de riesgo intermedio a alto dependerá de sus características (Tabla 3).41,42
Conciliación de medicamentos
Betabloqueadores y fármacos para control del ritmo (digoxina, amiodarona, ivabradina)
Se deben continuar durante el perioperatorio.7,29 Se sugiere no utilizar betabloqueadores en pacientes que no los estén tomando ya que pueden aumentar la morbimortalidad.43-45
IECA/ARA 2
Si los inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de angiotensina-2 (ARA 2) estaban indicados en el paciente por hipertensión arterial sistémica, se recomienda suspenderlos un día antes de la cirugía ya que pueden ocasionar hipotensión perioperatoria refractaria a aminas; se deben reiniciar en el posquirúrgico según la evolución clínica. Si están indicados como tratamiento de falla cardiaca se puede considerar continuarlos, siempre ponderando los riesgos.29,46
Diuréticos
En hipertensión se recomienda no tomar la dosis el día de la cirugía. Se pueden continuar para el tratamiento de la falla cardiaca congestiva, valorando el beneficio de prevenir la sobrecarga hídrica versus el riesgo de hipotensión, falla renal y desequilibrio hidroelectrolítico (hipocaliemia, hipomagnesemia), que pudieran a su vez precipitar arritmias cardiacas. Se debe solicitar electrolitos preoperatorios.29
Calcioantagonistas
Se recomienda continuarlos con cautela en el periodo perioperatorio.47 La nifedipina se ha asociado con aumento en la mortalidad en cirugía aorto-abdominal.29
Estatinas
Se sugiere continuarlas ininterrumpidamente en uso crónico7,29 e iniciarlas dos semanas antes de cirugía vascular; se ha observado que su uso disminuye la mortalidad.29
Insulina
En el paciente diabético hospitalizado, la meta debe ser mantener la glucemia preprandial < 140 mg/dL y la glucemia casual entre 140 y 180 mg/dL:48,49
Bomba de insulina: continuar infusión basal.
Insulina ultrarrápida: suspender dosis el día de la cirugía.
Insulinas premezcladas: suspender antes de la cirugía, cambiar por intermedia.
Insulina intermedia: dar 75 % de la dosis nocturna un día antes de la cirugía y 50 a 75 % de la dosis la mañana de la cirugía.
Insulina de larga duración: dar 100 % de la dosis nocturna un día antes de la cirugía, 75 a 100 % de la dosis de la mañana el día de la cirugía.
Metformina
Suspender 24 horas antes (o 48 horas si el paciente recibirá contraste intravenoso) para disminuir riesgo de acidosis láctica; reiniciar 48 horas después de la cirugía si no hay falla renal, náusea o vómito. Mantener control glucémico, con insulina de ser necesario.49
Inhibidores dipeptidil petidasa 4 (DPP-4), agonistas péptido similar a glucagón-1 (GLP-1), tiazolidonedionas, sulfonilureas, meglitinidas
Suspender un día antes (verificar vida media para disminuir riesgo de hipoglucemia) y reiniciar uno o dos días antes del egreso en el paciente estable. De ser necesario, emplear insulina para el control glucémico.48,49
Corticosteroides
En pacientes con sospecha de insuficiencia suprarrenal o a quienes se les haya aplicado durante el último año corticosteroides deberá administrarse dosis de estrés en el perioperatorio (200 a 300 mg de hidrocortisona en 24 horas).50,51
Antiinflamatorios no esteroideos
Suspender cinco a 10 días antes del procedimiento quirúrgico y reiniciar al lograr adecuada hemostasia.52
Aspirina a dosis bajas
En prevención primaria se sugiere suspender de siete a 10 días antes de la cirugía.53
Doble antiagregación
En colocación reciente de stent, se recomienda posponer la cirugía electiva hasta cumplir rangos de seguridad para prevenir la retrombosis. Si el stent es de metal puro, se recomienda esperar de cuatro a seis semanas y si es liberación farmacológica, por lo menos seis meses (si la cirugía es necesaria con doble antiagregación, esperar tres meses, pero continuar la aspirina durante el perioperatorio).53 Se sugiere reiniciar antiagregantes una vez lograda la hemostasia, aproximadamente a las 24 horas.37,52
Anticoagulantes
Warfarina: su manejo perioperatorio depende del riesgo de sangrado y trombosis del paciente. En riesgo alto de sangrado, suspender cinco días antes del evento quirúrgico y de ser necesario se puede revertir 24 a 48 horas antes usando vitamina K y plasmas frescos congelados.37,52 Se puede reiniciar la misma tarde de la cirugía porque su efecto toma hasta varios días.37 La terapia de puenteo con heparinas debe ajustarse según el riesgo trombótico del paciente.54
Heparinas: suspender la no fraccionada intravenosa entre dos y seis horas antes de los procedimientos y la subcutánea, entre 12 y 24 horas antes. En pacientes que reciben heparina de bajo peso molecular, suspenderla 24 horas antes de la cirugía. En pacientes que están con puenteo se recomienda reiniciarlas cuando se logra la hemostasia (aproximadamente 48 horas después de procedimientos de alto riesgo) y suspender una vez que la warfarina se encuentre en niveles terapéuticos.37
Anticoagulantes de acción directa: la decisión de cuándo suspender el tratamiento depende de varios factores (de dos a tres días en promedio, pero hay que tomar en cuenta la tasa de filtración glomerular). Debido a que ejercen su acción relativamente rápido, se recomienda reiniciarlos 48 horas después de procedimientos quirúrgicos de alto riesgo.37
Terapia antimicrobiana para profilaxis de infección asociada con herida quirúrgica
Se sugiere una dosis única estándar de antibiótico para la profilaxis de infección de herida quirúrgica. El tiempo de administración se sugiere 60 minutos antes de la incisión quirúrgica, sin embargo, se debe tomar en cuenta la vida media de algunos fármacos y su forma de administración.55,56 Las cefalosporinas de primera y segunda generación son los antibióticos más utilizados, ya que tienen un amplio espectro (grampositivos, gramnegativos y anaerobios) y una buena cobertura a nivel de la piel. La cefazolina es el antibiótico más utilizado (en México una buena opción es la cefalotina).55 Alternativas a las cefalosporinas, especialmente en pacientes alérgicos, son la vancomicina, clindamicina y fluoroquinolonas (levofloxacino/ciprofloxacino). Para asegurar una adecuada concentración se sugiere repetir la dosis inicial si el procedimiento se extiende más de dos vidas medias del antibiótico, en pacientes con quemaduras extensas o con pérdida de sangre mayor a 1500 mL.55 El intervalo de dosis debe medirse desde la administración de la primera dosis y no desde el inicio del procedimiento. No se sugiere administrar nueva dosis en pacientes con enfermedad renal crónica. Para heridas limpias y limpias-contaminadas no se sugiere administrar otra dosis posterior al cierre de la herida quirúrgica, aun cuando se hayan instalados drenes.55,56 No se sugiere repetir otra dosis posterior al cierre de la herida quirúrgica, ya que no hay diferencia en el desenlace y, además, se relaciona con infección por Clostridium difficile. Si se requiere profilaxis posterior al tiempo quirúrgico, debe tener una duración menor a 24 horas.56
Conclusiones
La valoración preoperatoria no debe limitarse a la valoración del riesgo cardiovascular. Los estudios de gabinete y laboratorio deben ser dirigidos. La disminución de las complicaciones quirúrgicas es el resultado de un trabajo multidisciplinario hospitalario donde el médico internista desempeña un papel fundamental al emitir recomendaciones conforme a la medicina basada en evidencia. Hay gran necesidad de implementar protocolos hospitalarios estandarizados para valorar a la población. Esta revisión es un resumen de recomendaciones basadas en nuestra interpretación de la literatura y nuestra experiencia y en ningún momento debe sustituir al criterio clínico.











 nueva página del texto (beta)
nueva página del texto (beta)


