Introducción
El linfoma cutáneo primario de células T (LCPCT) es un linfoma en piel en el cual no hay evidencia de enfermedad sistémica (extracutánea) en el momento del diagnóstico.
Según la Revisión de la Clasificación de Neoplasias Linfoides de la Organización Mundial de la Salud de 2016, el linfoma de células T CD30+ primario ocupa el segundo lugar en frecuencia, con 25 a 30 %, después de la micosis fungoide.1 Esta clasificación incluye el espectro desde la papulosis linfomatoide hasta el linfoma anaplásico de células grandes primario (LACGP), pasando por los casos intermedios.
El LACGP es una entidad rara, su incidencia no se conoce con certeza, posiblemente debido a la dificultad de separar esta patología del espectro de linfomas cutáneos primarios CD30+. En una revisión de 2008 de la base de datos de los Institutos Nacionales de Cáncer de Estados Unidos, se identificaron 157 casos de linfoma primario cutáneo de células T CD30+ en un periodo de 30 años.2
El diagnóstico requiere un estudio histopatológico, para el cual se prefiere la biopsia excisional sobre la incisional. Histológicamente se observan células con abundante citoplasma pálidamente eosinófilo; el núcleo puede ser redondo o pleomorfo (usualmente en forma de herradura), con un nucléolo prominente. Una cuarta parte de los linfocitos puede ser atípica, pero no aparenta ser anaplásica.3 En la periferia de las lesiones o en las zonas ulceradas puede haber linfocitos reactivos, histiocitos, eosinófilos y neutrófilos.
Todos los pacientes con sospecha de LACGP deberán ser estadificados, para confirmar o descartar la enfermedad sistémica. Se recomienda el aspirado de médula ósea en pacientes con ausencia de enfermedad sistémica demostrable por imagen.4,5 El diagnóstico diferencial se deberá hacer con la papulosis linfomatoide, micosis fungoide transformada, linfoma sistémico, leucemia-linfoma de células T del adulto, linfoma de Hodgkin e hiperplasia linfoide reactiva.
El tratamiento de las lesiones pequeñas o no muy extensas es la radioterapia o escisión con márgenes libres;6 el tratamiento de elección en pacientes con enfermedad diseminada de gran extensión o con múltiples recaídas es la monoterapia con metotrexate hasta por tres años continuos.7 En pacientes en los que esté contraindicado este medicamento se puede optar por bexaroteno (grado de evidencia 2C) o interferón.8-11 En los enfermos que no responden con el tratamiento previo se puede administrar monoterapia con brentuximab/vedotin, gemcitabina, etopósido o doxorubicina liposomal.4,12-15 La quimioterapia combinada y el trasplante alogénico de células hematopoyéticas se debe reservar para casos diseminados que no responden al tratamiento indicado.6
El pronóstico depende de múltiples factores clínicos e histopatológicos. En estadios tempranos, la supervivencia a cinco años es hasta de 97.5 % para la enfermedad clasificada en T1, cuando se clasifica como T2, de hasta 93 % y para tumores estadio T3, de 77 %.16,17
El objetivo de esta comunicación es presentar nueve casos que se diagnosticaron en nuestro hospital como linfomas anaplásicos de células T grandes primarios cutáneos CD30+ durante un periodo de 24 años.
Método
En este estudio retrospectivo se revisó la base de datos del Departamento de Dermatopatología del Hospital General “Dr. Manuel Gea González” y se obtuvieron los datos de pacientes con diagnóstico de linfoma anaplásico de células T, durante el periodo de 1993 a 2016. Se realizó estadística descriptiva.
Se recopilaron los datos de sexo, edad (en años), características clínicas (topografía, morfología y tiempo de evolución), resultados de pruebas complementarias, tratamientos previos y actuales, reportes de los estudios histopatológicos y el resultado de los estudios de inmunohistoquímica.
De 29 309 expedientes se encontraron nueve pacientes con diagnóstico de linfoma anaplásico de células T CD30+, lo que representa 0.000034 %.
Se hizo la confirmación del diagnóstico histopatológico e inmunohistoquímico por dos dermatopatólogos certificados. Se realizaron tinciones con hematoxilina y eosina y un panel de inmunohistoquímica, en los que se incluyeron CD3 (células T), CD4 (células T y dendríticas), CD8 (células T), CD20 (células B), CD30 (células precursoras T inmaduras), EMA (antígeno de membrana epitelial, marcador de múltiples carcinomas), ALK-1 (cinasa del receptor parecido a activina 1, proteína proangiogénica), MUM1 (oncogén del mieloma múltiple 1, marcador para linfomas) y Ki-67 (proteína necesaria para la proliferación celular, por lo que refleja el índice de división de las células de una neoplasia).
Las tinciones de inmunohistoquímica se realizaron con la técnica convencional y de acuerdo con las instrucciones del fabricante.
A cinco de los pacientes se les realizaron exámenes generales (biometría hemática, química sanguínea, reactantes de fase aguda), los cuales resultaron normales; a tres pacientes se les realizaron estudios de imagen, sin identificar evidencia de enfermedad diseminada.
Resultados
Se registraron nueve pacientes, predominaron las mujeres, la edad promedio fue de 61.2 años, topografía y morfología variada y los estudios histológicos fueron compatibles con linfoma; todos con técnica de inmunohistoquímica CD30+. No se descartó ninguna muestra durante el proceso. La topografía principal fue en tronco y nalgas (cuatro pacientes), así como en miembros inferiores y superiores (cuatro pacientes), cara y cuello (tres pacientes); morfológicamente las lesiones se caracterizaron por lesiones papulares eritematosas, únicas o múltiples que evolucionaron a lesiones tumorales nodulares o placas eritemato-violáceas con escama fina en su superficie; el tiempo de evolución promedio fue de dos años y 20 semanas (distribución de cuatro semanas a 10 años). Como estudios y datos adicionales se realizó química sanguínea, biometría hemática y exploración física completa; solo en un paciente se evidenció adenomegalias. Al momento de este informe, tres pacientes se encontraban en vigilancia, con manejo expectante, en cuatro se había perdido el seguimiento debido a que no continuaron su manejo en la institución por decisión propia o por envío a un centro especializado en cáncer, un paciente estaba en tratamiento con fototerapia y uno más con metotrexate.
Histológicamente encontramos cortes de piel con paraqueratosis y fibrina, epidermis con acantosis irregular, así como abundante espongiosis y exocitosis de neutrófilos e hiperpigmentación focal de la capa basal, con característica proliferación linfoide atípica desde la dermis papilar a la dermis reticular profunda, con núcleos prominentes, grandes, hipercromáticos y pleomórficos, así como abundante citoplasma eosinófilo y algunas células de aspecto plasmocitoide. La proliferación rodeaba los vasos sanguíneos y en algunas zonas invadió sus paredes. En la Tabla 1 se resumen los diagnósticos histológicos e inmunohistoquímicos de los nueve casos. Las Figuras 1 a 5 son imágenes clínicas representativas de los casos 1, 2, 3, 4 y 7; en la Figura 6 se muestra un estudio histopatológico representativo. El índice de proliferación determinado por Ki-67 fue de 40 a 70 % en los casos en los que se realizó.
Tabla 1 Casos de linfoma anaplásico de células grandes primario diagnosticados en el Departamento de Dermatología del Hospital General “Dr. Manuel Gea González”, 1994 a 2017
| Caso | Diagnóstico histopatológico | Resultados de las tinciones inmunohistoquímicas |
|---|---|---|
| 1 | Infiltrado linfocitario atípico, probable linfoma anaplásico de células T | CD3+, CD30+ |
| 2 | Trastorno linfoproliferativo CD30+ | CD30+, EMA-, ALK1- |
| 3 | Linfoma anaplásico de células grandes (rico en neutrófilos y eosinófilos) CD30+ | CD30+, CD3+, EMA+, ALK1– |
| 4 | Trastorno linfoproliferativo CD30+ | CD20–, CD3+, CD30+, Ki-67 60 % |
| 5 | Trastorno linfoproliferativo CD30+ | Citoqueratinas AE1-3–, CD45+, CD3+, CD4+, CD 30+, ALK1–, Ki-67 70 % |
| 6 | Infiltración linfoidea atípica CD30+ | CD3+, CD30+, CD20–, CD4–, CD8– |
| 7 | Linfoma cutáneo de células T CD30+ | CD4+, CD30+ |
| 8 | Micosis fungoide asociada con alteración linfoproliferativa CD30+ | CD3+, CD4+, CD8+, CD30+, MUM1+ |
| 9 | Alteración linfoproliferativa positiva para CD30 sugerente de linfoma anaplásico de células T grandes | CD3+, CD30+, MUM1+, Ki67 40 % |
LACGP = linfoma anaplásico de células grandes CD30+primario.
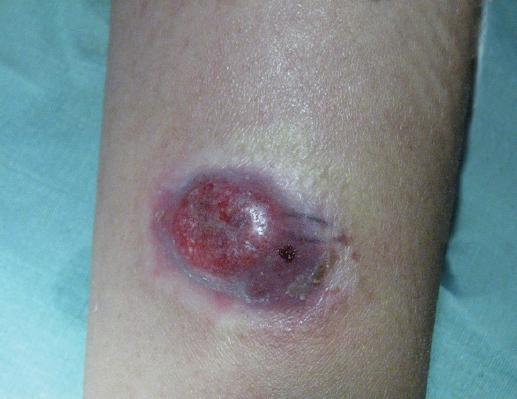
Figura 1 Caso 1. Neoformación de aspecto tumoral sobre placa eritemato-violácea infiltrada en el tercio distal del brazo izquierdo.

Figura 2 Caso 2. Múltiples lesiones de aspecto tumoral en cuello y tronco anterior, la mayor con costra sanguínea, escama e infiltrada a la palpación.
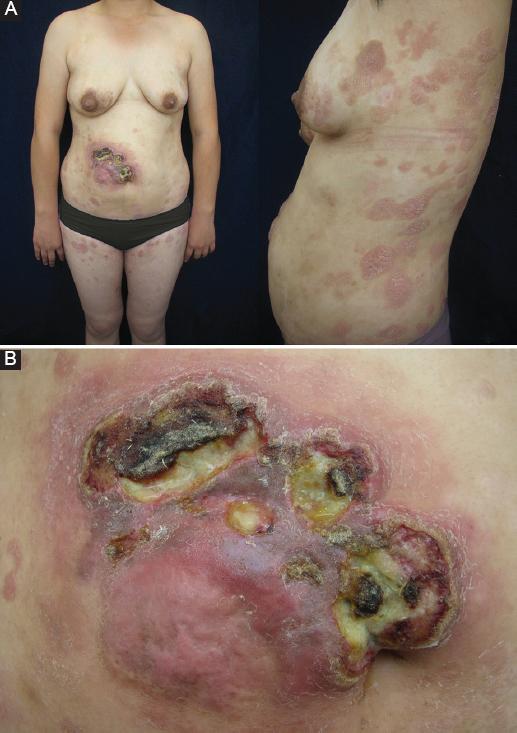
Figura 3 Caso 3. A) Múltiples placas eritemato-escamosas infiltradas en tronco anterior y lateral, así como en cara anterior de muslos, con una tumoración en el abdomen, en la que se identifica una lesión exofítica. B) Acercamiento de la tumoración exofítica, infiltrada y exulcerada con costras.
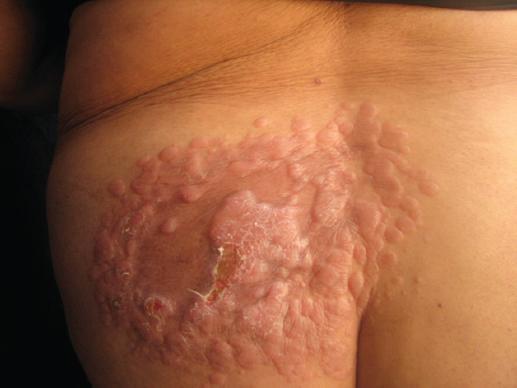
Figura 4 Caso 4. Dermatosis localizada a región lumbosacra constituida por una placa irregular, con múltiples lesiones, sobrelevada en la superficie, color de la piel, con áreas de atrofia y exulceración.

Figura 5 Caso 5. Lesión de aspecto papular, eritematosa con discreta escama en su superficie en la cara anterior del brazo.

Figura 6 A) Imagen histológica en la que se observa la epidermis con aplanamiento de los procesos interpapilares, la dermis está ocupada por un infiltrado en mantos de células pleomórficas, algunas con citoplasma claro, HE 10x. B) Corte histológico con técnica de inmunohistoquímica intensamente positiva para el anticuerpo CD30, 10×.
Discusión
El LACGP es una entidad poco frecuente, su incidencia no está reportada con certeza; en el Hospital General “Dr. Manuel Gea González” se diagnosticaron nueve casos en un periodo de 24 años, lo que representa 0.000034 % del total de 29 309 biopsias registradas; el número de casos fue muy bajo respecto a otros reportes, como la serie de Yu, en la que se reportan 157 casos en 31 años.2
La edad promedio fue de 61.2 años (distribución de 23 a 82 años), similar a 61 años reportada en la literatura.2 De nuestros nueve casos, seis fueron mujeres (66.6 %) y tres hombres, en contraste con lo reportado en el estudio de los Institutos Nacionales de Cáncer de Estados Unidos, en el cual tuvieron 157 casos, de los que 58 % fue del sexo masculino.2
La presentación clínica del LACGP clásicamente consiste en pápulas o nódulos solitarios, agrupados o multifocales, en el segmento superior del cuerpo (tronco y miembros torácicos), los cuales persisten de tres a cuatro semanas y tienden a ulcerarse con el tiempo. En nuestros casos, siete pacientes iniciaron con lesiones papulares eritematosas, que evolucionaron a placas eritemato-escamosas bien delimitadas, algunas con bordes infiltrados, ulceradas y de consistencia firme. Cinco pacientes tuvieron lesiones en tronco, cuatro lesiones en extremidades, dos presentaron lesiones en la cara y solo uno tuvo lesiones en el cuello (algunos pacientes tuvieron uno o más sitios afectados). En 20 a 42 % de las casos puede ocurrir resolución espontánea de las lesiones, las cuales no desaparecen del todo, y más de 50 % recurre.6,18-21 Debido a que los pacientes fueron enviados al Instituto Nacional de Cancerología para tratamiento especializado, se desconoce su evolución.
Histológicamente, la neoplasia se caracteriza por infiltrado dérmico denso y en ocasiones involucra la epidermis. El infiltrado comprende cúmulos cohesivos de linfocitos grandes, que morfológicamente semejan a los del linfoma anaplásico sistémico de células grandes.22 Los cortes histopatológicos mostraron un infiltrado linfocítico difuso, desde la dermis hasta el tejido celular subcutáneo, caracterizado por células medianas-grandes, con pleomorfismo moderado y abundante citoplasma eosinófilo, núcleos prominentes y mitosis atípicas, con algunas células de aspecto plasmocitoide. En uno de nuestros casos se observó infiltración a la vasculatura local.
Por definición, por lo menos 75 % del tumor debe expresar CD30;1,4,23,24 adicionalmente, la mayoría expresa CD4 y pueden tener pérdida variable de CD2, CD3 y CD5. Frecuentemente se evidencia antígeno cutáneo linfocitario y a diferencia del linfoma anaplásico de células grandes sistémico no expresa antígeno de membrana epitelial o ALK-1.1,4,25 Los nueve casos que reportamos fueron positivos para CD30, tres negativos para ALK-1, siete CD3 positivos, dos CD20 negativo, un caso positivo a antígeno de membrana epitelial y uno negativo; en tres se reportó elevado índice de proliferación con Ki-67.
Hay enfermedades que se han asociado con LACGP como la dermatitis atópica, hipersensibilidad a picadura de mosquitos, linfohistiocitosis hemofagocítica y síndrome paraneoplásico de secreción de hormona antidiurética, leucemia mielógena crónica, queratosis liquenoide crónica y carcinoma de células escamosas.26-35 El paciente 5 de nuestra serie padecía concomitantemente cáncer de próstata avanzado y el paciente 8, micosis fungoide antes del diagnóstico de LACGP.
También ha sido documentado el LACGP asociado con terapia con carbamazepina;36 en nuestros casos, ningún paciente tuvo antecedente de haber ingerido este medicamento. La asociación entre el incremento en la latitud y la prevalencia de linfoma de células T, incluyendo al LACGP, sugiere el efecto modulador de la radiación ultravioleta. En nuestro país, la exposición a este tipo de radiación es frecuente y pudiera ser una razón de la baja incidencia de estos casos en nuestra investigación.
El tratamiento indicado fue desde la conducta expectante, por la corta evolución, hasta el manejo en un centro oncológico; uno de los pacientes continuaba con metotrexate en dosis bajas y otro, tratamiento con fototerapia y terapia con baño de electrones debido a la concomitancia con micosis fungoide. Un pacientes solo recibió tratamiento paliativo dada la coexistencia del linfoma con cáncer de próstata en fase terminal.
La recaída después del tratamiento tiende a ser limitada a la piel, pero se ha reportado que 27 % recae con enfermedad extracutánea, la mitad en los nódulos linfáticos.17,37 La infiltración a órganos internos se puede dar desde dos a 10 años a partir del diagnóstico, según distintos análisis, y no siempre se asocia con estadio T avanzado.17 Cuatro pacientes continuaban con seguimiento en el servicio; no se ha observado progresión de la enfermedad o recaída en quienes se logró remisión.
Conclusión
Reportamos nueve casos de linfoma anaplásico de células grandes primario cutáneo CD30+, estudiados en un periodo de 24 años; predominaron las mujeres, la morfología y topografía fueron diversas, principalmente en el tronco y extremidades. El linfoma se manifestó principalmente con lesiones únicas papulares que evolucionaron a placas o lesiones tumorales eritemato-violáceas. Algunos linfomas se asociaron con enfermedad sistémica, a otras neoplasias como micosis fungoide y cáncer de próstata, y tuvieron respuesta variable al tratamiento. La importancia de conocer la incidencia y presencia de esta enfermedad radica en que el pronóstico depende del estadio clínico y en etapas tempranas es muy favorable.











 nueva página del texto (beta)
nueva página del texto (beta)


