Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Gaceta médica de México
versão On-line ISSN 2696-1288versão impressa ISSN 0016-3813
Gac. Méd. Méx vol.142 no.5 Ciudad de México Set./Out. 2006
Biología molecular y medicina
Defensinas humanas: ¿profilaxis y terapia contra el VIH?
Human defensin: prophilaxis and therapy against HIV?
Ernesto Prado–Montes de Ocaa,b,*
a Programa de Doctorado en Genética Humana, Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara, Jal., México.
b División de Genética, Centro de Investigación Biomédica de Occidente (CIBO), Instituto Mexicano del Seguro Social, Guadalajara, Jal., México
Coordinador. Fabio Salamanca–Gómez
Recibido en su versión modificada: 17 de abril de 2006
Aceptado: 12 de mayo de 2006
*Correspondencia y solicitud de sobretiros:
Dr. Ernesto Prado Montes de Oca.
División de Genética, Centro de Investigación Biomédica de Occidente (CIBO)
Instituto Mexicano del Seguro Social (IMSS)
Sierra Mojada 800, Col. Independencia SL, 44340 Guadalajara, Jal, México
Tel.: (+52) (33) 3668–3000, ext. 31929; fax: (+52) (33) 3618–1756.
Correo electrónico: ernestoprado@hotmail.com
Resumen
Las defensinas humanas son péptidos antimicrobianos de síntesis endógena, con potencial profiláctico y terapéutico anti VIH. La aplicación de las defensinas como agentes tópicos en mucosas expuestas podría bloquear la entrada del VIH, debido a la capacidad de estos péptidos de unirse a la envoltura viral. Además, la capacidad de las defensinas para inhibir la replicación del virus, activar el sistema del complemento y quimiotaxis hacia células dendríticas y células T de memoria, permitirá diseñar mejores drogas antiretrovirales, siendo necesario evaluar la eficacia de las defensinas en la práctica clínica.
Palabras clave: VIH, defensinas humanas, péptidos antimicrobianos, terapia, profilaxis
Summary
Human defensins are endogenous antimicrobial peptides with prophylactic and therapeutic potential against HIV. The ability of defensins to bind the HIV envelope could be exploited to design topic agents that block viral entry into exposed mucosa. Additionally, their capacity to inhibit viral replication, complement system activation, dendritic and memory T cells chemoattraction, together with peptide engineering could bring about new and better antiretroviral drugs. Clinical trials could be demonstrated the efficacy of defensins against HIV in clinical practice.
Key words: HIV, human defensins, antimicrobial peptides, therapy, prophylaxis
Introducción
La prolongada pandemia del Síndrome de Inmunodeficiencia Adquirida Humana (SIDA), ha obligado al desarrollo de métodos profilácticos para evitar la entrada y replicación del virus, así como a la búsqueda de una cura para esta letal enfermedad. Dentro de los compuestos candidatos para profilaxis y/o terapia se encuentran drogas que bloquean proteasas y la transcriptasa reversa del VIH,1 polímeros aniónicos que bloquean la unión del virus a las células diana, surfactantes o detergentes que inactivan las partículas virales, agentes ácidos que mantienen unpH protector en mucosas, entre otros.2
Adicionalmente, agentes potenciales se sintetizan como péptidos naturales dentro de nuestro organismo: los antimicrobianos. Dentro de éstos los de más ubicua expresión en humanos son las defensinas. Las defensinas son péptidos altamente conservados en la escala evolutiva formando parte de la respuesta inmune innata, tienen un tamaño de 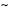 2–5 kilodaltons (típicamente de 30–45 aminoácidos) y presentan tres puentes disulfuro. En el humano se sintetizan principalmente en epitelios y leucocitos. Sus propiedades antimicrobianas son de amplio espectro (antibacterianas, antifúngicas, antivirales) variando en efectividad microbicida según su estructura y carga catiónica neta. De acuerdo con su patrón molecular de puentes disulfuro y distribución genómica se clasifican en las familias alfa (α), beta (β) y teta (θ).3 Todas las familias de defensinas presentan actividad anti VIH.4,5
2–5 kilodaltons (típicamente de 30–45 aminoácidos) y presentan tres puentes disulfuro. En el humano se sintetizan principalmente en epitelios y leucocitos. Sus propiedades antimicrobianas son de amplio espectro (antibacterianas, antifúngicas, antivirales) variando en efectividad microbicida según su estructura y carga catiónica neta. De acuerdo con su patrón molecular de puentes disulfuro y distribución genómica se clasifican en las familias alfa (α), beta (β) y teta (θ).3 Todas las familias de defensinas presentan actividad anti VIH.4,5
Las α–defensinas 1–4 tienen actividad anti–VIH y se ha demostrado que aunque no contribuyen al factor antiviral de linfocitos CD8+ (CAF) inicialmente reportado,6 tienen la propiedad de unirse al péptido C1q y activar de esta forma la vía clásica del sistema del complemento.7 Adicionalmente tienen un efecto quimiotáctico para linfocitos T, monocitos y células dendríticas maduras, además de inducir la síntesis de citocinas. La expresión de estas defensinas no se altera con el estado de seropositividad.8
Particularmente, la α–defensina 1 (human neutrophil peptide 1, HNP1) presenta una doble función anti VIH:
i) inhibe la actividad de proteína cinasa C (PKC) interfiriendo con la importación nuclear y transcripción en linfocitos T CD4+y macrófagos; e
ii) inactiva directamente al virus probablemente al unirse con glucanos presentes en CD4 y gp120 de la envoltura vírica.8
Respecto a su repercusión epidemiológica, en mujeres constantemente expuestas al VIH pero seronegativas, se ha encontrado una elevada expresión constitutiva de a–defensinas en sus linfocitos T CD8+ periféricos y de mucosa diez veces mayor comparada con controles y se ha propuesto que esto explica, al menos parcialmente, la no infección en individuos altamente expuestos pero no infectados.9 Asimismo, los niveles elevados de a–defensinas en leche materna están asociados con un menor riesgo de transmisión perinatal y posnatal en infantes de madres seropositivas.10
Se hipotetiza que las β–defensinas bloquean eventos tardíos de la repiicación del virus, con base en las siguientes evidencias:
i) la quimiotaxis de células dendríticas inmaduras y células T de memoria resulta de la unión directa y activación del receptor de quimiocinas CCR6 por estas defensinas, desplazando competitivamente a su ligando, la proteína inflamatoria de macrófago 3 alfa (MIP–3α); y
ii) las β–defensinas inducen además señales intracelulares al interactuar con receptores de quimiocinas y receptores similares a Toll(TLRs),11 cuyas vías promueven respuestas inmunes adaptativas reclutando células dendríticas y T al sitio de invasión.5
En particular, la expresión diferencial entre individuos del gen de la β–defensina humana 1 (péptido hBD1, gen DEFB1) podría ser explicada por el polimorfismo de un sólo nucleótido (SNP) DEFB1C > G 668 que crea un sitio putativo de unión para el factor de nuclear kappa–B (NF–κB),12 un factor de transcripción responsable de la expresión de citocinas inflamatorias y otras defensinas.13 La sobreexpresión producida por esta variante podría explicar la asociación de este SNP con protección contra la infección perinatal por VIH en niños italianos14 y brasileños,15 aun cuando la hBD1 es la que presenta menor actividad anti VIH dentro de esta familia.5
La hBD2 presenta potencia similar a la hBD1 e inhibe como máximo de 30–40% la infectividad, siendo la primera más activa contra las cepas X4. La inhibición del VIH por hBD2 ocurre entre los eventos de entrada–fusión y la transcripción reversa.5 En personas no infectadas, la hBD2 se expresa en mayor cantidad que las α–defensinas 1–3 en mucosa oral,5 que sumado a la presencia en saliva de hBD3,16 IgA, lisozima, trombospondina e inhibidor de proteasas de leucocitos secretorios (SLPI), así como a un menor número de células CD4+,17 se postulan como factores responsables de la baja frecuencia de transmisión del virus en esta mucosa comparado con la vaginal y rectal.5,17 Contrariamente, en pacientes infectados con VIH disminuye significativamente la expresión de hBD2 en mucosa oral, favoreciendo una mayor susceptibilidad al VIH, así como a infecciones oportunistas y a otras complicaciones orales.5 Además, las β–defensinas que son inducibles en otros tejidos, se expresan constitutivamente en epitelio oral, lo que no sucede con otras sustancias activas de esta mucosa.17 Recientemente, se descubrió que la hBD3 compite con el ligando natural de CXCR4, el factor 1 derivado de estroma (SDF–1), inhibiendo el flujo de calcio, la fosforilación de ERK–1/2 y la quimiotaxis.18
Las θ–defensinas presentan estructura cíclica producto de la fusión postraduccional de los extremos amino de una α–defensina con el extremo carboxilo de otra. La primera teta defensina se aisló del macaco Rhesus (Macaca mulatta) y se denominó Defensina Teta Rhesus 1 (RTD–1).19 Una mutación en la secuencia señal del pseudogen humano análogo de la RTD–1 produce un codón de paro prematuro que evita la formación del péptido maduro.20 Eliminando este codón de paro, se ha sintetizado la retrociciina,20 una lectina que se une a gp120 y CD4 como lo hacen las α–defensinas, pero adicionalmente también se une a galactosilceramida, todas ellas moléculas implicadas en la entrada del virus.21 La retrociciina actúa tardíamente en la cascada de fusión de Env del VIH–1 antes de la formación del haz de seis hélices uniéndose con gran afinidad al ectodominio de gp41 en la repetición de héptadas en C terminal en una manera dependiente de glucanos. Es por esto que el mecanismo inhibitorio de la retrociciina es comparable con el de los inhibidores peptídicos de entrada basados en las porciones de la secuencia gp41,22 La retrociciina es un péptido altamente inhibitorio de la repiicación del VIH tanto de cepas que infectan linfocitos T (tropismo T) como aquellas que infectan macrófagos (tropismo M), éstas últimas son las cepas más comunes de VIH de transmisión sexual, siendo por esto más promisorio su uso tópico que el de la RTD–1. Se ha postulado que la ausencia de la síntesis natural de este péptido en humanos podría ser responsable de la susceptibilidad misma a la infección por el virus.20
Las alteraciones en las defensinas endógenas parecen ser factores determinantes en la progresión a SIDA,9cuyas causas pueden ser una menor expresión o alteración de la funcionalidad in vivo del(los) péptido(s) originadas no sólo por SNPs14 sino además por polimorfismos en el número de copias de los genes de defensinas.23
En conclusión, el nivel de α–defensinas podría ser un marcador de no progresión, útil en población altamente expuesta, revelando que a pesar de la infección por VIH, los linfocitos CD8+ permanecen funcionales para generar estos PAs y actuar sobre las partículas virales, las células del hospedero o ambas. También podría ser útil para determinar el inicio oportuno de una terapia antiviral.24 Respecto a las β–defensinas, la genotipificación de SNPs en el gen DEFB1 podría servir como marcador de riesgo de la infección por VIH.14,15 Asimismo, el amplio espectro antirretroviral contra cepas que utilizan tanto los receptores CXCR4 como CCR5 como vía de entrada, hace idónea a esta familia para ser utilizada como modelo para desarrollar agentes tópicos para mucosas.5 Por último, las ventajas que hipotéticamente tendría utilizar la θ–defensina retrociciina como agente antirretroviral en comparación con inhibidores utilizados actualmente como el T–20 (enfuvirtida, DP–178 o pentafusida) son:
i) una mayor biodisponibilidad al no ser susceptible a peptidasas hepáticas y renales por su característica cíclica;
ii) bajos costos de producción, porque sería más barata sintetizarla u obtenerla por tecnologías recombinantes al presentar sólo 18 residuos en vez de 36;25 y
iii) gran potencia antibacteriana, lo que sería útil para evitar infecciones oportunistas, lo cual no se ha demostrado para el T–20.25
Estos hallazgos ubican a las defensinas naturales y aquellas mejoradas por ingeniería de péptidos26 como potenciales agentes profilácticos y como una alternativa terapéutica de primordial importancia para detener o al menos retardar la replicación del VIH en pacientes seropositivos. El reto ahora es demostrar si las defensinas son tan efectivas en la práctica clínica como lo son in vitro.
Agradecimientos
EPM es becario del Consejo Nacional de Ciencia y Tecnología, México (CONACyT, 176803) y del Instituto Mexicano del Seguro Social (IMSS, 99145989). El autor agradece a LE Figueray JE García por los comentarios al manuscrito.
Referencias
1. Agrawal L, Lu X, Jin Q, Alkhatib G. Anti–HIV therapy: Current and future directions. Curr Pharm Des 2006; 12:2031–2055. [ Links ]
2. Madan RP, Keller MJ, Herold BC. Prioritizing prevention of HIV and sexually transmitted infections: first–generation vaginal microbicides. CurrOpin Infect Dis. 2006; 19:49–54. [ Links ]
3. Selsted ME, Ouellette AJ. Mammalian defensins in the antimicrobial immune response. Nat Immunol 2005; 6:551–557. [ Links ]
4. Wang W, Owen SM, Rudolph DL, Cole AM, Hong T, Waring AJ, et al. Activity of alpha and theta defensins against primary isolates of HIV. J Immunol 2004; 173:51 5–520. [ Links ]
5. Sun L, Finnegan CM, Kish–Catalone T, Blumenthal R, Garzino–Demo P, La Terra Maggiore GM, et al. Human p–defensins suppress Human Immunodeficiency Virus Infection: potential role in mucosal protection. J Virol 2005; 79:14318–14329. [ Links ]
6. Chang TL, Francois F, Mosoian A, Klotman ME. CAF–mediated Human Immunodeficiency Virus (HIV) type 1 transcriptional inhibition is distinct from a–defensin–1 HIV inhibition. J Virol 2003; 77:6777–6784. [ Links ]
7. Prohaszka Z, Nemet K, Csermely P, Hudecz F, Mezo G, Fust G. Defensins purified from human granulocytes bind C1q and activate the classical complement pathway like the transmembrane glycoprotein gp41 of HIV–1. Mol Immunol 1997; 34:809–816. [ Links ]
8. Chang TL, Vargas J Jr, Del Portillo A, Klotman ME. Dual role of alpha–defensin–1 in anti–HIV–1 innate immunity. J Clin Invest 2005; 115:765–773. [ Links ]
9. Trabattoni D, Caputo SL, Maffeis G, Vichi F, Biasin M, Pierotti P, et al. Human alpha defensin in HIV–exposed but uninfected individuals. J Acquir Immune Defic Syndr. 2004;35:455–463. [ Links ]
10. Kuhn L, Trabattoni D, Kankasa C, Semrau K, Kasonde P, Lissoni F, et al. Alpha–defensins in the prevention of HIV transmission among breastfed infants. J Acquir Immune Defic Syndr 2005; 39:138–142. [ Links ]
11. Yang D, Chertov O, Bykovskaia SN, Chen Q, Buffo MJ, Shogan J, et al. Beta–defensins: linking innateand adaptive immunity through dendritic and Tcell CCR6. Science 1999;286:525–528. [ Links ]
12. Jurevic RJ, Bai M, Chadwick RB, White TC, Dale BA. Single–nucleotide polymorphisms (SNPs) in human beta–defensin 1: high–throughput SNP assays and association with Candida carriage in type 1 diabetics and nondiabetics controls. J Clin Microbiol 2003;41:90–96. [ Links ]
13. Jang BC, Lim KJ, Paik JH, Kwon YK, Shin SW, Kim SC, et al. Up–regulation of human beta–defensin 2 by interleukin–1 beta in A549 cells: involvement of PI3K, p38 MAPK, JNK,and NF–kappaB. Biochem Biophys Res Commun 2004; 320:1026–1033. [ Links ]
14. Braida L, Boniotto M, Pontillo A, Tovo PA, Amoroso A, Crovella S. A single–nucleotide polymorphism in the human beta–defensin 1 gene is associated with HIV–1 infection in Italian children. AIDS 2004;18:1598–1600. [ Links ]
15. Milanese M, Segat L, Pontillo A, Arraes LC, de Lima Filho JL, Crovella S. DEFB1 gene polymorphisms and increased risk of HIV–1 infection in Brazilian children. AIDS 2006;20:1673–1675. [ Links ]
16. Weinberg A, Quinones–Mateu ME, Lederman MM. Role of human beta–defensins in HIV infection. Adv Dent Res 2006;19:42–48. [ Links ]
17. Campo J, Perea MA, del Romero J, Cano J, Hernando V, Bascones A. Oral transmission of HIV, reality or fiction? An update. Oral Dis 2006;12:219–228. [ Links ]
18. Feng Z, Dubyak GR, Lederman MM, Weinberg A. Cutting edge: human beta defensin 3– a novel antagonist of the HIV–1 coreceptor CXCR4. J Immunol, 2006; 177:782–786. [ Links ]
19. Tang YQ, Yuan J, Osapay G, Osapay K, Tran D, Miller CJ, et al. A cyclic antimicrobial peptide produced in primate leucocytes by the ligation of two truncated alpha–defensins. Science 1999; 286:498–502. [ Links ]
20. Cole AM, Hong T, Boo LM, Nguyen T, Zhao C, Bristol G, et al. Retrocyclin: aprímate peptidethat protects cells from infection byT–and M–tropic strains of HIV–1. Proc Natl Acad Sci USA 2002; 99:1813–1818. [ Links ]
21. Wang W, Cole AM, HongT, Waring AJ, Lehrer Rl. Retrocyclin, an antiretroviral theta–defensin, is a lectin. J Immunol 2003; 170:4708–4716. [ Links ]
22. Gallo SA, Wang W, Rawat SS, Jung G, Waring AJ, Cole AM, et al. Theta–defensins prevent HIV–1 Env–mediated fusion by binding gp41 and blocking 6–helix bundle formation. J Biol Chem 2006;281:18787–18792. [ Links ]
23. Linzmeier RM, Ganz T. Human defensin gene copy number polymorphisms: comprehensive analysis of independent variation in alpha– and beta–defensin regions at 8p22–p23. Genomics 2005;86:423–430. [ Links ]
24. Ganz T. Versatile defensins. Science 2002;298:977–979. [ Links ]
25. Espona M, Ferrández O, Grau S, Carmona A. Enfuvirtida: primer fármaco de una nueva familia de antirretrovirales. Farm Hosp 2005;29:375–383. [ Links ]
26. Yu Q, Lehrer R, Tarn JP. Engineered salt–insensitive alpha–defensins with end to end circularized structures. J Biol Chem, 1999;275:3943–3949. [ Links ]














