Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Gaceta médica de México
versão On-line ISSN 2696-1288versão impressa ISSN 0016-3813
Gac. Méd. Méx vol.142 no.5 Ciudad de México Set./Out. 2006
Erecicio clínico patológico
Disfonía súbita, fiebre y tos productiva en una mujer de 65 años
Sixty–five year old woman with sudden dysphonia, fever and productive cough
Néstor G.Cruz–Ruiz,a* Luis Sánchez–Hurtado,a Guillermo Flores–Padilla,aHaikoNellen–Hummel,a Rocío Arriolaby Ma. De Jesús Fernández–Muñozc
Coordinador: Manuel de la Llata–Romero
Colaboradores: Juan Urrusti–Sanz, Jesús Aguirre–García, Roberto Sánchez–Ramírez
a Departamento de Medicina Interna, Hospital de Especialidades, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social México D. F., México
b Departamento de Patología, Hospital de Especialidades, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social México D. F., México
c Departamento de Cardiología, Hospital de Especialidades, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social México D. F., México
* Correspondencia y solicitud de sobretiros:
Dr. Néstor G. Cruz–Ruiz
Departamento de Medicina Interna, Hospital de Especialidades, CMN SXXI, IMSS.
Av. Cuauhtemoc No. 330, Col. Doctores, Del. Cuauhtemoc, 06725 México D. F., México
Tel.: 5627–6900 ext. 21544. Fax: 5578–9521.
Correo electrónico: lash@correo.unam.mx
Presentación del caso
Mujer de 65 años de edad sin antecedentes patológicos de importancia. Inició su padecimiento de forma súbita con disfonía, sin otro dato agregado. Realizadas laringoscopia directa y tomograf ía axial computada de cuello, se diagnosticó parálisis vocal izquierda. Durante las sesiones de terapéutica foniátrica presentó fiebre y tos productiva, por lo que fue hospitalizada.
Al momento de su internamiento se encontraba con disfonía acompañada de disfagia a líquidos y síndrome de condensación basal izquierda; el resto de la exploración fue negativa.
El estudio radiológico reveló infiltrado basal izquierdo y signos sugestivos de derrame pericárdico que fue estimado en 350 ml (Figuras 1 y 2) por el ecocardiograma transtorácico, mostrando así mismo compresión de la aurícula derecha. El electrocardiograma reveló discreta disminución del voltaje eléctrico.


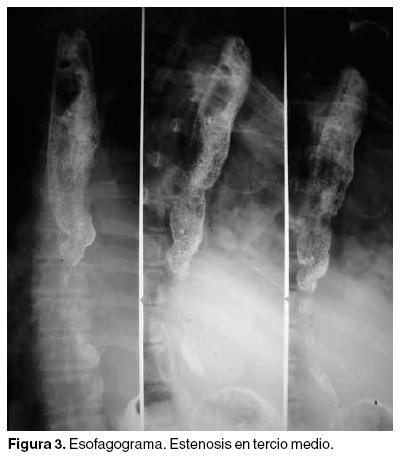
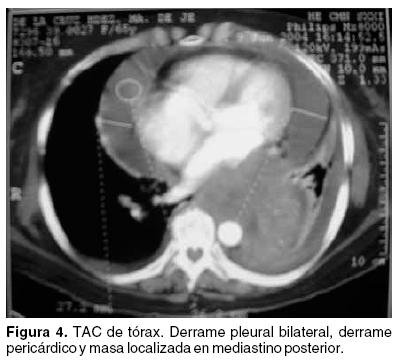
La tomografía de tórax evidenció derrame pleural bilateral de predominio izquierdo, derrame pericárdico y tumoración en mediastino posterior paraespinal izquierdo que rodeaba a la arteria aorta, comprimía al esófago en su tercio distal y ocasionaba atelectasia secundaria del lóbulo pulmonar inferior izquierdo (Figuras 3 y 4).
La función respiratoria de la paciente se fue deteriorando, se le practicó citología hemática y química sanguínea (Cuadros I y II) y se recurrió al apoyo ventilatorio mecánico y a la broncoscopia, practicándose aspiración de líquidos pleural y pericárdico, así como lavado y cepillado del bronquio izquierdo cuya luz estaba disminuida en 90% por la compresión a que estaba sometido (Cuadros III y IV).




Se practicó, así mismo punción de la masa mediastinal para su estudio citológico.
La paciente presentó choque séptico, falla orgánica múltiple y paro cardiocirculatorio.
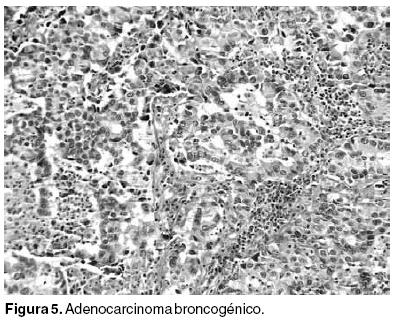
Los estudios citológicos resultaron positivos para adenocarcinoma (Figura 5).
Discusión clínica
La paciente ingresa por parálisis de la cuerda vocal izquierda de causa indeterminada y disfagia a líquidos, agregándose cuadro neumónico.
La parálisis de cuerdas vocales constituye un signo de enfermedad cuya causa puede radicar desde la corteza cerebral, hasta la musculatura intrínseca de la laringe. Puede ser uni o bilateral, congénita o adquirida; en ésta última existen múltiples etiologías. La parálisis unilateral es más frecuente (52%) que la bilateral (48%). Su origen es congénito en 10% de los casos.1
La parálisis adquirida es causada por lesión del nervio periférico vago en 90% de los casos,2 particularmente el nervio laríngeo recurrente (78%), por ser más largo su recorrido; en cambio, el nervio laríngeo derecho sólo es afectado en 16% de los casos y ambos lo son en 6%.
Las causas adquiridas se dividen en enfermedades malignas y benignas. Las malignas corresponden a casi el tercio de ellas (33%): cáncer de pulmón 50%, de esófago 20%, y de tiroides 10%.
El traumatismo quirúrgico, particularmente por cirugía de tiroides,1,2 seguido por cirugía de columna cervical anterior3 y de la carótida,4 son también causantes de parálisis local.
Algunas obedecen a traumatismos no quirúrgicos, como los causados por intubación endotraqueal,5 accidentes automovilísticos, fractura de cráneo, heridas penetrantes del cuello, insuficiencia cardiaca congestiva, aneurisma aórtico, o dilatación de la arteria pulmonar.
Las hay también de origen inflamatorio,1 por tuberculosis, tromboflebitis yugular, tiroiditis subaguda, y meningitis, entre otras.
Finalmente, las consideradas misceláneas: anemia hemolítica, trombosis de la vena subclavia, sífilis, colagenopatías, miastenia gravis, ingestión de plomo o arsénico.
Cuando no se determina su etiología transcurridos más de 18 meses se cataloga como idiopático.
La parálisis de la cuerda vocal izquierda fue el motivo de que se iniciara el protocolo para cáncer broncogénico.
El carcinoma broncogénico, la neoplasia más frecuente y de más elevada mortalidad, se manifiesta en ocasiones por parálisis vocal. Uno de cada tres casos de parálisis de cuerdas vocales es causado por dicha neoplasia.6 Cuando el carcinoma pulmonar se manifiesta por parálisis vocal se clasifica como T4 (estadio III B).7,8 La parálisis de las cuerdas vocales puede deberse a infiltración directa del nervio laríngeo recurrente, a invasión metastásica, a compresión intratorácica por el propio tumor o bien a adenopatía vecina.9
El cáncer pulmonar afecta al año a 94 mil hombres y 78 mil mujeres, con una incidencia máxima entre los 55 y 65 años, y es el causante de 31% de las muertes por tumores malignos en hombres y de 25% en las mujeres; la supervivencia está en relación con el grado de afectación: si es local 50% y si es regional 20% a los 5 años. La Organización Mundial de la Salud (OMS) lo clasifica en cuatro tipos celulares, responsables de 88% de estas neoplasias: carcinoma de células escamosas (epidermoide), carcinoma microcítico (células en "avena"), adenocarcinoma (incluyendo bronquioalveolar) y carcinoma de células grandes (anaplásico de células grandes); el resto son de tipo indiferenciado. Para toma de decisiones terapéuticas se clasifican en microcíticos y no microcíticos (epidermoide, adenocarcinoma, de células grandes, broncoalveolary mixtos). Existe asociación importante con el tabaquismo, porque el riesgo relativo de padecer cáncer de pulmón en personas con hábito tabáquico es 13 veces mayor en comparación con personas no fumadoras y 1.5 veces más frecuente en personas con tabaquismo pasivo. En relación con el sexo se aprecia mayor riesgo en el femenino, 1.5 veces mayor que en el masculino; también hay fuerte asociación con la herencia, porque los familiares de primer grado de pacientes con cáncer pulmonar tienen 2 a 3 veces mayor riesgo de presentar dicha neoplasia.
El cáncer de pulmón ha mostrado cierto número de lesiones genéticas que comprenden la activación de oncogenes dominantes y la inactivación de genes supresores u oncogenes recesivos.
Un papel peculiar tiene el cáncer microcítico, en el cual se aprecian mutaciones del gen p53 y del rb en 90% de los casos.
En la evolución de nuestro paciente se agregó cuadro neumónico postobstructivo (fiebre y tos productiva, síndrome de condensación pulmonar basal izquierda) por compresión extrínseca de masa tumoral, con afección de 90% de la luz del bronquio izquierdo.
Las manifestaciones clínicas del carcinoma broncogénico se pueden clasificar en: a) lesión primaria, b) extensión de masa intratorácica, c) metástasis a distancia; o d) síndromes paraneoplásicos.
Los signos y síntomas relacionados con la lesión primaria son diversos: tos (8 a 75%), pérdida de peso (0 a 68%), disnea (3 a 60%), dolor torácico ( 20 a 49%), hemoptisis (6 a 35%), dolor óseo (6 a 25%), fiebre (0 a 20%), síndrome de vena cava superior (0 a 4%), disfagia (0 a 2%) y estridor/ dificultad respiratoria (0 a 2%).10,11
Por extensión intratorácica los signos y síntomas están condicionados por diseminación directa del tumor o por propagación linfática y las manifestaciones obedecen a las estructuras involucradas: nervios (parálisis del nervio laríngeo recurrente, parálisis periférica, plexo braquial, nervios simpáticos) estructuras vasculares (síndrome de vena cava superior, pericardio y corazón) pared del tórax, pleura y estructuras viscerales (esófago).12
Aproximadamente una tercera parte de los pacientes presentan síntomas relacionados con las metástasis, siendo las más comunes al tejido óseo (25%), hígado, glándulas suprarrenales, ganglios linfáticos intraabdominales, piel y cerebro (10%).13
La radiografía de tórax juega un papel básico en la evaluación de pacientes con carcinoma pulmonar, pudiendo arrojar datos compatibles con el subtipo histológico; el adenocarcinoma es más frecuente observarlo en la periferia, el carcinoma de células escamosas casi siempre por arriba del bronquio central y comúnmente extendiéndose por el hilum y el mediastino.14 El carcinoma de células grandes es más común en la periferia y el de células pequeñas se desarrolla en la parte proximal de las vías respiratorias, involucrando hilum y mediastino.15,16
Hay gran interés por definir un método de estudio para la detección temprana del cáncer de pulmón y facilitar el posible manejo curativo o de control. Los estudios de escrutinio deben contar con dos criterios principales: 1) no causar daño o dolor y sus resultados no deben arrojar falsos negativos, ya que generarían ansiedad y necesidad de efectuar estudios invasivos, 2) prolongar la expectativa de vida. Se han propuesto, como pruebas de escrutinio, tres principales métodos: radiografía de tórax, citología de esputo y tomografía de tórax. Ninguno de los dos primeros estudios condiciona daño o dolor, sin embargo no existe evidencia de que prolonguen la expectativa de vida.17 En cuanto a la Tomografía Axial Computarizada (TAC) de tórax, reúne el primer criterio, no presenta dolor o lesión, sin embargo el segundo criterio, aún en controversia, podría asociarse con la reducción de la mortalidad de carcinoma pulmonar.1820 Entre otros estudios se propone la broncoscopia por fluorescencia, sin embargo es de alto costo, produce fotosensibilidad de la piel, requiere de preparación y no reúne los criterios establecidos. Otro estudio propuesto es latomografía por emisión de positrones (PET), pero aún no se cuenta con suficientes estudios al respecto.21
Sin embargo, hasta el momento no existe indicación para efectuar ningún tipo de prueba de escrutinio.22,23–27
En conclusión debemos considerar la posibilidad de carcinoma broncogénico como etiología de la parálisis vocal unilateral sobre todo cuando la afección es del lado izquierdo. Aun cuando esta presentación clínica no es frecuente, se debe descartar la posibilidad efectuando un interrogatorio completo y una exploración cuidadosa, solicitando como auxiliar diagnóstico de primera instancia una radiografía de tórax y, de considerar necesario, estudios más específicos (TAC de tórax, broncoscopia con toma de muestra, biopsia por aspiración, etc.).
Referencias
1. Harón EM,Sebastián Q.RubioM. Vocal Cord Pralalysisand Staging Bronchogenic Carcinoma. Arch Bronconeumol 2004;40:333–336. [ Links ]
2. Mountain CF. Staging classification of lung cancer. A critical evaluation. Clin Chest Med 2002; 23:103–121. [ Links ]
3. Loughran S, Alves C, McGregor FB. Current etiology of unilateral vocal cord paralysis in a teaching hospital in the West of Scotland. J Laryngol Otol 2002; 116:907–910. [ Links ]
4. Bobrov VM. Unilateral laryngeal paralysis as an early symptom of recurrent nerve compression caused by tumor or trauma. Vestn Otorinolaringol 1995; 1:47–49. [ Links ]
5. Miglets AW, Adam JS. Vocal cord paralysis. Association with superior mediastinal widening secondary to tortuosity of the great vessels. Arch Otolaryngol 1982; 108:112–113. [ Links ]
6. Kirchner JA. Intrathoracic injury to the motor nerve supply of the larynx. Acta Otolaryngol 1977; 83:163–169 [ Links ]
7. Daya H, Hosni A, Bejar–Solar I, Evans JN, Bailey CM. Vocal fold paralysis: a long–term retrospective study. Arch Otolaryingol Head Neck Surg 2000; 126: 21–25. [ Links ]
8. Fitzpatrick PC, Miller RH. Vocal cord paralysis. Department of Otolaryngology HNS, Tulane Medical Center, New Orleans, La, USA.1998; 150:340–343. [ Links ]
9. Kriskovich MD, Apfelbaum Rl, Haller JR. Vocal Fold paralysis after anterior cervical spine surgery: incidence, mechanism, and prevention of injury. Laryngoscope 2000; 110:1467–1473. [ Links ]
10. Remade M, Lawson G, Delos M, Jamart J. Correcting vocal fold immobility by autologous collagen injection for voice reabilitation. Ann Otol Rhinol Laryngol 1999; 108:788–793. [ Links ]
11. Kobanawa S, Atsuchi M, Tanaka J, Shigeno T. Jugular bulb diverticulum associated with lower cranial nerve palsy and multiple aneurysms. Department of Neurosurgery, Kantou Rosai Hospital, Kawasaki, Japan. Surg Neurol 2000; 53:559–562. [ Links ]
12. Patz EF Jr. Imaging bronchogenic carcinoma. Chest 2000; 117:90S–95S [ Links ]
13. Sider L. Radiographic manifestations of primary bronchogeniccarcinoma. Radiol Clin North Am 1990; 28:583–597. [ Links ]
14.Theros EG. 1976 Caldwell Lecture: varying manifestation of peripheral pulmonary neoplasms: a radiologic–pathologic correlative study. AJR Am J Roentgenol 1977; 128:893–914. [ Links ]
15. Andersen HA, Prakash UBS. Diagnosis of symptomatic lung cancer. Semin Respir Med 1982; 3:165–175. [ Links ]
16. ATS and ERS: Pretreatment evaluation of non–small–cell lung cancer. The American Thoracic Society and The European Respiratory Society. Am J Respir Crit Care Med 1997; 156:320–332. [ Links ]
17. Onuiigbo WIB. The spread of lung cancer to the heart, pericardium and great vessels. Jpn Heart J 1974; 15:234–238. [ Links ]
18. Merchut MP. Brain metastases from undiagnosed systemic neoplasms. Arch Intern Med 1989;149:1076–1080. [ Links ]
19. Grippi MA. Clinical aspects of lung cancer. Semin Roentgenol 1990; 25:12–24. [ Links ]
20. Michel A, BecklessMB, Stephen G. Initial Evaluation of The patient with Lung Cancer.Chest 2003; 123:97S–104S. [ Links ]
21. Henschke Cl, McCauley Dl, Yankelevitz DF, et al. Early Lung Cancer Action Project: a summary of the findings on aseline screening. Oncologist 2001; 6:147–15. [ Links ]
22. Henschke Cl, Naidich DP, Yankelevitz DF, et al. Early Lung Cancer Action Project: initial findings on repeat screenings. Cancer 2001; 92:153–159. [ Links ]
23. Miettinen OS, Yankelevitz DF, Henschke Cl. Screening for lung cancer [letter]. N Engl J Med 2001; 344:935. [ Links ]
24. Meter B, Michael J, Nelly MD. Screening for lung Cancer. Chest 2003; 123:72S–82S. [ Links ]
25. Karl–Matthias Depperman. Lung Career Screnning . Where we are in 2004. Lung Cancer 2004; 45(suppl.2):S39–S42. [ Links ]
26. Edward F. Patz, Philip C, Goodman and Gerold Bepler. Screening for lung cancer. N Engl J Med 2000; 342:1627–1633. [ Links ]
27. James L, Mulshine and Daniel C. Lung Cancer Screening. N Engl J Med 2005; 352:271 4–2720. [ Links ]














