Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.142 no.2 Ciudad de México mar./abr. 2006
Artículo de revisión
Eotaxinas en asma bronquial y poliposis nasal
The role of eotaxins in bronquial asthma and nasal polyposis
Luis M. Terán,* Yadira Ledesma–Soto, Sven Krengel, Diana Lezcano–Meza
Instituto Nacional de Enfermedades Respiratorias, SSA, México D. F., México
Recibido en su versión modificada: 22 de abril de 2005
Aceptado:22 de septiembre de 2005
*Correspondencia y solicitud de sobretiros:
Dr.Luis M. Terán,
Calzada de Tlalpan 4502,
México D. F., México
Resumen
Durante la última década se han descubierto tres péptidos con actividad quimotáctica específica para los eosinófilos y que son miembros de la familia de las quimocinas. Estas citocinas inducen a los eosinófilos a realizar diferentes funciones como quimotaxis, migración transendotelial e inducción de la liberación de radicales de oxígeno. Como los eosinófilos infiltran tanto las vías aéreas de pacientes asmáticos como los pólipos nasales, se ha postulado que las eotaxinas pueden ser responsables del reclutamiento de estas células. Los eosinófilos tienen la propiedad de inducir remodelamiento de la matriz extracelular y daño tisular a través de la liberación de proteasas tóxicas, mediadores inflamatorios, citocinas y radicales de oxígeno. Por lo cual, el desarrollo de estrategias terapéuticas que inhiban el reclutamiento de estas células constituye una esperanza en el tratamiento de las enfermedades alérgicas. Este artículo revisa la función de las eotaxinas en asma y poliposis nasal, además de discutir el posible uso de antagonistas de CCR3, receptor de las eotaxinas, como una nueva modalidad terapéutica de asma y poliposis nasal.
Palabras Clave: Eotaxina–1, –2 y –3, quimiocinas, CCR3, eosinófilos, asma y pólipos nasales
Summary
Over the last few years, three specific eosinophil activating peptides, eotaxin–1, –2 and –3, members of the chemokine family have been identified. These cytokines exert a number of functions on eosinophils including chemotaxis, transendothelial migration and induction of the release of reactive oxygen species. Eosinophils are considered to play an important role in allergic disease by causing tissue damage through the release of toxic proteases, lipid mediators, cytokines and oxygen free radicals. This article reviews the role of eotaxins in asthma and nasal polyps. Discussion focuses on therapeutic guidelines, particularly as it has been shown that CCR3, the major chemokine receptor in eosinophils, serves as a eotaxin receptor.
Keywords: Eotaxin–1, –2 and –3; chemokines; CCR3; eosinophils, allergic inflammation
Introducción
Los eosinófilos son células que participan en enfermedades parasitarias y alérgicas.1 En el caso de enfermedades respiratorias alérgicas se ha demostrado que estas células infiltran las vías aéreas de pacientes alérgicos. Se ha propuesto que una vez que los eosinófilos han migrado al sitio de inflamación, estas células contribuyen al proceso inflamatorio a través de la liberación de proteasas tóxicas (proteína básica mayor, proteína catiónica eosinofílica), mediadores de la inflamación (leucotrienos) y radicales de oxígeno.2
El proceso de reclutamiento de los eosinófilos desde la circulación sanguínea involucra una serie de procesos separados, primero una adhesión al endotelio y migración transendotelial que son dependientes de la expresión de moléculas de adhesión, y posteriormente migración a través de la matriz extracelular hacia el sitio de inflamación alérgica dependiente de estímulos quimotácticos. Las quimocinas son citocinas quimotácticas que juegan un papel central en la respuesta inmune e inflamatoria debido a la atracción y activación de los leucocitos, a través de receptores transmembranales acoplados a proteínas G.3,4 Las quimocinas se dividen en cuatro familias (CXCL, CCL, CL y CX3CL) en base a la posición de uno o dos residuos de cisteína localizados cerca del amino terminal (Figura 1). En la familia de las quimocinas CXCL los dos residuos de cisteína se encuentran separados por un aminoácido, mientras que en las CCL, los dos residuos de cisteína se encuentran adyacentes. Las quimocinas CL poseen un solo residuo de cisteína mientras que la familia CX3CL posee tres aminoácidos entre las dos cisteínas.5 Dentro de la familia CCL, se encuentran tres péptidos con actividad quimotáctica específica para eosinófilos conocidas como eotaxina–1, eotaxina–2 y eotaxina–3. De acuerdo a la nueva nomenclatura de las quimocinas, estas citocinas se clasificaron como CCL11 (eotaxina–1), CCL24 (eotaxina–2) y CCL26 (eotaxina–3). Por su acción especifica sobre los eosinófilos, se ha propuesto que las eotaxinas pueden jugar un papel muy importante en el proceso inflamatorio alérgico.6
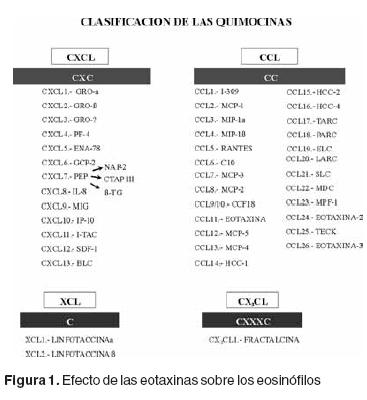
Caracterización de las eotaxinas
El desarrollo de nuevas técnicas de biología molecular así como el acceso a la tecnología bioinformática permitió el descubrimiento de la mayoría de las eotaxinas.
La eotaxina–1/CCL11 fue aislada en 1994 en los lavados broncoalveolares (LBA) de cobayos alérgicos expuestos a reto alergénico.5,6 Interesantemente, la presencia de esta citocina en el LBA se encontró asociada con la infiltración de eosinófilos presentes en la vía aérea de cobayos. En 1996 se describió el gen que codifica para la eotaxina–1/CCL11 humana. Se encontró que la eotaxina–1/CCL11 humana tiene 58% de homología con la eotaxina–1/CCL11 de cobayos.6,7 Los efectos in vitro de la eotaxina–1/CCL11 sobre los eosinófilos incluye quimotaxis, migración transendotelial, inducción y liberación de especies reactivas de oxígeno, inducción de la movilización de Ca2+, polimerización de actina, alta regulación de CD11b, degranulación y liberación de IL–4 y LTC4 sintetasa8,9,10 (Figura 2). Además se ha propuesto que la eotaxina–1/CCL11 coopera con la IL–5 para reclutar eosinófilos al sitio de inflamación: IL–5 estimula la liberación y diferenciación de los eosinófilos en la médula ósea, entre tanto la eotaxina–1/CCL11 dirige la migración de estas células circulantes a su destino local.11 Por otro lado, además de atraer eosinófilos, la eotaxina–1/CCL11 ejerce actividad quimotáctica para basófilos y linfocitos Th2.12,13 La administración de agentes que neutralizan el efecto de eotaxina–1/CCL11 a ratones sensibilizados, inhibe significativamente el reclutamiento de eosinófilos en el área de inflamación alérgica. De manera interesante, nuestro grupo ha demostrado que IL–4 en combinación con TNF–alfa induce la producción de varias formas truncadas de eotaxina–1/ CCL11 con pesos moleculares de 12.5, 12.8 y13 kd.14
La eotaxina–2/CCL24 fue identificada en 1997 a partir del ADNc derivado de monocitos humanos activados. 15 Debido a la actividad inhibitoria sobre la proliferación mieloide, se le denominó a esta quimocina factor–2 inhibidor de progenitor mieloide (MPIF–2); sin embargo, pocos meses después dos grupos independientes demostraron que esta quimocina posee una potente actividad quimotáctica para eosinófilos y fue llamada entonces eotaxina–2/CCL24.16,17 El gen que codifica para esta citocina está localizada en el cromosoma 7q11.23. Eotaxina–2 y eotaxina–1 son funcionalmente similares, pero son estructuralmente diferentes; únicamente existe entre ellas un 35% de identidad a nivel de su secuencia de aminoácidos y difieren completamente en la región amino terminal.16,17 Los efectos in vitro de la eotaxina–2//CCL24 sobre los eosinófilos incluye quimotáxis, migración transendotelial y un rápido incremento en el flujo de Ca+2. Además, activan a los basófilos induciendo la liberación de histamina y LTC4. Una característica de la eotaxina–2//CCL24 es su habilidad para inducir la rápida separación de la molécula de adhesión VCAM–1 de los eosinófilos, lo cual aumenta la adhesión de estas células a la albúmina sérica bovina en condiciones estáticas como de flujo.18 La inyección intradérmica de eotaxina–2 a monos rhesus induce el reclutamiento de eosinófilos en el sitio de inyección.16 Se ha encontrado que el reto pulmonar alergénico a ratones sensibilizados induce un incremento de la expresión de eotaxina–2/CCL24 localmente. Además la sobreexpresión transgénica de IL–4 en pulmón induce la expresión de esta citocina.19
La eotaxina–3/CCL26 fue identificada simultáneamente por dos grupos independientes, encontrando 32 y 34% de identidad en su estructura química con eotaxina–1 y eotaxina–2 respectivamente.20 Esta citocina se encuentra constitutivamente expresada en corazón y ovario. Los efectos de la eotaxina–3/CCL26 sobre los eosinófilos incluyen quimotaxis, transmigración celular y movilización del flujo de Ca+2. Además tiene la habilidad de activar a los basófilos; sin embargo, eotaxina–3/CCL26 es 10 veces menos potente que las otras dos eotaxinas. Por otro lado, la eotaxina–3/CCL26 muestra diferencias en su perfil de expresión y especificidad celular en comparación con eotaxina–1 y –2. Por ejemplo, las citocinas IL–4 y TNF–alpha inducen la expresión de eotaxina–1/CCL26 en fibroblastos dérmicos.14,20,22 En cambio, aunque IL–4 estimula a estas células a expresar eotaxina–3, TNF–alfa no tiene este efecto.
En un estudio reciente se mostró que la eotaxina–3/CCL26 media la transmigración de eosinófilos bajo condiciones de flujo laminar lento.20 La Inyección de eotaxina–3/CCL26 en monos cymonologus causa el reclutamiento de eosinófilos en el sitio de inyección.23
Eotaxinas en asma
El asma es una enfermedad inflamatoria crónica de las vías aéreas, asociada a obstrucción variable del flujo aéreo generalmente reversible, de manera espontánea o con tratamiento, y a un incremento en la reactividad de las vías aéreas a una variedad de estímulos. Una característica de esta enfermedad es la infiltración de las paredes bronquiales por células inflamatorias, incluyendo linfocitos T CD4+, mastocitos y eosinófilos.23,24Se ha propuesto que los eosinófilos juegan un papel central en la patogénesis de esta enfermedad aunque recientemente se ha cuestionado su importancia.11,24,25 Por ejemplo, se ha observado un incremento de eosinófilos en suero, LBA y biopsias de pacientes asmáticos y además, la exposición de estos pacientes a reto alergénico incrementa todavía más el número de eosinófilos en sus vías aéreas. Se ha propuesto que los eosinófilos contribuyen a la hiperreactividad bronquial en personas asmáticas a través de la liberación de proteasas, mediadores lipídicos y radicales de oxígeno.
Durante la última década, se han descrito un número importante de factores quimotácticos que podrían contribuir al reclutamiento de eosinófilos en la enfermedad respiratoria alérgica. Por ejemplo: IL–3, GM–CSF (Factor Estimulante de las Colonias–Granulocito Macrófagos) e IL–5 que promueven la diferenciación y crecimiento de los eosinófilos, sin embargo, tienen propiedades quimotácticas muy débiles. Por otro lado, moléculas pequeñas tal como el Factor activador de las plaquetas y la fracción C5a del complemento son potentes pero no selectivos, ya que también atraen neutrófilos. Miembros de la familia de las quimocinas como RANTES/CCL5, MCP–3/CCL7 y MCP–4/ CCL13 tienen actividad quimotáctica muy potente sobre los eosinófilos, sin embargo, atraen otros tipos celulares como los monocitos y linfocitos. A diferencia de las moléculas antes mencionadas las eotaxinas poseen actividad quimotáctica selectiva para los eosinófilos.
La eotaxina–1/CCL11 ha sido estudiada en numerosos modelos animales de asma. Por ejemplo, se ha observado que ratones expuestos a alergenos expresan niveles elevados del gen que codifica para esta citocina de tres a seis horas posterior al reto.6 Interesantemente, la administración de eotaxina–1/CCL11 en aerosol induce un flujo de eosinófilos en las vías aéreas de ratones. En cambio ratones deficientes en eotaxina–1/CCL11 no sólo muestran una disminución del reclutamiento de eosinófilos sino que también están protegidos de cambios inflamatorios inducidos por el reto alergénico.26 Por otro lado, se ha demostrado que la eotaxina–1/CCL11 juega un papel importante en la alergia gastrointestinal eosinofílica.27
En humanos, se ha demostrado que la eotaxina–1/CCL11 está involucrada en enfermedades respiratorias alérgicas tales como asma bronquial y rinitis alérgica. Un incremento del gen que codifica a la eotaxina–1/CCL11 ha sido encontrado en biopsias bronquiales, LBA, esputo y en suero derivado de pacientes asmáticos.28–32 Además, la expresión de esta citocina se incrementa aun más en las vías aéreas de pacientes asmáticos expuestos a reto alergénico.31 Estudios sobre la cinética de liberación de eotaxina–1/CCL11 han mostrado que posterior al reto alergénico los niveles de eotaxina–1/ CCL11 alcanzan concentraciones máximas a las 4 horas y declinan a las 24 horas.33 Interesantemente, IL–5 tiene una cinética de liberación diferente: posterior al reto alergénico, los niveles de IL–5 se incrementan gradualmente en LBA alcanzando su máximo a las 24 horas,34 lo cual sugiere que las eotaxinas inician el reclutamiento de eosinófilos, mientras que la IL–5 mantiene la migración de estas células en el pulmón. Estudios en animales han demostrado que ambas citocinas cooperan en el proceso de reclutamiento de eosinófilos en el sitio de la inflamación alérgica.12,13
Existe evidencia de que la eotaxina–2/CCL24 juega un papel prominente en el proceso inflamatorio alérgico. Por ejemplo, ratones expuestos a antígeno liberan concentraciones elevadas de eotaxina–2/ CCL24, lo cual se asocia con el reclutamiento de eosinófilos en sus vías aéreas.19 Además, se ha reportado que la inyección intradérmica de eotaxina–2/ CCL24 humana a monos rhesus induce el reclutamiento de eosinófilos en el sitio de aplicación.16 Las evidencias más convincentes derivan del análisis de biopsias de pacientes. Por ejemplo Ying y cols., encontraron aumentada la expresión de eotaxina–2/CCL24 en biopsias de piel obtenidas durante la fase tardía de la respuesta cutánea inducida por alergenos, así como en biopsias bronquiales derivadas de asmáticos atópicos y no atópicos.28,35 Recientemente nuestro grupo ha demostrado que los esteroides inhalados inhiben la liberación de eotaxina–2/CCL24 inducida por reto nasal alergénico en pacientes con rinitis alérgica.36
El papel de la eotaxina–3/CCL26 en el proceso inflamatorio alérgico ha sido poco estudiado.
Pólipos nasales
Los pólipos nasales ocurren usualmente como resultado de una hiperplasia pediculada local de la mucosa y submucosa nasal del hueso etmoides y causan obstrucción nasal.37,38 El diagnóstico generalmente se realiza por rinoscopia, que permite observar tumoraciones de color característico: blancas, grisáceas o amoratadas dando la impresión de ser semitranslúcidas cuando están muy edematizadas. Los estudios radiológicos pueden ser de utilidad para investigar si los pólipos infiltran los senos paranasales. La frecuencia de pólipos nasales en la población alérgica es de casi 4% y se incrementa aún más en asmáticos (7%) comparado con pacientes que sólo tienen rinitis.12 La etiología de la poliposis nasal no está bien establecida; sin embargo, una tercera parte de los casos se ha asociado a problemas atópicos y asma, y el resto a otras entidades patológicas del aparato respiratorio como: fibrosis quística, disquinesia ciliar primaria, intolerancia a la aspirina, hiperreactividad nasal y en ocasiones no hay etiología determinada.39
Estudios histológicos han demostrado que de 80 a 90% de los pólipos se caracterizan por presentar una infiltración de eosinófilos, células T y B, células plasmáticas y mastocitos. Aunque todas estas células tienen la capacidad de contribuir a la poliposis nasal, los eosinófilos constituyen 60% de las células que infiltran los pólipos nasales.37,39 Por ejemplo, se ha demostrado que los eosinófilos promueven la proliferación epitelial, generan componentes de matriz extracelular y causan remodelamiento a través de la liberación de citocinas como Factor de Necrosis Tumoral (TNF)–α, TNF–(β y GM–CSF. Estudios previos han vinculado a la quimocina RANTES, potente quimoatrayente para eosinófilos, en poliposis nasal tanto en pacientes atópicos como no atópicos,40 sin embargo esta proteína además de activar a estas células también activa otros leucocitos.
Por su habilidad de atraer específicamente a los eosinófilos, las eotaxinas han adquirido gran relevancia en la poliposis nasal. Por ejemplo, se ha encontrado una elevada expresión del ARNm así como de la proteína de eotaxina–1/ CCL11 en biopsias de pólipos nasales. Por inmunohistoquímica, se ha demostrado que diferentes tipos celulares son fuente de eotaxina–1 incluyendo monocitos/macrófagos, eosinófilos, células T y fibroblastos. En 1997 Bartels y colaboradores demostraron por primera vez que los pólipos nasales de pacientes atópicos y no atópicos presentan una elevada expresión de transcriptos para eotaxina–1/CCL11.41 En cambio no se detectó MCP–3, la cual es también un potente atrayente de eosinófilos. Consistente con este reporte, otros estudios han confirmado la participación de eotaxina–1/ CCL11 en poliposis nasal. Recientemente, Bachert y cols. determinaron por ELISA la presencia de eotaxina–1/CCL11 en homogeneizados de pólipos nasales.42 En ese estudio demostraron que los homogeneizados contenían concentraciones elevadas de eotaxina–1/CCL11 comparando con homogeneizados de tejido nasal no polipoideo. En paralelo Lamblin y cols., encontraron que pacientes con asma y poliposis nasal presentan alta expresión de eotaxina–1/CCL11 e IL–5 en la mucosa bronquial.43 En cambio, pacientes con poliposis nasal asociados con hiperreactividad bronquial pero sin asma expresaban IL–5 pero no eotaxina–1/CCL11. Más recientemente, otros dos grupos han documentado la participación de eotaxina–1/CCL11 en poliposis nasal.44,45. Esto sugiere que esta citocina juega un papel importante en pacientes con asma y poliposis nasal.
Aunque no hay muchos reportes de eotaxina–2/CCL24 en poliposis nasal, en un trabajo muy elegante Janhssen y cols., demostraron que la eotaxina–2/CCL24 es la quimocina más altamente expresada en pólipos nasales comparada con otras quimocinas incluyendo RANTES y MCP–4.46 Recientemente nosotros hemos estudiado la eotaxina–2 en un modelo in vitro de poliposis nasal.47 En este estudio demostramos que los pólipos producen constitutivamente eotaxina–2. Además, se encontró que IL–4 regula la producción de eotaxina–2. Fue interesante observar que concentraciones muy bajas de esta citocina (0.1ng/ml) son capaces de inducir la producción de eotaxina–2/CCL24, lo que sugiere que en condiciones fisiológicas la IL–4 participa en la producción de esta citocina (Figura 3). Esto es relevante ya que la IL–4 está involucrada en la patogénesis de la poliposis nasal en pacientes atópicos y no atópicos.
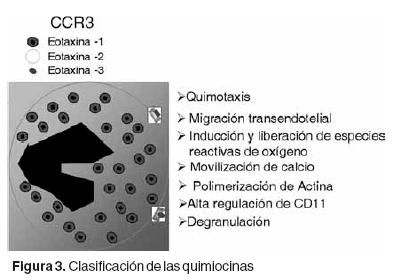
CCR3 es receptor para las eotaxinas
Las quimocinas son pequeñas moléculas que ejercen su acción quimotáctica sobre leucocitos a través de receptores transmembranales acoplados a proteínas G. En el caso de las eotaxinas, estas moléculas ejercen sus efectos a través del receptor CCR3 (derivado de "chemokine CC receptor–3").48,49 Este receptor se expresa principalmente en eosinófilos y basófilos aunque también pueden encontrarse cantidades mínimas en otros tipos celulares como: células dendríticas, linfocitos Th2, células epiteliales, mastocitos y tejidos embrionarios responsables de células hematopoyéticas.
El CCR3 es un receptor promiscuo ya que además de servir como receptor para las eotaxinas también media los efectos de otras quimocinas entre las que se encuentran: RANTES (CCL–5), MCP–2 (CCL18), MCP–3 (CCL7), MCP–4 (CCL13) y HCC–2 (MIP–5). Las eotaxinas sin embargo, activan específicamente CCR3 mientras que las otras quimocinas activan otros receptores adicionales.48,49 Una vez que el ligando (quimocina) se une con su receptor, ocurre una serie de cambios bioquímicos como activación de proteínas Gi, incremento en el tránsito de la concentración de calcio intracelular, activación de la vía Protein–Cinasa–Mitógeno Activada (MAP), una rápida y prolongada internalización del receptor en un compartimiento endocítico compartido con el receptor de transferrina, polimerización de actina y cambios asociados con la respuesta quimotáctica.50
Numerosos estudios han demostrado que el uso de medicamentos antagonistas de CCR3 pueden tener efectos benéficos en el tratamiento de la enfermedad alérgica. De hecho, se ha desarrollado gran número de antagonistas de CCR3 entre los que se encuentran anticuerpos, péptidos de bajo peso molecular para CCR1 y CCR–3 y mutantes de quimocinas.48,49,51,52 En 1997, por primera vez se reportó que el uso de un anticuerpo monoclonal contra CCR3 bloqueaba completamente la migración de los eosinófilos en respuesta a varias quimiocinas ligandos de este receptor.49 De manera interesante, estudios posteriores mostraron que péptidos y no péptidos antagonistas de CCR3, inhiben varias funciones como: el flujo de calcio intracelular, cambios en la estructura, quimotaxis, migración transendotelial y degranulación.17 Otra alternativa terapéutica ha sido desarrollar quimocinas mutantes con actividad anti–CCR3. Met–RANTES y Met–quimocina –7 (C kbeta7) constituyen dos ejemplos.26 Met–RANTES inhibe las funciones del eosinófilo a través del antagonismo con CCR1 y CCR3 mientras Ckbeta7 antagoniza específicamente CCR3. Ambos antagonistas inhiben el flujo de calcio en eosinófilos y la quimotaxis. Sin embargo, Ckbeta7 es mucho más potente antagonista comparado con Met–RANTES. Recientemente se ha demostrado que la forma truncada de eotaxina–2 (P30–R99) convierte a esta citocina en un antagonista de eotaxina–1/CCL11.53 Resulta de interés, el hallazgo de que algunas quimocinas son antagonistas naturales de CCR–3, como es el caso de las quimocinas I–TAC, Mig e IP–10.54 De todos éstos antagonistas, Met–RANTES es la molécula más estudiada en modelos animales de inflamación alérgica. Por ejemplo, se ha encontrado que la administración de Met–RANTES en ratones antes del reto antigénico inhibe el reclutamiento de eosinófilos en la reacción alérgica cutánea55 así como procesos inflamatorios de las vías aéreas.26
Conclusiones
Durante los últimos años se han acumulado numerosas evidencias mostrando que las eotaxinas juegan un papel importante en el reclutamiento de eosinófilos que caracterizan las enfermedades respiratorias como: asma bronquial y poliposis nasal. Además, se ha reportado que el uso de anticuerpos neutralizantes (anti–eotaxinas) en diferentes modelos animales de asma no sólo inhiben el reclutamiento de eosinófilos en respuesta al reto alergénico, sino que también inhiben la hiperreactividad bronquial, lo que sugiere que el desarrollo de medicamentos que neutralicen el efecto de las eotaxinas puede ser de utilidad terapéutica en enfermedades alérgicas. Varios estudios realizados en humanos han mostrado que las eotaxinas pueden funcionar durante distintas etapas del proceso de la enfermedad alérgica, por ejemplo, se reportó que hay una diferencia en la generación de eotaxina–1 y –2 en la reacción cutánea alérgica tardía: se observó que la expresión de eotaxina–1 se eleva 6 horas después del reto, mientras que la expresión de eotaxina–2 se hace evidente hasta las 24 horas.35 Por otro lado, se ha demostrado que la expresión de eotaxina–3 en las vías aéreas de asmáticos se eleva a las 24 horas.56 Estos hallazgos sugieren que las eotaxinas participan en diferentes estadios de la enfermedad alérgica.
El CCR3 es el receptor para las eotaxinas y se encuentra altamente expresado en los eosinófilos. Esto ha hecho a este receptor un blanco para intervención terapéutica. Por ejemplo, distintos reportes muestran que antagonistas de CCR3 bloquean la activación de los eosinófilos in vitro inducido por las eotaxinas y otros ligandos de CCR3. Por otro lado, estudios en ratones demuestran que la preadministración de mutantes de las quimocinas tal como met–RANTES antes del reto cutáneo alérgico previene el reclutamiento de eosinófilos. Recientemente se ha demostrado que además de CCR3, CCR4 (receptor para las quimocinas TARC y MDC) también participa en el proceso alérgico. Esto sugiere que el desarrollo de medicamentos que neutralicen estos receptores pueden ser de utilidad en el tratamiento del asma bronquial y poliposis nasal.
Referencias
1. Schmid–Grendelmeier P, Altznauer F, Fischer B, Bizer C, Straumann A, Günter M, et al. Eosinophils express functional IL–13 in eosinophilc inflammatory diseases. J Immunol 2002; 169:1021–1027. [ Links ]
2. Stoop AE, van der Heijden HA, Biewenga J, van der Baan S. Eosinophils in nasal polyps and nasal mucosa: An immonohistochemical study. J Allergy Clin. Immunol 1993; 91:616–622. [ Links ]
3. Tiffany HL, Alkhatib G, Combadiere C, Berger EA, Murphy PM. CC chemokine receptors 1 and 3 are differentially regulated by IL–5 during maduration of eosinophilic HL–60 cells. J Immunol 1998; 160:1385–1392. [ Links ]
4. Teran LM. CCL chemokines and asthma. Immunol. Today. 2000; 21:235–242. [ Links ]
5. Barrett JR. Chemokines. Blood 1997; 90:909–928. [ Links ]
6. Jose PJ, Griffiths–Johnson DA, Collins PD, Walsh DT, Moqbel R, et al. Eotaxin: cloning of an eosinophil chemoattractant cytokine and increased mRNA expresión in allergen–challenged guinea–pig lungs. Biochem Biophys Res Commun 1994; 205: 788–794. [ Links ]
7. Lilly CM, Nacamura H, Kesselman H, Anderson CN, Asano K, Garcia Zepeda EA, et al. Expression of eotaxin by human lung epithelial cells. J Clin Invest 1997; 99:1767–1773. [ Links ]
8. Stellato C, Brummet EM, Plitt RJ, Shahabuddin S, Baroody MF, Liu CM, et al. Expression of the C–C chemokine receptor CCR3 in human airway epithelial cells. J Immunol 2001; 166:1457–1461. [ Links ]
9. Clemetson KJ, Clemetson JM, Proudfoot AEI, Power CA, Baggiolini M, Wells TNC. Functional expression of CCR1,CCR3,CCR4, and CXCR4 chemokine receptors on human platelets. Blood 2000; 96:4046–4054. [ Links ]
10. Yasmin D, Kluthe C, Buschermöhle T, Barg , Knöb S, Kapp A, et al. IL–13 induces down–regulation of CCR3 protein and m RN A in human eosinophils. J Immunol 2001; 167:3443–3453. [ Links ]
11. Leckie MJ, ten Brinke A , Jamey Khan, Zuzana Diamant, Brian J O'Connor, et al. Effects of an interleukin–5 blocking monoclonal antibody on eosinophils, airway hyper–responsiveness, and the late asthmatic response. Lancet 2000; 356:2144–2148. [ Links ]
12. Palframan RT, Collins PD, Severs NJ, Rothery S, Williams TJ, Rankin SM. Mechanisms of acute eosinophil mobilization from the bone marrow stimulated by interleukin 5: the role of specific adhesión molecules and phosphatidylinositol 3–kinase. J Exp Med. 1998; 188:1621 –1632. [ Links ]
13. Palframan RT, Collins PD, Williams TJ, Rankin SM. Eotaxin induces a rapid release of eosinophils and their progenitors from the bone marrow. Blood 1998; 91:2240–2248. [ Links ]
14. Teran LM, Mochizuki M, Bartels J, Valencia E, Schröder J. Th1 and Th2 type cytokines regulate the expression and production of eotaxin and RANTES by human lung fibroblasts. Am J Resp Cell Mol Biol 1999; 20:777–786. [ Links ]
15. Patel VP, Kreider BL, Li Y, Li H, Leung K, Salcedo T, et al. Molecular and functional characterization of two novel human C–C chemokines as inhibitors of two distinct classes of myeloid progenitors. J Exp Med 1997; 185:1163–1172. [ Links ]
16 Forssmann U, Uguccioni M, Loetscher P, Dahinden CA, Langen H, Thelen M, et al. Eotaxin–2, a novel CC chemokine that is selective for the chemokine receptor CCR3, and acts like eotaxin on human eosinophil and basophil leucocytes. J Exp Med 1998; 185:2171–2176. [ Links ]
17. White JR, Imburgia C, Dul E, Appelbaum E, O'Donnell K, O'Shannessy DJ, et al. Cloning and functional characterization of a novel human CC chemokine that binds to the CCR3 receptor and activates human eosinophils. J Leukoc Biol 1997; 62:667–675. [ Links ]
18. Tachimoto H, Burdick MM, Hudson SA, Kikuchi M, Konstantopoulos K, Bochner BS. CCR3 active chemokines promote rapid detachment of eosinophils from VCAM–1 in vitro. J Immunol 2000; 165:2748–2754. [ Links ]
19. Zimmermann N, Hogan SP, Mishra A, Brandt EB, Bodette TR, Pope SM, et al. Eotaxin–2: A Constitutive Eosinophil Chemokine Induced by Allergen Challenge and IL–4 Overexpression. J Immunol 2000; 165:5839–5846. [ Links ]
20. Shinkai A, Yoshisue H, Koike M, Shoji E, Nakagawa S, Saito A, et al. A novel human CC chemokine, eotaxin–3, which is expressed in IL–4 stimulated vascular endothelial cells, exhibits potent activity toward eosinophils. J Immunol 1999; 163:1602–1610. [ Links ]
21. Kitaura M. Molecular cloning of a novel human CC chemokine (eotaxin–3) that is a functional ligand of CC chemokine receptor 3. J Biol Chem 1999; 274:27975–27980. [ Links ]
22. Hoeck J, Woitsetschlager M. STAT6 mediates eotaxin–1 expression in IL– 4 or TNF–alpha–induced fibroblasts. J Immunol 2001; 166:4507–4515 [ Links ]
23. Teran LM, Carroll M, Frew AJ, Redington AE, Davies DE, Lindley I, et al. Leukocyte recluitment after local endobronchial allergen challenge in asthma. Relationship to procedure and to airway interleukin–8 release. Am J Respir Crit Care Med 1996; 154:469–476. [ Links ]
24. Frew AJ, St Pierre J, Teran LM, Madden J, Trefillieff A, Carroll MP. Cellular and mediator responses twenty–four hours after local endobronchial allergen challenge of asthmatic airways. J Allergy Clin Immunol 1996; 98:133–143. [ Links ]
25. Teran LM, Noso N, Carroll MP, Davies DE, Holgate ST, Schröder J. Eosinophil recluitment following allergen challenge is associated with the release of the chemokine RANTES into asthmatic airways. J Immunol 1996; 57:1806–1812. [ Links ]
26. Gonzalo JA, Lloyd CM, Wen D, Albar JP, Wells TN, Proudfoot AEI, et al. The coordinated action of CC chemokines in the lung orchestrates allergic inflammation and airway hyperresponsiveness. J Exp Med 1998; 188:157–167. [ Links ]
27. Hogan SP, Mishra A, Brandt EB, Royalty MP, Pope SM, Zimmermann N, et al. A pathological function for eotaxin and eosinophils in eosinophilic gastrointestinal inflammation. Nature Immunol 2001; 1:353–360. [ Links ]
28. Ying S, Meng Q, Zeibecoglou K, Robinson DS, Macfarlane A, Humbert M, Kay AB. Eosinophil chemotactic chemokines (eotaxin, eotaxin–2, RANTES, monocyte chemoattractant protein–3 (MCP–3), and (MCP–4) and CC chemokine receptor 3 expression in bronchial biopsies from atopic and nonatopic (intrinsic) asthmatic. J Immunol 1999; 163:6321–6329. [ Links ]
29. Lamkhioued B, Renzi PM, Abi–Younes S, Garcia–Zepada EA, Allakhverdi Z, Ghaffar O, et al. Increased expression of eotaxin in bronchoalveolar lavage and airways of asthmatics contributes to the chemotaxis of eosinophils to the site of inflammation. J Immunol 1997; 159:4593–4601. [ Links ]
30. Nakamura H. Eotaxin and impaired lung function in asthma. Am J Respir Crit Care Med 1999; 160:1952–1956. [ Links ]
31. Tateno H, Nakamura H, Minematsu N, Nakajima T, Takahashi S, 51. Nakamura M, et al. Plasma eotaxin level and severity of asthma treated with corticosteroid. Respir Med 2004; 98:782–90. [ Links ]
32. Hadjicharalambous C, Dent G, Handy RL, Anderson IK, Davies DE, Djukanovic R. Measurement of eotaxin (CCL11) in induced sputum supernatants: validation and detection in asthma. J Allergy Clin Immunol 2004; Apr; 113(4):657–62. [ Links ]
33. Brown JR, et al. Kinetics of eotaxina expression and its relationship to eosinophil accumulation and activation in bronchial biopsies and bronchoalveolar lavage (BAL) of asthmatic patients after allergen inhalation. Clin Exp Immunol 1998; 114:137–146. [ Links ]
34. Teran LM, Carroll MP, Shute JK, Holgate ST. Interleukin 5 release into asthmatic airways 4 and 24 hours after endobronchial allergen challenge: its relationship with eosinophil recluitment. Cytokine 1999; 11:518–522. [ Links ]
35. Ying S, Robinson DS, Meng Q, Barata LT, McEuen AR, Buckley MG, et al. C–C chemokines in allergen–induced late–phase cutaneous responses in atopic subjects: association of eotaxin with early 6–hour eosinophils, and of eotaxin–2 and monocyte chemoattractant protein–4 with the later 24–hour tissue eosinophilia, and relationship to basophils and other C– C chemokines (mono–cyte chemoattractant protein–3 and RANTES). J Immunol 1999; 163:3976–3984 [ Links ]
36. Teran LM, González L, Valencia–Maqueda E, Negrete–García C. The kinetics of eotaxin–2 release in nasal secretions following nasal allergen challenge: its inhibition by a topical steroid. J Allergy Clin Immunol 2003; 111: A 520. [ Links ]
37. Dellacono FR, Eisma R, Lafreniere D, Leonard G, Kreutzer D. Interferon gamma expression in human nasal polyps. Laryngoscope 1997; 107:626–630. [ Links ]
38. Azuara–Pliego E, García–Palmer R. Rinología ciencia y arte.1996. México D.F. Editorial JGH. pp. 148–149. [ Links ]
39. Pawankar R. Nasal polyposis: an update: editorial review. Curr Opin Allergy Clin Immunol 2003; 3(1):1–6. [ Links ]
40. Teran LM, Park HS, Djukanovic R, Roberts K, Holgate ST. Culture nasal polyps from nonatopic and atopic patients release RANTES spontaneously and after stimulation with phytohemagglutinin. J Allergy Clin Immunol 1997; 100:499–504. [ Links ]
41. Bartels J, Maune S, Meyer JE, Kulke R, Schluter C, Rowert J, et al. Increased eotaxina mRNA expression in non–atopic and atopic nasal polyps: comparison to RANTES and MCP–3 expression. Rhinology 1997; 35(4):171–174 [ Links ]
42. Bacher C, Gevaert P, Holtappels G, Johansson SG, van Cauwenberge P. Total and specific IgE in nasal polyps is related to local eosinophilic inflammation. J Allergy Clin Immunol. 2001; 107(4):607–614. [ Links ]
43. Lamblin C, Bolard F, Gosset P, Tsicopoulos A, Perez Darras JJ, et al. Bronchial interleukin–5 and eotaxina expression in nasal polyposis. Am J Respir Crit Care Med 2001; 163:1226–1232. [ Links ]
44. Woodworth BA, Joseph K, Kaplan AP, Schlosser RJ. Alterations in eotaxin, monocyte chemoattractant protein–4, interleukin–5, and interleukin–13 after systemic steroid treatment for nasal polyps. Otolaryngol Head Neck Surg 2004; 13:585. [ Links ]
45. Seto H, Suzaki H, Shioda S. Immunohistochemical localization of eotaxin immunoreactivity in nasal polyps. Acta Otolaryngol Suppl 2004; 553:99–104. [ Links ]
46. Jahnsen FL, Haye R, Gran E, Brandtzaeg P, Johansen FE. Glucocorticosteroids inhibit mRNA expression for eotaxin, eotaxin–2, and monocyte–chemotactic protein–4 in human airway inflammation with eosinophilia. J Immunol 1999; 163(3):1545–1551. [ Links ]
47. Lezcano–Meza D, Dávila–Dávila B, Vega–Miranda A, Negrete–García MC, Teran. LM. Interleukin (IL)–4 and to a Lesser Extent either IL–13 or Interferon (IFN)–gamma Regulate the Production of Eotaxin–2/CCL24 in Nasal Polyps. Allergy 2003; 58:1011–1017. [ Links ]
48. Fujisawa T. Chemokines induce eosinophil degranulation through CCR3. J Allergy Clin Immunol 2000; 106:507–513. [ Links ]
49. Heath H, Qin S, Rao P, Wu L, LaRosa G, Kassam N, et al. Chemokine receptor usage by human eosinophils. The importance of CCR3 demonstrate using an antagonistic monoclonal antibody. J Clin Invest 1997; 99:178–184. [ Links ]
50. Zimmermann N, Daugherty BL, Stark JM, Rothenberg ME. Molecular analysis of CCR–3 events in eosinophilic cell. J Immunol 2000; 164:1055–1064. [ Links ]
51. Elsner J, Petering H, Hochstetter R, Kimmig D, Wells TN, Kapp A, Proudfoot AE. The CC chemokines antagonist Met–RANTES inhibits eosinophil effector functions through the chemokine receptors CCR1 and CCR3. Eur J Immunol 1997; 27:2892–2898. [ Links ]
52. Sabroe I, Peck MJ, Van Keulen BJ, Jorritsma A, Simmons G, Clapham PR, et al. A small molecule antagonist of chemokine receptors CCR1 and CCR3. Potent inhibition of eosinophil function and CCR3 mediated HIV–1 entry. J Biol Chem 2000; 275:25985–25992. [ Links ]
53. Loetscher P, Pellegrino A, Gong JH, Mattioli I, Loetscher M, Bardi G, et al. The ligands of CXC chemokine receptor 3, I–TAC, Mig and IP–10 are natural antagonists for CCR3. J Biol Chem 2001; 276:2986–2991. [ Links ]
54. Grzegorzewski KJ, Yao XT, Kreider B, Olsen HS, Morris TS, Zhang L, et al. Analysis of eosinophils and myeloid progenitor responses to modified forms of mipf–2. Cytokine. 2001; 13:209–219. [ Links ]
55. Teixeira MM, Wells TN, Lukacs NW, Proudfoot AE, Kunkel SL, Williams TJ, Hellewell PG. Chemokine–induced eosinophil recruitment. Evidence of a role for endogenous eotaxin in an in vivo allergy model in mouse skin. J Clin Invest 1997; 100(7):1657–66. [ Links ]
56. Berkman MP, Finkelman FD, Rothenberg ME. Murine Eotaxin–2: a constitutive eosinophil chemokine induced by allergen challenge and IL–4 overexpression. J Immunol 2000; 165:5839–5846. [ Links ]














