Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.142 no.1 Ciudad de México ene./feb. 2006
Artículo original
Implicaciones clínicas y pronósticas del estudio circadiano de la modulación simpático–vagal de la variabilidad de la frecuencia cardiaca en pacientes con hipertensión arterial pulmonar grave
Clinical implications and prognostic significance of the study on the circadian variation of heart rate variability in patients with severe pulmonary hypertension
Martín Rosas–Peralta,a* Julio Sandoval–Zárate,b Fause Attie,a Tomás Pulido,b Efrén Santos,b Nuria Z. Granados,c Teresa Mirandab y Verónica Escobar a
a Departamentos de Investigación Cardiopulmonar e
b Investigación de Cardiología Clínica, Instituto Nacional de Cardiología Ignacio Chávez, México, D.F., México
c Instituto Cardiovascular, República de El Salvador
Recibido en su versión modificada: 10 de octubre del 2005
Aceptado:11 de octubre del 2005
*Correspondencia y solicitud de sobretiros:
Dr Martin Rosas Peralta,
Unidad de Estudios Avanzados en Hipertensión Arterial y Factores de Riesgo. Instituto Nacional de Cardiología,
Juan Badiano 1, Secc. XVI, Delegación Tlalpan,
México, D.F., México, CP 14080.
Correo electrónico: martinrp02@yahoo.com.mx
Resumen
Introducción: La reducción en la variabilidad de la frecuencia cardiaca ha sido identificada como factor de riesgo en enfermedad cardiovascular, pero su descripción en hipertensión arterial pulmonar severa se desconoce.
Material y métodos: Se estudiaron pacientes con hipertensión arterial pulmonar grave, 32 con hipertensión pulmonar primaria, 34 con hipertensión pulmonar secundaria a cardiopatía congénita (Eisenmenger) y 44 sujetos control sin evidencia de enfermedad. La evaluación del registro ambulatorio de la frecuencia cardiaca se realizó por métodos convencionales. El análisis espectral y la relación a baja y alta frecuencia se realizó utilizando el método de Fourier. Comparaciones entre día y noche se realizó entre los grupos. Después de conocer el perfil circadiano, 15 pacientes con hipertensión pulmonar fueron seleccionados para recibir tratamiento al azar con Treprostinil (Prostaglandina) o placebo por vía subcutánea. Posteriormente (3 meses) se analizaron nuevamente los parámetros de variabilidad de frecuencia cardiaca y de hemodinámica para conocer el impacto de dicha terapéutica.
Resultados: Se detectó un estado franco de hipertonía simpática en el grupo de hipertensión pulmonar, sobre todo en los pacientes con hipertensión pulmonar primaria. El efecto de Treprostinil fue claramente asociado con disminución del tono simpático y un aumento de la capacidad física.
Conclusiones: Los pacientes con hipertensión arterial pulmonar, cursan con equilibrio simpático–vagal alterado sobre todo durante el día. Hay pérdida del ritmo circadiano. Dichos trastornos pueden ser reversibles con la aplicación de treprostinil. El equilibrio simpático–vagal de la frecuencia cardiaca es un instrumento no invasivo que permite estratificar mejor al paciente con hipertensión arterial pulmonar grave.
Palabras Clave: Hipertensión arterial pulmonar, supervivencia, treprostinil, ensayo clínico controlado
Summary
Background: A reduction of heart rate variability (HRV) is currently considered an independent risk factor for morbidity, mortality and severity of several cardiac disease, however, the dynamic sympathovagal modulation on HR V during 24 hr in primary pulmonary hypertension (PPH) had not been described.
Methods: 24 hr Holter monitoring (HM) were recorded in 32 patients (mean age 34, +/–12, 90% female) with severe primary pulmonary hypertension (mean pulmonary pressure, 9O :t: 12mm Hg), and in 34 patients (mean age 36 +/–14, 60% female) with Eisenmenger syndrome (ES) secondary to septal ventricular defect or atent duc tus arteriosus. A control group (n=44) paired for age, gender and arterial pulmonary pressure was included. HR V time and spectral parameters (mean, SDNN, SDANN, rMSSD, PNN50, LF, HF and LF/HF ratio) were analyzed during three periods: 24 hr; day (8–22:00), night (23–07:00) and also every hour of recording at 5 min–intervals). After detection of sympatho–vagal balance 15 patients were randomized, Treprostinil (prostaglandin) was administered to 6 patients and subcutaneous placebo to 9.
Results: HRV frequency parameters during 24 hr HM were significantly different among groups. LF/HF (day) 5.9:1:12.5:1:1P.001 and LF/ HF night)2.8:t1vs.1.5:1:.8.034. Sympathovagal modulation on 24hr HRV showed that heart rate circadian rhythm is clearly altered in both PPH and ES, but the sympathetic tone in PPH is higher at l 24hr. (p<. 05), after administering treprostinil a recovery of sympathovagal balance was observed.
Conclusions: A utonomic cardiac disturbance is clearly present in PPH and ES. The circadian rhythm of HRV is first lost due to an increase of sympathetic tone. These changes may be markers of autonomic disbalance that favor the development of arrhythmias and sudden death. The sympathovagal balance in PPH could be considered an important risk marker.
Key words: Heart rate variability, cardiac disease, sympathovagal modulation, risk markers
Introducción
Las enfermedades cardiovasculares ocupan el primer lugar en morbilidad y mortalidad de la población adulta del mundo.1 Después de la hipertensión arterial sistémica, la hipertensión arterial pulmonar (HAP) es la manifestación hemodinámica más común de afección en el sistema cardiovascular.2 Sin embargo, su presencia, independientemente de su causa –primaria o secundaria–, establece un pronóstico mucho más deletéreo a corto, mediano y largo plazo.3–7 Es una enfermedad cuyos mecanismos fisiopatológicos y etiopatogénicos no están completamente aclarados.8–10 Aunque, en general, hay acuerdo en que el pronóstico de supervivencia está claramente asociado a la velocidad de su instalación, su causa –primaria o secundaria–, su mantenimiento, progresión y magnitud y reversibilidad del daño vascular, así como a su capacidad de respuesta al tratamiento establecido; la vía final común de muerte para el caso de la hipertensión pulmonar primaria, es el desarrollo de insuficiencia ventricular derecha, con o sin arritmias letales que frecuentemente se asocian.11–13
En contraste, la insuficiencia cardiaca derecha, cuando se debe a problemas secundarios (afección valvular reumática o claudicación moderada del ventrículo izquierdo) es "mejor" tolerada que cuando se debe a hipertensión pulmonar primaria, sin embargo su manejo representa todo un reto para el clínico.
Así, la insuficiencia cardiaca derecha es la tercera causa de hospitalización en hospitales de concentración de la especialidad y la cuarta en hospitales generales de segundo nivel.14 En general, para cuando un paciente con enfermedad vascular pulmonar desarrolla síntomas, su calidad de vida y clase funcional se deterioran progresiva y rápidamente, siendo motivo frecuente de invalidez.15–18 Debido a que su compensación requiere de estancias hospitalaria prolongadas y la recidiva aún con tratamiento es elevada, su impacto económico–social es devastador.
La mediana de supervivencia una vez que se establece el diagnóstico de HAP primaria es menor a tres años y tan sólo el 34% alcanza los 5 años de sobrevida.19–20 Aún cuando los avances en el conocimiento de los posibles mecanismos que detonan y perpetúan el desarrollo de esta entidad han permitido el florecimiento de nuevos fármacos capaces de modificar la historia natural y calidad de vida de dichos enfermos, su impacto epidemiológico es apenas perceptible. El trasplante cardio–pulmonar dista con mucho de ser la mejor alternativa terapéutica y en México es aún anecdótico.
Sin embargo, la pregunta clave hoy día es: ¿por qué algunos pacientes incluso con la misma gravedad en el perfil hemodinámico, tiempo de evolución, etiología, etc., desarrollan insuficiencia ventricular derecha y otros no?, su respuesta posiblemente dilucidará los mecanismos adaptativos contra reguladores que desplieguen nuevas alternativas terapéuticas, tal vez más prometedoras que el propio trasplante cardiopulmonar. Múltiples mecanismos han sido implicados, y nuevas evidencias señalan una posible red de interacciones múltiples, más que un solo factor. Más recientemente nuestro grupo de trabajo se ha enfocado al posible papel del sistema nervioso autónomo en la fisiopatología de esta entidad.21 Más allá de ser un simple marcador de riesgo cardiovascular, nuestra hipótesis es que el Sistema Nervioso Autónomo, bajo ciertas circunstancias puede pasar de ser un mecanismo de adaptación neurocardiovascular o un mecanismo nocivo y de progresión de daño tisular en HAP, como también ha sido sugerido por algunos autores.
El estudio de la modulación simpático–vagal de la frecuencia cardiaca y su ritmo circadiano, ha demostrado de manera congruente ser un marcador de riesgo independiente en patología que afecta la función ventricular izquierda,22–31 sin embargo, en nuestro conocimiento, sus implicaciones en HAP primaria no ha sido estudiada. Su estudio, podría ayudarnos a comprender mejor los mecanismos de daño a órgano blanco (e.g., denervación ventricular regional adquirida en HAP) o incluso, como un monitor práctico y no invasivo, de estratificación pronóstica de supervivencia y respuesta al tratamiento establecido.
El impacto de la terapéutica con Eproprostenol (Prostaciclina) y sus análogos ha sido recientemente identificado.32–42 Sin embargo, su relación con la modulación autonómica circadiana de la variabilidad de la frecuencia cardiaca no ha sido informada.
El presente trabajo se dividió en dos fases; Fase A, estudio exploratorio para: i) conocer el perfil de variación del ritmo circadiano de la modulación autonómica simpático–vagal de la variabilidad de la frecuencia cardiaca, tanto en el ámbito del tiempo como en el ámbito de frecuencias, en pacientes con hipertensión arterial pulmonar; y ii) su posible asociación con el perfil clínico, ecocardiográfico y hemodinámico. Fase B, definir si el estudio de la variabilidad de la frecuencia cardiaca es de utilidad pronóstica y de respuesta al tratamiento con Prostaciclina de aplicación subcutánea.
Material y métodos
Selección de Pacientes
Fase A
Se incluyeron pacientes de ambos sexos con: Diagnóstico establecido de hipertensión arterial pulmonar definida por la Organización Mundial de la Salud como aquella elevación de la presión arterial pulmonar sistólica en reposo superior a 25 mmHg ó 30 mmHg en ejercicio. En esta clasificación de HAP se incluye a: 1) Hipertensión arterial pulmonar primaria; (a) esporádica y (b) familiar; y 2) Hipertensión arterial pulmonar relacionada a: (a) enfermedad de la colágena, (b) cardiopatía congénita con Qp/Qs invertido (Eisenmenger), hipertensión portal, infección por HIV, drogas/toxinas (e.g. anorexigénicos), hipertensión pulmonar persistente del recién nacido. Se incluyeron los siguientes estudios: Cateterismo cardiaco completo; ecocardiograma reciente; capacidad física para realizar la prueba de caminata de 6 minutos con el protocolo internacional; consentimiento informado; tolerancia al decúbito; ritmo sinusal. Se excluyeron pacientes con factores de comorbilidad o defectos asociados que pudieran influir en la supervivencia o clase funcional del paciente, tales como cáncer, afección renal, pulmonar, hepática o ventricular izquierda.
Protocolo de estudio
Todos los pacientes fueron sometidos a historia clínica completa, exámenes de laboratorio que incluyeron, biometría hemática completa, química sanguínea, examen general de orina, pruebas de coagulación y funcionamiento hepático, perfil de lípidos y capacidad física evaluada mediante caminata supervisada. Además, todos los pacientes fueron sometidos a estudio de ecocardiografía transtorácica (o transesofágica si la ventana percutánea fue deficiente) y, a estudio de cateterismo cardiaco derecho completo, con medición de volúmenes de saturación y presión en mmHg en cavidades. El gasto cardiaco fue determinado por termodilución (promedio de tres determinaciones) y por el método de Fick. Todos los pacientes fueron seguidos por al menos un año.
Estudio de variabilidad de frecuencia cardiaca
Todos los pacientes fueron sometidos a estudio de variabilidad de la frecuencia cardiaca mediante ECG ambulatorio de 24 h utilizando equipo comercial estandarizado (Model 109, Del Mar Avionics, Inc., Palo Alto, California). Se colocaron siete electrodos de alta sensibilidad (central de cloruro de plata). La técnica de preparación dérmica fue la recomendada de forma internacional.43 El registro de la señal de ECG se realizó en derivaciones estándar (V1, V4, V6), por 24 h continuas. El paciente fue instruido a realizar sus actividades diarias normales. La captura de la señal se hizo mediante tarjeta de formato digital. La edición y estudio del análisis de variabilidad de la frecuencia cardiaca se hizo al registro completo de 24 h y en periodos de 5 minutos cada hora. Para fines de comparación se dividió las horas de registro en: i) Día, de las 8:00 am a las 21:00 h; ii) Noche, de las 22:00 h a las 7:00 am; iii) Mañana, de las 8:00 am a las 12:00 h; Tarde, de las 15:00 h a las 21:00 h. El editor de las señales desconoció el diagnóstico y perfil clínico de cada paciente estudiado. Fueron seleccionados 40 sujetos control con edad y sexo similar a los pacientes con HAP para fines de comparación de modulación autonómica.
Análisis de tiempo de la variabilidad de la frecuencia cardiaca
Los índices utilizados para el análisis de la variabilidad de la frecuencia cardiaca en el dominio del tiempo fueron: El promedio de la duración del intervalo R–R; la desviación estándar de los R–R (SDNN); la raíz cuadrada de las medias cuadráticas de las diferencias latido a latido (rMSSD); el número de latidos que difirieron en más de 50 milisegundos de latido a latido (NN50) y su porcentaje del total de latidos registrados (PNN50%).
Análisis espectral de la variabilidad de la frecuencia cardiaca
Los procedimientos para determinar el análisis de la potencia espectral de los intervalos R–R fueron los recomendados por el consenso internacional,43 en resumen, nosotros utilizamos el análisis computado utilizando la Transformada de Fourier para generar la potencia de densidad espectral y así, analizar los componentes de baja frecuencia (BF) ubicados en la banda de 0.05 a 0.15 Hz, y los componentes de alta frecuencia (AF) ubicados en la banda entre 0.15 y 0.40 Hz. La relación BF/AF fue calculada como un índice de balance simpático–vagal.
Fase B
Toda vez que fue identificado el patrón circadiano de variabilidad de frecuencia cardiaca de los pacientes con HAP incluidos en la fase A, fueron seleccionados pacientes (n=15) con diagnóstico reciente (< 1 año) de HAP. En esta fase, los pacientes fueron seleccionados al azar para recibir: 1). Treprostinil por vía subcutánea a dosis inicial de 1.25 Ig/kg/min o bien, 2).– Placebo por vía subcutánea. Debido a que, los informes internacionales comprobaron y a que nuestro propio estudio, mostró que, los pacientes con treprostinil incrementaban su calidad y esperanza de vida, todos los pacientes incluidos en el grupo placebo fueron cruzados a grupo de treprostinil a los tres meses de haber iniciado el protocolo. Todos los pacientes, fueron sometidos a estudio circadiano de la variabilidad de la frecuencia cardiaca de forma simultanea o a los ± 1 días del estudio basal de cateterismo y a los 3 meses. Los pacientes incluidos fueron sometidos a un nuevo cateterismo a los tres meses, como se muestra en el diagrama de la Figura 1.
Análisis de datos
Basados en la literatura médica, se conoce que la varianza de la variabilidad esperada de la frecuencia cardiaca en el sujeto normal, en un registro de 24 h es de al menos 20 unidades. Así, para demostrar diferencias clínicamente significativas con una potencia del 80% y un error alfa del 0.05, con una delta de 25 % de diferencia en la variabilidad (> 5 unidades) entre pacientes con HAP y controles sin evidencia de enfermedad cardiovascular, pareados para edad y sexo, se obtiene que 13 pacientes por grupo –más 20% de posibles pérdidas–, es decir al menos 15 pacientes por grupo, fue suficiente para los propósitos del presente estudio. Las variables continuas se presentan en media ± desviación estándar o mediana con cuartiles 1 y 3 según correspondiera. Las variables categóricas se presentan en frecuencias y proporciones. Para comparación entre grupos independientes se utilizó la prueba t de Student, o bien su correspondiente no paramétrica, U Mann y Whitney, según el caso. Para comparaciones antes y después se utilizó la prueba t de Student pareada o prueba de Wilcoxon. Para el análisis de registros subsecuentes de variabilidad cada hora se utilizó el método de ANOVA para muestras repetidas de una y dos vías.44 Modelos de regresión y correlación se utilizaron para identificar posibles tendencias de asociación. Los parámetros de análisis de variabilidad de frecuencia cardiaca fueron los recomendados por el consenso internacional.43 Para el análisis en el ámbito de frecuencias se utilizó el método de transformación de Fourier. Para el análisis de bajas y altas frecuencias se utilizó el método normalizado. Para el análisis del efecto farmacológico se comparó las medias de las diferencias de respuesta del grupo placebo vs. grupo control. Modelos de regresión múltiple fueron aplicados para la identificación de los parámetros asociados a la respuesta autonómica hemodinámica y clínica. Una p menor de 0.05 fue considerada como nivel mínimo para significancia estadística.
Resultados
Debido a la factibilidad del estudio, nosotros incluimos para la fase A, a 34 pacientes con hipertensión arterial pulmonar primaria, 32 pacientes con HAP relacionada a cardiopatía congénita (Eisenmenger) y 40 sujetos control pareados por edad y sexo, para identificar el comportamiento circadiano de la variabilidad de la frecuencia cardiaca. Las características demográficas de la población de estudio se muestra en cuadro I.
La edad promedio para el grupo de HAP (primaria y Eisenmenger), fue de 33.7 ± 7.2 años, muy similar a la del grupo control. No se observaron diferencias clínicas, demográficas ni hemodinámicas entre los grupos de HAP, con excepción del nivel de hemoglobina que fue más elevado en el grupo de Eisenmenger. A pesar de tener perfiles hemodinámicos similares en uno y otro grupos de HAP (Primaria y Eisenmenger) mostraron francas diferencias con el grupo control. El promedio de duración del intervalo R–R fue similar en todos los grupos (779, 765 y 779 para el grupo control, HAPP y Eisenmenger, p= NS). La desviación estándar de las diferencias latido a latido (SDNN) fue reducida en los grupos de HAP en comparación con el grupo control. Esta diferencia también fue significativa para RMSSD, PNN50, COVAR y SDANN, entre el grupo control y los grupos de HAP, sin embargo, no entre los grupos de HAP. (Cuadro II).
La modulación autonómica simpática de la variabilidad de la frecuencia cardiaca medida a través de la relación BF/ AF del análisis espectral fue notoriamente incrementada durante el día en el grupo de HAP primaria, comparada con el grupo control y el grupo de Eisenmenger. Durante la Noche el efecto de la actividad simpática no cesó en el grupo de HAP primaria. El comportamiento circadiano de la VFC en los grupos de estudio se muestra en la figura 2. Fue notable que los grupos de HAP desarrollan paroxismos de actividad simpática en el día, mientras que, durante la noche continúan con estado hiperadrenérgico.
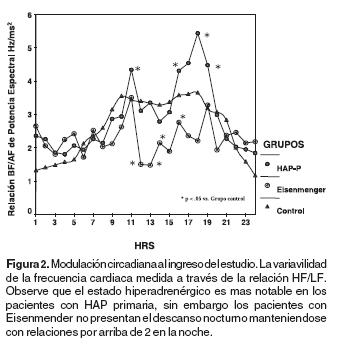
Fase B
Quince pacientes con HAP de menos de un año de evolución fueron seleccionados para participar en la segunda fase del estudio que fue la aplicación de treprostinil por vía subcutánea vs el grupo placebo. Las características generales de los pacientes se muestran en el cuadro III. No se detectaron diferencias en el perfil demográfico y hemodinámico de uno y otro grupos. Sólo hubo tres hombres quienes por azar quedaron incluidos en el grupo de tratamiento. A los tres meses de iniciado nuestro protocolo los informes internacionales y nuestros propios resultados obligaron a suspender el brazo del grupo placebo y todos los pacientes fueron incluidos en treprostinil. Así, el estudio de modulación autonómica también fue realizado en el grupo placebo a los tres meses de haber iniciado treprostinil.

El análisis de los componentes de la variabilidad de la frecuencia cardiaca mostrado en el cuadro IV, muestra que el comportamiento de la misma fue de predominio en el tono simpático, con gran actividad matutina y vespertina sin diferencias entre los grupos placebo y de treprostinil (p=NS).
Impacto de treprostinil en la modulación autonómica de la VFC
De manera notable, los cambios en la modulación autonómica se observaron en el ritmo circadiano. Así, el comportamiento en el dominio del tiempo fue prácticamente imperceptible (Cuadro V). Sin embargo, el análisis de la potencia espectral en términos del balance simpático–vagal medido a través de la relación banda baja y alta (BF/AF) mostró disminución significativa en todo el día. (Figura 3).
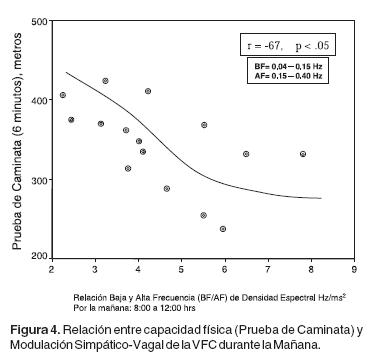
Además, la relación inversamente proporcional entre la severidad de la modulación simpática y la limitación física de caminata (Figura 4), es completamente revertida e incluso se vuelve correlación positiva a los tres meses de tratamiento (Figura 5).

Impacto de treprostinil en el perfil hemodinámico y clínico
Después de tres meses de aplicación subcutánea de treprostinil, su impacto fue registrado en dos de los principales marcadores del perfil hemodinámico, el gasto cardiaco y la presión de la aurícula derecha. (Cuadro VI) El impacto del tratamiento medido a través de la delta efectiva de las diferencias entre los grupos muestra una ganancia neta de más de un litro en el gasto cardiaco (1.57 L/min), una reducción de más de 5 mmHg en la presión del atrio derecho, y una mejoría de la saturación venosa mixta, reflejo de la mejoría en el gasto cardiaco. Sin embargo, no hubo modificación en la presión media de la arteria pulmonar en ambos grupos. Debido a que el cateterismo cardiaco fue siempre realizado por la mañana, se correlacionaron los valores de la modulación autonómica de la frecuencia cardiaca en la mañana y sólo se observó tendencia de asociación con gasto cardiaco y presión de atrio derecho sin alcanzar la significancia.
Limitaciones
El número de pacientes de la fase B, permite realizar estimaciones apropiadas de la modulación autonómica de la variabilidad de la frecuencia cardiaca, sin embargo el perfil hemodinámico es difícil de correlacionar por el tamaño de la muestra. Además, los pacientes del grupo placebo fueron cateterizados a los tres meses justo cuando se decidió cambiar a todos los pacientes al brazo de treprostinil, pero lamentablemente no fueron nuevamente cateterizados a los tres meses después de iniciar treprostinil, pues se consideró no ético. No obstante el comportamiento con el resto de los pacientes permitió demostrar un efecto contundente del treprostinil, sobre la capacidad física. Así, al final la comparación de los 15 pacientes antes y después de treprostinil permitió demostrar de forma contundente la mejoría de la modulación autonómica de la variabilidad de la frecuencia cardiaca.
Discusión
Tradicionalmente el estudio de la variabilidad de la frecuencia cardiaca como marcador de riesgo cardiovascular para morbilidad y mortalidad fue demostrada utilizando modelos humanos de patología predominantemente del ventrículo izquierdo (Miocardiopatía dilatada, Chagas, cardiopatía isquémica, estenosis aórtica y otras). En todas ha demostrado su utilidad como marcador de riesgo independiente.23–27 Más recientemente el papel del sistema nervioso autónomo como modulador de progresión del daño tisular en enfermedades como hipertensión arterial sistémica y diabetes, ha vuelto a atraer el interés por el estudio de la variabilidad de la frecuencia cardiaca. A pesar de los grandes avances al respecto, el estudio de la modulación autonómica en patología que afecta predominantemente a las cavidades derechas ha sido rezagado. En nuestro conocimiento no existían estudios enfocados al impacto de la variabilidad de la frecuencia cardiaca en pacientes con hipertensión arterial pulmonar. Sorpresivamente, se detectó un estado hiperadrenérgico de comportamiento circadiano muy peculiar. Así, hacia el medio día, el paciente con hipertensión arterial pulmonar primaria, eleva de forma significativa su índice de relación de potencia espectral de bandas baja y alta (BF/AF) con cifras muy por arriba de las detectadas en los sujetos control. Coincide que son las horas en que el paciente inicia su actividad física. Después del medio día hay una atenuación de la elevación del índice BF/AF, para volver a elevarse hacia la tarde y posteriormente caer a cifras cercanas a 2 unidades, sin embargo su descenso nocturno no es tan evidente como ocurre con el paciente control. Lo anterior traduce un estado hiperadrenérgico o de modulación simpática bastante incrementado. La demostración en estudios previos, de que durante el ejercicio el paciente con HAP desarrolla caída del gasto cardiaco y por ende un estado de estrés hemodinámico, apoya nuestra hipótesis de que un factor hemodinámico puede ser el detonante del estado hiperadrenérgico. Además cuando se correlacionó la capacidad física medida por la prueba estandarizada de seis minutos, se demostró una clara relación inversamente proporcional de los metros caminata y el estado de equilibrio simpático.
Ahora bien, cuando el paciente con HAP fue sometido a tratamiento con prostaglandina (Treprostinil), hubo claros cambios en la hemodinámica, capacidad física y estado de modulación simpático–vagal.
Pese a nuestros hallazgos, algunas observaciones deben hacernos reflexionar. El no haber encontrado de manera directa una relación entre el grado de recuperación del gasto y el descenso en la relación BF/AF, puede deberse al tamaño de muestra, pero también puede deberse a que existen otros mecanismos inducidos por prostaglandina, capaces de modular la actividad autonómica. La franca decapitación de la actividad simpática en las horas de la mañana y tarde después de la aplicación de treprostinil es de tal magnitud que hace difícil pensar que sólo se deba a efecto hemodinámico. Además, la capacidad física recuperada tampoco puede explicarse por las modificaciones hemodinámicas. Suponemos que los cambios en la modulación autonómica participan de alguna forma en la recuperación de la capacidad física, como ha sido plenamente demostrado para los casos de insuficiencia cardiaca izquierda.
Se requieren nuevos estudios de seguimiento para evaluar el impacto pronóstico del estudio de la modulación de la VFC en pacientes con hipertensión arterial pulmonar sometidos a tratamiento.
Conclusiones
La modulación simpático–vagal en pacientes con hipertensión arterial pulmonar se encuentra alterada. El desequilibrio es mejor apreciado en el estudio circadiano. El análisis en el ámbito del tiempo de periodos prolongados enmascara la grave disfunción autonómica. La relación BF/AF, en periodos de tiempo divididos durante el día permite detectar elevaciones abrutas del tono simpático en pacientes con hipertensión arterial pulmonar primaria. Aunque el estado de modulación simpática se encuentra en menor grado alterado en pacientes con HAP secundaria a defectos congénitos, esto puede ser secundario a fenómenos de hiporeactividad autonómica, como se ha sugerido recientemente mediante estudios con radio trazador. El análisis circadiano de la modulación autonómica se correlacionó con la capacidad física y con la respuesta a la intervención terapéutica con prostaglandina. El registro de la modulación simpático–vagal de la variabilidad de la frecuencia cardiaca tiene implicaciones clínicas y posiblemente pronósticas en pacientes con hipertensión arterial pulmonar. Nuestro estudio sugiere que dicho estudio no invasivo debe practicarse en todo paciente con HAP. Se requieren más estudios para dilucidar el impacto de la sobre estimulación adrenérgica detectada en el paciente con HAP.
Agradecimientos
Este estudio se realizó con apoyo de CONACyT, proyecto 1998 (responsable, Fause Attie.) Los autores agradecen al Instituto Nacional de Cardiología su apoyo incondicional para la realización de este trabajo, así como al personal de enfermería y a los pacientes quien con su ayuda hicieron posible este estudio.
Referencias
1. Cohen MC, Rohtla KM, Lavery CE, Muller JE, Mittleman MA. Metaanalysis of the morning excess of acute myocardial infarction and sudden cardiac death. Am J Cardiol 1997; 79:1512–6. [ Links ]
2. Lee KL, Woodlief LH, Topol EJ, et al. Predictors of 30–day mortality in the era of reperfusion for acute myocardial infarction: results from international trial of 41021 patients. Circulation. 1995; 91:1659–1668. [ Links ]
3. D'Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension. Results from national prospective registry. Ann Intern Med 1991; 115:343–9. [ Links ]
4. Rich S. Executive summary from the world symposium primary pulmonary hypertension 1998. <http:// www.who.int/ncd/cvd/pph.htm> 1998. [ Links ]
5. Miyamoto S, Nagaya N, Satoh T, et al. Clinical correlates and prognostic significance of six–minute walk test patients with primary pulmonary hypertension. Comparison with cardiopulmonary exercise testing. Am J Respir Crit Care Med 2000;161:487–92. [ Links ]
6. Singh SJ, Morgan MD, Scott S, et al. Development of shuttle walking test of disability in patients with chronic airways obstruction. Thorax 1992;47:1019–24. [ Links ]
7. Yock P, Popp R. Noninvasive estimation of right ventricular systolic pressure by Doppler ultrasound in patients with tricuspid regurgitation. Circulation 1994; 70:657. [ Links ]
8. Gurtner HP. Aminorex and pulmonary hypertension. Review. Cor Vasa 1985; 27:160–71. [ Links ]
9. Langleben D. Familial primary pulmonary hypertension. Chest 1994; 105:13S–16S. [ Links ]
10. Loyd JE, Primm RK, Newman JH. Familial primary pulmonary hypertension: clinical patterns. Am Rev Respir Dis 1984;129:194–197. [ Links ]
11. Rubin LJ. Primary pulmonary hypertension. N Engl J Med 1997; 336:111–7. [ Links ]
12. Fuster V, Steele PM, Edwards WD, et al. Primary pulmonary hypertension: natural history and the importance of thrombosis. Circulation 1984; 70:580–7. [ Links ]
13. Kanemoto N. Natural history of pulmonary hemodynamics in primary pulmonary hypertension. Am Heart J 1987; 114:407–13. [ Links ]
14. Rector TS, Cohn JN. Prognosis in congestive heart failure. Ann Rev Med. 1994; 45:341–350. [ Links ]
15. The primary pulmonary hypertension study group. N Engl J Med 1996; 334:296–302. [ Links ]
16. Ravy O, Azarian R, Brenot F, et al. Clinical significance the pulmonary vasodilator response during short–term infusion of prostacyclin in primary pulmonary hypertension. Circulation 1996; 93:484–8. [ Links ]
17. Altman R, Scazziota A, Rouvier J, et al. Coagulation and fibrinolytic parameters in patients with pulmonary hypertension. Clin Cardiol 1996; 19:549–54. [ Links ]
18. Welsh CH, Hassell KL, Badesch DB, et al. Coagulation and fibrinolytic profiles in patients with severe pulmonary hypertension. Chest 1996; 110:710–7. [ Links ]
19. D'Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension. Results from national prospective registry. Ann Intern Med 1991 ;115:343–9. [ Links ]
20. Miyamoto S, Nagaya N, Satoh T, et al. Clinical correlates and prognostic significance of six–minute walk test patients with primary pulmonary hypertension. Comparison with cardiopulmonary exercise testing. Am J Respir Crit Care Med 2000; 161:487–92. [ Links ]
21. Singh RB, Cronélisen G, Weydhal A, et al. Circadian heart rate and blood pressure variability considered for research and patient care. Int J Cardiol 2003; 87:9–28. [ Links ]
22. Vaidya AB, Bhatt MA. Chronobiology of ischemic heart disease events: relevance of ancient insights in human lifestyle. J Assoc Phys India 1999; 47:629–30. [ Links ]
23. Mehta SR, Das S, Karloopia SD, Mathur P, Dham SK, Raghunathan D. The circadian pattern of ischemic heart disease in Indian population. J Assoc Phys India 1998; 46:767–77. [ Links ]
24. Pell S, D'Allonzo CA. Acute myocardial infarction in a large industrial population. J Am Med Assoc 1963; 185:831–8. [ Links ]
25. Smolensky M, Halberg F, Sargent F. II: Chronobiology of the life sequence. In: Itoh S, Ogata K, Yoshimura H, editors, Advances in climatic physiology, Tokyo: Igaku Shoin, 1972, pp. 281–318. [ Links ]
26. Reinberg A, Gervais P, Halberg F et al. Mortalite des adultes: rythmes circadiens et circannuels dans un hôpital parisien et en ' France. Nouv Presse Med 1973;2:289–94. [ Links ]
27. Wennerblom B, Lurje L, Karsson T, Tygesen H, Vahisalo R, Hjamarson A. Circadian variation of heart rate variability and the rate of autonomic change in the morning hours in healthy subjects and angina patients. Int J Cardiol 2001; 79:61–9. [ Links ]
28. Churisna SK, Ganelina IE. On the distribution of incidence of acute myocardial infarction within a 24–hour period. Kardiologia 1975; 15:115–8. [ Links ]
29. Christ M, Seyffart K, Wehling M. Attenuation of heart rate variability in postmenopausal women on progestin containing hormone replacement therapy. Lancet 1999; 353:1939–40. [ Links ]
30. La Rovere MT, Bigger Jr. JT, Marcus FI et al. Baroreflex sensitivity and heart–rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) Investigators. Lancet 1998; 351:478–84. [ Links ]
31. Bigger Jr. JT, Fleish JL, Steinman RC, Rolnitzsky LM, Kleiger RE, Rottman JN. Frequency domain measures of heart period variability and mortality after myocardial infarction. Circulation 1992; 85:164–71. [ Links ]
32. Rich S, McLaughlin V. The effects of chronic prostacyclin therapy for primary pulmonary hypertension. J AmColl Cardiol. 1999; 34:1184–1187. [ Links ]
33. Barst R, Rubin L, Long W, et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med. 1996; 334:296–301. [ Links ]
34. McLaughlin V, Genthner D, Panella M, et al. Reduction in pulmonary vascular resistance with long–term epoprostenol (prostacyclin) therapy primary pulmonary hypertension. N Engl J Med. 1998; 338:273–277. [ Links ]
35. Sandoval J, Bauerle O, Palomar A, et al. Survival in primary pulmonary hypertension: validation of a prognostic equation. Circulation. 1994; 89:1733–1744. [ Links ]
36. Uretsky BF, Jesup M, Konstam MA, et al. Multicenter trial of oral enoximone in patients with moderate to moderately severe congestive heart failure: lack of benefit compared to placebo. Enoximone Multicenter Trial Group. Circulation. 1990; 82:774–780. [ Links ]
37. Packer M, Carver JR, Rodenheffer RJ, et al for the PROMISE Study Research Group. Effect of oral milrinone on mortality in severe chronic heart failure. N Engl J Med. 1991; 325:468–475. [ Links ]
38. Feldman AM, Bristow MR, Parmley WW, et al. Effects of vesnarinone morbidity and mortality in patients with heart failure. N Engl J Med 1993; 329:149–155. [ Links ]
39. Cohn JN, Goldstein SO, Greenberg BH, et al. A dose–dependent increase in mortality with vesnarinone among patients with severe heart failure. N Engl J Med. 1998; 339:1810–1816. [ Links ]
40. Clapp LH, Finney P, Turcato S, et al. Differential effects of stable prostacyclin analogs on smooth muscle proliferation and cyclic AMP generation in human artery. Am J Respir Cell Mol Biol. 2002; 26:194–201. [ Links ]
41. Badesch D, Tapson V, McGoon, et al. Continuous intravenous epoprostenol for pulmonary hypertension due to the scleroderma spectrum disease. Ann Intern Med. 2000; 132:425–434. [ Links ]
42. Rosenzweig E, Kerstin D, Barst R. Long–term prostacyclin for pulmonary hypertension with associated congenital heart defects. Circulation. 1999; 99:1858–1865. [ Links ]
43. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability, standards of measurement, physiological interpretation and clinical use. Circulation 1996; 93:1043–65. [ Links ]
44. Bailar JC III, Mosteller F, eds. Medical uses of statistics. 2nd ed. Waltham, Mass.: NEJM Books, 1992; 261–9:281–291. [ Links ]














