Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.6 Ciudad de México nov./dic. 2005
Artículo original
Desarrollo de anticuerpos y frecuencia de eventos temporalmente asociados a las vacunas contra el sarampión y rubéola en personal de salud universitario de Jalisco
Antibody development and frequency of events temporarily with measles and rubella vaccines among university health personnel in Jalisco
Albert o Villaseñor–Sierra,ª* José Ignacio Santos–Preciado,b María Teresa Álvarez–y–Muñoz,c María Elena Rivas–García,d Francisco Martínez–Sandoval,e y Marco Antonio Falcón–Francoe
ª Hospital de Pediatría Centro Médico Nacional Occidente, Instituto Mexicano del Seguro Social, Guadalajara, Jal., México
b Hospital Infantil de México Federico Gómez, Instituto Nacional de Salud, México, D. F., México
c Unidad de Investigación Médica en Enfermedades Infecciosas y Parasitarias del Hospital de Pediatría Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, México, D.F., México
d Departamento de Salud Pública, Facultad de Medicina, Universidad Autónoma de Guadalajara, Guadalajara, Jal., México
e Universidad Autónoma de Guadalajara. Guadalajara, Jal., México
*Correspondencia y solicitud de sobretiros.
Dr. Alberto Villaseñor–Sierra.
Dirección de Educación e Investigación en Salud. UMAE. Hospital de Pediatría del Centro Médico de Occidente, Instituto Mexicano del Seguro Social.
Belisario Domínguez 735, Col. Independencia,
44340 Guadalajara, Jalisco. México.
Tel: (33) 3668–3000 ext. 31664. Fax: (33) 3618–8618.
Correo electrónico: avillase@prodigy.net.mx
Recibido en su versión modificada: 28 de febrero de 2005
Aceptado: 4 de marzo de 2005
Resumen
Objetivo: Evaluar el estado inmune y la seroconversión o respuesta anamnésica posterior a inmunización con vacuna de sarampión–rubéola (SR) y eventos temporalmente asociados, en personal de salud universitario.
Materiales y métodos: Estudio prospectivo, longitudinal y comparativo de mayo a junio de 2000 en 120 adultos sanos de un Hospital de la Universidad Autónoma de Guadalajara. Previo consentimiento informado se aplicó la vacuna SR de sarampión (Schwarz) y rubéola (RA 27/3). Se realizó seguimiento telefónico semanal para identificar eventos locales y sistémicos temporalmente asociados a la vacunación (30 días posteriores a su aplicación, no atribuibles a otro proceso mórbido). Se tomó suero antes y seis semanas después de la vacunación. Los anticuerpos (IgG) contra sarampión y rubéola fueron cuantificados por análisis inmunoenzimático (Enzygnost®, Dade Behring) con puntos de corte de > 300mUI/mL y > 8UI/mL, respectivamente. Análisis: media, desviación estándar (DS), Prueba t de Student pareada (significancia de P < 0.05).
Resultados: Se logró seguimiento en 105/120 (87.5%) durante seis semanas. El 87.4% fue personal de salud y 44.6% varones. Rango de edad 17–71 años (mediana = 21). En la historia clínica hubo antecedente de posible sarampión en 57.1%. Se obtuvo suero pareado en 75 casos. La proporción de voluntarios con anticuerpos para sarampión y rubéola antes (90.7 y 94.7%) y después (100 y 100%) de la vacuna se incrementó de manera significativa (P < 0.001). Dolor, calor, rubor e induración en el sitio de inyección se presentó en 4/105 (~4%). Fiebre, exantema, artralgias y artritis en 9/105 (~9%).
Conclusiones: La proporción de susceptibles a sarampión fue alta si tomamos en consideración la potencialidad de transmisión del virus de sarampión a la población que atenderían durante el período de contagiosidad (3–5 días). La respuesta de inmunidad postvacunal fue óptima. La vacunación en personal de salud debe ser prioritaria.
Palabras clave: Sarampión y rubéola, vacuna, desarrollo de anticuerpos, personal de salud
Summary
Objective: To evaluate the seroprevalence, seroconversion, anamnesic response and events temporally associated with immune status pre and post immunization with measles and rubella vaccine in health personnel from a public University in Guadalajara, Mexico.
Material and methods: We carried out a prospective, longitudinal and comparative study from May to June 2000 among 120 healthy volunteers. Informed consent was obtained from all participants. We administered measles (Schwarz) and rubella (RA 27/3) vaccines. Weekly phone calls during six weeks were recorded from each volunteer to assess local and systemic events temporally associated with immunization non attributable to any other disease. Serum samples were obtained before and after vaccination in 75 volunteers. Antibodies against measles and rubella were measured by an enzyme immunoassay kit (Behring) with cut–off points of 3300mUI/mL and 38UI/mL respectively. Statistical analysis included mean, standard deviation and paired Student's t–test (P < 0.05).
Results: 105/120 participants (87.5%) were followed during 6 weeks. 87.4% were health personnel and 44.6% were males. The age range was 17–71 years (median = 21). We found a prior history of measles in 57.1%. Local events included pain, heat, redness and induration and were reported by 4/105. Systemic events such as fever, exanthema, pain in joints and arthritis was reported by 9/105. The proportion of study subjects with protective antibodies against measles and rubella prior to vaccination was 90.7 and 94.7% respectively. Both groups reached 100% after vaccination.
Conclusions: The proportion of non–immune health personnel was low and similar to other reports. However, the potential spread of measles and rubella virus from a non–immunized infected health care provider could be amplified by the number of patients seen daily during the peak period of 3–5 days. The vaccination of health personnel should be encouraged.
Key words: Measles rubella, vaccine, antibody, induction, health personnel
Introducción
En todos los países de la región de las Américas, la erradicación del sarampión es un objetivo del sector salud. Acciones como la integración en una cohorte de los recién nacidos que recibirá diferentes vacunas en las edades adecuadas, incluyendo la del sarampión se establecerán de acuerdo a un esquema preestablecido. Aunque la cobertura de vacunación contra el sarampión alcanza el 80% en las Américas, persisten brotes aislados que indican la necesidad de reforzar y ampliar el esquema rutinario de vacunación y dirigirlo a grupos especialmente vulnerables.1 Algunos ejemplos de brotes son los informados en 1997 en São Paulo, Brasil2durante 1996 y 1997 que incluyó a 20,921 casos, 47% de los cuales fueron en personas de 20 a 29 años de edad, así como los brotes recientes en México en el 2003 y 2004, que afectaron a menores de 12 meses y adultos jóvenes. Los factores de riesgo identificados durante la epidemia de São Paulo fueron la carencia de la vacuna de sarampión, contacto con alguien con una enfermedad tipo sarampión en la casa o en el trabajo, o ser empleado de una institución semicerrada tal como una guardería, un asilo o una escuela.2 En su historia natural, la generación de los brotes está asociada a una ausencia de virus circulante en la comunidad por varios años, seguido por incremento en el número de niños o adultos susceptibles (por carencia de vacunación o por deficiente desarrollo de títulos de anticuerpos protectores post–vacunación) en la comunidad.3
En México, la vacuna contra el sarampión se empezó a aplicar en 1973 en todos los niños a los 9 meses de edad, y a partir de 1998 a niños de 1 año. Después de la epidemia durante 1989–1990, en 1991 se implementó una revacunación a preescolares. A partir de 1994 la cobertura de vacunación para sarampión en menores de 5 años era superior al 95%, con morbilidad, desde 1995 hasta el momento, de 85 casos. En 1995 se registraron sólo nueve casos y dos casos más en 1996. En el año 2000 se reintrodujo el virus del sarampión informándose 30 casos importados (la aparición del exantema fue en los primeros 18 días de su ingreso al país, y ausencia de posible transmisión local) de una cepa que estuvo en circulación en Europa. En el año 2001 se detectaron e informaron tres casos también importados (paciente con exposición al virus en Estados Unidos de Norteamérica).4 Durante 2003 se registraron dos brotes (en México, D. F. y en el Estado de México); uno entre los meses de abril y julio con 22 casos y el segundo entre los meses de julio y agosto con 21 casos.5 Hasta la semana 48 de 2004 se conocieron 64 casos más.6
La preocupación basada en la erradicación del virus en la mayoría de los países de América, y que por lo tanto ofrece un terreno fértil para la ocurrencia de brotes en toda la región, se celebró la "XIII Reunión del Grupo Técnico Asesor de la OPS Sobre Enfermedades Prevenibles por Vacunación" en Hull, Quebec, Canadá en abril de 1999; en donde se hicieron diversas recomendaciones para la prevención de epidemias dentro de las que se encuentran: 1) la vacunación de 95% de lactantes poco después del año de edad, 2) realizar campañas de revacunación cada 4 años, 3) vacunar a personas que trabajan en establecimientos de salud y que tengan contacto con niños y con enfermedades infecciosas, sin tomar en cuenta su historial de vacunación o antecedentes de haber tenido la enfermedad. Se recomendó que esta vacuna contenga también el virus atenuado de rubéola. Debemos enfa–tizar que la tercera recomendación se hizo basándose en que el personal de salud (en especial aquéllos nacidos antes de 1972) que no recibieron la vacuna y que pudieron no haber sufrido la enfermedad (inmunes) corren mayor riesgo de exposición al virus del sarampión y son fuente potencial de transmisión del virus a pacientes en establecimientos de atención a la salud.7
En México, la información del estado inmunológico, la respuesta inmune a la vacunación y la frecuencia de los eventos temporalmente asociados a inmunización en trabajadores de la salud es todavía escasa. En un estudio sobre la presencia de anticuerpos contra sarampión, determinados mediante análisis inmunoenzimático en una muestra representativa de 424 niños menores de 15 años de edad de Ciudad Netzahualcóyotl en el Estado de México, demostró que el 22.6% de los niños con aplicación de la vacuna (corroborado por cartilla) carecían de anticuerpos, siendo esta cifra mayor (50%) comparada con quienes no la habían recibido.8 Aunque se espera que el 95% de los niños inmunizados al año de edad desarrollen anticuerpos,9 un porcentaje pequeño puede perder la protección después de varios años.
Los eventos locales temporalmente asociados a la inmunización (dolor, calor, rubor y/o induración) han sido informados en el de 5 al 15%,10 mientras que los sistémicos ocurren con la siguiente frecuencia: fiebre (5–15%), exantema (15%), artralgias transitorias (0–25%), artritis transitoria (20%) y encefalitis (1 en 1'000,000 de vacunados).9
El objetivo del presente estudio fue la evaluación de las siguentes variables: 1) títulos basales de anticuerpos contra sarampión y rubéola previo a la aplicación de vacuna de sarampión y rubéola, 2) el desarrollo de anticuerpos contra el virus del sarampión y rubéola a las seis semanas posteriores de la aplicación de la vacuna, y 3) la frecuencia de presentación de eventos locales y sistémicos temporalmente asociados a la inmunización con las vacunas de sarampión y la rubéola en personal de salud de la Universidad Autónoma de Guadalajara (UAG).
Material y métodos
El presente estudio fue prospectivo, longitudinal y comparativo.
Universo de estudio. La UAG cuenta con una población en el área de Ciencias de la Salud (médicos, estudiantes de medicina, enfermeras, técnicos de laboratorio clínico y personal administrativo) de aproximadamente 2,500 personas. En este estudio fueron incluidos trabajadores y estudiantes previo consentimiento informado y que de manera voluntaria aceptaron recibir la aplicación de la vacuna contra sarampión y rubéola. Los sujetos con inmunodeficiencias conocidas o bajo tratamiento inmunosupresor, con antecedentes de alergia anafiláctica a las proteínas del huevo o a la neomicina, embarazo o el antecedente de haber recibido gammaglobulina o transfusión en los últimos tres meses no fueron incluidos en el estudio. Los sujetos en quienes no fue posible obtener la segunda muestra de suero a las seis semanas posteriores a la aplicación de la vacuna fueron excluidos.
Vacunas. Se utilizó la vacuna de sarampión–rubéola (SR) fabricada por Serum Institute of India. La vacuna contiene la cepa Schwarz de sarampión producida en fibroblastos de embrión de pollo con una eficacia de 95% en estudios controlados y > 85% en condiciones habituales. Además esta vacuna contiene la cepa RA 27/3 de rubéola producida en fibroblastos diploides humanos, con eficacia > 95% en estudios controlados y cercana a 90% en condiciones habituales. La vacuna fue aplicada por vía subcutánea en el área del deltoides.
Obtención de la muestra y determinación de anticuerpos. Las muestras de sangre fueron obtenidas del antebrazo y llevadas de inmediato al laboratorio para la separación del suero y congelación a –70 °C. A las seis semanas se obtuvo una segunda muestra y el suero fue conservado de la misma manera.
La determinación de anticuerpos tipo IgG se llevó a cabo por ensayo enzimático (Enzygnost®, Dade Behring) utilizando un espectrofotómetro Reader 210 (Organon, Teknika). Se incluyeron controles negativos y positivos. Para fines del análisis, los puntos de corte de los títulos de anticuerpos considerados como positivos para sarampión y rubéola fueron de > 300 mUI/mL y > 8 UI/mL, respectivamente. Estas mediciones fueron realizadas en el Laboratorio de la Unidad de Investigación Médica en Enfermedades Infecciosas y Parasitarias del Hospital de Pediatría, Centro Médico Nacional Siglo XXI del IMSS en México D.F.
Seguimiento. Cada sujeto que recibió la vacuna fue evaluado mediante seguimiento telefónico semanal durante un período de cuatro semanas para recabar información sobre la presencia de eventos adversos temporalmente asociados a la inmunización (definidos como aquellos signos y síntomas que se presentaron dentro de los 30 días posteriores a la administración de la vacuna y que no pudieron ser atribuidos a alguna otra entidad nosológica específica).
Análisis estadístico. Las variables sociodemográficas fueron analizadas mediante estadística descriptiva (frecuencias, media, mediana y desviación estándar). La comparación de los títulos de anticuerpos en muestras pareadas (antes y después de la vacunación) se llevó a cabo mediante el uso de la Prueba t de Student pareada, con un nivel de significancia de P < 0.05. Los eventos adversos temporalmente asociados a inmunización se expresó como porcentajes.
Resultados
Del 29 de mayo al 29 de junio de 2000, fueron incluidos 120 voluntarios con un rango de edad de 17 a 71 años (mediana = 21). De éstos, 50 (44.6%) fueron del sexo masculino. En relación con su condición laboral, 62 (55.9%) fueron estudiantes de medicina, 20 (18%) médicos, 14 (12.6%) administrativos y los 24 restantes (13.5%) fueron técnicos de laboratorio clínico y otros. Sólo 64 (57.1%) dijeron recordar haber tenido sarampión en alguna época de su vida. De los 120 voluntarios incluidos al inicio del estudio, 105 (87.5%) pudieron ser evaluados cada semana hasta el final del estudio.
Eventos locales temporalmente asociados a inmunización. Los eventos locales que en todos los casos se presentaron durante las semanas uno y dos de seguimiento fueron los siguientes: dolor (2.9 y 1.9%); calor (3.8 y 1.9%); rubor (3.8 y 1%) e induración (1.9 y 1.9%) (Figura 1).

Eventos sistémicos temporalmente asociados a inmunización. La frecuencia de presentación de eventos sistémicos también ocurrió durante las semanas uno y dos de seguimiento en los siguientes porcentajes: fiebre (8.6 y 1%); exantema (8.6 y 1 %); artralgias (7.6 y 2.9%) y artritis (1 y 1.9%). No hubo ningún caso con desarrollo de encefalitis. La fiebre y el exantema se presentaron de manera simultánea en un solo paciente (Figura 2).

Seroprevalencia y desarrollo de anticuerpos contra el virus del sarampión y de la rubéola. De los 105 voluntarios en los que pudo darse completo seguimiento durante las cuatro semanas, en 75 de ellos se obtuvieron muestras pareadas de suero antes y seis semanas después de la vacunación. El porcentaje de voluntarios con anticuerpos contra sarampión en el suero antes y después de la inmunización fue de 90.7 y 100%, respectivamente. El porcentaje de voluntarios con anticuerpos contra rubéola antes y después de su inmunización fue de 94.7 y 100%, respectivamente.
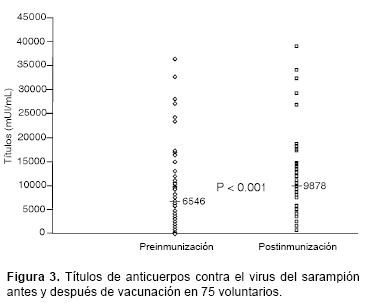
Seroconversión y respuesta anamnésica. El incremento en los títulos de anticuerpos contra sarampión antes (media = 6546, D.S. = 7869) y después de la vacunación (media = 9878, D.S. = 7522) fue significativo (P < 0.001). De similar manera, el incremento en los títulos de anticuerpos contra rubéola antes (media = 74, D.S. = 56) y después de la vacunación (media = 258, D.S. = 102.8) fue también significativo (P < 0.001). (Figuras 3 y 4).

Discusión
La eliminación y eventual erradicación del sarampión en las Américas es un objetivo a lograr en cada uno de los países que la integran, mediante la aplicación de vacunas en la población de niños y en aquellos otros grupos que recientemente se han detectado como vulnerables, tales como el personal de salud que atiende enfermos en todos los niveles.11
En México, con el inicio de la vacunación masiva en 1973 resultó en la drástica reducción del número de casos de sarampión registrados entre 1973 y 1975. Esto fue seguido de un importante repunte en la segunda mitad de los años setenta, con más de 20 mil casos por año, y el inicio de un período de epidemias. La última de ellas, que formó parte de una pandemia mundial durante el bienio 1989 y 1990 con 20,381 y 68,782 casos, respectivamente, cifras similares e incluso mayores a las registradas en eventos similares ocurridos a mediados de siglo. Este período coincide con la intensificación de las acciones de vacunación contra el sarampión y con la creación de nuevas estrategias operativas que permitieron incrementar las coberturas en los grupos de edad preescolar y escolar, con la consecuente reducción de casos a partir de 1991 y la ausencia total de casos autóctonos desde 1997. Las tasas de incidencia disminuyeron igualmente de 80.2 en 1990 a 0.14 en 1994.4
La reducción de casos en los últimos años se ha debido, sin duda, a factores diversos que incluyen, entre otros, al mantenimiento de altas coberturas de vacunación en la población preescolar y escolar, al desarrollo de estrategias de eliminación más enérgicas, al fortalecimiento de la vigilancia epidemiológica y al agotamiento de poblaciones susceptibles debido a la última epidemia, lo cual permitió obtener las cifras más bajas; 128 en 1994, 12 en 1995 y dos en 1996. Entre 1997 y 1999 no se registraron casos, el panorama epidemiológico del sarampión cambió de manera radical hacia una disminución casi completa de nuevos casos.4 Sin embargo, esto condicionó un terreno propicio para la aparición potencial de brotes en grupos de personas que han sido detectadas como susceptibles. Este es el caso de quienes en el año 2004 tenían 31 o más años de edad, debido a que por su edad no les fue aplicada la vacuna y pudieron no haber padecido sarampión. Asimismo, en aquellos que recibieron la vacuna a los 9 meses de edad y no recibieron refuerzo hace más de dos décadas, los títulos de anticuerpos podrían ser mínimos o no protectores. En este grupo de riesgo se encuentra el personal de salud que atiende a la población abierta que acude a consulta de primero, segundo y tercer nivel de atención.
En el presente estudio encontramos que del personal de salud encuestado, 90.7% tenía anticuerpos contra sarampión y 94.7% contra rubéola. Por lo tanto, el porcentaje de susceptibles a contraer el sarampión o la rubéola fue de 9.3 y 5.3% respectivamente.
Estos resultados concuerdan con un estudio realizado en Estados Unidos de Norteamérica utilizando el mismo inmuno–análisis enzimático en 20,100 sueros de personas de 6 años y mayores obtenidos durante el período de 1988–1994, en donde se demostró que el 93% era inmune a sarampión. Este porcentaje fue mayor en personas de la era prevacunal (99%) el que disminuyó en los nacidos entre 1967 y 1976 (81%) y aumentó en aquéllos nacidos de 1977 a 1988 (89%).12
En Polonia, (donde la cobertura de vacunación es mayor de 95%), un análisis de 3,000 sueros de pacientes de uno a 30 años atendidos en seis centros de atención comunitaria, mostró anticuerpos protectores contra el virus del sarampión en 96% de éstos.13 En Taiwán, un estudio de 1,564 muestras de pacientes entre 3 y 19 años de edad del período de 1974 a 1980 mostró que el 97% de los mayores de 10 años tenían anticuerpos protectores.14 En otro estudio en personal de un hospital de Brasil, se evaluaron 150 pediatras de 23 a 46 años de edad después de la epidemia ocurrida en 1996 y 1997 y se demostró que 147 (98%) tenían anticuerpos protectores.11
Con relación a la técnica de medición de anticuerpos usada en diversos estudios, es conveniente comentar que comparada con el estudio de reducción de neutralización en placa como estándar de oro, el ensayo inmunoenzimático tiene sensibilidad de 98.8% y especificidad de 93.9% cuando el valor de corte es > 120 mUI/mL. Aunado a su gran disponibilidad, facilidad de operación y rapidez en los resultados, lo hacen una de las mejores opciones para la determinación rutinaria.15
Aunque el porcentaje de individuos susceptibles detectado en el personal de salud en el presente estudio parecería bajo, el contagio con el virus del sarampión y su potencial transmisión a la población atendida podría ser de una magnitud insospechada. Si consideramos que el período de contagiosidad inicia de 3 a 5 días antes de la aparición del exantema, un médico susceptible que ha sido infectado, y que atiende hasta 20 pacientes al día podría transmitir el virus a por lo menos 60 a 100 pacientes durante ese período facilitando la aparición de brotes.
Considerando dicho riesgo, la Academia Americana de Pediatría hace las siguientes recomendaciones para la contratación de trabajadores de la salud que nacieron después de 1956; 1) que exista evidencia de haber tenido sarampión, 2) que se demuestre inmunidad para sarampión (anticuerpos en títulos protectores) o 3) haber recibido 2 dosis de vacuna antes de empezar a trabajar.9
En relación con la descripción de los eventos locales o sistémicos asociados temporalmente a la aplicación de diversos inmunógenos, se ha puesto mayor énfasis en su identificación debido a la menor incidencia de las enfermedades prevenibles por vacunación. En el presente estudio, la frecuencia de eventos locales asociados fue baja (< 4%), correspondiendo en su totalidad a inflamación en el sitio de la inyección durante la primera semana posterior a su aplicación. Los eventos sistémicos se presentaron en menos del 9% de los casos y predominó la aparición de fiebre, exantema y artralgias durante las dos primeras semanas a partir de la aplicación del biológico. La frecuencia tanto de eventos locales como sistémicos temporalmente asociados a vacunación se presentaron con frecuencia ligeramente inferior a reportes previos.9,10
Aunque el estudio tiene limitaciones respecto al número de sujetos encuestados y a que éstos pertenecen a una fracción de trabajadores de la salud de la zona metropolitana de Guadalajara, la frecuencia de susceptibles fue baja pero similar a otros estudios realizados fuera del país. No obstante que el porcentaje de trabajadores de la salud susceptibles fue bajo, el impacto de su contagio e infección con el virus del sarampión y su diseminación subsecuente a la población de enfermos que atiende, podría facilitar el desarrollo de brotes. Esto evidencia la necesidad de atender la sugerencia de la Organización Mundial de la Salud de ampliar los esquemas de inmunizaciones al personal de salud mayor de 31 años.
Agradecimientos
Los autores agradecen que el presente estudio fue autorizado por el Comité de Ética e Investigación de la UAG y cumplió con la normatividad internacional para estudios de investigación realizada en sujetos humanos. Este trabajo fue presentado en parte en el XI Congreso de la Asociación Panamericana de Infectología. III Congreso Argentino de SADI. II Congreso Interamericano de SIC. III Congreso Panamericano de SIDA. Córdoba, Argentina. Mayo 11–14, 2003.
Referencias
1. de Quadros CA, Olive JM, Hersh BS, Strassburg MA, Henderson DA, Brandling–Bennett D, et al. Measles elimination in the Americas. Evolving strategies. JAMA 1996; 275:224–229. [ Links ]
2. Camargo MC, de Moraes JC, Souza VA, Matos MR, Pannuti CS. Predictors related to the occurrence of a measles epidemic in the city of São Paulo in 1997. Rev Panam Salud Publica 2000; 7:359–365. [ Links ]
3. Cox MJ, Azevedo RS, Massad E, Fooks AR, Nokes DJ. Measles antibody levels in a vaccinated population in Brazil. Trans R Soc Trop Med Hyg 1998; 92:227–230. [ Links ]
4. Santos JI, Nakamura MA, Veras–Godoy M, Alvarez–Lucas C, Kuri P, Tapia–Conyer R. Measles in Mexico, 1941–2001: Interruption of endemic transmission and lessons learned. J Infect Dis 2004; 189:S243–S250. [ Links ]
5. Sistema Nacional de Vigilancia Epidemiológica. Prevención y vigilancia epidemiológica del sarampión en México. Epidemiología Sistema Único de Información 2003; 20:1–3. [ Links ]
6. Sistema Único de Información para la Vigilancia Epidemiológica. Sarampión. Casos nuevos de enfermedades de notificación inmediata hasta la semana 48 del 2004. Epidemiología Sistema Único de Información 2004; 21:1–23. [ Links ]
7. Organización Panamericana de la Salud. División de Vacunas e inmunización. Conclusiones y Recomendaciones Informe Final. XIII reunión del grupo técnico asesor de la OPS sobre enfermedades prevenibles por vacunación. 12–4–0099. Hull, Quebec, Canadá. [ Links ]
8. Herrera–Basto EA, Santos–Preciado JI, Escamilla–Godinez G, Villaseñor–Sierra A, Avila–Figueroa C, et al. Estudio seroepidemiológico de sarampión en Ciudad Netzahualcóyotl, México: una estrategia de evaluación. Bol Med Hosp Infant Mex 1995; 52:690–687. [ Links ]
9. Sarampión. En: Red Book: Report of the Committee on Infectious Diseases. Pickering LK, (Ed). American Academy of Pediatrics. 25th Edition Elk Grove Village, IL, 2000. p. 662–676. [ Links ]
10. Bennett JV, Fernandez DC, Valdespino–Gomez JL, García–García M de L, Islas Romero R, et al. Aerosolized measles and measles–rubella vaccines induce better measles antibody booster responses than injected vaccines: randomized trials in Mexican school children. Bull World Health Organ 2002; 80:806–812. [ Links ]
11. Guerra AL, Rossi A, Jr, Paiva LM, Sato HK, Souza VA, et al. Measles seroprevalence among pediatricians in a teaching hospital. Rev Saude Publica 1999; 33:374–378 [ Links ]
12. Hutchins SS, Redd SC, Schrag S, Kruszon–Moran D, Wooten K, et al. National serologic survey of measles immunity among persons 6 years of age or older, 1988–1994. Med Gen Med 2001 ;E5. [ Links ]
13. Janaszek W, Gut W, Gay NJ. The epidemiology of measles in Poland: prevalence of measles virus antibodies in the population. Epidemiol Infect 2000; 125:385–392. [ Links ]
14. Lee MS, Nokes DJ, Wu YC, Huang YH, Lu CF. Measles IgG seroprevalence prior to mass vaccination in Taiwan. Int J Infect Dis 2002; 6:42–47. [ Links ]
15. Ratnam S, Gadag V, West R, Burris J, Oates E, et al. Comparison of commercial enzyme immunoassay kits with plaque reduction neutralization test for detection of measles virus antibody. J Clin Microbiol 1995; 33:811–815. [ Links ]














