Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.5 Ciudad de México sep./oct. 2005
Artículo original
Regulación del metabolismo del colesterol y ácidos grasos en el síndrome nefrótico experimental por las proteínas que se unen a los elementos regulatorios de esteroles (SREBP's): efecto de la soya
Metabolism of cholesterol and fatty acids in nephrotic syndrome and its regulation by sterol regulatory element brinding proteins (SREBP's). Effect of soy protein consumption
Armando Tovar,ª* Natalia Manzanoª y Nimbe Torresª
ª Departamento de Fisiología de la Nutrición, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, México, D.F. México.
* Correspondencia y solicitud de sobretiros:
Dr. Armando Tovar–Palacio,
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, Departamento Fisiología de la Nutrición,
Vasco de Quiroga No. 15. Col. Sección XVI. Deleg. Tlalpan.
México D.F. 14000.
Tel: 56553038, Fax: 56553038.
Correo electrónico: artovar@quetzal.innsz.
Recibido en su versión modificada: 24 de diciembre del 2004
Aceptado: 24 de febrero del 2005
Resumen
El síndrome nefrótico (SN) cursa con hiperlipidemia. Se conoce que la biosíntesis del colesterol y de los ácidos grasos es regulada por los factores transcripcionales que se unen a los elementos de respuesta a esteroles (SREBP's). El consumo de proteína de soya disminuye la concentración de estos lípidos, aunque su mecanismo de acción no es del todo conocido. El objetivo de este estudio fue conocer si el consumo de la proteína de soya reduce los niveles de colesterol y triglicéridos a través de una regulación de las SREBP 's. Se estudiaron ratas Wistar macho con SN experimental por 64 días. Se observó que las concentraciones plasmáticos de colesterol y triglicéridos plasmáticos, así como de la proteinuria eran significativamente menores en las ratas alimentadas con proteína de soya que aquellas que consumían caseína. Estos cambios se asociaron con disminución de la expresión del ARNm SREBP 1 y de las enzimas de la síntesis de ácidos grasos. Los análisis por Western Blot revelaron que en los núcleos de hepatocitos obtenidos de ratas alimentadas con proteína de soya hubo menor presencia del factor transcripcional SREBP 1. Los resultados de este estudio indican que el consumo de proteína de soya produce efectos benéficos durante el síndrome nefrótico.
Palabras clave: SREBPs, síndrome nefrótico, colesterol, triglicéridos
Summary
Hyperlipidemia occurs during nephrotic syndrome (NS). It is known that cholesterol and fatty acid biosynthesis is controlled by the transcription factors sterol regulatory element binding proteins (SREBPs). Soy protein consumption reduces the concentration of these lipids, although its mechanism of action is not well known. The aim of the present study was to establish whether soy protein consumption reduces cholesterol and triglycerides levels by regulating of SREBPs. Male Wistar rats with experimental NS were studied for 64 days. The results showed that rats fed with soy protein had significantly lower plasma cholesterol and triglyceride concentrations as well as proteinuria than rats fed with casein diet. These decrements were associated with a decrease in the expression of SREBP 1 and fatty acid biosynthetic enzymes. In addition, Western blot analysis revealed that in nuclear extracts from hepatocytes of rats fed with soy protein, there was a lower concentration of SREBP 1 than in rats fed with casein. The results of this study indicate that consumption of a soy protein diet has beneficial effects on nephrotic syndrome.
Key words: SREBPs, nephrotic syndrome, cholesterol, triglycerides
Introducción
Los nutrimentos contenidos en la alimentación de un individuo no son sólo importantes por su aporte energético o de materias primas para la síntesis de otras macromoléculas o como parte estructural del propio organismo. Los nutrimentos en muchas ocasiones constituyen importantes reguladores de la expresión de gran diversidad de genes, pudiendo actuar a nivel de la transcripción o sobre el procesamiento, estabilidad y traducción del ARNm.1
En el caso del colesterol ésta no es una excepción. El colesterol es un lípido de gran importancia tanto para la morfología como para la fisiología de la célula, así como para el correcto desarrollo de los organismos, pues es uno de los constituyentes principales de las membranas celulares y un importante precursor de las hormonas esteroideas, de los esteroles fecales y de los ácidos biliares.2 Los organismos superiores tienen dos vías de adquisición del colesterol, ya sea mediante la dieta, o bien, si la dieta no lo contiene tienen la capacidad de sintetizarlo a partir de Acetil–CoA.3
La forma como la célula censa los niveles de colesterol es a través de una familia de proteínas denominadas SREBP's (siglas en inglés de "sterol regulatory element binding proteins"). Estas proteínas regulan a varios genes involucrados en la biosíntesis y captura del colesterol.4 y reciben su nombre por unirse a una secuencia de 10 pb (5'– ATCACCCCAC – 3')5 denominada SRE–1 ("Sterol Regulatory Element–1") ubicada en la región 5' promotora de los genes del receptor de LDL y de las enzimas 3–Hidroxi–3–metilglutaril coenzima A sintasa (HMG–CoA sintasa),6 3–hidroxi–3–metilglutaril coenzima A reductasa (HMG–CoA reductasa),7–11 farnesil difosfato sintasa6,7,10,12–14 y la escualeno sintasa.6,7,9,13,15,16 Asimismo, se ha encontrado que las SREBP's modulan la transcripción de genes que codifican para las enzimas de la síntesis y captura de ácidos grasos, como la acetil CoA carboxilasa,7,9,15,16 la sintasa de ácidos grasos,8–10,15–19 la estearoil CoA desaturasa–17,9,14,16 y la lipoproteín lipasa9,20–23 así como los genes de los receptores de HDL (High density lipoprotein),24 del receptor de activadores de la proliferación de peroxisomas (PPAR–[] 1 y 3), la proteína microsomal de transferencia de triglicéridos,7,25 la ATP–citrato liasa, la glucosa–6–fosfato deshidrogenasa, la 6–fosfogluconato deshidrogenasa y la enzima málica.
Se han identificado tres familias de SREBP's ( SREBP–1 a, SREBP–1c y SREBP–2).5,26 Las SREBP's tienen un peso molecular de 125 kD5,26,27 y están localizadas en el retículo endoplásmico con los extremos NH2 y COOH terminales orientados hacia el citoplasma y el pequeño fragmento intermedio orientado hacia el lumen de este organelo.28,29 El dominio NH2– terminal de las SREBP's, es un factor transcripcional con un peso molecular de 65 kD5,5,26,27 que pertenece a la familia de los factores transcripcionales "basic–helix–loop–helix–leucine zipper" (bHLH–Zip). La forma en que el dominio NH2 terminal es liberado del retículo endoplásmico para posteriormente entrar al núcleo celular es a través de dos pasos proteolíticos, uno de ellos regulado por esteroles27,30,31 que son catalizados por las proteasas denominadas SP1 y SP2. Fisiológicamente, se cree que de manera general, aunque no exclusiva,9 las formas SREBP–1 están involucradas en la activación de los genes de las enzimas que regulan la síntesis de ácidos grasos mientras que la forma SREBP–2 está relacionada más bien con los genes de las enzimas de la vía de síntesis del colesterol.7,8,14
Las dietas ricas en colesterol, tan comunes en el Mundo Occidental provocan graves daños en la salud del individuo. Asimismo se ha encontrado que la administración de dietas basadas en proteína de origen animal tales como la caseína, aumentan los niveles de colesterol en sangre provocando problemas de aterosclerosis en animales de experimentación. Por otra parte, es bien conocido el hecho de que una alimentación basada en proteínas vegetales disminuye en gran medida los niveles de colesterol de los individuos.32 La soya es la proteína vegetal más utilizada para estos fines32–35 se ha reportado que el consumo de soya en animales experimentales reduce los niveles de colesterol total36 de LDL, de VLDL y de apo B,37 así como de HDL e IDL.38 No se conocen bien los mecanismos por los cuales la proteína de soya modifica los niveles de colesterol, y tampoco se sabe si regulan a las SREBPs.
Existen patologías en las que se observa un aumento en las concentraciones de colesterol en sangre como es el caso del síndrome nefrótico. La sintomatología de este padecimiento se caracteriza por la coexistencia de proteinuria, hipoproteinemia, hiperlipidemia e hipercoagulabilidad.39 En lo referente al metabolismo de lípidos, el síndrome nefrótico se caracteriza por la elevación de la concentración plasmática del colesterol total, aunque también se registran valores altos de triglicéridos; asimismo, las IDL, las LDL y las VLDL aumentan y están además enriquecidas de ésteres de colesterol.40
Anteriormente se recomendaba para el tratamiento de pacientes con síndrome nefrótico el consumo de dietas ricas en proteína para compensar la pérdida de estas macromoléculas a través de la orina; sin embargo en los últimos años se ha fomentado el uso de dietas con bajo contenido proteico, pues se ha encontrado que altas concentraciones de proteína dietaria aumentan la tasa de filtración de los riñones y se acelera entonces la pérdida de proteínas, así como su catabolismo.41 El tipo de proteína utilizada en estas dietas ha sido normalmente de origen animal, pero en la última década se ha sugerido el consumo de proteína vegetal como una alternativa para los pacientes con trastornos renales.41,43 Estudios realizados recientemente en nuestro laboratorio muestran que la alimentación de ratas con proteína de soya permite un desarrollo y un crecimiento similar al de ratas alimentadas con caseína, lo que demuestra que el consumo de proteína vegetal a concentraciones adecuadas llena los requerimientos nutricionales de estos animales, con la ventaja de que la dieta basada en proteína de soya reduce significativamente los niveles de colesterol plasmático.44
Por lo que el objetivo del presente estudio fue el de conocer si el mecanismo molecular por medio del cual la soya reduce los niveles de colesterol y triglicéridos en el modelo del síndrome nefrótico experimental en ratas es a través de la regulación de la expresión de los factores transcripcionales SREBPs.
Materiales y métodos
Se utilizaron ratas macho de la cepa Wistar de entre 100 y 120 gramos de peso al inicio del experimento, que duró 64 días. La inducción del síndrome nefrótico crónico se llevó a cabo por la administración subcutánea del aminonucleósido de puromicina (ANP) en los días 0, 14, 28 y 42 en dosis de 50, 40, 40 y 25 mg/kg de peso respectivamente. Los animales fueron divididos en los siguientes grupos experimentales de 12 individuos cada uno: 1) Grupo Control + caseína: Ratas normales alimentadas con una dieta con 20 % de caseína tratadas con inyecciones subcutáneas de solución salina. 2.) Grupo Síndrome Nefrótico + caseína: Ratas con síndrome nefrótico inducido con ANP alimentadas con una dieta con 20 % de caseína. 3) Grupo Control + soya: Ratas normales alimentadas con dieta con 20 % de soya tratadas con inyecciones subcutáneas de solución salina. 4) Grupo Síndrome Nefrótico + soya: Ratas con síndrome nefrótico inducido con ANP alimentadas con una dieta con 20 % de soya. Los animales estuvieron en condiciones de bioterio bajo un ciclo de luz–oscuridad de 12 por 12 horas en jaulas individuales con libre acceso al agua y al alimento. La medición del peso de los animales se realizó tres veces por semana y el consumo de alimento dos veces por semana. A los 7, 21, 35 y 63 días se hicieron determinaciones de colesterol y triglicéridos en suero y de proteínas urinarias. El colesterol y los triglicéridos séricos se determinaron por métodos enzimáticos colorimétricos y las proteínas urinarias por el método de Lowry modificado. Los animales se sacrificaron en el día 64 del experimento por decapitación. Se analizó el contenido de colesterol y de triglicéridos en hígado de acuerdo al método de Folch.
Se realizaron ensayos de Northern Blot para determinar la concentración de ARNm en hígado de la HMG–CoA reductasa, de la HMG–CoA sintasa, del receptor LDL, de la enzima málica y de la sintasa de ácidos grasos, así como de la SREBP–1 por el método de Chomzynski. 15 mg de ARN se separaron electroforéticamente en gel de agarosa al 1%. El ARN fue transferido a una membrana de nylon (Hybon N+). Las sondas de ADNc necesarias se prepararon por medio de la transcripción reversa de la reacción en cadena de la polimerasa (RT–PCR) y de PCR, a partir de primers obtenidos por medio del programa computacional Oligo 5.0 y basándose en las secuencias reportadas en el GenBank para los genes estudiados. Las sondas fueron marcadas radiactivamente con P32 (Fósforo 32) con ayuda del Kit Redy–Prime de Amersham Pharmacia Biotech. La cantidad de cpm (cuentas por minuto) y la digitalización de las bandas se realizó mediante el uso del Instant Imager de Packard.
Por otra parte se realizaron ensayos de Western Blot para las proteínas SREBP–1 y 2, en los que se utilizaron anticuerpos contra éstas provenientes de hibridomas. Hibridomas de ATCC (American Type Culture Collection) anti–SREBP–1 (CRL–2121) e hibridoma anti–SREBP–2 (CRL–2128). Se aislaron previamente los núcleos por centrifugación diferencial en gradiente de sacarosa. Se homogeneizaron 4 gramos de hígado en buffer de lisis (Sacarosa 0.3 M, ditiotrietol 5 mM, MgCl2 5 mM, Tris/HCI 10 mM, pH 5 y tritón 100X al 0.05%), se filtró y centrifugó a 2500 r.p.m. por 10 minutos a 4°C. El botón se resuspendió en buffer con sacarosa 2.3 M, MgCl2 2 mM y Tris/HCI 10 mM, pH 7.5, se depositó en un tubo Quick Seal con el mismo buffer y se centrifugó a 33,5000 r.p.m. por 45 minutos a 4°C. El botón fue resuspendido en 500 ml de buffer de almacenamiento (Glicerol 50%, MgCl2 2 mM, EDTA 0.1 mM y HEPES 50 mM, pH 7.5). Se utilizó en todos los pasos una mezcla inhibidora de proteasas (EDTA, EGTA, Benzamidina, DTT, Pepstatina A y Leupeptina). Se determinó la concentración de proteína del extracto nuclear por el método de Lowry y 20 mg se sometieron a una electroforesis discontinua en geles de poliacrilamida al 8 %, en presencia de SDS al 1% y DTT 0.2 M. Las proteínas fueron electrotransferidas a membranas de PVDF. Las membranas fueron bloqueadas durante 2 horas–toda la noche con leche descremada al 3–5 %; se usaron los anticuerpos anti–SREBP–1 y anti–SREBP–2 por 1.5 horas–toda la noche y se reveló la reacción a través de la oxidación de luminol con el Kit ECL de Amersham Pharmacia Biotech que utiliza un anticuerpo secundario marcado con peroxidasa de rábano.
Resultados
Ingesta de alimento y ganancia de peso
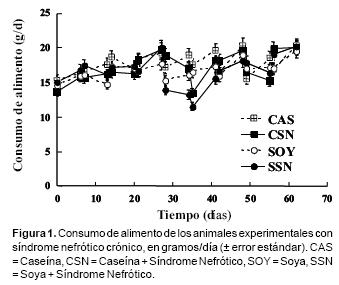
Las ratas controles alimentadas con dieta de proteína de soya o caseína consumieron cantidades similares de alimento durante los 64 días del estudio (Figura 1). La inducción del síndrome nefrótico con el aminonucleósido de puromicina no cambió el patrón de ingesta de alimento observado en las ratas controles, excepto en los días 28 a 35, donde las ratas nefróticas mostraron una reducción significativa en la ingesta de alimento (p<0.05). La ganancia de peso no mostró el mismo patrón que la ingesta de alimento (Figura 2). Las ratas controles alimentadas con caseína crecieron a una tasa de aproximadamente 4.4 g/día, mientras que las alimentadas con proteína de soya crecieron a una tasa de 3.6 g/día. La tasa de crecimiento fue significativamente diferente entre los grupos alimentados con caseína y proteína de soya a partir del día 21 de estudio, y esto se mantuvo hasta el final del periodo experimental. Las ratas nefróticas durante los primeros 30 días de estudio mostraron tasas de crecimiento similares a las de los grupos controles de caseína o proteína de soya (4.5 y 3.6 g/día, respectivamente). Sin embargo, después del día 40, las ratas nefróticas mostraron una significativa reducción en su tasa de crecimiento (p<0.05). Al final del estudio, las ratas nefróticas alimentadas con dieta de proteína de soya tuvieron menor ganancia de peso que las ratas nefróticas alimentadas con dieta de caseína (p<0.05).

Proteínas totales urinarias
La excreción de proteínas totales urinarias no varió significativamente entre los grupos controles alimentados con caseína o proteína de soya durante el estudio; las concentraciones permanecieron por debajo de los 22 mg/día/dL. Como se muestra en la figura 3, las ratas nefróticas alimentadas con caseína o soya a partir del día 10 presentaron proteínas urinarias significativamente mayores que las de sus correspondientes grupos control. Sin embargo, la proteinuria fue siempre significativamente mayor en las ratas nefróticas alimentadas con dieta de caseína en comparación con las ratas nefróticas alimentadas con proteína de soya. Al final del estudio, la proteína urinaria fue 21 veces mayor en las ratas nefróticas alimentadas con caseína que su grupo control, mientras que las ratas nefróticas alimentadas con proteína de soya mostraron incremento de 12 veces con respecto a su grupo control. Así, las ratas nefróticas alimentadas con proteína de soya redujeron 53% la excreción de proteína urinaria comparada con la de las ratas nefróticas alimentadas con dieta de caseína.

Lípidos séricos
Las figuras 4 y 5 muestran las concentraciones séricas de triglicéridos y colesterol en las ratas controles y nefróticas. Los resultados no mostraron diferencia significativa en triglicéridos séricos (99.5 ± 4.1 vs. 74 ± 5.7 mg/dL) y colesterol sérico (65.1 ± 1.8 vs. 72.1 ± 2.3 mg/dL) entre las ratas controles alimentadas con caseína o proteína de soya respectivamente. Desde el día 2, las ratas nefróticas tuvieron concentraciones significativamente mayores de triglicéridos y colesterol séricos en comparación con sus controles. Sin embargo, las ratas nefróticas alimentadas con proteína de soya presentaron menores incrementos de triglicéridos y colesterol séricos que las ratas nefróticas alimentadas con caseína a partir del día 21 hasta el final del estudio (p<0.05). Así, en el día 64, la dieta de proteína de soya produjo 56% y 59% de triglicéridos y colesterol séricos más bajos que los de las ratas nefróticas alimentadas con caseína. Al final del estudio los triglicéridos séricos de las ratas nefróticas alimentadas con caseína fue 230% más elevados que los de sus controles, mientras que las ratas nefróticas alimentadas con proteína de soya sólo presentaron incremento de 70% en comparación a sus respectivos controles. El colesterol sérico mostró un patrón similar; los niveles fueron 460% y 140% mayores en las ratas nefróticas alimentadas con caseína o proteína de soya en comparación con sus correspondientes controles.


Lípidos en hígado
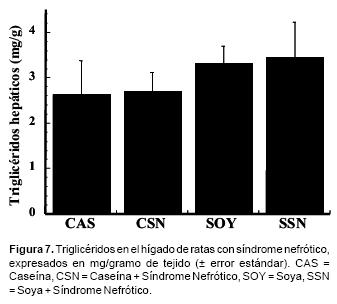
La figura 6 muestra que las ratas control alimentadas con proteína de soya presentaron valores de colesterol en hígado 85% más altos que los encontrados en las ratas control con dieta de caseína (p<0.05). Asimismo, las ratas nefróticas con dieta de caseína tuvieron mayor concentración (50 %) (p<0.05) de este lípido en hígado con respecto a las ratas control con dieta de caseína mientras que el grupo de ratas nefróticas alimentadas con soya presentaron valores 21.8 % más bajos que su grupo control. Por otra parte, no se observaron diferencias estadísticamente significativas en los niveles de triglicéridos en hígado de los cuatro grupos experimentales (Figura 7).

Análisis por Northern Blot de la expresión génica de enzimas de la biosíntesis de lípidos y colesterol
Las ratas control alimentadas con proteína de soya tuvieron valores más bajos (p<0.05) en la expresión génica de la Sintasa de ácidos grasos, la enzima málica y la proteína SREBP–1 en 44, 47 y 54 % respectivamente, comparadas con la expresión génica observada en las ratas control alimentadas con caseína. Por el contrario, las ratas control con dieta de soya presentaron mayor expresión (p<0.05) de los genes de las enzimas HMG–CoA sintasa, HMG–CoA reductasa, así como del receptor LDL en un 94, 23 y 68% respectivamente, comparadas con lo encontrado en las ratas control que recibieron dieta de caseína (Figura 8). Las ratas con síndrome nefrótico crónico alimentadas con caseína presentaron menor expresión de la sintasa de ácidos grasos, de la enzima málica, así como de la proteína SREBP–1 (51, 39 y 33%, respectivamente) y una mayor expresión de la HMG–CoA reductasa (1.5 veces) que las ratas control con dieta de caseína (p<0.05). Las ratas nefróticas que consumieron proteína de soya presentaron una menor expresión génica para la HMG–CoA sintasa, la HMG–CoA reductasa y el receptor LDL (27, 33 y 50 %, respectivamente) comparadas con lo encontrado en las ratas control que consumieron dieta de soya (Figura 8).
Análisis por inmunoblot de SREBP–1 y –2 en extractos nucleares
Los animales del grupo control que recibieron una dieta basada en proteína de soya tuvieron valores más bajos (73.6 %) de la cantidad de la forma madura de SREBP–1 en extractos nucleares comparados con los de los animales control que recibieron dieta de caseína (Figura 9). El Síndrome Nefrótico Crónico en ratas alimentadas con caseína o soya provocó incremento de este factor transcripcional con respecto al observado en sus respectivos grupos control del 22.87 % y del 91.42 %, respectivamente. En la proteína SREBP–2 se observó el efecto contrario, pues sus niveles en los animales control con dieta de soya fueron mayores (119 %) que en los núcleos del grupo control con dieta de caseína. Las ratas nefróticas que recibieron dieta de caseína tuvieron menor cantidad de la proteína SREBP–2 (63.7 %) en los extractos nucleares comparada con su grupo control, sin embargo, las ratas nefróticas alimentadas con proteína de soya tuvieron valores muy similares a su grupo control (Figura 9).

Discusión
El presente estudio demostró que la ingestión de proteína de soya mejora los parámetros bioquímicos del síndrome nefrótico en el modelo experimental de este padecimiento inducido con ANP. No hubo diferencias en consumo de alimento entre los 4 grupos experimentales, lo que asegura que los efectos observados en otros parámetros no se debieron a posibles diferencias en la cantidad de dieta ingerida por los animales. El peso corporal de los animales del experimento con SNC aumentó en los 4 grupos a lo largo de los 64 días del estudio, fue ligeramente menor en el grupo control que recibió dieta de soya comparado con el grupo control que recibió dieta de caseína. En lo que se refiere a los grupos con SNC debe tomarse en cuenta que los animales presentan edema como parte del cuadro clínico de esta patología, por lo que este parámetro debe tomarse con reserva. Sin embargo, es posible que la disminución en peso observada en el grupo que recibió dieta de soya con respecto al grupo con dieta de caseína pueda deberse al efecto benéfico de la soya, que cause una menor acumulación de líquidos en la cavidad abdominal de estos animales.
Se observó la proteinuria independientemente de la dieta consumida, sin embargo los valores obtenidos por el grupo que recibió dieta de soya fueron significativamente menores que los del grupo que consumió dieta de caseína, lo cual concuerda con lo observado por D' Amico et al.42 en pacientes nefróticos. Estudios tanto en animales experimentales como en humanos han mostrado que el consumo de soya, disminuye el flujo sanguíneo renal, la hiperfiltración y la hipertensión glomerular por lo que existe un menor deterioro de los glomérulos y de esta manera disminuye la albuminuria.43
Con respecto al colesterol sérico se observó que los valores de los grupos control independientemente de la dieta recibida eran normales y similares entre sí. De hecho, se sabe que la proteína de soya disminuye los niveles de colesterol sólo cuando se encuentran elevados, pero en personas normocolesterolémicas la proteína de soya no tiene ningún efecto.45 Por el contrario, los grupos a los que se les indujo el SN experimental tuvieron valores muy altos en este parámetro, sin embargo y de manera muy interesante los animales con dieta basada en proteína de soya presentaron valores significativamente más bajos que los animales que recibieron dieta de origen animal lo cual es similar a lo observado por D' Amico et al.42 en pacientes con nefropatía en cuanto al colesterol total y al LDL–colesterol. Este hecho confirma que la proteína de origen vegetal es recomendable en la dieta de los pacientes con síndrome nefrótico. En cuanto a los triglicéridos séricos se observó el mismo comportamiento que para el colesterol. Existen pocos datos reportados acerca de la influencia de la proteína de soya en los niveles de triglicéridos séricos, algunos autores mencionan un decremento,46 otros un aumento47 y existen trabajos que no reportan cambios en este parámetro.48
A través de los ensayos de Northern Blot se puede observar que el consumo de proteína de soya provocó aumento en la expresión de los genes de algunas de las enzimas de la biosíntesis de colesterol en los controles, pero no en los animales con síndrome nefrótico. La soya posiblemente favorezca que el colesterol sea excretado a través de las heces o bien utilice otro mecanismo para su control, y entonces sea necesaria la síntesis endógena de este compuesto para compensar esta pérdida. Existen varios trabajos donde reportan que una dieta libre de colesterol basada en proteína de soya incrementa la excreción de ácidos biliares a través de las heces de animales experimentales con respecto a una dieta basada en caseína34 y proponen que éste sea uno de los mecanismos por los cuales la soya logra decrementar los niveles de colesterol sérico. A pesar de esto, el receptor LDL no sufrió cambios en su expresión génica por la ingesta de proteína de soya. Esto posiblemente se explique en algunos estudios que han mostrado que lo que aumenta es la actividad del receptor,33 posiblemente a través de las isoflavonas que contiene la proteína de soya.49
Por otra parte, la expresión de las enzimas de la biosíntesis del colesterol no cambió significativamente en los grupos con SN. La biosíntesis de colesterol hepática ha sido evaluada en el SN experimental y los resultados han sido contradictorios, pues se ha reportado que aumenta50 que disminuye51,52 o bien que permanece igual que en condiciones normales.52 Asimismo se ha reportado que la actividad de la HMG CoA reductasa en el modelo de ANP es normal,53 por lo que se ha postulado que la hipercolesterolemia posiblemente no depende tanto del aumento en la síntesis de colesterol sino del bajo catabolismo de las lipoproteínas.54
Para las enzimas de la biosíntesis de lípidos se observó que existe menor expresión génica de éstas en los grupos control que recibieron dieta de soya con respecto a los grupos control que recibieron dieta con caseína, lo cual ya había sido observado por Iritani, et al.55 Esto puede deberse a que uno de los posibles mecanismos de la proteína de soya para bajar los niveles de triglicéridos es que exista una relación insulina/ glucagón menor que la provocada por la56 y por lo tanto que haya menor estimulación de la proteína SREBP–1, lo cual de hecho se observó en estos experimentos, y de este modo no haya gran expresión de las enzimas de esta ruta biosintética. Se sabe que los aminoácidos indispensables son relativamente más efectivos para la liberación de insulina que los aminoácidos no indispensables; particularmente la arginina y los precursores del piruvato liberan preferencialmente glucagón. En general, las dietas vegetarianas tienden a contener mayor cantidad de aminoácidos no esenciales que las dietas de proteína animal, por lo que una dieta vegetariana promueve la actividad del glucagón como lo hemos demostrado.56
Al igual que en el caso de las enzimas de la biosíntesis de colesterol, la expresión de las enzimas de la biosíntesis de lípidos no aumentó en los grupos con SNC sino que se encontró aproximadamente a los mismos niveles que la observada en el grupo control con dieta de soya. Esto tal vez podría explicarse porque la pérdida de proteínas a través de la orina incluye también a la insulina que es el activador de la expresión de SREBP–1, lo que a su vez reduce la expresión de enzimas lipogénicas.56
En los análisis por Western blot para la detección de la forma madura nuclear de SREBP–1, se observó el mismo comportamiento que el encontrado con los niveles de su ARNm. El consumo de la dieta de soya en las ratas controles redujo la concentración de este factor transcripcional en el núcleo de hepatocitos con respecto a los controles alimentados con caseína. Sin embargo se encontró que su presencia fue mayor en animales con SN comparándolos con sus respectivos grupos control. Posiblemente la estabilidad de esta proteína aumente en el SN ya que los niveles de su ARNm no siguen el mismo comportamiento. Se ha demostrado que el consumo de ácidos grasos poliinsaturados disminuye la estabilidad de la proteína SREBP–1, lo que demuestra que puede existir una regulación postraduccional de la proteína.57
En lo referente a la SREBP–2 se observó que la soya promovió que hubiera una mayor concentración de la forma madura de este factor transcripcional, lo cual se reflejó en una mayor expresión génica de sus enzimas blanco. Asimismo el grupo con SN alimentado con caseína presentó menor proporción de esta proteína que su respectivo grupo control. Por otro lado, no hubo diferencia entre los alimentados con soya con y sin SN. El grupo con SN alimentado con dieta de soya mostró concentraciones mucho más altas comparándolas con el grupo con SN que se alimentó con caseína, lo que concuerda con los cambios observados con el ARNm de la HMG–CoA sintasa. Sin embargo, no se muestra un paralelismo con la expresión del ARNm de la HMG–CoA reductasa y el receptor de LDL. La expresión de la HMG–CoA reductasa y del receptor LDL está controlada principalmente por la SREBP–2 aunque la tasa final de transcripción del receptor LDL y de la HMG–CoA reductasa depende de un grupo diferente de factores corregulatorios. Se ha mostrado que el promotor del receptor LDL requiere SREBP–2 y Sp1 (Specific protein 1), mientras que el promotor de la HMG–CoA reductasa requiere SREBP–2, NF–Y (Nuclear Factor Y) y CREBP (cAMP response element binding protein).58 La regulación de estos otros factores transcripcionales puede explicar la diferencia de expresión de los genes en las ratas nefróticas alimentadas con caseína con respecto a las de soya. Estos resultados apoyan la evidencia de que durante el SN existe una baja actividad del receptor LDL. Además también explica en parte que el incremento de la HMG–CoA reductasa se asocie con un aumento en la tasa de biosíntesis de colesterol como ha sido observado por algunos investigadores.
En resumen, estos resultados muestran que la proteína de soya ejerce un efecto benéfico en los parámetros bioquímicos de los animales que tienen síndrome nefrótico, en particular aquéllos con SNC. Los mecanismos por los cuales la proteína de soya disminuye las concentraciones séricas de colesterol y triglicéridos es diferente. Aunque los factores transcripcionales SREBP–1 y SREBP–2 están involucrados en estos mecanismos, la expresión de genes, en especial del metabolismo de colesterol, están controlados también por otros factores de transcripción, lo que no permite en varios casos que exista asociación directa entre los niveles de la forma madura de SREBP–2 con las concentraciones de los ARNm de genes involucrados en la síntesis de colesterol. En el caso de las enzimas lipogénicas, la respuesta parece estar más directamente asociada con la SREBP–1, y ésta a su vez posiblemente regulada por el nivel de insulina. Estos estudios están iniciando la elucidación del mecanismo por el cual la proteína de soya regula la concentración de lípidos en el organismo. Es importante reconocer que en meses recientes se han descrito otros factores transcripcionales que son de gran importancia, particularmente para el control del metabolismo de colesterol, los cuales pertenecen a la familia de los receptores huérfanos como es el LXR (Liver X Receptor).59 Esto muestra la complejidad de la regulación del metabolismo de lípidos en el organismo. Finalmente, desde el punto de vista aplicativo, el consumo de proteína de soya en humanos que tengan problemas relacionados con síndrome nefrotico, puede ser de gran beneficio, ya que este padecimiento está asociado a enfermedades de alta prevalencia como la diabetes o algunas enfermedades autoinmunes. Por lo tanto, su utilización en humanos debe considerarse como una opción en el tratamiento de este padecimiento.
Referencias
1. Torres N, Bourges H, Tovar AR. Regulación de la expresión génica por nutrimentos. Arch. Latinoam. Nutr. 1996; 46:89–96. [ Links ]
2. Brown MS, Goldstein JL. A receptor–mediated pathway for cholesterol homeostasis. Science 1986; 232:34–47. [ Links ]
3. Gasic GP. Basic–helix–loop–helix transcription factor and sterol sensor in a single membrane–bound molecule. Cell 1994; 77:17–19. [ Links ]
4. Brown MS, Goldstein JL. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane–bound transcription factor. Cell 1997;89:331–340. [ Links ]
5. Yokoyama C, Wang X, Briggs MR, Admon A, Wu J, Hua X, et al. SREBP–1, a basic helix–loop–helix leucine zipper protein that controls transcription of the LDL receptor gene. Cell 1993; 75:187–197. [ Links ]
6. Goldstein JL, Brown MS. Regulation of the mevalonate pathway. Nature 1990; 343:425–430. [ Links ]
7. Horton JD, Bashmakov Y, Shimomura I, Shimano H. Regulation of sterol regulatory element binding proteins in livers of fasted and refed mice. Proc Natl Acad Sci USA 1998; 95:5987–5992. [ Links ]
8. Kawabe Y, Suzuki T, Hayashi M, Hamakubo T, Sato R, Kodama T. The physiological role of sterol regulatory element binding protein–2 in cultured human cells. Biochim Biophys Acta 1999; 1436:307–318. [ Links ]
9. Shimano H, Horton JD, Hammer RE, Shimomura I, Brown MS, Goldstein JL. Overproduction of cholesterol and fatty acids causes massive liver enlargement in transgenic mice expressing truncated SREBP–1 a. J Clin Invest 1996; 7:1575–1584. [ Links ]
10. Shimano H, Schimomura I, Hammer R, Hero J, Goldstein JL, Brown MS, Horton JD. Elevated levels of SREBP–2 and cholesterol synthesis in livers of mice homozygous for a targeted disruption of the SREBP–1 gene. J Clin Invest 1997; 100:2115–2124. [ Links ]
11. Shimomura I, Bashmakov Y, Shimano H, Horton JD, Goldstein JL, Brown MS. Cholesterol feeding reduces nuclear forms of sterol regulatory element binding proteins in hamster liver. Proc Natl Acad Sci USA 1997; 94:12354–12359. [ Links ]
12. Ericsson, Jackson SM, Lee BC, Edwards PA. Sterol element binding protein binds to a cis element on the promoter of the farnesyl diphosphate synthase gene. Proc Natl Acad Sci USA 1996; 93:945–950. [ Links ]
13. Guan G, Jiang G, Koch RL, Scechter I. Molecular cloning and functional analysis of the promoter of the human squalene synthasa gene. J Biol Chem 1995; 270:21958–21965. [ Links ]
14. Pai J, Gurney O, Brown MS, Goldstein JL. Differential stimulation of cholesterol and unsatured fatty acid biosynthesis in cells expressing individual nuclear sterol regulatory element–binding protein. J Biol Chem 1998; 273:26138–26148. [ Links ]
15. Shimano H, Horton JD, Shimomura I, Hammer RE, Brown MS, Goldstein JL. Isoform 1c of sterol regulatory element binding protein is less active than isoform 1a in livers of transgenic mice and in cultured cells. J Clin Invest 1997; 99:846–854. [ Links ]
16. Shimomura I, Shimano H, Korn B, Bashmakov Y, Horton J. Nuclear sterol regulatory element binding proteins active genes responsibles for the entire programs of unsaturated fatty acid biosynthesis in transgenic mouse liver. J Biol Chem 1998; 273:35229–35306. [ Links ]
17. Boizard M, LeLiepvre X, Lemarchand P, Fuvfelle F, Ferré P, Dugali I. Obesity–related overexpression of fatty acid synthase gene in adiposite tissue involves sterol regulatory element–binding protein transcription factors. J Biol Chem 1998; 273:29164–29171. [ Links ]
18. Horton JD, Shimomura I, Brown MS, Hammer RE, Goldstein JL, Shimano H. Activation of cholesterol synthesis in preference to fatty acid synthesis in liver and adipose tissue of transgenic mice overproducing sterol regulatory element–binding protein. J Clin Invest 1998; 101:2331–2339. [ Links ]
19. Magaña MM, Koo SH, Towle HC, Osborne TF. Different sterol regulatory element binding protein–1 isoforms utilize distinct co–regulatory factors to activate the promoter for fatty acid synthase. J Biol Chem 2000; 275:4726–4733. [ Links ]
20. Kim JB, Spiegelman BM. ADD1/SREBP1 promotes adipocyte differentiation and gene expression linked to fatty acid metabolism. Genes & Development 1996; 10:1096–1107. [ Links ]
21. López JM, Bennett MK, Sánchez HB, Rosenfeld JM, Osborne TF. Sterol regulation of acetyl coenzyme A carboxylase: a mechanism for coordinate control of cellular lipid. Proc Natl Acad Sci USA 1996; 93:1049–1053. [ Links ]
22. Magaña MM, Osborne TF. Two tandem binding sites for sterol regulatory element binding proteins are required for sterol regulation of fatty–acid synthase promoter. J Biol Chem 1996; 271:32689–32694. [ Links ]
23. Tontonoz P, Kim JB, Graves RA, Spiegelman BM. ADD1: a novel helix–loop–helix transcription factor associated with adipocyte determination and differentiation. Mol Cell Biol 1993; 13:4753–4759. [ Links ]
24. López D, McLean MP. Sterol regulatory element binding protein–1a binds to cis elements in the promoter of the rat high density lipoprotein receptor SR–BI gene. Endocrinol 1999; 140:5669–5681. [ Links ]
25. Sato R, Miyamoto W, Inoue J, Terada T, Imanaka T, Maeda M. Sterol regulatory element binding protein negatively regulates microsomal triglyceride transfer protein gene transcription. J Biol Chem 1999; 274:24714–24720. [ Links ]
26. Hua X, Yokoyama C, Wu J, Brigss MR, Brown MS, Goldstein JL, Wang X. SREBP–2 a second basic–helix–loop–helix–leucine zipper protein that stimulates transcription by binding to a sterol regulatoy element. Proc Natl Acad Sci USA 1993; 90:11603–11607. [ Links ]
27. Wang X, Sato R, Brown MS, Hua X, Goldstein JL. SREBP–1, a membrane–bound transcription factor released by sterol–regulated of proteolysis. Cell 1994; 77:53–62. [ Links ]
28. Duncan EA, Brown MS, Goldstein JL, Sakai J. Cleavage site for sterol–regulated protease localized to a leu–ser bond in lumenal loop of sterol regulatory element binding protein–2. J Biol Chem 1997; 272:12778–12785. [ Links ]
29. Hua X, Sakai J, Ho YK, Goldstein JL, Brown MS. Hairpin orientation of sterol regulatory element binding protein–2 in cell membranes as determinated by protease protection. J Biol Chem 1995; 270:29422–29427. [ Links ]
30. Hua X, Sakai J, Brown MS, Goldstein JL. Regulated cleavage of sterol regulatory element binding proteins requires sequences on both sides of the endoplasmic reticulum membrane. J Biol Chem 1996; 271:10379–10384. [ Links ]
31. Sakai J, Duncan EA, Rawson RB, Hua X, Brown MS, Goldstein JL. Sterol–regulated release of SREBP–2 form cell membranes requires two sequential cleavages, one within a transmembrane segment. Cell 1996; 85:1037–1046. [ Links ]
32. Anderson JW, Johnstone BM, Cook–Newell ME. Meta–analysis of the effects of soy protein intake on serum lipids. N Engl J Med 1995; 333: [ Links ]
33. Baum A, Teng H, Erdman JW, Weigel R, Klein BP, Persky VW, et al. Long–term intake of soy protein improves blood lipid profiles and increases mononuclear cell low–density–lipoprotein receptor messenger RNA in hypercholesterolemic postmenopausal women. Am J Clin Nutr 1998; 68:545–551. [ Links ]
34. Nagata C, Takatsuka N, Kurisu N, Shimizu H. Decreased serum total cholesterol concentration is associated with high intake of soy products in japanese men and women. J Nutr 1998; 128:209–213. [ Links ]
35. Wong WW, O'Brian S, Stuff JE, Hachey DL, Heird WC, Pownell HJ. Cholesterol–lowering effect of soy protein in normocholesterolemic and hypercholesterolemic men. Am J Clin Nutr 1998; 72:1385S–1389S. [ Links ]
36. Potter SM, Pertile J, Berber–Jiménez D. Soy protein similar lower blood erum cholesterol but differently affect thyroid hormones in hamsters. J Nutr 1996; 126:2007–2011. [ Links ]
37. Tovar–Palacio C, Potter SM, Hafermann JC, Shay NF. Intake of soy protein and soy protein extracts influences lipid metabolism and hepatic gene expression in gerbils. J. Nutr. 1998; 128:839–842. [ Links ]
38. Greaves KA, Parks JS, Williams JK, Wagner JD. Intact dietary soy protein, but not adding an isoflavone–rich soy extract to casein improves plasma lipids in ovariectomized cynomolgus monkeys. J. Nutr. 1999; 129:1585–1592 [ Links ]
39. Harris VC, Ismail N. Extrarenal complications of nephrotic syndrome. Am J Kidney Dis 1994; 23:477–497. [ Links ]
40. Wheeler DC, Bernard DB. Lipid abnormalities in the nephrotic syndrome: causes, consequences, and treatment. Am J Kidney Dis 1994; 23:331–346. [ Links ]
41. D'Amico G, Remuzzi G, Maschio G, Gentile MG, Gotti E, Oldrizzi L, et al. Effect of dietary proteins and lipids in patients with membranous nephropathy and nephritic syndrome. Clin Nephrol 1991; 35:237–242. [ Links ]
42. D'Amico G, Gentile MG, Manna G, Fellin G, Ciceri R, Cofano F, et al. Effect of vegetarian soy diet on hyperlipidaemia in nephrotic syndrome. Lancet 1992; 339:1131–1134. [ Links ]
43. Kontessis P, Jones S, Dodds R, Trevisan R, Nosadini R, Fioretto P, et al. Renal, metabolic and hormonal responses to ingestion of animal and vegetable proteins. Kidney Int. 1990; 38:136–144. [ Links ]
44. Tovar AR, Murguia F, Cruz C, Hernández–Pando R, Aguilar–Salinas CA, Pedraza–Chaverri J, et al. A soy protein diet alters hepatic lipid metabolism gene expressión and reduces serum lipids and renal fibrogenic cytokines in rats with chronic nephrotic syndrome. J Nutr 2002; 132:2562–2569. [ Links ]
45. Sacks FM, Breslow JL, Wood PG, Kass EH. Lack of an effect of dietary protein (casein) and soy protein on plasma cholesterol of strict vegetarians. An experimental and a critical review. J lipid Res 1983; 24:1012–1020. [ Links ]
46. Grundy MS, Abrams JJ. Comparison of actions of soy protein and casein on metabolism of plasma lipoprotein and cholesterol in humans. Am J Clin Nutr 1983; 38:245–252. [ Links ]
47. Duane WC. Effect of soybean protein and very low dietary cholesterol on serum lipids, billiary lipids, and fecal sterol in humans. Metabolism 1999; 48:489–494. [ Links ]
48. Crouse JR, Morgan T, Terry JG, Ellis J, Vitolins M, Borke GL. A randomized trial comparing the effect of casein with that of soy protein containing varying amounts of isoflavones on plasma concentrations of lipids and lipoproteins. Arch Intern Med 1999; 159:2070–2076. [ Links ]
49. Powell EE, Kroon PA. Low density lipoprotein receptor and 3–hidroxy–3–methylglutaryl coenzyme A reductase gene expression in human mononuclear leucocytes is regulated coordinately and parallels gene expressión in human liver. J Clin Invest 1994; 93:2168–2174. [ Links ]
50. Golper TA, Feingold KR, Fulford MH, Siperstein MD. The role of circulating mevalonate in nephrotic hypercholesterolemia in the rat. J Lipid Res 1986; 27:1044–1051. [ Links ]
51. Dulbach U, Recant L, Hatch E, Koch MB. Negative feedback mechanism of cholesterol synthesis in experimental nephrosis. Proc Soc Exp Biol USA 1961;106:136–139. [ Links ]
52. Vaziri ND, Liang KH. HMG–CoA reductase gene expression during the course of puromycin–induced nephrosis. Kidney Int. 1995; 48:1979–1985. [ Links ]
53. Thabet MAEH, Calla A, Chanj LM, Paudak WH, Heuman DM, Vlahcevic ZR. Studies of the alteration of hepatic cholesterol metabolism in puromycin–induced nephrotic syndrome in rats. Kidney Int 1993; 44:789–794. [ Links ]
54. Shearer GC, Stevenson FT, Atkinson DN, Hardin Jones J, Staprans I, Kaysen GA. Hypoalbuminemia and proteinuria contribute separately to reduced lipoprotein catabolism in the nephrotic syndrome. Kidney Int. 2001; 59:179–189. [ Links ]
55. Iritani N, Hosomi H, Fukuda H, Tada K, Ikeda H. Soybean protein suppresses hepatic lipogenic enzyme gene expression in Wistar fatty rats. J. Nutr. 1996; 126:380–388. [ Links ]
56. Tovar AR, Ascencio C, Torres N. Soy protein, casein, and zein regulate histidase gene expression by modulating serum glucagon. Am J Physiol Endocrinol Metab 2002; 283:E1016–E1022. [ Links ]
57. Xu J, Teran–Garcia M, Park JH, Nakamura MT, Clarke SD. Polyunsaturated fatty acids suppress hepatic sterol regulatory element–binding protein–1 expression by accelerating transcrit decay. J Biol Chem 2001; 276:9800–9807. [ Links ]
58. Bennet MK, Osborne TF. Nutrient regulation of gene expression by the sterol regulatory element binding protein: increased recruitment of gene–specific coregulatory factors and selective hyperacetylation of histone H3 in vivo. Proc Natl Acad Sci USA 2000; 97:6340–6344. [ Links ]
59. DeBose–Boyd RA, Ou J, Goldstein JL, Brown MS. Expression of sterol regulatory element–binding protein 1c (SREBP–1c) mRNA in rat hepatoma cells requires endogenous LXR ligands. Proc Natl Acad Sci USA 2001; 98:1477–1482. [ Links ]














