Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.5 Ciudad de México sep./oct. 2005
Artículo original
Radiocirugía estereotáxica con acelerador lineal (LINAC). Informe de la experiencia técnica en el manejo de 100 casos en el Hospital General de México
Stereotactic radiosurgery with linear accelerator (LINAC). Report of the technical experience in 100 cases treated at the Mexico General Hospital
Pomponio José Lujan–Castilla,ª Mauricio Durán–Cruz,ª* Mario Enríquez–Barrera,ª Luís García–Muñóz,b Jorge Omar Hernández–Oviedoc y José Antonio Barragán–Pérezc
ª Departamentos de Radio–Oncología,
b Neurocirugía y
c Física Médica, Hospital General de México, SSA, México, D.F. México.
* Correspondencia y solicitud de sobretiros:
Dr. Mauricio Duran Cruz.
Departamento de Radioterapia Unidad No. 111 Oncología. Hospital General de México. OD.
Dr. Balmis No. 148. Col. Doctores. Delegación Cuauhtémoc.
México. D.F. C.P. 06726.
Teléfonos. 10350575 59996133 ext.: 1517.
Correo electrónico: drduran09@yahoo.com.mx
Recibido en su versión modificada: 5 de noviembre del 2004
Aceptado: 4 de febrero del 2005
Resumen
La radiocirugía estereotáxica consiste en la liberación de una dosis única y grande de radiación a una lesión intracraneal, pequeña, bien definida y localizada estereotáxicamente.
Objetivo: El objetivo de este estudio es detallar las consideraciones técnicas y correlacionarlas con los resultados clínicos, así como reportar los márgenes de dosis utilizados.
Métodos: Fueron tratados 100 pacientes mediante radiocirugía estereotáxica con LINAC. Treinta y cuatro casos de malformaciones arteriovenosas, 22 meningiomas, 18 astrocitomas, 11 adenomas hipofisiarios, 5 angiomas cavernosos, 3 neurinomas del acústico, 3 craneofaringiomas, 2 casos de epilepsia, una metástasis cerebral y un ependimoma. Las dosis de radiación utilizadas variaron en cada caso. Variables estudiadas: respuesta de la lesión, toxicidad, dosis al volumen blanco, número de isocentros, número de arcos de tratamiento, número de colimadores, dosis a órganos riesgo, homogeneidad volumen blanco, margen de error, volumen blanco, diámetro de colimadores y localización del volumen blanco. Se realizó la prueba x2 con significancia estadística p <0.05. La media seguimiento fue de 17.7 meses.
Resultados: Se presentaron tres casos de toxicidad menor. Se confirmó que a mayor volumen blanco tratado será necesario mayor número de arcos de tratamiento, con amplio margen de error y mayor número de isocentros.
Conclusión: La radiocirugía es un método seguro y confiable para el manejo de entidades patológicas benignas y malignas intracraneales.
Palabras clave: Radiocirugía, neoplasias cerebrales, radiología terapéutica, acelerador lineal, sistemas estereotáxicos
Summary
Stereotactic radiosurgery consists of the release and high dose radiation inside the intracraneal, small, well defined and stereotactic localized injury.
Objective: In this study we describe the technical aspects, clinical results and dose radiation levels used in 100 patients treated with LINAC.
Methods: One hundred patients received treatment withe LINAC stereotactic radiosurgery, 34 AVM, 22 meningiomas, 18 astrocytomas, 11 pituitary adenomas, 5 cavernous malformations, 3 acoustic neuromas, 3 craniopharyngiomas, 2 cases of epilepsy, one brain metastases and one ependymoma. The radiation dose changed in each case. Studied variables: response of the injury, toxicity, in target dose, number of isocenters, number of treatment arcs, number of collimators, dose of risk organ, homogeneity of target, margin of error, target, diameter of collimator and location of target. We applied the %2 test with statistical significance of p < 0.05.
Results: The median follow up was 17.7 months. We had 3 cases of minor toxicity. We confirmed that for a greater target volume, greater number oftreatment arcs were necessary, with greater margins of errors and greater number of isocenters.
Conclusions: Radiosurgery is a safe and reliable technique to treat benign and malignant intracranial lesions.
Key words: Radiosurgery, brain neoplasms, therapeutic radiology, linear accelerator, stereotactic systems
Introducción
La palabra estereotaxia se deriva de dos palabras griegas: stereos, tridimensional y taxis, arreglo metódico. En 1889, la primera unidad de estereotaxia fue utilizada en una neurocirugía en humanos en Rusia.1
Diferentes sistemas de estereotaxia se han desarrollado con la idea básica de obtener un marco rígido para sujetar gentilmente el cráneo, asociado a un juego de ejes externos fijos relativamente al cráneo.2
El concepto de radiocirugía estereotáxica deriva del entendimiento y el uso de la neurocirugía estereotáxica. Lars Leksell en 1951, fue el primero en introducir el concepto de radiocirugía, para la destrucción de lesiones pequeñas en el cerebro mediante haces de energía radiante dirigidos estereotáxicamente.3 En la descripción inicial de este método fueron usados rayos X 200 kV, pero dada la limitada penetración de los mismos al tejido cerebral se utilizaron isótopos radiactivos como el cobalto – 60 (Co60), que emite rayos gamma de mayor penetración con una energía promedio de 1.25 MV, así pues, una unidad de tratamiento que contenía un arreglo fijo de fuentes de Co60 fue construida por el profesor Lars Leksell en el Instituto Karolinska en Estocolmo, Suecia en 1960, llamándose Gamma Knife.4
El Gamma Knife utiliza 201 fuentes de Co60 que son posicionadas a lo largo del eje longitudinal, y cada fuente es orientada a lo largo del radio de la esfera apuntadas al punto central de la unidad. Presenta dos niveles de colimadores, uno fijo inmediatamente adyacente a las fuentes y colimadores circulares que pueden medir 4, 8, 14 o 18 mm de diámetro. Se emiten rayos gamma con una energía de 1.17 y 1.33 MV durante el decaimiento del Co60, resultando en curvas de dosis en profundidad semejantes a las producidas con energía rayos X 4 MV en el acelerador lineal. La dosis deseada es producida precisamente por el tiempo de exposición a la irradiación.5
Los aceleradores lineales fueron simultáneamente desarrollados en USA e Inglaterra en 1950. Su mecanismo básico consistía en acelerar electrones a velocidades cercanas a la de la luz. El haz de electrones es apuntado a la cabeza metálica de la aleación que sirve como blanco; esta interacción resulta en la producción de rayos X, los cuales pueden ser colimados para ser enfocados al paciente.6
En 1984, Betti y Derechinsky describieron un sistema de radiocirugía utilizando acelerador lineal (LINAC) como fuente de irradiación. Colombo y colaboradores informaron también este método en 1985. Muchas investigaciones subsecuentes modificaron los LINACs en varios sentidos, con el fin de asegurar un sistema de radiocirugía adecuado. Winston y Lutz brindaron avances significativos en la tecnología de los LINACs al incorporar un sistema posicionador estereotáxico. En el sistema radioquirúrgico del LINAC un haz colimado de rayos X es enfocado al paciente mediante la localización estereotáxica del volumen blanco intracraneal; el gantry del LINAC rota arriba del paciente, produciendo un arco de radiación enfocado al volumen blanco. La mesa con el paciente es entonces rotada en el plano horizontal y otro arco es formado. De esta manera, se producen múltiples intersecciones de arcos no coplanares de radiación. En contraste con su análogo, el Gamma knife; con el LINAC debido a los arcos creados se asegura una mayor dosis al volumen blanco con mínima irradiación a tejido cerebral circundante.7
La mayoría de los LINACs pueden ser modificados para realizar procedimientos radioquirúrgicos, porque existen guías publicadas con los programas y requisitos para mantener una calidad estándar en los tratamientos.8
El isocentro del LINAC es definido como un punto en el espacio, que representa la intersección de los ejes de rotación del gantry, el colimador y la mesa, generalmente este punto se localiza a 100 cm del blanco de rayos X.9
Diversos componentes son necesarios para realizar una radiocirugía basada en el LINAC. Primero, se necesita un LINAC con habilidad de generar fotones en rangos de 4–10 MV. El LINAC debe tener un apropiado mecanismo para la relación exacta espacial entre el isocentro y las múltiples posiciones del gantry y la mesa. Un número de accesorios también son requeridos como una funda para el marco cefálico, un freno para la mesa, una funda para los colimadores y una variedad de colimadores con rangos de apertura de 4–40 mm de diámetro. El sistema de localización estereotáxica incluye accesorios como tomografía computada (TC) o resonancia magnética (RM) y si es requerida angiografía, un marco cefálico estereotáxico de metal, postes de fijación, clavijas de fijación, una funda para el marco cefálico en la cama del tomógrafo o resonador magnético y finalmente el sistema de planeación, incluyendo el software y el hardware en la computadora.10
El sistema de radiocirugía con LINAC ha sido usado para tratar lesiones anatómicas incluyendo las siguientes entidades patológicas:
a Enfermedades benignas, meningiomas, neurinoma del acústico, adenoma hipofisaro, malformaciones arterio venosas, neuralgia del trigémino y otros transtornos funcionales.
b Tumores malignos, metástasis, gliomas y otras neoplasias malignas.
En general la mayoría de los neurocirujanos utilizan la radiocirugía en pacientes que no son candidatos para un procedimiento neuroquirúrgico convencional, otras indicaciones clínicas incluyen comúnmente la presencia de lesiones inoperables, lesiones persistentes o recurrentes a cirugía, o alguna condición médica que contraindique la cirugía. En todos los casos la decisión de ofrecer radiocirugía dependerá de un estudio individualizado del caso realizado por un equipo multidisciplinario en el que intervienen el neurocirujano y el radio oncólogo, entre otros.11
En nuestro país la primera institución pública en iniciar procedimientos de radiocirugía con acelerador lineal fue el Centro Médico Nacional 20 de Noviembre, ISSSTE, con un total de 38 pacientes de agosto de 1998 a mayo de 1999 abarcando los siguientes transtornos: 31 malformaciones arteriovenosas, 3 meningiomas, 1 tumor región pineal, 1 adenoma hipofisario, un caso de dolor difícil control y 1 caso transtorno obsesivo–compulsivo.12
Nuestra institución (Hospital General de México, OD) inició con este procedimiento a partir del 09 diciembre 1999 hasta la fecha, con un total de 130 pacientes manejados con distintos transtornos intracraneales benignos o malignos. En este artículo informamos la experiencia obtenida en el manejo de nuestros primeros 100 casos, haciendo énfasis en los detalles y consideraciones técnicas del procedimiento y su correlación clínica.
Material y métodos
De diciembre 1999 a junio del 2003, un total de 100 pacientes fueron tratados mediante radiocirugía estereotáxica por diversos transtornos benignos y malignos intracraneales; los pacientes fueron seleccionados de acuerdo a los siguientes criterios: Diámetro lesion < 4 cm, Karnofsky > = 70, lesiones intracraneales benignas o malignas con probabilidad de respuesta a la radiocirugía, lesiones irresecables quirúrgicamente, lesiones recurrentes a manejo previo quirúrgico y pacientes no candidatos a cirugía por alguna contraindicación médica.
Todos los pacientes fueron tratados mediante radiocirugía estereotáxica con acelerador lineal, las dosis variaron de acuerdo a la entidad tratada.
El estudio se realizó en las instalaciones del Hospital General de México, dentro de los servicios de Neurocirugía, Radio–oncología y Tomografía.
El equipo utilizado para el procedimiento de radiocirugía consta de:
– Tomógrafo.
– Software radiocirugía: Sistema STP3 Leibinger 1994, versión 3.31 – 2P1.
– Sistema estereotaxia Leibinger 1994.
– LINAC. SL 15 Phillips, 1983. Energías Rx 6 y 10 MeV, y electrones 4, 6, 8, 10, 12 y 15 MeV.
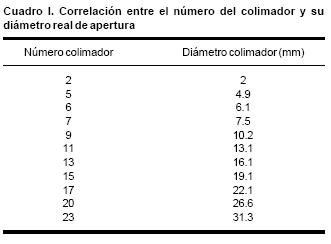
– Colimadores. En el cuadro I se describen los números de colimadores disponibles y sus diámetros en cm.
Las variables estudiadas fueron:
A) Variables de interés primario:
– Mejoría clínica.
– Disminución tamaño lesión por imagen.
– Toxicidad tardía.
– Dosis al volumen blanco.
– Número de isocentros.
– Número de arcos.
– Número de colimadores.
– Dosis a órganos de riesgo.
– Homogeneidad de dosis en volumen blanco.
– Error.
– Volumen del blanco.
– Diámetro de colimadores.
B) Variables auxiliares:
– Sexo.
– Edad.
– Localización volumen blanco.
Estudio de tipo observacional, retrospectivo longitudinal, descriptivo, que corresponde a una revisión de casos.
Para determinar los límites de normalidad en una población determinada se sugiere como tamaño de muestra mínimo 100 casos por cada grupo que se desee estudiar. Este número es adecuado para la suposición de que el promedio muestral de la media está muy cercano del promedio poblacional, y de que la desviación estándar muestral y la desviación estándar poblacional estén cercanas.13
Para la búsqueda sistemática de asociaciones entre variables, el tamaño de la muestra deberá determinarse de modo que el número mínimo de elementos en cada margen de las variables a comparar sea de 5.13
Para determinar la asociación entre dos variables categóricas se realizó la prueba de  para independencia, determinando como nivel de significación una p < 0.05.
para independencia, determinando como nivel de significación una p < 0.05.
La descripción del procedimiento se detalla a continuación.
La planeación del tratamiento en la radiocirugía basada en LINAC se inicia almacenando los datos de las imágenes axiales dentro del sistema de planeación de tratamiento de la computadora vía conexión directa con la sala de imagen o mediante archivos. Los programas del sistema de planeación reconstruye las imágenes para mostrarlas, algunos sistemas tienen integrado reconstrucción para TAC, RMN y angiografía. La mayoría de los sistemas requiere delimitar en forma manual el contorno del volumen blanco, así como de otras estructuras de interés como quiasma óptico y tallo cerebral. Algunos sistemas ofrecen una configuración automática de estos contornos. Paso seguido, se delimita el contorno del volumen tumoral en forma tridimensional y son identificados el isocentro y colimador adecuados. La prescripción de la dosis se selecciona con base en el tamaño de la lesión y a la situación clínica.
Para obtener resultados satisfactorios, la radiocirugía basada en LINAC debe incorporar rígidos sistemas de calidad que pueden dividirse en tres categorías:
a) Calidad en la adquisición de las imágenes.
b) Calidad en el LINAC y accesorios relacionados.
c) Calidad al brindar el tratamiento.
La adquisición de las imágenes mediante TC, RM o angiografía y el hardware para su localización estereotáxica debe ser evaluado para asegurar su sensibilidad espacial y su reproducibilidad.
La calidad en el LINAC involucra asegurar la estabilidad mecánica del isocentro, función del gantry, mesa y posición de colimadores, también se requiere de calibración rutinaria, alineación del campo de luz con el de fotones y sistema de láser, fundas o sujetadores para los colimadores y para el arco cefálico.
La calidad en el tratamiento debe asegurar que el paciente es tratado reproduciéndose de forma exacta el plan trazado de tratamiento. Un procedimiento de confirmación en la localización del isocentro del tratamiento es mandatorio antes de iniciar éste. Así mismo, una metodología debe realizarse para asegurar que no existan colisiones entre el gantry, mesa, piso y paciente durante la ejecución del tratamiento.
Una vez que el plan de tratamiento generado en la computadora ha sido aprobado y las normas de calidad para el LINAC han sido cubiertas, el paciente es transportado al área de tratamiento y colocado en la cama de tratamiento, y se fija el marco cefálico a su funda o sujetador en la mesa de tratamiento reproduciendo la posición del paciente con la obtenida por imagen diagnóstica. La localización del isocentro de tratamiento seleccionado es entonces confirmado mediante la obtención de placas en AP y lateral mediante doble exposición, usando un colimador con apertura de 1–2 mm de diámetro que es el blanco del isocentro elegido. Las coordenadas estereotáxicas del isocentro son calculadas a partir de las placas tomadas en doble exposición y checadas con las coordenadas del isocentro aprobado en el plan de tratamiento. Una vez que la localización del isocentro ha sido confirmada y el paciente ha sido colocado en posición de tratamiento, los arcos no coplanares de tratamiento son brindados, usualmente en un periodo de 30 – 60 minutos dependiendo del número de arcos requeridos. Al término del tratamiento, el marco cefálico es retirado y el paciente es transportado a hospitalización para su observación o egresado a su hogar, dependiendo de la situación clínica. Dependiendo de las características técnicas del LINAC y de los miembros del equipo multidisciplinario de radiocirugía, el total del procedimiento puede requerir entre 4 a 5 horas, promedio.14
A continuación se detalla la Rutina de Verificación y Tratamiento de Radiocirugía Estereotáxica con Acelerador Lineal llevada en nuestro Hospital:
Colocación del sistema referencial estereotáxico
Previo a la colocación del anillo estereotáxico se realiza asepsia y antisepsia de las regiones frontal y occipital e infiltración anestésica. Se administra sedación en la mayoría de los casos y sólo anestesia general para los pacientes pediátricos. Posterior a esto se coloca un anillo con aleación de titanio (Fischer, Leibinger, Alemania) al diploe mediante 4 tornillos.
Obtención de la información estereotáxica
Se coloca un sistema coordinado de localización sobre el anillo estereotáxico previo a la realización de los estudios de neuroimagen. En todos los casos llevados a cabo en nuestro estudio se realizó tomografía craneal computada (TC), que se tomó como referencia para la planeación, ya que se considera el estudio de imagen más preciso estereotáxicamente, la TC se realizó a través de un tomógrafo helicoidal en fase contrastada, realizando cortes cada 2 mm., con un espesor de 2 mm., desde la base hasta la convexidad del cráneo.
En los casos donde la TC no fue adecuada para determinar los límites de la lesión a tratar, se realizó entonces resonancia magnética (RM), la cual se llevó a cabo antes de colocar el anillo estereotáxico, aplicando previamente marcas visibles para uno y otro estudios. Las imágenes obtenidas tanto de la TC como de la RM fueron transferidas en formato DICOM. a un disco optomagnético, para posteriormente ser descargadas a una estación de trabajo con el programa de cálculo para radiocirugía (Stereo Treatment, STP; versión 3.0 Fischer, Leibinger, Alemania). Posteriormente los estudios fueron correlacionados para trabajar con la RM conservando la precisión de la TC.
Para las malformaciones arteriovenosas se realizó panangiografía cerebral con sustracción digital (PAC), seguida de una TC contrastada. Las proyecciones anteroposterior y lateral de la PAC fueron transferidas a la estación de trabajo mediante digitalización por medio de un Scanner, empleando para ello el programa de radiocirugía referida. Posteriormente fueron correlacionadas estereotáxicamente con la TC.
Planeación
Todos los pacientes contaron previo al tratamiento con radiocirugía, con TC y RM y sólo en los casos de malformaciones arteriovenosas se requirió de PAC.
Los estudios de TC y RM en formato DICOM fueron transferidos a la computadora mediante disco optomagnético. La información de la TC se transformó a formato estereotáxico mediante la localización del sistema coordinado (CTloc. Fischer. Leibinger. Alemania). La RM se integró al espacio referenciado de la TC mediante la correlación de marcas existentes entre los estudios manteniendo factores de error de precisión entre 0.5 – 0.9 mm.
Cuando se usó PAC, las imágenes obtenidas en las proyecciones anteroposterior y lateral, fueron integradas a la computadora mediante digitalización por medio de un Scanner, posteriormente fueron convertidas a formato estereotáxico mediante la localización del sistema coordinado empleado (Angiloc. Fischer. Leibinger. Alemania). Posteriormente, el servicio de neurocirugía se encargó de delimitar los contornos de las estructuras cefálicas, neurales normales y neurales patológicas, con el fin de determinar volúmenes y dimensiones, así como generar imágenes tridimensionales.
En la mayoría de los casos se utilizó un isocentro con 5 a 6 arcos, los cuales fueron ajustados de acuerdo a la elocuencia de las estructuras neurales periféricas. Las dosis se ajustaron también de acuerdo a las tolerancias de los tejidos sanos circundantes con márgenes que oscilaron entre los 16 y 25 Gy con una línea isodósica al 80%.
Preparación del acelerador lineal
Al mismo tiempo que se desarrolla la planeación del tratamiento por parte de los neurocirujanos y radiooncólogos, el servicio de Física Médica procede a desarrollar la verificación preliminar de colisiones del LINAC siguiendo el protocolo que se detalla a continuación:
a Obtener coordenadas del blanco o blancos,
b Obtener copia preliminar del plan de tratamiento,
c Ubicar mesa en coordenadas correspondientes a ( 0,0,0) estereotáxico.
d Desplazar la mesa en relación al origen estereotáxico hasta hacer coincidir las coordenadas estereotáxicas del blanco con el isocentro del LINAC.
e Anotar las coordenadas de la mesa como referencia,
f Simular arcos con base en el plan de tratamiento y observar colisiones,
g Informar del resultado de la simulación a los médicos que realizan la planeación.
Preparación del paciente
A continuación se detalla el protocolo a seguir en este rubro:
a Dar indicaciones generales al personal sobre precauciones de NO tocar la mesa durante la simulación del tratamiento, precauciones relacionadas a seguridad y la autorización sólo al personal del equipo físico y médico dentro de la sala.
b Montar placa posterior de angiografía.
c Rotar mesa a 0°.
d Colocar al paciente en la mesa e indicarle que se abstenga de movimientos bruscos.
e Nivelar anillo ( vertical y giro ) con nivel de agua.
f Montar topes de referencia a 0.
g Montar localizador de blancos en anillo .
h Verificar que no exista rotación o inclinación ( con nivel de agua ).
i Desplazar firmemente marcadores hasta ceros de referencia.
j Encender marcadores y poner en ceros.
k Verificar número de plan de tratamiento.
l Verificación de los ceros por un tercero.
m Desplazar marcadores hacia coordenadas del blanco.
n Verificación de coordenadas por un tercero.
o Desplazar mesa hasta hacer coincidir marcadores con los láseres.
p Verificación de posición por un tercero (ubicación anatómica de la lesión).
q Anotar como referencia la posición final de la mesa.
r Retirar localizador de blancos y colocar en su caja.
s Firmas del personal de Física Médica que realizó y autorizó esta fase del procedimiento.
Verificación de colisiones
Se verifican posibles colisiones de acuerdo al plan de tratamiento con el portacolimador instalado. Se verifica que la mesa no tenga desplazamientos usando el localizador de blancos o verificando que las coordenadas lateral, longitudinal y vertical no varíen. Firma del personal de Física Médica que realizó y autorizó esta fase.
Verificación del isocentro por película portal
Una vez colocada la lesión en el isocentro del gantry del LINAC se procede a tomar 2 proyecciones radiográficas del cráneo (antero–posterior y lateral) con campo abierto de 10 x 10 cm y con colimador de 2 mm, en doble exposición para determinar de manera visible el isocentro. Las placas se transfieren a la computadora mediante digitalización por medio de un escáner (Angioloc. Fischer. Leibinger. Alemania). Se determina con precisión la posición del isocentro en base al plano cartesiano y se da como margen de error un máximo de desplazamiento de 1.0 mm. La rutina que se sigue en la toma de dichas placas es la siguiente:
a Colocar placas de angio (A,L y R), verificar que P ya esté colocada.
b Rotar cabezal a 0°.
c Preparar placas y soportes,
d Toma de placa lateral:
– Verificar que el portacolimador esté firmemente asegurado.
– Colocar colimador No. 2.
– Cerrar campo a 10 x 10 cm.
– Rotar gantry a 90 o 270° horizontal.
– Ubicar película lateral al paciente (extremo opuesto al gantry).
– Efectuar disparo con 4 UM (unidades/monitor).
– A partir de este punto no se deberá tocar la película ni la mesa.
– Retirar porta colimador.
– Abrir campo hasta que cubra todas las placas y la lesión.
– Efectuar disparo con 5 UM.
– Retirar película, revelar y evaluar, si es necesario repetir,
e Toma de placa antero–posterior:
– Rotar gantry a 0° vertical.
– Ubicar película posterior al paciente.
– Abrir campo hasta que cubra todas las placas y la lesión.
– Efectuar disparo con 5 UM.
– A partir de este punto no se deberá tocar la película ni la mesa.
– Verificar que el portacolimador esté asegurado con firmeza.
– Colocar colimador No. 2.
– Cerrar campo a 10 x 10 cm.
– Efectuar disparo con 4 UM.
– Retirar película, revelar y evaluar, si es necesario repetir.
– Retirar y guardar colimador No. 2, no se usará para tratamiento.
Revisión de imágenes portales
Se verificará que los marcadores de las placas sean claramente visibles, remarcar si es necesario.
Se procede a escanear las tomas anteroposterior y lateral en sistema STP y se verificará la orientación adecuada. Se verifica margen de error y se autoriza.
Tratamiento
a Montar porta colimadores.
b Asegurar porta colimadores.
c Ajustar campo a 10 x 10 cm.
d Verificar coordenadas lateral, longitudinal y vertical de la mesa.
e Insertar colimador prescrito.
f Verificar rotación del cabezal del gantry a 0°.
g Revisar protocolo final impreso.
h El plan de tratamiento deberá incluir las coordenadas del blanco, dosis al blanco, número de arcos a utilizar, porcentaje de dosis en profundidad al isocentro, angulación de la mesa de tratamiento, número de colimador (diámetro) a utilizar, angulación del gantry de inicio y término, unidades monitor prescritas.
i Durante el tratamiento deberán estar presentes tanto neurocirujanos, radio oncólogos, físicos médicos y técnicos en radioterapia.
Resultados
Se trataron un total de 100 pacientes con distintas lesiones intracraneales benignas y malignas en la unidad de radiocirugía del Hospital General de México, en un periodo comprendido entre el 09 de diciembre de 1999 al 10 de junio del 2003.
La distribución general por sexo fue de 39 casos (39%) hombres y 61 casos (61%) mujeres.
Los márgenes de edad de la población estudiada oscilaron entre los 4 – 80 años, media de 42 años.
Las entidades patológicas tratadas se describen en el cuadro II.
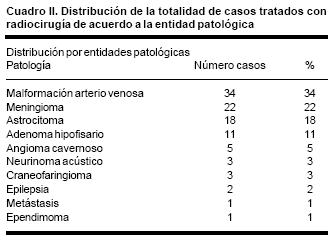
El volumen blanco tratado para la totalidad de pacientes osciló entre 0.21 – 38.47 cc, con una media de 19.34 cc. El margen de error para la totalidad de los pacientes osciló entre 0 – 2.97 mm, con una media de 1.48 mm. Los resultados de acuerdo a cada entidad patológica, en función de las variables definidas para su análisis se reseña a continuación
Malformación arteriovenosa (MAV)
Número de casos: 34.
Distribución por sexo: 20 mujeres y 14 hombres.
Límite de edad: 6 – 48 años, media 27 años.
Distribución por localización anatómica de la lesión : arteria cerebral media 10 casos, tallo cerebral siete casos, lóbulo parietal 5 casos, tálamo cuatro casos, lóbulo frontal dos casos, arteria cerebral posterior un caso, lóbulo fronto parietal un caso, lóbulo occipital un caso, núcleos basales un caso, lóbulo parieto occipital un caso y lóbulo temporo parietal un caso.
Número de isocentros utilizados por caso tratado: un isocentro 27 pacientes y dos isocentros siete pacientes, total de isocentros utilizados 41.
La dosis prescrita al volumen blanco (isocentro) por cada caso: cinco casos tratados con 25 Gy, cuatro casos tratados con 24 Gy, dos casos tratados con 22 Gy, 17 casos tratados con 20 Gy, cuatro casos tratados con 18 Gy y dos casos tratados con 16 Gy.
La prescripción de la dosis a superficie tumoral siempre se basó en elección de curvas que aseguraran por lo menos 80% de la dosis para con esto tener un intervalo entre el isocentro (centro volumen blanco) y la superficie del volumen blanco (límites externos volumen blanco) de máximo 20% para asegurar mayor homogeneidad de la dosis.
Número de arcos utilizados por isocentro tratado: un isocentro tratado con cuatro arcos, tres isocentros tratados con cinco arcos, 27 isocentros tratados con seis arcos, cuatro isocentros tratados con siete arcos, un isocentro tratado con ocho arcos y cinco isocentros tratados con nueve arcos.
Número de colimadores utilizados por isocentro tratado: 30 isocentros tratados con un colimador, seis isocentros tratados con dos colimadores y cinco isocentros tratados con tres colimadores.
En cuanto al volumen del blanco tratado, el margen fue de 0.43 cc – 38.47 cc, con una media de 19.45 cc. Número de casos de acuerdo al volumen tratado: cuatro casos volumen blanco < 1cc, siete casos 1.1–2 cc, seis casos 2.1–4cc, 13 casos 4.1–10cc, un caso 10.1–20cc, tres casos de 20.1 a más cc.
En relación a la dosis recibida por los órganos de riesgo al 100% de su volumen la dosis fue de 0 – 4 Gy con una media de 2 Gy. Los tres órganos de riesgo mayormente involucrados son tallo cerebral, tálamo y cápsula interna.
El margen de error varió de 0 – 2.9 mm, media 1.45 mm, el error en 50% de los casos tratados de 1.1 a 2.0 mm.
Meningiomas
Número total de casos: 22
Márgenes de presentación por edad: 15 – 80 años, media de 47.5.
Distribución por sexo: mujeres 18 y hombres 4. Distribución por localización anatómica de la lesión: seis casos seno cavernoso derecho, cinco casos en región petroclival, cuatro casos en seno cavernoso izquierdo, dos casos en cavum de Meckel, un caso en seno longitudinal superior, un caso en la hoz, un caso región parasagital derecha, un caso región parasagital izquierda y un caso en seno transverso.
De acuerdo al número de isocentros utilizados por caso tratado, 10 pacientes fueron manejados con un isocentro y 12 pacientes con 2 isocentros, para un total de isocentros tratados en este grupo de pacientes de 34.
Se aseguró una adecuada homogeneidad de la dosis al mantener una dosis en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro. Dosis prescrita al volumen blanco (isocentro) para los casos tratados de esta patología: siete casos fueron tratados con 25 Gy, tres casos con 24 Gy, seis casos con 22 Gy, tres casos con 20 Gy, dos casos con 18 Gy y un caso con 16 Gy. Relación de arcos utilizados por cada isocentro tratado: tres isocentros tratados con cuatro arcos, nueve isocentros tratados con cinco arcos, 18 isocentros tratados con seis arcos y cuatro isocentros tratados con siete arcos.
Relación del número de colimadores utilizados por cada isocentro: 32 isocentros tratados con un colimador y dos isocentros tratados con dos colimadores. El volumen del blanco tratado para cada caso, presentó rangos de 0.4 –38.41 cc, con una media de 19.4 cc, y se distribuyó de la siguiente manera: un caso con volumen del blanco < 1cc, 2 casos 1.1 a 2 cc, tres casos 2.1 a 4 cc, 11 casos 4.1 a 10 cc, tres casos 10.1 a 20 cc, y dos casos con más de 20.1 cc.
La dosis recibida a los órganos de riesgo al 100% de su volumen varió de 0 – 5.12 Gy, con media de 2.56 Gy. Los tres órganos de riesgo mayormente involucrados fueron tallo cerebral, nervios ópticos y quiasma óptico.
El margen de error para cada paciente tratado varió de 0.5 mm – 2.8 mm, media de 1.65 mm, presentando el 54% de los casos tratados un margen de error de 1.1 – 2.0 mm.
Astrocitomas
Número total de casos: 18
Márgenes de edad: 4 – 29 años, media de 16.5 años.
Distribución por sexo: mujeres ocho, hombres 10. Distribución topográfica de la presentación de estas lesiones: cinco casos en el lóbulo frontal, tres casos intraventriculares, tres casos cerebelo, dos casos en tallo cerebral, un caso en quiasma óptico, un caso en lóbulo frontoparietal, un caso en lóbulo occipital, un caso región pineal y un caso en tálamo.
De acuerdo al número de isocentros manejados por caso tratado: todos los casos se manejaron con un isocentro.
Dosis prescrita al volumen blanco (isocentro) para cada caso: dos casos tratados con 25 Gy, dos casos tratados con 22 Gy, 11 casos tratados con 20 Gy, dos casos tratados con 18 Gy y un caso tratado con 16 Gy.
Se aseguró una adecuada homogeneidad de la dosis al mantenerla en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro. Número de arcos de tratamiento utilizados por isocentro tratado: un isocentro tratado con 5 arcos, 13 isocentros tratados con 6 arcos, 3 isocentros tratados con 7 arcos y 1 isocentro tratado con 8 arcos.
Número de colimadores utilizados por isocentro tratado: 14 isocentros tratados con 1 colimador y 4 isocentros tratados con 2 colimadores.
El margen del volumen del blanco tratado fue de 1.0 – 21. 48 cc, con una media de 11.24 cc, presentándose 1 caso con volumen del blanco < 1 cc, 3 casos 1.1 a 2 cc, 4 casos 2.1 a 4 cc, 8 casos 4.1 a 10 cc, 1 caso 10.1 a 20 cc, y 1 caso con más de 20.1 cc.
En cuanto a la dosis a órganos de riesgo al 100% de su volumen ésta fue de 0 – 3.73 Gy, con media de 1.86 Gy. Los tres órganos de mayor riesgo involucrados son tallo cerebral, tálamo y núcleo caudado.
El margen de error osciló estre 0.95 – 2.1 mm, media de 1.52 mm, donde 44% de los casos tratados estuvo entre 1.1 – 2.0 mm.
Adenomas hipofisarios
Número total de casos: 11
Márgenes de edad: 29 – 57 años, media de 43 años.
La distribución por sexo corresponde a 5 mujeres y 6 hombres.
La localización de la lesión corresponde a hipófisis en todos los casos.
De acuerdo al número de isocentros tratados por cada caso ocho pacientes utilizaron un isocentro y tres pacientes dos isocentros, para un total de 14 isocentros manejados. Distribución de acuerdo a dosis prescrita al volumen blanco (isocentro): un caso tratado con 24 Gy, un caso tratado con 23 Gy, cuatro casos tratados con 22 Gy y cinco casos tratados con 20 Gy.
Se aseguró una adecuada homogeneidad de la dosis al mantener una dosis en la periferia del volumen blanco de por 10 menos 80% de la dosis prescrita al isocentro. Número de arcos de tratamiento utilizados por isocentro; cinco isocentros tratados con cinco arcos, siete isocentros tratados con seis arcos, un isocentro tratado con siete arcos y un isocentro tratado con cuatro arcos.
Número de colimadores utilizados por isocentro tratado: 11 isocentros tratados con un colimador y tres isocentros tratados con dos colimadores. Rango del volumen del blanco de 0.7 a 11.04 cc, con una media de 5.87 cc, cuatro casos con volumen del blanco < 1 cc, dos casos 1.1 a 2 cc, tres casos 2.1 a 4 cc, un caso 4.1 a 10 cc, un caso 10.1 a 20 cc.
El margen de error fue de 0.72 a 1.86 mm, con media de 1.29 mm.
Los órganos de riesgo recibieron dosis al 100% de su volumen en un parámetro de 0 – 3.19 Gy, con una media de 1.59. Los tres órganos de riesgo mayormente involucrados fueron quiasma óptico, nervios ópticos e hipotálamo.
Angioma cavernoso
Número total de casos: cinco
Márgenes de edad: 18 – 54 años, media de 36 años.
Distribución por sexo corresponden cuatro mujeres y un hombre.
De acuerdo a la localización anatómica de la lesión, cuatro casos se presentaron en tallo y uno en hipotálamo.
De acuerdo al número de isocentros utilizados por caso tratado, todos se trataron con un solo isocentro.
En la distribución por dosis prescrita al volumen blanco (isocentro), tres casos se prescribió dosis de 20 Gy, un caso 19 Gy y un caso 18 Gy.
Se aseguró una adecuada homogeneidad de la dosis al mantener una dosis en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro.
El número de arcos utilizados por isocentro tratado fue de seis arcos en tres pacientes, siete arcos en un paciente y nueve arcos en un paciente más.
El número de colimadores utilizados por isocentro tratado fue de dos pacientes manejados con un solo colimador, dos pacientes con dos colimadores y un paciente más con tres colimadores.
La relación del volumen del blanco tratado para cada caso presentó márgenes de 0.21 – 4.69 cc, media de 2.45 cc, dos casos con volumen del blanco < 1 cc, un caso 1.1 a 2 cc, un caso 2.1 a 4 cc, y un caso 4.1 a 10 cc.
El margen de error fue de 0.56 – 2.36 mm, media de 1.46 mm.
El margen de dosis recibida al 100% del volumen de órganos críticos fue de 0.54 a 1.45 Gy, media de 0.99 Gy. El tallo cerebral fue el mayormente involucrado.
Neurinoma del acústico
Número de casos: tres
Edades: 34 – 47 años, media de 40.5 años
Distribución por sexos, dos mujeres y un hombre.
Número de isocentros utilizados por cada caso tratado: un isocentro para todos los casos.
La dosis prescrita al volumen blanco (isocentro) en cada caso fue de 22.5 Gy un caso, 22 Gy un caso y 20 Gy un caso más.
Se aseguró una adecuada homogeneidad de la dosis al mantener una dosis en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro.
El número de arcos utilizados por isocentro tratado: un caso de seis arcos, un caso de siete arcos y un caso de cinco arcos.
En dos pacientes se usó un colimador por isocentro y en otro paciente tres colimadores.
En cuanto al volumen tumoral dos pacientes se encontraban en límite de 4.1 a 10 cc y uno en margen de 10.1 a 20 cc, rangos de 5.3 a 17.38 cc, con una media de 11.34 cc.
El margen de error fue de 0.51 a 0.94 mm, media de 0.72 mm.
Los órganos de riesgo recibieron una dosis al 100% de su volumen en margen de 0.30 – 1.10 Gy, media de 0.7 Gy. Siendo los órganos de riesgo mayormente involucrados tallo cerebral y cerebelo.
Craneofaringioma
Número total de casos: tres
Margen de edad: 4 – 17 años, media de 10.5 años.
Distribución por sexo: dos hombres y una mujer.
Localización supraquiasmática en todos los casos.
Se utilizó: un isocentro en dos pacientes y dos isocentros en un paciente, para un total de cuatro isocentros tratados.
Dosis prescrita al volumen blanco (isocentro): 22 Gy en un caso y 20 Gy en dos casos.
Se mantuvo una dosis en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro.
Número de arcos por isocentro tratado: ocho arcos manejados en un isocentro y seis arcos en tres isocentros.
Número de colimadores manejados por isocentro tratado: un colimador en tres isocentros tratados y dos colimadores en un isocentro tratado.
El volumen del blanco tratado estuvo entre 1.2 – 10.43 cc, media de 5.81 cc, donde un caso se encontraba entre 1.1 – 2 cc, un caso en 10.1 – 20 cc y un caso en 2.1 – 4 cc.
El margen de error fue de 0.88 – 2.25 mm, con una media de 1.56 mm.
La dosis recibida al 100% del volumen de órganos de riesgo osciló entre 0.53 – 2.68 Gy, con una media de 1.6 Gy. El neuro óptico y quiasma óptico presentaron mayor riesgo.
Epilepsia
Número de casos: dos
Rangos de edad: Media 36 años.
Distribución por sexo: un hombre y una mujer.
Localización anatómica: Hipocampo derecho un caso, hipocampo izquierdo otro caso.
Número de isocentros manejados por caso: un isocentro uno y otro caso.
Dosis prescrita al volumen blanco (isocentro): 30 Gy en los dos casos.
Adecuada homogeneidad de la dosis al mantener en la periferia del volumen blanco por lo menos 80% de la dosis prescrita al isocentro.
Número de arcos utilizados por isocentro tratado: cinco arcos en un isocentro y seis arcos en otro isocentro.
Número de colimadores utilizados por isocentro: un colimador para ambos casos.
Volumen del blanco osciló entre 2.21 – 2.97 cc, media de 2.59 cc, estando los dos casos en 2.1 – 4 cc.
El margen de error fue de 1.52 – 1.64 mm, media de 1.58 mm.
La dosis recibida en 100% del volumen a órganos de riesgo estuvo entre 0 – 0.02 Gy, media de 0.01 Gy. Mayor riesgo para el mesencéfalo.
Metástasis cerebrales
Número de casos: uno
Edad: 71 años
Sexo: mujer
Localización anatómica: lóbulo parietal izquierdo.
Número isocentros utilizados: dos
Dosis prescrita al volumen blanco (isocentro): 20 Gy.
Adecuada homogeneidad de la dosis al mantener una dosis en la periferia del volumen blanco de por lo menos 80% de la dosis prescrita al isocentro.
Número de arcos utilizados: nueve para cada isocentro.
Número de colimadores utilizados: uno para cada isocentro.
Volumen del blanco: 1.7 cc.
Error: 2.97 mm
Dosis recibida 100% volumen órganos riesgo. Límites de 1.2 – 2.34 Gy, media de 1.77 Gy.
Ependimoma
Número de casos: uno
Sexo: mujer.
Edad: 14 años
Número de isocentros utilizados: uno
Dosis prescrita al volumen blanco (isocentro): 25 Gy
Adecuada homogeneidad de la dosis al mantener en la periferia del volumen blanco por lo menos 80% de la dosis prescrita al isocentro.
Número de arcos por isocentro: seis
Número de colimadores por isocentro: uno
Volumen del blanco: 1.9 cc
Error. 1.2 mm
Dosis 100% volumen órganos de riesgo: 1.3 – 2.1 Gy, media de 1.7 Gy.
Resultados clínicos
En esta sección se detallarán los resultados relacionados a la respuesta al tratamiento, morbilidad del mismo y tiempo de seguimiento y se representará por cada entidad patológica.
Malformación arteriovenosa
Total de casos manejados 34, de éstos dos casos no presentaron respuesta, 12 casos respuesta parcial a la radiocirugía, en seis casos la lesión obliteró en menos de un año posterior a la radiocirugía, en 12 casos la lesión obliteró entre 1.1 a 2 años postratamiento, y en dos casos la lesión obliteró a más de dos años del tratamiento.
Sólo se presentó hemiparesia como complicación asociada a la radiocirugía. La media de seguimiento fue de 19 meses.
Meningioma
Se trató un total de 22 casos, de los cuales tres presentaron respuesta por estudio de imagen menor al 50%, cinco casos respuesta de 50 a 80% y 14 casos respuesta mayor 80% por estudio de imagen postratamiento.
Se presentaron disestesias faciales asociadas a la radiocirugía. Media de seguimiento 18.5 meses.
Astrocitomas
Se trató un total de 18 casos de los cuales, tres presentaron respuesta por estudio de imagen (TC o RM) menor de 50%, un caso respuesta del 50 al 80% y 14 casos respuesta mayor del 80% postratamiento.
No se presentaron complicaciones asociadas a la radiocirugía. Tres pacientes fallecieron por causas no asociadas al tratamiento, dos de ellos por progresión de la enfermedad y uno por tromboembolismo pulmonar. Media de seguimiento 21 meses.
Adenoma hipofisario
Se manejaron 11 casos, de los cuales dos presentaron respuesta por imagen ( TC o RM ) menor del 50%, cuatro casos respuesta de 50 a 80% y cinco casos respuesta mayor de 80% postratamiento.
Se logró el control hormonal en aquellos tumores funcionantes, en dos pacientes de forma temporal (menos seis meses) y cuatro pacientes de forma definitiva. No se presentaron complicaciones asociadas a la radiocirugía. Media de seguimiento 14.5 meses.
Angioma cavernoso
Cinco casos manejados de los cuales, dos presentaron respuesta por imagen menor a 50%, un caso respuesta entre 50 a 80%, y dos casos con respuesta mayor de 80% postratamiento.
Se presentó un evento de hemorragia no mortal. Media de seguimiento 16.5 meses.
Neurinoma del acústico
Tres casos manejados de los cuales uno presentó respuesta por imagen menor de 50%, un caso más respuesta entre 50 y 80% y otro caso más respuesta mayor de 80% postratamiento. No se presentaron complicaciones asociadas al tratamiento. Media de seguimiento 16 meses.
Craneofaringioma
Tres casos manejados de los cuales, los tres presentaron una respuesta por imagen mayor de 80% postratamiento.
No se presentaron complicaciones asociadas al tratamiento. Media de seguimiento 18.5 meses.
Los resultados para los dos casos tratados por epilepsia demuestran una respuesta satisfactoria con disminución del número de eventos e intervalo entre los mismos de forma considerable, sin observarse complicaciones asociadas al tratamiento.
Para el caso de las metástasis cerebrales, el paciente falleció cuatro meses posterior a la radiocirugía, secundario a progresión de su enfermedad, su tumor primario fue de pulmón.
Para el caso del ependimoma se obtuvo respuesta mayor 80% sin complicaciones asociadas al tratamiento.
Resultados de la comparación estadística de las variables estudiadas
Al investigar la asociación entre dos variables categóricas en una misma población, como se mencionó anteriormente se utilizó la prueba de  para independencia, con la finalidad de determinar la relación de dos variables estudiadas, es decir, determinar si la proporción de individuos en cada una de las categorías de una variable se modifica al cambiar las categorías de la otra variable. Se obtuvieron los siguientes resultados:
para independencia, con la finalidad de determinar la relación de dos variables estudiadas, es decir, determinar si la proporción de individuos en cada una de las categorías de una variable se modifica al cambiar las categorías de la otra variable. Se obtuvieron los siguientes resultados:
Relación entre el número de isocentros utilizados por tratamiento y el volumen blanco tratado. Al aplicar la prueba, ningún valor tuvo significancia estadística, sin embargo se mostró una tendencia de que con un volumen blanco > 4 cc se utilizaron dos isocentros, es decir, a mayor volumen blanco tratado mayor número de isocentros utilizados, pero esto como se mencionó sin significancia estadística.
Relación entre el número de arcos utilizados por tratamiento y el volumen blanco tratado. Al aplicar la prueba se obtuvo una significancia estadística adecuada p < 0.05, con respecto al volumen blanco tratado mayor 4 cc al relacionarlo con un número de arcos utilizados mayor de 6, es decir, se corrobora que a mayor volumen blanco tratado mayor número de arcos utilizados.
Relación entre la dosis recibida al 100% de órganos de riesgo y el volumen blanco tratado. Al aplicar la prueba, ningún valor tuvo significancia estadística por lo que la dosis recibida a órganos de riesgo durante el tratamiento no se correlaciona con el volumen blanco tratado.
Relación entre el margen de error durante el tratamiento y el volumen blanco tratado. Al aplicar la prueba se obtuvo significancia estadística adecuada, p < 0.05, al relacionar un margen de error > 2 mm con un volumen blanco tratado > 4 cc, con lo que se concluye que se tendrá un margen de error mayor al tratar un mayor volumen blanco.
Relación entre el número de isocentros utilizados por tratamiento y el margen de error. Al aplicar la prueba, no se obtuvieron diferencias estadísticamente significativas, pero existe una tendencia a presentar un mayor margen de error (> 2 mm ) a mayor número de isocentros utilizados.
Toxicidad: sólo en 3 casos : Caso 1. Meningioma petroclival. Tratado con un isocentro, diámetro colimadores utilizado 22.1 mm, volumen blanco tratado 9.51cc, dosis prescrita al isocentro 24 Gy. Desarrolló disestesias por afectación primera y segunda ramas sensitivas del trigémino. Caso 2. MAV tálamo. Tratada con un isocentro, diámetro de colimadores 19.1mm, volumen blanco tratado 1.59 cc, dosis prescrita a isocentro de 20 Gy. Desarrolló hemiparesia derecha.
Caso 3. Angioma cavernoso en mesencéfalo y protuberancia anular. Tratado con un isocentro, diámetro de colimadores utilizados de 13.1 mm, volumen blanco tratado 1.6 cc, dosis prescrita al isocentro 20 Gy. Presentó un nuevo evento de hemorragia no mortal. Los tres fueron tratados con un solo isocentro por lo que no podemos asociar que a mayor número de isocentros mayor morbilidad. El diámetro de los colimadores utilizados éstos fueron de 13.1, 19.1 y 22.1 mm, es decir, tampoco se pudo asociar un diámetro mayor del colimador a mayor posibilidad de complicaciones. El volumen tratado fue de 1.5 cc, 1.6 cc y 9.51 cc, este último valor corresponde al caso del meningioma. En relación a la dosis utilizada al ISC, estuvieron dentro del margen, excepto para el caso del meningioma donde se utilizó dosis de 24 Gy. Con lo anterior sólo se infiere que para el caso de la toxicidad relacionada en el paciente con meningioma, se tienen dos variables posiblemente asociadas como mayor dosis y mayor volumen tratado.
Dosis: En relación a las dosis prescritas al isocentro por entidad patológica, sólo en cuatro patologías se utilizaron dosis mayores a las referidas por la literatura, siendo éstas, meningiomas, gliomas, neurinomas del acústico y craneofaringioma, con resultados satisfactorios y sin incremento de morbilidad.
Discusión
Nuestros resultados muestran en orden decreciente las entidades nosológicas que con mayor frecuencia fueron tratadas: MAVs, meningiomas y gliomas. Con relación a otros grupos de estudio en USA e Inglaterra, la frecuencia en orden decreciente fue metástasis cerebrales, MAVs y meningiomas. A este respecto, nuestro estudio sólo incluyó un caso con metástasis cerebral. Los gliomas ocupan el cuarto escalón en frecuencias de tratamiento en las series comentadas.15
Resultados en relación a la dosis prescrita por entidad patológica en la Universidad de Florida (Friedman y cols.):6 MAV 10 – 25 Gy, meningioma 12.7 Gy, gliomas 12.7 Gy, neurinoma del acústico 12.5 – 22.5 Gy y metástasis 12.7 Gy.
Las MAVs, Betti y cols.,16 reportaron dosis no mayores de 40 Gy con curva de isodosis de 75% en 66 pacientes manejados con RC (radiocirugía) LINAC. Colombo y cols.,17 reportaron dosis de 18.7 a 40 Gy en 97 pacientes manejados con RC LINAC. Souhami y cols,18 reportaron dosis de 50 – 55 Gy en 33 pacientes manejados con RC LINAC. Loeffler y cols.,19 reportaron en 16 pacientes manejados con RC LINAC dosis de 15 – 25 Gy con curvas isodosis prescripción 80–90%. Flickinger y cols; en la Universidad de Pittsburgh, demostraron que con dosis de 22– 29 Gy se lograban excelentes resultados con 95% de obliteración del nido de la MAV y disminución en la incidencia de hemorragia.15
Con respecto a los meningiomas, Hakim y cols,20 reportaron la experiencia con 155 meningiomas manejados con LINAC, utilizando márgenes de dosis 9.4 – 25 Gy, media 17.8 Gy, con dosis al margen del volumen blanco de 9 – 20 Gy, media 15 Gy. En tres series más de la literatura,15 se utilizaron dosis entre 12 – 18 Gy, dosis media 15 – 16 Gy.
Para el caso de los gliomas, la Universidad de Pittsburgh y la JCRT (15), reportan margen de dosis utilizado de 12 – 16 Gy para volumen blanco menor 10 cc.
En el manejo de adenomas hipofisiarios, Mitsumori y cols.,21 reportaron márgenes de dosis utilizados entre 8 – 20 Gy ( media 14.5 Gy). Lunsford y cols.,15 en la Universidad de Pittsburgh reportaron márgenes de dosis de 19 – 30 Gy para adenomas hipofisarios funcionales, y 16 – 20 Gy para no funcionales.
Para el manejo de angiomas cavernosos, tres series (Universidad Pittsburgh, Clínica Mayo y Hospital Komaki City) reportaron a 180 pacientes manejados con dosis media de 16 – 18 Gy.15
Miller y cols han descrito15 que dosis mayores de 14–18 Gy para el caso de los neurinomas del acústico repercuten en un mayor grado de complicaciones.
Niranjan y cols.,15 reportaron rangos de dosis de 11 – 16 Gy para el manejo de los craneofaringiomas.
Dentro del manejo de la epilepsia refractaria a manejo convencional, Barcia – Salorio en España,22 reportó márgenes de dosis de 10 – 20 Gy.
Recientemente el grupo RTOG publicó recomendaciones en relación a la dosis a utilizar para el caso de metástasis cerebrales,23 en éstas se menciona que para metástasis < 20 mm utilizar dosis máximas de 24 Gy, tumores de 21 – 30 mm dosis de 15 – 21 Gy y para tumores de 31 – 40 mm dosis de 12 Gy.
En términos generales, las dosis utilizadas para las distintas entidades nosológicas tratadas en nuestro estudio corresponden a las reportadas en la literatura, a excepción de los meningiomas, gliomas, neurinomas del acústico y craneofaringiomas en los que se usaron dosis mayores a las reportadas por la literatura.
En relación a las MAVs, Flickinger y cols. En la Universidad de Pittsburgh15 demostraron que el margen de dosis para lograr una obliteración del nido de la MAV en 95% de los casos oscila entre 22 – 29 Gy, porque con dosis menores los márgenes de obliteración decaen a menos de 80% y dosis mayores de 29 Gy no ofrecen mayor beneficio.
Así mismo, este mismo autor demostró el impacto del volumen tratado en relación a las secuelas asociadas a la radiocirugía, donde a mayor volumen tratado por arriba de 5 cc, con una dosis mayor de 12 Gy, se tendrá mayor porcentaje de secuelas asociadas a la radiocirugía.
Otro punto interesante es la observación realizada por este mismo autor en relación al impacto de la localización de la MAV y su correlación con la toxicidad demostrando que las lesiones ubicadas en el lóbulo frontal, temporal, parietal o cerebelo tendrán los menores márgenes de toxicidad asociados, en comparación con lesiones ubicadas en lóbulo occipital, ganglios basales, médula, tálamo, intraventriculares, puente o cuerpo calloso que tendrán los más altos márgenes de toxicidad asociada a la radiocirugía.
En nuestro estudio dado el número muy limitado de secuelas no se pudo correlacionar estas variables mencionadas como localización de la lesión, tamaño de la misma y dosis.
En ocho estudios recientes de la literatura15 con 1307 pacientes se ha demostrado que 79% de las MAVs obliteran después de tres años del manejo con radiocirugía. En nuestro estudio observamos mayor rango de obliteración a los dos años de terminado el tratamiento.
Brown y cols., en la Clínica Mayo,15 demostraron que la historia natural de una MAV es hacia la hemorragia, con un riesgo de hemorragia de 2.25% por año, con 29% de mortalidad en el primer evento de hemorragia y 23% de morbilidad significativa en dicho evento hemorrágico. Colombo y cols.15 mencionan que este riesgo de hemorragia disminuye con radiocirugía 4.8% durante los primeros seis meses hasta ser de 0% después de 12 meses, sin embargo Friedman y cols., en un análisis exhaustivo estadístico no demostraron alteraciones en el riesgo de hemorragia con la radiocirugía, con un riesgo mantenido de 3–4% por año.24 Por otra parte Karolinska y Karlsson,15 demostraron que la incidencia de hemorragia disminuye de forma proporcional a la dosis utilizada, con un riesgo de 2% por año con dosis 22 Gy hasta 1% por año con dosis 31 Gy.
En nuestro estudio, hasta el corte del seguimiento no se ha presentado una nueva hemorragia.
Flickinger y cols.,15 informan incidencia de 8% complicaciones posterior a la radiocirugía en MAVs, siendo las más comunes edema cerebral en 80% casos, crisis convulsivas en 20% casos y lesiones SNC en 19% casos, otras menos comunes como formación de quistes, estenosis vasculares.
Se han mencionado algunos factores predictivos de falla a radiocirugía en el manejo de MAVs,25 siendo los más importantes una dosis en la periferia del volumen tratado menor de 15 Gy, así como un volumen tratado mayor de 10 cc. En nuestros resultados, las dos fallas que se tuvieron en este grupo irradiado, sólo podemos corroborar que se trataban de volúmenes mayores de 10 cc, porque la dosis a periferia siempre fue mayor de 15 Gy.
Miller y cols.,15 han descrito una serie de factores predictivos de mayor incidencia de secuelas asociadas a la radiocirugía en pacientes tratados por neurinoma del acústico, estos factores son: neurofibromatosis tipo 2 asociada, diámetro tumor > 2 cm, longitud del nervio irradiado, cirugía previa, mujeres, planeación realizada con TAC ( mejores resultados planeación realizada con RMN), y dosis mayores de 14–18 Gy al isocentro.
A pesar de que en nuestro estudio utilizamos dosis mayores a esta recomendación en los tres casos de neurinomas del acústico, no observamos ninguna secuela.
Para el grupo de los meningiomas 10 reportes recientes de la literatura,15 coinciden en afirmar que no existen diferencias en el control local al utilizar dosis menores de 15 Gy y dosis mayores de 15 Gy, pero con la salvedad que a mayores dosis mayor margen de complicaciones esperadas, por lo que la recomendación es utilizar dosis promedio de 15–16Gy.
El riesgo de complicaciones dependerá de la dosis, siendo de 85% para dosis mayores de 19 Gy. Las lesiones al nervio trigémino se presentarán arriba de estas dosis. En nuestro estudio tuvimos una complicación en este grupo de pacientes caracterizada por afectación sensitiva del trigémino, corroborando lo antes mencionado ya que utilizamos dosis mayores al margen referido de 19 Gy.
Dentro del grupo de Angiomas cavernosos, tres recientes estudios ( Universidad Pittsburgh, Clínica Mayo y Hospital de la Ciudad de Komaki),15 han demostrado que el riesgo por año de hemorragia sin tratamiento es de 32–57%, y después de la radiocirugía disminuye a 7–9% por año, hasta los dos años y de 1–5% por año de los 2 a 6 años posterior a la radiocirugía. En nuestro estudio, observamos un caso de resangrado en este grupo de pacientes, el cual se presentó dos años posterior a la radiocirugía.
Para el caso de los adenomas hipofisarios, Lunsford y cols. En la Universidad de Pittsburgh,15 reportan márgenes control local 94% ( 46% regresión y 48% enfermedad estable) con disminución en los niveles hormonales en el caso de los funcionantes de un 15–25% de forma pasajera con una media de mantenimiento de esta mejoría hormonal de 16–20 meses, y mantenimiento de valores normales hormonales en el 50–60% de los casos. En nuestro estudio la media de mantenimiento de niveles hormonales normales para las respuestas pasajeras fue de seis meses solamente.
Para los gliomas se han reportado márgenes de media supervivencia con radiocirugía que van de 17 a 21 meses, con una probabilidad de supervivencia a dos años que oscila entre 20 – 41 %, y márgenes de reintervención quirúrgica de 19 a 50%.15 En nuestro estudio 83% de los pacientes manejados en este grupo siguen vivos a 21 meses media seguimiento.
Para las metástasis cerebrales se han reportado márgenes de control local a un año con radiocirugía de acuerdo al diámetro de la lesión, 92% para lesiones menores 1cm hasta 37% para lesiones mayores 3 cm, así mismo, de acuerdo a la dosis utilizada, 88% para dosis de 18 Gy hasta 29% dosis menores 15 Gy. Pirzkall y cols,15 reportaron los factores pronósticos relacionados a mala respuesta: enfermedad extracraneal, edad mayor 50 años, Karnofsky menor 80, volumen metástasis mayor 1.7 cc, no radioterapia externa holocráneo previa y más de una metástasis. En nuestro estudio sólo tratamos un caso en este grupo, el cual falleció por progresión de la neoplasia pulmonar de base. Dentro de los factores de mal pronóstico reportados anteriormente, nuestro único caso tratado presentaba los siguientes, edad mayor de 50 años, más de una metástasis (dos tratadas) y volumen mayor de 1.7 cc (1.8 cc caso tratado).
Una energía de fotones 6MV fue la utilizada en nuestros procedimientos, esto es debido a que la dosis máxima para fotones 6 MV es liberada a una profundidad aproximada de 1.5 cm, así a una profundidad de 15 cm la dosis se reduce un 40–50% de la dosis máxima. Debido a que la radiocirugía basada en el LINAC se basa en la suma de múltiples haces no coplanares hacia un punto común, es muy importante la dosis de entrada y salida del haz para asegurar una dosis alta al blanco y una rápida caída de la dosis fuera del volumen blanco. El uso de haces de fotones mayores de 10 MV es usualmente no indicado para la radiocirugía basada en el LINAC, ya que una gran dosis de salida asociada a una energía mayor del haz de fotones resulta en una menor caída de la dosis fuera del volumen blanco, como consecuencia volúmenes mayores de tejido cerebral normal reciben altas dosis de radiación.25
La ventaja del LINAC de asegurar altas dosis en el volumen blanco y una rápida y escalonada caída de la dosis fuera de él a través del sistema de múltiples haces no coplanares, sólo es cierto para aperturas del haz pequeñas, típicamente menores o iguales a 4 cm. Aperturas del haz mayores irradiarán mayor volumen de tejido cerebral normal, excediendo la tolerancia de éste, de ahí que la recomendación en la radiocirugía con LINAC sea tratar volumen blanco no mayor de 4 cm.,26 siendo este un criterio de inclusión para los pacientes que tratamos en este estudio.
En la radiocirugía con Gamma Knife se utilizan colimadores en el casco del equipo con aperturas en rango de 4 – 16 mm diámetro, por consiguiente el uso de una combinación de múltiples campos sobrepuestos o múltiples disparos es necesario para asegurar una dosis conformacional con decaimiento rápido. Esto lleva a la creación de áreas significativas con inhomogeneidad de la dosis en los puntos de sobreposición de los campos o disparos, prescribiéndose la dosis para cada disparo aproximadamente al 50% de su dosis máxima.
En distinción, la radiocirugía basada en el LINAC utiliza un solo colimador de uno o varios diámetros para cubrir el entero de la lesión, así mismo durante la planeación del tratamiento se debe definir la combinación óptima de los arcos convergentes no coplanares (usando colimadores seleccionados) para producir una dosis conformacional al volumen blanco y un decaimiento rápido de la dosis fuera de éste. La dosis en la radiocirugía basada en el LINAC se prescribe al punto o cerca del centro del volumen blanco, este punto es usualmente referido como isocentro del tratamiento; especial cuidado debe tenerse a la hora de seleccionar el tamaño del colimador para asegurar una mínima dosis periférica al volumen blanco, la cual debe ser aproximadamente 80% de la prescripción de la dosis al punto central, esto asegura una adecuada homogeneidad de la dosis en el volumen blanco. En algunas circunstancias, se necesitan volúmenes blanco no esféricos por la forma de la lesión, ameritando más de un isocentro para su tratamiento. Cuando múltiples isocentros son requeridos, debe tenerse especial cuidado en identificar y minimizar el volumen de la sobreposición de la dosis, lo cual es inevitable en muchas situaciones.27
Nedzi y cols., identificaron el volumen de la sobreposición de la dosis para tratamientos con múltiples isocentros como un factor asociado con el incremento en las complicaciones en la radiocirugía basada en el LINAC.28
La discrepancia en el número de colimadores obtenibles en Gamma Knife y en LINAC hace la diferencia en los resultados físicos. Para lesiones mayores de 18 mm de diámetro, en Gamma Knife y en LINAC, uno y otro sistemas producen tratamientos muy equivalentes : una alta línea de isodosis (89–90%) puede seleccionarse para cubrir a la lesión, produciendo una dosis homogénea al blanco y un gradiente descendente en la dosis. Para lesiones de 18 – 24 mm de diámetro, el Gamma knife no produce un haz colimado suficientemente grande para cubrir la lesión en un campo con una alta línea de isodosis, por lo que esta lesión debe cubrirse con una línea de isodosis muy baja (típicamente 50%), generando un tratamiento con una dosis inhomogénea (el doble de dosis más alto en el centro que en la periferia). Para lesiones mayores de 24 mm de diámetro, en el Gamma knife debe tratarse con múltiples isocentros cubriendo generalmente el volumen de la lesión con una línea de isodosis baja. En adición a esto, la sobreposición de los haces generada por los múltiples isocentros condiciona un gradiente de la dosis substancialmente más plano (disminución lenta de la dosis) que el que se presenta con un solo colimador generado en los sistemas del LINAC.29
Larson y cols., propusieron un modelo simplificado para categorizar el volumen blanco radioquirúrgico. Este sistema de clasificación es en función de los contrastes radiobiológicos y consideraciones anatómicas entre el volumen blanco y el tejido normal que lo acompaña.30
Este modelo de Larson sirve como un contexto importante para concebir protocolos radioquirúrgicos y tratar de forma individualizada a cada paciente.30
Categoría 1. Volumen blanco de respuesta tardía incluido dentro de tejido normal de respuesta tardía
Un ejemplo de esta categoría son las malformaciones arterio venosas (MAV), la cual consiste en un nido de vasos anormales entrelazados dentro de una matriz de células gliales. En este caso, los tejidos normal y blanco tienen valores bajos de alfa / beta y son expuestos a la misma dosis de radiación. El mecanismo que contribuye a la obliteración de la MAV después de la radiocirugía no ha sido completamente entendido, pero probablemente involucre la proliferación de células endoteliales resultando en oclusión de vasos pequeños en un tiempo largo, esto posiblemente debido a la producción de factores de crecimiento radioinducidos. Si se da una dosis con radiocirugía al volumen blanco de 20 Gy, el tejido periférico a escasos milímetros tendrá un decaimiento de la dosis aproximado a 5–10 Gy, haciendo una equivalencia con un fraccionamiento convencional de 2 Gy por día con radioterapia externa, el volumen blanco de respuesta tardía con alfa / beta de 2 tendrá una dosis equivalente a 100 – 200 Gy, semejante a la que recibirá el tejido sano también de respuesta tardía.31
Categoría 2. Volumen blanco de respuesta tardía rodeado por tejido normal de respuesta tardía
Como ejemplo está el meningioma, el cual usualmente no invade parénquima cerebral normal. En este caso, ambos tejidos normal y blanco son de respuesta tardía, alfa / beta bajo, pero son expuestos a diferentes dosis de radiación. Si se da una dosis de radiocirugía de 20 Gy al volumen blanco, en la periferia de éste, a escasos milímetros tendremos una dosis aproximada de 5–10 Gy, haciendo la equivalencia con fraccionamiento convencional de 2 Gy por día con radioterapia externa, el tejido anormal del volumen blanco de respuesta tardía ( alfa / beta de 2) recibirá 100–200 Gy, mientras que el tejido normal de respuesta tardía ( alfa / beta de 2 ) al recibir menor dosis de radiación en la periferia (5–10 Gy), recibirá un equivalente de sólo 10–30 Gy.31
Categoría 3. Volumen blanco de respuesta temprana incluido dentro de tejido normal de respuesta tardía
Los astrocitomas de bajo grado, en donde ambas células gliales normales y malignas residen dentro del volumen blanco. En estos casos, el tejido blanco tiene una alfa / beta de 10 y el tejido normal alfa / beta de 2, y son expuestos a la misma dosis de radiación. Si se da una dosis de radiocirugía de 20 Gy, en la periferia a escasos milímetros se tendrá un decaimiento de la dosis a 5–10 Gy. Por lo que haciendo una equivalencia con fraccionamiento convencional con 2 Gy por día de radioterapia externa, el tejido anormal del volumen blanco de respuesta temprana (alfa / beta de 10) recibirá una dosis equivalente a 50–100 Gy, mientras que el tejido normal de respuesta tardía ( alfa / beta de 2) recibirá la misma dosis de 20 Gy con equivalente de 100–200 Gy.31
Categoría 4. Volumen blanco de respuesta temprana rodeado por tejido normal de respuesta tardía
Un ejemplo de esta categoría son los glioblastomas y las metástasis. Es evidente que el tejido anormal (volumen blanco) con una alfa / beta de 10 experimenta un efecto radiobiológico equivalente a un fraccionamiento convencional de radioterapia externa de 50–100 Gy, mientras que el tejido normal con un alfa / beta de 2 experimenta un efecto radiobiológico equivalente a sólo un fraccionamiento convencional de radioterapia externa de 10–30 Gy. Esto lleva a que la dosis esperada en el volumen blanco sea lo suficientemente alta para matar a las células oxigenadas de forma efectiva, y por otra parte, las células hipóxicas, especialmente aquellas que pudieran estar cerca del margen del volumen blanco, puedan no recibir dosis suficiente, con la posibilidad de recurrencias. Esto no parece ser un problema importante en el caso de las metástasis, porque se tienen parámetros de control de 90%, sugiriendo incluso, mejoría en éstos al combinar una terapia fraccionada y radiocirugía que con sólo radiocirugía. Sin embargo, para pacientes con glioblastomas la recurrencia después de la radiocirugía es muy común, pero, los vasos que nutren al tumor se comportan como tejido de respuesta tardía con un alfa / beta de 2 por lo que reciben una radiación equivalente a un fraccionamiento convencional de radioterapia externa de 100–200 Gy, lo cual contribuye al mejor control del tumor.31
Larson en 1993,32 en un excelente artículo sobre la radiobiología de la radiocirugía, describió la correlación que existe entre las dosis de radiocirugía y las dosis con radioterapia con fraccionamiento convencional de 2 Gy por día, para lograr un efecto radiobiológico similar en tejidos de respuesta temprana y tardía. (Cuadro III).
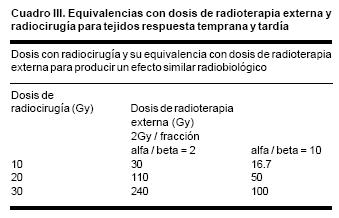
La tolerancia a la radiación del tejido normal del sistema nervioso central depende de un número de factores incluyendo la dosis total, dosis por fracción, tiempo total de tratamiento, volumen de tratamiento, calidad de la radiación y terapias adyuvantes. Como ya se mencionó anteriormente, la dosis brindada con radiocirugía presenta su equivalencia biológica con un fraccionamiento convencional con radioterapia externa dependiendo del tejido, si es de respuesta temprana o tardía, así pues, las dosis a considerar como tolerancia para los principales órganos de riesgo con radiocirugía son:
Nervio óptico 8 Gy, Tallo cerebral 10 Gy, Nervios craneales V, VII y VIII 15 Gy ,
Área sensitivo motora 18 Gy, Substancia blanca 20 Gy, Médula, Tálamo, Puente, Cuerpo Calloso y Sistema Intraventricular 12 Gy.33
Aunque existen otros efectos secundarios tardíos irreversibles en el sistema nervioso central condicionados por la radiocirugía, la radionecrosis es el más importante indicador de complicaciones tardías en la irradiación al sistema nervioso central.
Las reacciones en el cerebro irradiado son generalmente clasificadas de acuerdo al tiempo de presentación: reacciones agudas, reacciones subagudas y reacciones tardías. A pesar de que la radiocirugía se basa en la administración de radiación a un volumen blanco definido sin significativa irradiación al tejido cerebral adyacente, reacciones radioinducidas secundarias a la radiocirugía han sido reportadas.
Las reacciones agudas después de la radiocirugía son raramente reportadas incluyendo, reacción en la piel, fatiga y alopecia parcial. Loeffler y colaboradores reportaron náusea y vómito 6 horas después del tratamiento en 7 de 44 pacientes, estos síntomas perduraron por espacio de 12 horas después del tratamiento y se correlacionaban con la dosis recibida al área postrema. La dosis media al área postrema en pacientes sintomáticos fue de 618 cGy. Alopecia es raramente reportada después de radiocirugía. Las crisis convulsivas presentadas algunas horas después del tratamiento también han sido reportadas. Por esta razón en la mayoría de los centros de radiocirugía se premedica a los pacientes con anticonvulsivantes iniciando el día de la radiocirugía y manteniéndose por espacio de 7 días de terminado éste.33
Las reacciones subagudas pueden ocurrir de uno a seis meses posteriores a la radiocirugía, en general entre uno a tres meses. Usualmente los pacientes se presentan con signos y síntomas de deterioro neurológico o la aparición de un nuevo déficit neurológico. Estos últimos síntomas son más comúnmente asociados a la radionecrosis. Estudios de imagen (TAC, RMN) muestran un área incrementada de edema periférico a la lesión tratada, en estos casos el paciente es mejor manejado con esteroides. Con el manejo con esteroides, los síntomas usualmente se resuelven en un periodo de algunas semanas, suspendiendo posterior a esto el uso de los esteroides. Cuando los nervios craneales son involucrados, los síntomas son más focales y relacionados al nervio involucrado.34
Las reacciones tardías pueden ocurrir de uno a cinco años después de la radiocirugía o incluso más de 10 años de terminada ésta. Estas reacciones incluyen radionecrosis, parálisis de los nervios craneales, dependencia crónica a esteroides y desarrollo de nuevos tumores.
Los resultados reportados de radionecrosis varían. En la experiencia de Boston, radionecrosis sintomática se presentó en 18 (67%) de 27 pacientes, todos ellos requirieron eventualmente resección.35 Radionecrosis sintomática fue reportada en 2 (2.4%) de 84 pacientes estudiados por Breneman y cols;36 en 20 (16.7%) de 120 pacientes en el estudio de Stanford (37), y en 1 (1%) de 116 pacientes en el estudio de Flickinger.38
La mayoría de las hipótesis sobre la patogénesis de la radionecrosis la relacionan con un efecto primario de la radiación en las células gliales, en las células vasculares o en ambas.39
La aparición de una nueva parálisis de un nervio craneal es más típica de pacientes con tumores adyacentes a nervios craneales como tumores hipofisarios y lesiones del acústico.
Otra complicación adscrita a la radiocirugía es el edema persistente, el cual requerirá de manejo crónico con esteroides, con todas las complicaciones que esto implica. La aparición de esta complicación varía: 4 (7%) de 54 pacientes en la experiencia de Wisconsin,40 de 8% en el grupo de Boston,41 y 10.8% en el análisis de Flickinger,42
El desarrollo de nuevas neoplasias después de irradiación, ya ha sido documentado después del manejo con radioterapia externa, pero se necesitan estudios con un seguimiento muy largo para determinar la experiencia en radiocirugía, y determinar si es real este riesgo.43
La sensibilidad espacial de las imágenes con RM no ha sido bien establecida para cirugía estereotáxica, la susceptibilidad de los artefactos magnéticos puede llevar a distorsiones anatómicas y a inadecuadas coordenadas estereotáxicas con la RM (Resonancia Magnética), especialmente cuando el blanco está en regiones del encéfalo fuera del centro del campo magnético. Sin embargo, la guía de la RM para localización estereotáxica, provee mejor resolución multiplanar del blanco que con la TC (Tomografía computada).44
Existen varios estudios en los cuales se compara la sensibilidad de las coordenadas estereotáxicas determinadas por RM y TC; uno de estos estudios realizado con 41 pacientes (53 blancos) demostró que en el plano axial la distancia promedio de variación de la RM en relación a la TC es de 2.13 mm, con una media de 1.19 mm en el eje de las X, 1.55 mm en el eje de las Y, con una diferencia de 2.09 mm entre un blanco localizado en el centro y otro periférico.44
Landi y cols, realizaron un trabajo experimental mediante fantomas y encéfalos humanos fijos para determinar la extensión real de la distorsión de la RM en la localización estereotáxica comparada con la TC, las diferencias encontradas fueron de 1 mm en el eje de las X, 1 mm en el eje de la Z y 2 mm en el eje de las Y.45
En el caso de la neurocirugía funcional, Holtzheimer y cols. Realizaron un estudio en 83 pacientes para determinar la sensibilidad de la localización del blanco en talamotomías ventrolaterales y palidotomías posteroventrales demostrando que a pesar de existir una diferencia estadística, ésta es muy pequeña para las coordenadas del blanco con RM y TC.46
Yu y cols., realizaron un estudio para validar la sensibilidad geométrica por medio de un fantoma entre la TC y RMN con un sistema de localización estereotáxica, sus resultados arrojan valores de error máximos para el eje de las X de 1 mm, 0.4 mm para el eje de las Y, y 3.8 mm para el eje de las Z para la TC; los valores de error máximo para RM (Philips) fueron de 0.9 mm eje X, 0.2 mm eje Y, 1.9 mm eje Z; por último, para RM (Siemens) los valores fueron 0.4 mm eje X, 0.6 mm eje Y, 1.6 mm eje Z.47
Finalmente, Choi y cols., demostraron que la desviación total del isocentro en la totalidad del procedimiento de radiocirugía estereotáxica usando TC es de 1.3 mm.48
Así pues, se puede concluir en relación a la sensibilidad para las coordenadas estereotáxicas de la TC y RM, que la TC es exacta ya que se basa en densitometría, por esta razón, se le considera el estándar en precisión. La RM aunque muestra una extraordinaria definición anatómica, no tiene aún la precisión de la TC, por lo que requiere integrarse a ella. En la actualidad, todos los programas dedicados a la planeación de la RC, aunque empleen RM necesitan obligadamente del uso de TC. La tomografía constrastada de alta definición obtenida en los tomógrafos helicoidales de última generación, permiten observar la mayoría de la patología cerebral, incluso la localizada en la base del cráneo, en el tallo cerebral y en la región sellar. Por esta razón sólo se usó la RM cuando la TC fue inadecuada para visualizar los sitios a tratar. Cabe mencionar que existen contraindicaciones para el uso de la RM y entre éstas están, la presencia de material metálico magnético que haya sido empleado en la cirugía. Se considera que si la lesión es visible en una TC contrastada, no es necesario arriesgar la vida del paciente con una RM (por migración de grapas vasculares). El hecho de no contar con RM no impide dar tratamientos con radiocirugía, ya que la TC permite sustituirlo, a la vez, existen indicaciones específicas en radiocirugía que requieren de la RM como en los casos de neuralgia del trigémino y en transtornos del movimiento.49
De acuerdo a los resultados vertidos previamente las siguientes conclusiones de nuestro estudio son las siguientes:
La radiocirugía es un método seguro y confiable para el manejo de entidades patológicas benignas y malignas intracraneales.
Las dosis utilizadas en nuestra Institución son en términos generales semejantes a las reportadas en la literatura mundial
Las complicaciones tardías obtenidas en nuestra Institución están por debajo de las reportadas en la literatura mundial, haciendo mención que aun el tiempo de seguimiento no es el adecuado para establecer con certeza lo anterior.
Existe cierta tendencia de que a mayor volumen tratado mayor número de isocentros serán requeridos.
A mayor volumen tratado mayor número de arcos serán necesarios para brindar una adecuada distribución de la dosis.
La dosis recibida a órganos de riesgo periféricos a la lesión no se incrementa al tratar un volumen mayor de la lesión.
A mayor volumen tratado el margen de error dentro de la norma de calidad del procedimiento será mayor.
Existe una tendencia a presentar un mayor margen de error a mayor número de isocentros utilizados por tratamiento.
Se pudo corroborar que para el subgrupo de los meningiomas utilizar dosis mayores de 19 Gy se correlacionan con mayor toxicidad tardía.
Los resultados en cuanto a control local y supervivencia son semejantes a los reportados en la literatura mundial por subgrupo de entidad patológica tratada.
Por último recomendamos el siguiente esquema de rangos de dosis para el tratamiento de las distintas entidades patológicas intracraneales. (Cuadro IV).
Referencias
1. Zernoff DN. L'encephalomethre. Rev Gen Clin Ther 1890; 4:302–305. [ Links ]
2. Phillips MH, Stelzer KJ, Griffin TW, et al. Stereotactic radiosurgery: a review and comparison of methods. J Clin Oncol 1994; 12:1085–1099. [ Links ]
3. Leksell L. The stereotactic method and radiosurgery of the brain. Acta Chir Scand 1951; 102:316–319. [ Links ]
4. Lunsford LD, Flickinger J, Lindner G, et al. Stereotactic radiosurgery of the brain using the first United States 201 cobalt–60 source gamma knife. Neurosurgery 1989; 24:151–159. [ Links ]
5. Gunderson LL, Tepper JE, et al. Clinical radiation oncology. Churchill–Livingstone 2000:218. [ Links ]
6. Friedman WA, Bova FJ, Spiegelmann R. Linear accelerator radiosurgery at the University of Florida. Neurosurgery Clinics of North America 1992; 3:140–166. [ Links ]
7. Betti OO, Derechinsky VE. Hyperselective encephalic irradiation with linear accelerator. Acta Neurochir Suppl (Wien) 1984; 33:385–390. [ Links ]
8. Tsai JS, Buck BA, Svensson GK. Quality assurance in stereotactic radiosurgery using a standard linear accelerator. Int J Radiat Oncol Biol Phys 1991; 21:737–748. [ Links ]
9. Germano IM et al. Linac and Gamma Knife radiosurgery. The American Association of Neurological Surgeons 2000:20–26. [ Links ]
10. Lutz W, Winston KR, Maleki N. A system for stereotactic radiosurgery with a linear accelerator. Int J Radiat Oncol Biol Phys 1988; 14:373–381. [ Links ]
11. Steiner L, Forster D, Leksell L, et al. Gammathalamotomy in intractable pain. Acta Neurochir (Wien) 1980; 52:173–184. [ Links ]
12. Ramírez–Castañeda V. Radiocirugía con acelerador lineal. Gac Med Mex 2003; 139:572–578 [ Links ]
13. Mendez I, Namihira D, Moreno L y cols. El protocolo de investigación. 2000, México, Trillas.2ª. ed. [ Links ]
14. Tsai JS, Buck BA, Svensson GK, et al. Quality assurance in stereotactic radiosurgery using a standard linear accelerator. Int J Radiat Oncol Biol Phys 1991; 21:737–748. [ Links ]
15. 44th Annual Meeting of the American Society for Therapeutic Radiology and Oncology. 2002. [ Links ]
16. Betti OO, Munari C,Rosler R. Stereotactic radiosurgery with the linear accelerator: treatment of arteriovenous malformations. Neurosurgery 1989; 24:311–321. [ Links ]
17. Colombo F, Benedetti A, Pozza F, et al. Linear accelerator radiosurgery of cerebral arteriovenous malformations. Neurosurgery 1989; 24:833–840. [ Links ]
18. Souhami L, Olivier A, Podgorsak EB, et al. Radiosurgery of cerebral arteriovenous malformations with the dynamic stereotactic irradiation. Int J Radiat Oncol Biol Phys 1990; 19:775–782. [ Links ]
19. Loeffler JS, Alexander E III, Siddon RL, et al. Stereotactic radiosurgery for intracranial arteriovenous malformations using a standard linear accelerator. Int J Radiat Oncol Biol Phys 1989; 17:673–677. [ Links ]
20. Hakim R, Alexander E III, Loeffler JS, et al. results of linear accelerator–based radiosurgery for intracranial meningiomas. Neurosurgery 1998; 42:446–454. [ Links ]
21. Mitsumori M, Shrieve DC, Alexander E III, et al. Initial clinical results of LINAC–based stereotactic radiosurgery and stereotactic radiotherapy for pituitary adenomas. Int J Radiat Oncol Biol Phys 1998; 42:573–580. [ Links ]
22. Barcia JA, Barcia–Salorio JL, Lopez–Gomez L, et al. Stereotactic radiosurgery may be effective in the treatment of idiopathic epilepsy: report on the methods and results in a series of eleven cases. Stereotact Funct Neurosurg 1994; 63:271–279. [ Links ]
23. Shaw E, Scott C, Souhami L, et al. Radiosurgery for the treatment of previously irradiated recurrent primary brain tumors and brain metastases: initial report of Radiation Therapy Oncology Group protocol 90–05. Int J Radiat Oncol Biol Phys 1996; 34:647–654. [ Links ]
24. Friedman WA, Blatt DL, Bova FJ, et al. The risk of hemorrhage after radiosurgery for arteriovenous malformations. J Neurosurg 1996; 84:912–919. [ Links ]
25. American Association of Neurological Surgeons Task Force, American Society of Therapeutic Radiology and Oncology Task Force: Consensus statement on stereotactic radiosurgery: quality improvement. Neurosurgery 1994;34:193–195. [ Links ]
26. Colombo F, Benedetti A, Pozza F, et al. External stereotactic irradiation by linear accelerator. Neurosurgery 1985; 16:154–160. [ Links ]
27. Hartmann GH, Schlegel W, Sturm V, et al. Cerebral radiation surgery using moving field irradiation at a linear accelerator facility. Int J Radiat Oncol Biol Phys 1985; 11:1185–1192. [ Links ]
28. Nedzi LA, Kooy H, Alexander E III, et al. Variables associated with the development of complications from radiosurgery of intercranial tumors. Int J Radiat Oncol Biol Phys 1991; 21:591–599. [ Links ]
29. Lyman JT, Phillips MH, Frankel KA, et al. Stereotactic frame for neuroradiology and charged particle Bragg peak radiosurgery of intracranial disorders. Int J Radiat Oncol Biol Phys 1989; 16:1615–1621. [ Links ]
30. Larson DA, Loeffler JS, Flickinger J. Radiobiology of radiosurgery. Int J Radiat Oncol Biol Phys 1993; 25:557. [ Links ]
31. Hall EJ, Brenner DJ. The radiobiology of radiosurgery: rationale for different treatment regimens for AVMs and malignancies. Int J Radiat Oncol Biol Phys 1993; 25:381–385. [ Links ]
32. Larson DA. Radiosurgery dose and corresponding total radiotherapy dose. Int J Radiat Oncol Biol Phys 1993; 12:557–561. [ Links ]
33. Loeffler JS, Siddon RL, Wen PY, et al. Stereotactic radiosurgery of the brain using a standard linear accelerator: a study of early and late effects. Radiother Oncol 1990; 17:311–321. [ Links ]
34. Sheline GE, Wara WM, Smith V. Therapeutic irradiation and brain injury. Int J Radiat Oncol Biol Phys 1980; 6:1215–1228. [ Links ]
35. Alexander E, moriarty TM, Davis RB, et al. Stereotactic radiosurgery for the definitive, noninvasive treatment of brain metastases. J Natl Cancer Inst 1995; 87:34–40 [ Links ]
36. Breneman JC, Warnick RE, Albright RE, et al. Stereotactic radiosurgery for the treatment of brain metastases; results of a single institution series. Cancer 1996; 79:551–557 [ Links ]
37. Joseph J, Adler JR, Cox RS, et al. Linear accelerator based stereotactic radiosurgery for brain metastases: the influence of number of lesions on survival. J Clin Oncol 1996; 14:1085–1092. [ Links ]
38. Flickinger JC, Kondziolka D, Lunsford LD, et al. A multi–institutional experience with stereotactic radiosurgery for solitary brain metastasis. Int J Radiat Oncol Biol Phys 1994; 28:797–802. [ Links ]
39. Schultheiss TE, Stephens LC, Maor MH. Analysis of the histopathology of radiation myelopathy. Int J Radiat Oncol Biol Phys 1988; 14:27–32. [ Links ]
40. Boyd TS, Mehta MP. A comprehensive review of the role of radiosurgery in patients with intracranial metastases. Radiosurgery 1997; 2:31–50 [ Links ]
41. Loeffler JS, Alexander E. Radiosurgery for the treatment of intracranial metastases. Stereotactic Radiosurgery,McGraw–Hill,NY, 1993. [ Links ]
42. Flickinger JC, Kondziolka D, Lunsford. Principles of dose prescription and risk minimization for radiosurgery. Porg Neural Surg 1998; 13:39–50. [ Links ]
43. Danoff BF, Cowchock FS, Marquette C, et al. Statement of the long term effects of primary irradiation therapy for brain tumors in children. Cancer 1982; 4:1580–1586. [ Links ]
44. Kondziolka D, Dempsey PK, Lunsford LD, et al. A comparison between magnetic resonance imaging and computed tomography for stereotactic coordinate determinatior. Neurosurgery 1992; 30(3):402–406. [ Links ]
45. Landi A, Marina R, DeGrandi C, et al. Accuracy of stereotactic localization with magnetic resonance compared to CT scan: experimental findings. Acta Neurochir 2001; 143(6):593–601. [ Links ]
46. Holtzheimer PE, Roberts DW, Darcey TM. Magnetic resonance imaging versus computed tomography for target localization in functional stereotactic neurosurgery. Neurosurgery 1999; 45(2):290–297. [ Links ]
47. Yu C, Apuzzo ML, Zee CS, et al. A phantom study of the geometric accuracy of computed tomographic and magnetic resonance imaging stereotactic localization with the Leksell stereotactic system. Neurosurgery 2001; 48(5):1092–1098. [ Links ]
48. Choi DR, Ahn YC, Kim DY, et al. Accuracy in target localization in stereotactic radiosurgery. Med Dosis 1997; 22(1):53–58. [ Links ]
49. Karger CP, Hipp P, Henze M, et al. Stereotactic imaging for radiotherapy: accuracy of CT, MRI, PET and SPECT. Physics in Medicine and Biology 2003; 48(2):211–221. [ Links ]














