Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.4 Ciudad de México jul./ago. 2005
Artículo original
Diferencias somáticas, bioquímicas y de presión arterial al finalizar la adolescencia, según el peso al nacer
Somatic, biochemical and arterial pressure at the end of adolescence, according to weight at birth
Isabel García de Quevedo–Landa,ª Leopoldo Vega–Franco,ª* María del Carmen Iñarrituª Oscar C. Thompson–Chagoyan,b Maricarmen Lopéz–Moreno,c Marcial Huerta,c Silvia Villanueva–Recillas
ª Departamento de Salud Pública Facultad de Medicina, UNAM, México, D. F., México
b Departamento de Pediatría, Hospital General de Zona 1 A Los Venados, IMSS, México, D. F., México
c Laboratorio Central, Hospital General Manuel Gea González, SSA, México, D. F., México
*Correspondencia y solicitud de sobretiros:
Dr. Leopoldo Vega Franco.
Depto. de Salud Pública, Facultad de Medicina, Universidad Nacional Autónoma de México Ciudad Universitaria, Delegación Coyoacán
Recibido en su versión modificada: 30 de septiembre de 2004
Aceptado: 6 de diciembre de 2004
Resumen
Objetivo: Investigar las discrepancias somáticas, bioquímicas y de presión arterial según el peso al nacer.
Material y métodos: Se estudiaron 53 jóvenes que nacieron con peso < 2500 g y 100 jóvenes con peso normal. Variables: somatometría, presión arterial, y concentraciones en suero de glucosa, insulina, colesterol y triglicéridos. Se estudió la presencia de resistencia a la insulina y de síndrome metabólico.
Resultados: Los varones nacidos con peso normal tuvieron mayor colesterol en suero, pliegue tricipital y resistencia a la insulina. Las diferencias en resistencia a la insulina persistieron por razón de momios. En los de peso bajo al nacer, a menor peso mayor concentración de glucosa. Se encontró sobrepeso obesidad en 30% (46/153) y síndrome metábólico en 10% (14/140): la frecuencia de éste aumentó con el IMC; de 2% (2/100) en eutróficos a 30 % (12/40) en quienes tenían sobrepeso obesidad.
Conclusiones: Los hallazgos resaltan la magnitud de la adiposidad y del síndrome metabólico en jóvenes.
Palabras clave: Sobrepeso–obesidad, síndrome metabólico, resistencia a la insulina, hipótesis de Barker
Summary
Objective: To investigate in young people differences among somatic measurements, biochemical issues and arterial tension, according to weight at birth.
Material and methods: 53 youth born with body weight <2500 g, and 100 born with normal weight were studied. Variables: somatic measurements, arterial pressure, glucose, insulin, cholesterol and triglycerides. Insulin resistance and metabolic syndrome were also evaluated.
Results: Men born with normal weight had higher cholesterol and resistance to insulin. Differences persisted for odds ratio. Those born with <2500 g had a negative correlation among weight at birth and glucose level. Overweight–obesity was found in 30.0% (46/153) and the metabolic syndrome in 10% (14/140); the frequency of this syndrome increased with the IMC was higher: from 2.0% (2/100) in eutrophics to 30% (12/40) in those with overweight–obesity.
Conclusions: The findings stand out the magnitude of the adiposity and of the metabolic syndrome in youths.
Key words: Overweight–obesity, metabolic syndrome, insulin resistance, hypothesis of Barker
Informes de estudios publicados en años recientes han estimulado al debate acerca del "origen fetal" de enfermedades crónicas en la vida adulta. Barker,1 el autor de esta hipótesis, propone que cuando el feto es sometido a una deficiencia de nutrimentos, su organismo se adapta a esta eventualidad y adquiere la particularidad metabólica de ser "ahorrativo" (thrifty phenotype).2 En la vida postnatal, esta peculiar expresión fenotípica se atribuye a quienes nacen con peso bajo y se considera que éste es un factor de riesgo para desarrollar en la vida adulta diabetes mellitus tipo 2, accidentes cardiovasculares, obesidad, e hipertensión.3–9 La mayoría de estos estudios procede de naciones desarrolladas.3–7Son pocos los informes que tienen como origen países en vías de desarrollo,8,9 a pesar de que es en éstos donde ocurre la mayor incidencia de niños con peso bajo al nacer y de que la Organización Mundial de la Salud (OMS) considera que las muertes por enfermedades cardiovasculares en estos países es ya el doble de lo que ocurre en naciones desarrolladas. De ser cierta esta presunción, el peso bajo al nacer estaría involucrado en la actual epidemia de obesidad y de diabetes tipo 2 que aqueja al mundo.10
Las evidencias que dan sustento a la teoría de Barker son aún motivo de intensa polémica; la gran mayoría de las investigaciones, que inicialmente tuvieron interés en probar el origen fetal de las enfermedades crónicas, en años recientes se han centrado en la búsqueda de discrepancias bioquímicas y metabólicas en etapas de la niñez y en la pubertad. Es en este sentido que se planeó un estudio de carácter exploratorio, en sujetos que están a punto de culminar su adolescencia, con el propósito de buscar posibles divergencias somáticas, bioquímicas y de tensión arterial, en los que nacieron con un peso <2500 g. Los resultados son el motivo de este informe.
Material y métodos
Los sujetos de estudio provienen de una cohorte de 894 estudiantes que ingresaron a la Facultad de Medicina de la Universidad Nacional Autónoma de México, en el ciclo escolar 2002–2003. Con objeto de identificar quiénes de ellos sabían su peso al nacer, se hizo una encuesta de la que se obtuvo información acerca de su edad, sexo, peso al nacer, lugar que ocupaban entre sus hermanos y si habían nacido de parto múltiple. De esta manera se identificaron 100 jóvenes, aparentemente sanos, nacidos de parto único, con peso <2500 g; de ellos, se excluyeron a 12 por asistir a clase en el horario vespertino (debido a la dificultad para obtener en ellos una muestra de sangre en ayuno). Se invitaron a participar a 88 y de ellos accedieron 53. Éstos formaron parte del grupo de peso < 2500 g.
Entre los 894 que mencionaron en la encuesta haber nacido con un peso >2500 g, 209 pesaron al nacer entre 3200 y 3500 g, el cual se consideró apropiado para niños de 40 semanas; de éstos, 21 fueron excluidos por asistir a clase en el horario vespertino y 88 se negaron a participar. Así, este grupo estuvo integrado por 100 jóvenes (figura l). La razón entre uno y otro grupo: (<2500 g y de 3200 g a 3500 g), fue de 1:1.89.

De acuerdo con el propósito de la investigación se planeó obtener mediciones somáticas en los jóvenes que aceptaron participar en el estudio, con especial interés en aquellas que permiten identificar un aumento en el contenido de grasa corporal. También se obtuvo en ellos, entre las 7:00 y 8:00 am, una muestra de sangre en ayuno para cuantificar las concentraciones en suero de glucosa, insulina, colesterol y triglicéridos; además se les midió su presión arterial. Antes de reclutarlos se les informó por escrito, de manera detallada, en qué consistía la investigación y su derecho a negarse a seguir colaborando en el momento en que así lo decidieran. El proyecto fue aprobado por la Coordinación de Investigación de la Facultad de Medicina de la Universidad Nacional Autónoma de México.
Mediciones
Somatometría. Previo a un ejercicio de homogenización de mediciones somatométricas por dos de los autores se tomaron por duplicado las mediciones, de peso y talla, de los perímetros de cintura, cadera y brazo izquierdo, y el grosor de los pliegues tricipital y bicipital. Todas estas mediciones se hicieron de acuerdo a las recomendaciones que se han dado a este respecto.11 El peso se obtuvo en una báscula de pie (marca Torino®, México) con aproximación de 100 g. Para la talla se fijó una cinta métrica a una pared, en la que los sujetos se colocaban erguidos, en posición vertical, y con una escuadra de madera se obtuvo la medición de su estatura, con aproximación a 1 mm.Para medir los pliegues cutáneos se usó un plicómetro Lange® (Cambridge, Maryland, E.U.A.) y para obtener los perímetros, una cinta de fibra vidrio con aproximación a 1 mm. Algunas de las mediciones se usaron para calcular dos índices: el de masa corporal (IMC) (peso en kg/talla en m2) y el de cintura–cadera (perímetro de la cintura/ perímetro de la cadera). Para el IMC se consideraron los puntos de corte sugeridos por la OMS: delgadez < 18.5, eutrofia de 18.5–24.9, sobrepeso de 25–29.9 y obesidad > 30; para el perímetro de cintura: hombres >102 cm, mujeres >88 cm.12
Presión arterial. La tensión arterial se obtuvo con un esfigmomanómetro de mercurio. Las mediciones se hicieron por duplicado en el brazo derecho de los jóvenes en posición sedente y frente al observador, siguiendo las recomendaciones que se han dado.13 Para facilitar el análisis de esta variable se estimó la presión media (presión media sistólica + diastólica/2).
Estudios bioquímicos. Para la cuantificación de las variables bioquímicas se obtuvieron muestras de sangre en ayuno, las cuales fueron preservadas en un termo hasta ser centrifugadas 30 a 60 minutos después. Para la cuantificación de los lípidos se usaron varios métodos: la determinación del colesterol total se hizo por el método enzimático de colesterol–oxidasa; el colesterol de alta densidad (HDL–C) se obtuvo después de precipitar las lipoproteínas que no eran de alta densidad (no–HDL) mediante un reactivo de magnesio–dextan empleando el método de homogéneos. Los triglicéridos fueron analizados por el método GPO. El colesterol de baja densidad (LDL–C) se calculó con la ecuación de Friedewald. La determinación de la glucosa se hizo por el método de la glucosa oxidasa. Ambos, el perfil de lípidos y la concentración de glucosa fueron analizados en un equipo Synchron CX–70 (Beckman Coulter, Fullerton CA). La determinación de la insulina se hizo mediante el método de quimioluminiscencia usando un equipo modelo Access® (Beckman Coulter, Fullerton CA).
Con las determinaciones de insulina y glucosa en ayuno, se estimó la resistencia a la insulina, usando con este propósito la fórmula HOMA (Homeostasis Model Assesment):14 HOMA = Insulina (mU/ml) x glucemia (mmol) ÷ 22.5.
Para identificar el Síndrome Metabólico, se optó por el criterio sugerido en el Reporte III del Panel para el Tratamiento de los Adultos (ATP III) del Programa Nacional de Educación para Adultos en Colesterol (NCEP), que considera los siguientes puntos de corte: a circunferencia abdominal: hombres >102 cm, mujeres >88 cms; triglicéridos: > 150 mg/dl; colesterol HDL: hombres <40 mg/dl, mujeres <50 mg/dl; presión arterial > 130/ 85 (mm/Hg); glucosa sanguínea en ayuno > 110 (mg/dl).15
Análisis de los datos. Para concentrar la información en una base de datos se usó el programa EPINFO 6.04. A partir de esta base se usó el programa SPSS 10.0 para el análisis de la información. Se usaron pruebas de hipótesis de estadística paramétrica: prueba de t, correlación de Pearson, y de no paramétrica: 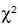 , prueba de Mann–Whitney, correlación de Spearman y razón de momios (RR).
, prueba de Mann–Whitney, correlación de Spearman y razón de momios (RR).
Resultados
El promedio de edad de los 153 jóvenes fue de 19 ± 1.1 años. De 18 a 20 años fueron 142 (92.8 %); 2 (1.3 %) fueron de 17 años y 9 (58 %) tenían una edad comprendida entre 21 y 25 años. La razón entre los hombres con peso <2500 g/3200–3500 g, fue de 1:3.1 (13/40), y en las mujeres fue de 1:1.7 (37/ 63). Entre uno y otro grupo no hubo diferencias en cuanto al lugar que ocuparon al nacer, y en la frecuencia con la que dijeron que sus padres y hermanos padecían de obesidad, hipertensión, diabetes o enfermedades cardiovasculares.
Al analizar los datos por sexo y peso al nacer, se evidenció la natural discrepancia somática entre hombres y mujeres: en cada grupo de jóvenes hubo diferencias significativas en peso, talla, perímetro de cintura, ICC y presión arterial a favor de los hombres, y en la circunferencia de cadera y panículos adiposos a favor de las mujeres. Lo que es importante notar, es que entre los nacidos con peso >2500 g la concentración de insulina (5.3 vs 10.5 mU/l) y el puntaje HOMA (1.04 vs 2.29) fueron más altos en las mujeres (p <0.05), y en el grupo de peso de 3200 g – 3500 g, los triglicéridos fueron más elevados en los hombres (117.3 vs 87.8 mg/dl, p<0.04) y el colesterol HDL en las mujeres (37.0 vs 42.1 mg/dl, p<0.005). En los nacidos con peso bajo, la presión distólica fue mayor en los hombres (66.5 vs 61.5 cm, p<0.001) y en los de peso normal al nacer, tanto en la presión diastólica como en la sistólica fueron más altas en los hombres (115.7165.8 vs 104.7/61.9, p<0.001 en ambas). Por otro lado, considerando los puntos de corte sugeridos por la OMS para el IMC, la distribución de frecuencias de los 153 jóvenes fueron las siguientes: con < 18.5 kg/m2 hubo 6 (3.9 %); entre 18.5 y 24.9 kg/m2, hubo 101 (66%) y con sobrepeso hubo 46, (30.0 %); de ellos, 34 (22.2 %) tuvo sobrepeso y 12 (7.8 %) obesidad.
La comparación de los promedios en mujeres y hombres de cada grupo de peso al nacer, se presenta en el cuadro I. Como se observa, entre las mujeres, no hubo ninguna diferencia, en cambio, los promedios fueron significativamente más altos en los hombres que pesaron al nacer de 3200–3500 g (en el pliegue tricipital: 12.5 mm vs 16.9 mm; en la concentración de insulina: 5.3 mU/ml vs 10.1 mU/ml; y en el puntaje HOMA: 1.04 vs 2.0 1).
Se realizó el análisis de cada variable en tablas de 2 x 2, de acuerdo a su mediana correspondiente en el grupo total. En el cuadro II aparecen los resultados de las variables que tuvieron diferencias significativas. En los hombres, que al nacer tuvieron 3200–3500 g de peso, el IMC, el pliegue tricipital, la insulina y el puntaje HOMA dieron diferencias significativas (p<0.05) para la 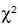 y al estimar el riesgo relativo con la razón de momios, éste fue 7.2 y 9.0 veces mayor. El peso al nacer < 2500 g mostró ser protector de tener un pliegue tricipital alto. Entre las mujeres no hubo divergencias.
y al estimar el riesgo relativo con la razón de momios, éste fue 7.2 y 9.0 veces mayor. El peso al nacer < 2500 g mostró ser protector de tener un pliegue tricipital alto. Entre las mujeres no hubo divergencias.
También en los hombres con <2500 g, con respecto a las mujeres, el peso corporal mostró ser un factor protector de valores altos en IMC (RM = 0.16, IC 95%: 0.02–0.96; la 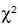 4.09 p<0.05). Por otro lado, en el pliegue tricipital, la estimación del riesgo relativo por la razón de momios, fue marginalmente significativa (RM =.0.22, IC 95%: 0.04 – 1.08;
4.09 p<0.05). Por otro lado, en el pliegue tricipital, la estimación del riesgo relativo por la razón de momios, fue marginalmente significativa (RM =.0.22, IC 95%: 0.04 – 1.08; 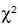 4.56). No hubo diferencia alguna entre hombres y mujeres que nacieron con un peso entre 3200–3500 g.
4.56). No hubo diferencia alguna entre hombres y mujeres que nacieron con un peso entre 3200–3500 g.
Se cotejaron las mediciones del pliegue tricipital, la insulina y el HOMA, según la distribución tercilar de estas variables de acuerdo al peso con que nacieron. En el cuadro III se puede observar que en los hombres, la 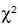 de tendencias fue significativa (p < 0.03): la frecuencia de sujetos con mediciones altas tuvo una tendencia a aumentar entre aquellos que nacieron con peso de 3200 – 3500 g, en tanto que en los que nacieron con un peso <2500 g tendieron a disminuir.
de tendencias fue significativa (p < 0.03): la frecuencia de sujetos con mediciones altas tuvo una tendencia a aumentar entre aquellos que nacieron con peso de 3200 – 3500 g, en tanto que en los que nacieron con un peso <2500 g tendieron a disminuir.
La correlación entre el peso al nacer y las variables bioquímicas de hombres nacidos con peso <2500 g no mostraron diferencias, excepto que la concentración de la glucosa tuvo una correlación inversa con el peso (r = –0.75, p < 0.001 ) de tal manera que a menor peso al nacer tuvieron una mayor concentración de glucosa al ser estudiados. Cabe hacer notar que en las mujeres con peso al nacer <2500 g, éste correlacionó negativamente con el IMC (r – 0.35, p < 0.034) y con la concentración de colesterol (r = 0.32, p = 0.05).
En cuanto al síndrome metabólico,el cuadro IV muestra la prevalencia entre hombres y mujeres que tuvieron tres o más factores de riesgo, según los criterios del ATP III(15) para calificar este síndrome; 14 (10%) del total de los jóvenes reunieron criterios de síndrome metabólico. También se puede observar la distribución de la frecuencia de ellos, de acuerdo a los puntos de corte para el IMC. Hubieron más jóvenes con sobrepeso y obesidad que tuvieron tres o más de los criterios del ATP III; en la mayoría de los eutróficos no se identificó el síndrome. Cabe mencionar que uno de los 11 varones y una de las 36 mujeres, con peso al nacer <2500 g, tuvieron tres criterios del ATP III, además de sobrepeso, y tres mujeres con peso al nacer < 2500 g más tres criterios y un IMC por arriba de 30 kg/m2 (obesidad).

Discusión
Los resultados de esta investigación no permiten verificar que el antecedente de haber nacido con un peso <2500 g, se asocie a diferencias somáticas y de presión arterial, en jóvenes a punto de concluir su segundo brote de crecimiento. El único dato a favor de la presunción planteada por Barker es el hecho de que los varones nacidos con peso <2500 g mostraron una correlación negativa entre la concentración de la glucosa y su peso al nacer: a menor peso al nacimiento, mayor concentración de glucosa. En las mujeres, la correlación fue negativa entre el peso y el IMC. En cambio, los que nacieron con peso de 3200 a 3500 g mostraron diferencias a su favor en el grosor del pliegue tricipital, el puntaje HOMA y la concentración de insulina, y cuando las variables fueron analizadas con enfoque de riesgo, persistieron las diferencias: el mayor peso al nacer se asoció con el IMC alto, lo que en ellos traduce una mayor adiposidad.
Es oportuno recordar que los estudios de índole transversal, como éste, tienen la limitación de no controlar otras variables que pudieran intervenir en el lapso que transcurre entre la causa —como el peso al nacer— y el efecto que se investiga; tales variables pueden magnificar o aminorar la dimensión de las consecuencias. No obstante esta limitación, los resultados obtenidos en estudios transversales, en esta línea de investigación, revelan cierta consistencia;16,17 aunque también hay discrepancias, sobre todo en investigaciones en las que los sujetos de estudio han sido niños, adolescentes y jóvenes adultos; ya que proporcionan argumentos a favor de esta hipótesis,18,19 en tanto que otros encuentran resultados negativos.20,21 Son los estudios longitudinales los que parecen sustentar la hipótesis planteada por Barker, aunque en varios de ellos no sólo se considera el peso al nacer, sino también la velocidad del crecimiento ponderal en la infancia o la niñez.
A este respecto, los autores de un estudio longitudinal, en el que la causa se ubicó en la etapa escolar y la adultez,22 señalan que la ganancia excesiva de peso entre los 7 y 23 años, es la variable que mejor correlaciona con los incrementos registrados en la concentración de insulina, triglicéridos, HDL–C y la presión arterial. Por otro lado, otro estudio prospectivo menciona que el peso al nacer está asociado al IMC de la madre y que es este índice el que mejor explica la asociación entre el peso al nacer y el IMC de sus hijos a los 33 años de edad. Con base a este hallazgo sugieren que éste puede ser un indicador importante para la predicción de obesidad.23
La trascendencia de estas observaciones resalta la importancia que pueden tener otras variables ambientales relacionadas con la obesidad y consecuentemente con el riesgo de enfermedades crónicas asociadas a esta condición. A este respecto, en una cohorte de afroamericanos seguidos desde su nacimiento hasta su adultez temprana (18–22.9 años), la velocidad con la que éstos ganaron peso los primeros cuatro meses de vida pudo haber predicho quiénes iban a padecer obesidad a la edad de 20 años.24 También en Finlandia, se ha observado que los que nacen con peso bajo y después del primer año de vida tienen una ganancia ponderal acelerada, están a mayor riesgo de padecer enfermedad oclusiva de las coronarias.25 Estos mismos investigadores habían divulgado antes una observación semejante: los que nacen con peso bajo y a los siete años tienen un IMC igual o mayor a lo esperado para su edad, están en mayor riesgo de morir por obstrucción de los vasos coronarios.7
Los resultados de estas investigaciones están a favor de las ideas de Hales y Barrer:2 de que al nacer el estigma del fenotipo ahorrativo que ocasiona la desnutrición intrauterina, los hace proclives a tener una recuperación acelerada de su déficit ponderal aun con una alimentación adecuada sin excesos. Se piensa que esta respuesta se debe a una disyunción de las células beta del páncreas, con la consecuente discapacidad funcional de la insulina secretada: que da lugar a la resistencia a esta hormona, lo que favorece en ellos la adiposidad.
Estos informes adquieren aún mayor relevancia ante el hallazgo de que la adiposidad y la hiperinsulinemia están ya presentes al nacer. Los neonatos nacidos en la India con mediciones somáticas significativamente menores a niños nacidos en Londres, discrepan de éstos en la concentración de glucosa, insulina y leptina en la sangre obtenida del cordón.26 Es razonable pensar que las consecuencias de esta discrepancia pueden después expresarse como resistencia a la insulina y diabetes tipo 2, tal como lo sugieren algunos informes,27,28 por lo que es necesario reconocer de manera temprana a los niños que tienen esta huella bioquímica. A este respecto se sabe que los niños que nacen prematuramente y tienen un crecimiento rápido en sus primeras semanas de vida entre los 13 y 16 años tienen una mayor concentración de un precursor de la insulina (proinsulina fraccionada 31–32), que los autores consideran puede ser un marcador bioquímico temprano de la resistencia a esta hormona.20
Todo parece indicar que además de los factores genéticos, los excesos en la alimentación y una vida sedentaria —a los que comúnmente se atribuye el sobrepeso y la obesidad— parece sensato añadir, como una condición más que favorece la incidencia de enfermedades crónicas, al peso bajo al nacer.10 Aunque en esta investigación sólo parecen ir a favor de esta idea la correlación negativa entre la concentración de la glucosa de los jóvenes nacidos con un peso <2500 g y su peso al nacer, es pertinente destacar que la frecuencia de sobrepeso–obesidad entre los 153 jóvenes de este estudio fue de 30% (46/153), que 10 (6.5%) de ellos (8 mujeres y 2 hombres), registraron un perímetro abdominal por arriba de 88 cm y 102 cm respectivamente, que la prevalencia del síndrome metabólico fue de 10% y que este síndrome aumentó en función del IMC, de 2% en los eutróficos a 30% en quienes tenían sobrepeso o estaban obesos. Estos datos resaltan la magnitud de la frecuencia de adiposidad y del síndrome metabólico en los jóvenes que frisan los 20 años; la adiposidad, dislipidemia, hiperglucemia y elevación de la presión arterial, como componentes de este síndrome, subyacen como antecedente de enfermedades cardiovasculares y diabetes. Un informe del estudio de Framinghain señala que el síndrome metabólico por sí sólo predice alrededor de 25% de todos los nuevos casos de enfermedades cardiovasculares.29 Por esto no se puede dejar de soslayar la trascendencia de los problemas asociados al sobrepeso–obesidad. En cuanto al hecho de no haber encontrado que el peso al nacer fuese causa de diferencias en la presión arterial, coincide con otros informes,30,31 uno de ellos es un estudio de meta–análisis de datos publicados en 50 informes relacionados con este tema.31
De acuerdo a la información proporcionada por estudios prospectivos y los hallazgos de estudios transversales, es deseable fomentar estudios longitudinales, que permitan identificar la interacción de factores que intervienen en el lapso entre la exposición y la enfermedad. De esta manera se podrían identificar aquellos que pueden ser factibles de modificar, para reducir el posible efecto sinérgico que pueda tener con el antecedente de haber tenido deficiencia de nutrimentos en la vida fetal.
Agradecimientos
Los autores agradecen a la QFB Silvia Villanueva Recillas, Jefa del Laboratorio del Hospital General Gea González SSA, las determinaciones bioquímicas realizadas en este estudio.
Referencias
1. Barker DJP. Mothers Babies and Health in later life. 2nd edition, London: Churchill Livingstone, 1998: 7–112. [ Links ]
2. Hales CN, Barker DJP. The thifty phenotype hypothesis. Brit Med Bull 2001; 60:5–20. [ Links ]
3. Ong KL, Ahmed M, Emmet P, Preece M, Dunger D. Association between postnatal catch–up growth and obesity in childhood: a prospective cohort study. BMJ 2000–320:967–971. [ Links ]
4. Leon D, Lithell H, Vagero D, Koupilova I, Mohsen R, Berglund L, et al. Reduced fetal growth rate and increased risk of death from ischaemic heart disease: cohort study of 15 000 Swedish men and women born 1915–29. BMJ 1998;317:241–245. [ Links ]
5. Rich–Edwards WJ, Stampfer MJ, Manson JE, Rosner B, Hankinson SE, Colditz GA. Birthweight and risk of cardiovascular disease in a cohort of women followed up since 1976. BMJ 1997;315:396–400. [ Links ]
6. Sparén P, Vagerö D, Shestov DB, Plavinskaja S, Parfenova N, Hoptiar V, et al. Long term mortality after severe starvation during the siege of Leningrad: prospective cohort study. BMJ, doi:10.116/bmj.37942.6039709A(publshed 5 December 2003) [ Links ]
7. Ericksson JG, Forsen T, Tuomilehto J, Winter PD, Osmond C, Barker DJP. Catch up growth in childhood and death from coronary heart disease: longitudinal study. BMJ 1999; 318:427–431. [ Links ]
8. Forrester T, Wilks R, Bennett F, Simeon D, Osmond C, Allen M, et al. Fetal growth and cardiovascular risk factors in Jamaican school children BMJ 1996;312:156–160. [ Links ]
9. Law C, Egger P, Dada 0, Delgado H, Kylberg E, Lavin P, et al. Body size at birth and blood pressure among children in developing countries. Int J Epid 2001; 30:52–57. [ Links ]
10. World Health Organization. World Health Report 2002. Shapenig the future. Ginebra: WHO, 2003. Chapter 6 and 7. [ Links ]
11. Lohman T, Roche A, Martorell R. Anthropometric standarization reference manual. 1a edición, Illinois: Hwnan Kinetics Books, 1988. p. 3–91. [ Links ]
12. VMO/FAO Experts Consultation. Report: Diet, nutrition and prevention of chronic diseases. Geneva: World Health Organization, 2002 (WHO Technical Report Series, 916). [ Links ]
13. World Health Organization–International Society of Hypertension. Guidelines for the management of hypertension. J Hypertension 1999; 63:184–188 [ Links ]
14. Fukushima M, Taniguchi A, Sakai M, Doi K, Nagasaka S, Tanaka H, et al. Homeostasis model assessment as a clinical index of insulin resistance: comparison with the minimal model analysis. Diabetes Care 1999; 22:1911–1915. [ Links ]
15. NHLBI/AHA. Definition of metabolic syndrome. Circulation 2004; 109:433–438. [ Links ]
16. Mogren I, Hoberg U, Stegmayr B, Lindahl B, Stenlund H. Fetal exposure, heredity and risk indicators for cardiovascular disease in a Swedish welfare cohort. Int J Epid 2001; 30:853–862. [ Links ]
17. Walker B, Connachie A, Noon J, Webb D, Watt G. Contribution of parental blood pressures to association between low birth weight and adult high blood pressure. BMJ 1998; 316:834–837. [ Links ]
18. Dabelea D, Pettitt DJ, Hanson RL, Imperatore G, Bennett PH, Knowler WC. Birth weight, type 2 diabetes, and insulin resistance in Pima Indian children and young adults. Diabetes Care 1999; 22:944–950. [ Links ]
19. Leger J, Levy–Marchal C, Bloch J, Pinet A, Chevenne D, Porquet D, et al. Reduced final height and indications for insulin resistance in 20 year olds bom small for gestational age: regional cohort study BMJ 1997; 315:341–347. [ Links ]
20. Singhal A, Fewtrell M, Cole TJ, Lucas A. Low nutrient intake and early growth for later insulin resistance in adolescents bom preterm. Lancet 2003; 361:1089–1097. [ Links ]
21. Jensen C, Storgaard H, Dela F, Holst J, Madsbad S, Vaag AA, et al. Early differential defects of insulin secretion and action in 19–year–old Caucasian men who had low birth weight. Diabetes 2002; 51:1271–1279. [ Links ]
22. Sinako A, Donahue RP, Jacobs DR, Prineas RJ. Relation of weight and rate of increase in weight during childhood and adolescence to body size, blood pressure, fasting insulin and lipids in young adults: The Minneapolis children's blood pressure study. Circulation 1999; 99:1471–1476. [ Links ]
23. Parsons T, Power C, Manor O. Fetal and early life growth and body mass index from birth to early adulthood in 1958 British cohort: longitudinal study. BMJ 2001; 323:1331–1335. [ Links ]
24. Li C, Jonson M, Goran M. Effects of low birth weight on insulin resistance syndrome in Caucasian and African American children. Diabetes Care 2001;24:2035–2042. [ Links ]
25. Eriksson JG, Tuomilehto J, Osmond C, Parker JP. Growth in utero and, during childhood among women who develop coronary heart disease: longitudinal study. BMJ 1999; 319:1403–7 [ Links ]
26. Veening MA, Van Weissenbruch MM, Heine RJ, Delemarre–van de Waal H. Betacell capacity and insulin sensitivity in prepuberal children born small for gestational age Influence of body size during childhood. Diabetes 2003;52:1756–1760. [ Links ]
27. Yajnik C, Lubree G, Rege S, Naik S, Deshpande JA, Deshpande SS, et al. Adiposity and hyperinsulinemia in Indians are present at birth. J Clin Endocrinol Metab 2002; 87:5575–5580. [ Links ]
28. Vaessen N, Janssen JA, Heutink P, y col. Association between genetic variation in the gene for insulin–like growth factor–I and low birth weight. Lancet 2002; 359:1036–1038. [ Links ]
29. Lakka HM, Laaksonen DE, Laaka TA, Niskanen LK, Kumpusalo E, Toumilehto J, et al. The metabolic syndrome and total and cardiovascular disease mortality in middle–aged men. JAMA 2002; 288:2709–2716. [ Links ]
30. Laor A, Stevenson DK, Shemer J, Gale R, Seidman DS. Size at birth, maternal nutritional status in pregnancy, and blood pressure at age 17: population based analysis. BMJ 1997; 315:449–453 [ Links ]
31. Huxley R, Neil A, Collins R. Unravelling the fetal origins hypothesis: is there really an inverse association between birth weight and subsequent blood pressure? Lancet 2002; 360:659–665. [ Links ]














