Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.2 Ciudad de México mar./abr. 2005
Artículos originales
Conceptos actuales sobre la muerte súbita
Current concepts on sudden death
Enrique Asensio,* René Narváez,* Joel Dorantes,* Jorge Oseguera,* Arturo Orea T,* Pablo Hernández R,* Verónica Rebollar G,* Lluís Mont,** Josep Brugada**
* Clínica de Arritmias y Marcapasos, Departamento de Cardiología. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
** Servei D'Arítmies, Hospital Clínic, Universidad de Barcelona, España.
Crespondencia y solicitud de sobretiros:
Dr. Enrique Asensio Lafuente
Cínica de Arritmias y Marcapasos, Departamento de Cardiología
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán
Vasco de Quiroga 15, Col. Sección XVI, Tlalpan, México 14000 D.F.
Tel/fax: 56553306
Correo electrónico: easensio@avantel.net
Recibido en su versión modificada: 14 de agosto de 2004
Aceptación: 2 de octubre de 2004
Resumen
La muerte súbita se define como aquella que ocurre antes de una hora de la aparición de los síntomas. Es una condición grave que en diversos países supone un problema de salud pública y que en México implica entre 33 y 53 mil muertes anuales, en su mayoría ligadas a enfermedad isquémica del corazón.
La causa primordial de la muerte súbita son las arritmias ventriculares graves, sin embargo determinar qué sujetos son susceptibles de tener un episodio arrítmico es complejo y por ello la relación costo efectividad de las medidas de estratificación de riesgo suele ser mala. En el presente trabajo se revisan las diferentes estrategias para determinar el riesgo de muerte súbita.
Las estrategias para el tratamiento oportuno de la muerte súbita relativas a la población general utilizadas en diversos países tienen impactos variables en la supervivencia, sin embargo, en las poblaciones seleccionadas con alto riesgo de padecer un evento arrítmico ventricular, la mejor terapia disponible actualmente es el desfibrilador automático implantable, aunque en el trabajo se discuten otras opciones de tratamiento. En nuestro país es necesario hacer un importante esfuerzo de detección prevención y tratamiento oportuno para limitar las consecuencia de este problema.
Palabras clave: Muerte súbita, arritmias ventriculares, estratificación de riesgo, variabilidad de la frecuencia cardiaca, desfibrilador automático externo, desfibrilador automático implantable
Summary
Sudden death is defined as the death occurring less than one hour before the onset of the patient's symptoms. It is a severe condition considered a public health issue in several countries and in ours, it accounts for 33 000 to 53 000 annual deaths mainly related to ischemic heart disease. The main cause of sudden death are severe ventricular arrhythmias, but determining what patients are at risk for such an episode is complex, that is why risk stratification is usually a low cost–effective intervention. In the present study, we describe different sudden death risk stratification strategies.
Different sudden death treatment strategies regarding general population have different success rates in different countries, nevertheless, among select high risk populations; the best therapy currently available is the automatic implantable cardioverter defibrillator. We also discuss other treatment options. In Mexico it is deemed necessary to do an important effort for the early detection, prevention and treatment of sudden death in order to limit the consequences of this problem.
Key words: Sudden death, ventricular arrhythmia, risk stratification, heart rate variability, external automated defibrillator, automatic implantable cardioverter–defibrillator
Introducción
La muerte súbita cardiaca es un problema de salud pública que en los Estados Unidos de Norteamérica supone alrededor de 300 mil muertes al año1 y en la Comunidad Económica Europea cerca de 400 mil.2 Hasta hace algunos años se trataba de un problema de difícil solución, en vista de que se desconocían muchos de sus aspectos fisiopatológicos. Los avances en el estudio de las arritmias, la cardiopatía isquémica y la insuficiencia cardiaca han permitido establecer estrategias de prevención, estratificación de riesgo y finalmente, tratamiento, que dan una perspectiva más amplia de este complejo problema, aunque sin resolver a satisfacción muchas de sus interrogantes. Nuestro país aún tiene limitaciones importantes, desde el conocimiento de la incidencia real del problema, hasta las diversas estrategias de tratamiento temprano y tardío que suponen costos importantes.
Definición del problema y epidemiología
La definición de muerte súbita más aceptada la describe como aquella que ocurre antes de una hora de aparición de los síntomas.1 Con esta definición, imperfecta, se ponen de manifiesto al menos dos aspectos relevantes: el primero es que se trata en la mayor parte de los casos, de una enfermedad cuyas manifestaciones son de inicio brusco (aunque pueda ser la agudización de un problema crónico) y muchas de las veces desconocida por el enfermo. El otro aspecto que queda patente es la necesidad de actuar con rápidez para realizar cualquier tipo de maniobra de reanimación o de rescate de estos enfermos, porque la muerte es inminente. Se pueden discutir otras definiciones considerando la temporalidad y la ausencia de enfermedad aparente, sin embargo la que se usa simplifica la comprensión de un problema de por sí complejo en el que el evento final es un fenómeno de inestabilidad eléctrica cardiaca que lleva a la aparición de una arritmia letal.
Los 300 mil casos de muerte súbita al año en los EEUU suponen una incidencia cercana a 12% como causa de muerte en una población general. De ellos, 88% son de origen cardiaco.3 Por otro lado, aproximadamente la mitad de los enfermos con insuficiencia cardiaca fallece por muerte súbita cardiaca (MSC),4–6 y de acuerdo a diversas series, la MSC ocurre entre 34 y 75% de todas las muertes coronarias.7,8
En la República Mexicana sólo se cuenta con información indirecta sobre la incidencia de muerte súbita. En 1999, entre 443,950 defunciones, la primera causa de muerte fue la cardiopatía, responsable de 69,278 fallecimientos. La cardiopatía isquémica causó 44,070 de ellos y se registraron 998 causas de muerte como "paros cardiacos".9 Si se hace una extrapolación de las cifras obtenidas en otros países, se podría hablar de alrededor de 53,000 muertes súbitas anuales en el nuestro, que corresponden 76% de las muertes cardiacas. Si se considera 75% de las muertes por cardiopatía isquémica, entonces se habla de aproximadamente 33 mil muertes súbitas anuales. Por otro lado, vale la pena mencionar que 997 de los 998 "paros cardiacos" ocurrieron en el grupo de edad entre 15 y 24 años. Esta información es poco precisa debido a que carece de un enfoque dirigido a detectar específicamente las muertes súbitas. Se puede asumir que el número de casos no es desdeñable y se debe tomar en cuenta al revisar los aspectos que se mencionarán más adelante.10–12
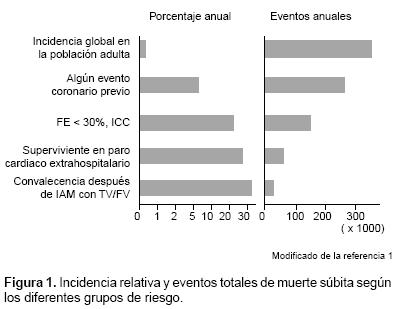
En la figura 1 se pone de manifiesto que proporcionalmente, la incidencia de MSC aumenta cuando se agregan factores de riesgo como infartos previos, fracciones de expulsión bajas y arritmias inducibles en un estudio electrofisiológico (EEF).13 Sin embargo, en una población general, identificar, y tal vez tratar, a los enfermos en riesgo de muerte súbita supondría costos enormes.14,15 Esta es una de las limitaciones más importantes dentro del estudio y prevención de este problema. De ahí la necesidad de buscar estrategias que permitan identificar a los sujetos de alto riesgo de una manera más precoz. Por esta razón también se intenta incidir sobre la población de alto riesgo que es más fácilmente identificable, como los supervivientes de un infarto de miocardio o los pacientes que se encuentren en una clínica de insuficiencia cardiaca.16
Aspectos generales
La muerte súbita puede ocurrir en el contexto de un individuo aparentemente sano o sin cardiopatía estructural, como se menciona más adelante. Puede presentarse también en el paciente que tiene una enfermedad cardiaca o puede ser el evento terminal de la enfermedad en otros sujetos. En estos últimos, la intervención para revertir el paro cardiaco debe ser evitada. Sin embargo, la necesidad de tratar a los enfermos que presenten el paro cardiaco como primera manifestación de una enfermedad arterial coronaria en su domicilio o en el sitio en el que presenten MSC es manifiesta. De acuerdo al estudio de Maastrich, sólo en 60% de las ocasiones17 los paros cardiacos son presenciados. También se demostró que la mortalidad de los pacientes que tienen un episodio de MSC en su domicilio es mayor que la de aquellos que lo tienen en la vía pública. Sólo 8% de los primeros es dado de alta de un hospital, mientras que el 18% de los segundos alcanza ese punto. Esto aparentemente tiene que ver con las condiciones favorables para alcanzar un equipo de desfibrilación más tempranamente.
De acuerdo al estudio de Bayés de Luna,18 aproximadamente 80% de las muertes súbitas son producto de taquiarritmia, ya sea taquicardia o fibrilación ventricular, y solamente 20% lo son de una bradiarritmia como ritmos idioventriculares, bloqueos auriculo–ventriculares o asistolia. Ese estudio establece la importancia de tratar a las taquiarritmias antes de que evolucionen hacia un ritmo "intratable" como la asistolia. Las mejores tasas de supervivencia se encuentran con las taquicardias ventriculares monomórficas (TVM), seguidas de la fibrilación ventricular (FV) y finalmente la asistolia. De estos hallazgos se deriva la importancia de la desfibrilación temprana, ya sea por personal médico o no.19 En el último caso, los esfuerzos se han dirigido a proveer con aparatos automáticos de desfibrilación externa a los llamados "primeros respondientes" como policías, bomberos, vigilantes u otras personas con un entrenamiento mínimo para su uso. Estos equipos, disponibles en lugares públicos, permiten un acceso casi inmediato a la terapia adecuada.20,21 En nuestro país no se han implementado estrategias de este tipo y sería importante que las sociedades académicas influyesen en ello. Uno de los aspectos importantes que ha sido tradicionalmente despreciado por los médicos, es el de la atención prehospitalaria. Se deben dar las condiciones para permitir que los tiempos de respuesta de las ambulancias con personal técnico entrenado y equipo de soporte vital avanzado se reduzcan drásticamente, porque actualmente rondan los 40 minutos (datos no publicados). Por otro lado, el personal técnico en urgencias médicas debe tener un entrenamiento específico y estandarizado sobre el que no hay legislación ni medios de certificación por la secretaría de salud, mucho menos planes de educación médica continua.
Causas de muerte súbita
Las causas de MSC son variadas. Ya se ha mencionado con insistencia a la cardiopatía isquémica, sin embargo hay otras causas miocárdicas conocidas como las cardiomiopatías hipertróficas, dilatadas, y las otras mencionadas en el cuadro I.

La cardiopatía isquémica tiene un papel relevante por su frecuencia. En este caso, las arritmias ventriculares letales sobrevienen como consecuencia de reentradas alrededor de cicatrices de infarto o en zonas de tejido isquémico. Estudios de autopsia muestran que sólo en 19% de los pacientes hay trombosis coronaria aguda, aunque de 40 a 75% tiene un infarto antiguo.8,22–24 Esto resalta la posibilidad de que haya un sustrato arrítmico primario relacionado con la cicatriz pero no necesariamente con isquemia activa. La presencia de fluctuaciones en el tono autonómico,25–27 alteraciones electrolíticas, tratamiento con fármacos antiarrítmicos, los intervalos de acoplamiento de las extrasístoles ventriculares y las presiones de llenado ventricular son elementos todos que pueden favorecer la aparición de arritmias ventriculares letales.28–31
Los pacientes con miocardiopatía hipertrófica deben ser clasificados como de origen idiopático o hipertensivo, y el pronóstico en uno y otro es diferente.32 En la segunda, la hipertrofia ventricular con sobrecarga sistólica y diastólica, reúne las condiciones necesarias para inducir desequilibrio de aporte–demanda de oxígeno en el miocardio, lo que se traduce en isquemia, que puede ser el sustrato final de las arritmias.33,34 La cardiomiopatía hipertrófica familiar o congénita, de la que hay varias formas y que por sí misma puede ser motivo de una revisión,35 tiene un origen diferente de las arritmias: el desarreglo de las fibras miocárdicas es el responsable de que se generen zonas de conducción lenta que favorecen la reentrada que origina la taquicardia. En esta población, el riesgo de tener un episodio de MSC es de entre 2 y 3% anual.36–38
La cardiomiopatía dilatada idiopática tiene una mortalidad que va de 25 a 45% anual, y de esta cifra, 30% son muertes súbitas.39,40 El único elemento que permite identificar pacientes de alto riesgo en este tipo de enfermos es la historia de síncope y la documentación de taquicardias ventriculares (TV). Si estas taquicardias se inducen durante un EEF en individuos con extrasístoles ventriculares y función ventricular deprimida, el riesgo de muerte súbita es elevado.8 Este tipo de enfermos presentan con mayor frecuencia una taquicardia ventricular por reentrada de rama a rama (Figura 2) que es susceptible de ablación por radiofrecuencia como tratamiento de elección.
Los enfermos con disfunción ventricular grave, independientemente de su origen, y en clase funcional IV de la NYHA tienen mortalidad superior a 50% anual.6,41 Como en los demás grupos, la influencia autonómica, los cambios electrolíticos y los propios fármacos antiarrítmicos pueden ser factores desencadenantes de arritmias ventriculares graves. Aquí sería importante enfatizar la diferencia entre un evento terminal de la enfermedad y un paciente con posibilidades de recuperación. Los enfermos que tienen TV inducible tienen un riesgo de recurrencia de 15 a 50%, aun con terapia antiarrítmica que elimine incluso la arritmia inducible. Nuevamente el síncope es un elemento que se asocia con incidencia de MSC de 45% anual.42–45
El síndrome de Wolf–Parkinson–White (WPW) es una causa frecuente de arritmias en el joven y tiene una incidencia baja de MSC: De acuerdo a algunas series es del 1 al 4% anual, incluso un estudio reciente en una población de militares mostró una incidencia del 0.02% anual en el seguimiento de 22 años de una población de 228 sujetos.46 El principal problema es la aparición de fibrilación atrial, que en caso de ser conducida hacia el ventrículo, puede provocar una fibrilación ventricular (FV). Esta eventualidad se asocia más frecuentemente con vías accesorias postero–septales, vías múltiples y un intervalo RR preexcitado menor a 250 ms.8,47
El síndrome de QT largo congénito, por una mutación en el gen SCN5A, induce un incremento en la función de los canales de sodio y por ello prolonga la despolarización y repolarización, además de disminuir el umbral de despolarización. Rara vez la MSC es la primera manifestación de este problema, pero es una eventualidad que puede ocurrir espontáneamente o como consecuencia del tratamiento antiarrítmico. Los individuos con historia de síncope, episodios previos de muerte súbita o historia familiar de muerte súbita tienen un riesgo mayor. Los individuos mayores de 30 años asintomáticos, sin historia de síncope, tienen un riesgo menor. Clínicamente se han descrito dos tipos de síndrome de QT largo, el asociado a sordera (Lange Jervell Nielsen), que tiene peor pronóstico, y el que no se asocia a sordera (Romano–Ward). Aun así, se han identificado al menos 7 mutaciones diferentes que lo provocan.8,48–51
Una rara entidad es la displasia arritmogénica del ventrículo derecho. Esta alteración muscular del ventrículo derecho se caracteriza por infiltración grasa y fibrosa del mismo. La extensión de la displasia determinará en buena medida la gravedad de los síntomas. Hay formas localizadas al tracto de salida del ventrículo y formas generalizadas. Su presentación va desde la extrasistolia ventricular frecuente, la TV sostenida o no sostenida hasta la FV. El pronóstico dependerá de la presentación clínica. Nuevamente, si se trata de síncope o muerte súbita, el riesgo de recurrencia de MSC es elevado. El compromiso del ventrículo izquierdo también implica un peor pronóstico.53,54
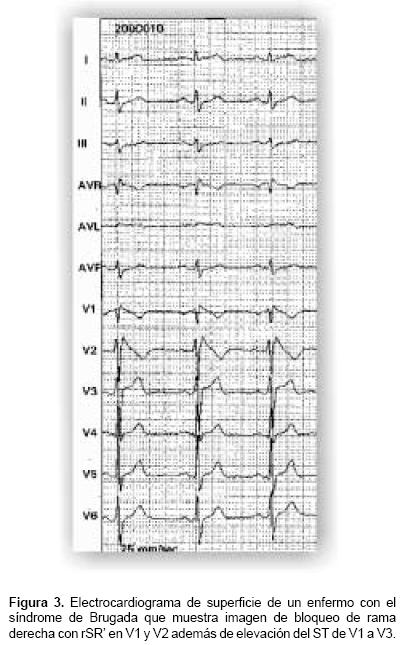
El síndrome de Brugada (Figura 3) es una entidad recientemente descrita, caracterizada por la presencia de imagen de bloqueo de rama derecha, elevación del ST de V1 a V3 y muerte súbita. Se sabe actualmente que es la primera causa de muerte súbita en hombres asiáticos jóvenes con corazón estructuralmente normal. La alteración primaria es disfunción de los canales de sodio, como en el síndrome de QT largo, pero aquí, a la inversa, hay disminución de la función de dichos canales. Esto hace más evidente el efecto de las corrientes repolarizadoras de potasio, con lo que se presenta disminución, aparentemente selectiva, en la duración del potencial de acción epicárdico del ventrículo derecho. Esto genera un gradiente epicardio/endocardio que favorece la dispersión de los periodos refractarios. Una característica de esta entidad es que así genera su propio sustrato y disparador, con lo que la aparición de TV o FV dependerá de la modulación autonómica. En nuestro país se han descrito ya algunos casos, aunque como ya se mencionó, su incidencia es de hasta 0.6% en Asia y en Europa se calcula que ésta se encuentra alrededor de 1:100,000 habitantes.54,55
Estratificación de riesgo
La estratificación de riesgo para la muerte súbita se ha convertido en una necesidad en muchos ámbitos que se ha ido haciendo cada vez más compleja. Como se mencionó al inicio, la necesidad de determinar quién puede tener un episodio de muerte súbita implica el estudio de una población que puede ser tan abierta o tan cerrada como se desee establecer.56,57 Por otro lado, a mayor riesgo, mayor beneficio potencial del tratamiento adecuado. Actualmente, las herramientas más potentes se centran en el estudio de riesgo en sujetos postinfarto y con insuficiencia cardiaca.58–64
La "dependencia temporal de riesgo" es un concepto relevante. Estudios como el CAST65 demostraron que en poblaciones postinfarto, las mayores tasas de muerte secundaria al evento "índice" se producen entre los 6 y 18 meses después del mismo. Después de ese lapso, la pendiente de las curvas de supervivencia es similar a las de los individuos que no han tenido enfermedades cardiovasculares.66 Esto puede relacionarse con la repercusión que los diferentes tratamientos pueden tener, o la corrección de factores de riesgo para cardiopatía isquémica o insuficiencia cardiaca, además de la presencia de factores neurohumorales aún no completamente caracterizados, que pueden explicar esta disminución de la mortalidad. Se sale de los objetivos de este trabajo abundar en esta temática, que sin duda genera una serie importante de investigaciones.67–73
Un elemento imprescindible para determinar el riesgo de MSC es conocer el sustrato de la probable arritmia responsable. Esto implica el estudio de las causas estructurales, las celulares y las bioquímicas para establecer un plan de acuerdo a los datos epidemiológicos conocidos.
No todas las herramientas para estratificación tienen las mismas cualidades en todas las enfermedades. Por ejemplo, la variabilidad del RR es útil en pacientes con cardiopatía isquémica, pero aún queda por determinar su importancia y confiabilidad real en casos de cardiomiopatía dilatada. La combinación de elementos puede ser útil para establecer un riesgo lo más próximo posible al real.74
La medición más fiable hasta el momento y con sus limitaciones, es la fracción de expulsión ventricular (FEV).75 La correlación que existe entre el grado de disfunción ventricular y la supervivencia es bastante precisa, y se sabe que los pacientes con FEV inferior 35% tienen tasas de mortalidad que van de 9 a 18% anual de acuerdo a varias series.76–80 Lo que la fracción de expulsión no permite discriminar es la modalidad de muerte. Aproximadamente la mitad de los enfermos con FEV baja fallece por falla de bomba y la otra mitad lo hace por muerte súbita arrítmica.81 De esta observación se deriva la necesidad de complementar este parámetro con otras herramientas. Se supone que los parámetros de función autonómica pueden ser la mejor opción, sin embargo los datos son contradictorios y hay estudios que muestran una utilidad marginal de la medición de la variabilidad del RR, por ejemplo.82
La prueba de esfuerzo (PE) es una herramienta que ha mostrado cierta utilidad.83,84 El ejercicio eleva las catecolaminas circulantes y con ello la frecuencia cardiaca, la presión arterial, la demanda miocárdica de oxígeno y puede inducir isquemia. Esta última a su vez puede asociarse a la pérdida del potencial de reposo de membrana, heterogeneidad de los periodos refractarios, incremento del automatismo y reducción de los periodos refractarios. El potencial arritmogénico de estos cambios es elevado. En una serie de pacientes postinfarto, la mortalidad a tres años iba de 10% en los que tenían una PE sin extrasístoles, a 25% de los que tenían extrasistolia ventricular compleja. Sin embargo, los estudios clínicos han mostrado gran heterogeneidad de resultados, por lo que en general, la prueba de esfuerzo tiene utilidad limitada para predecir eventos de muerte súbita.8,83
La variabilidad del RR (de la frecuencia cardiaca) ha suscitado recientemente gran interés debido a que se trata de una herramienta no invasora que permite evaluar el estado del equilibrio simpático–parasimpático y su influencia en la modulación de la frecuencia cardiaca: la disminución del tono vagal se asocia con una disminución de la variabilidad y aumento de la frecuencia cardiaca. Los parámetros para la medición de la variabilidad son en el dominio del tiempo y en el dominio de las frecuencias. En la clínica posiblemente sean los parámetros en el dominio del tiempo los más útiles, y en particular el SDNN (La desviación estándar del intervalo entre cada latido normal a normal).84–92 Un valor de SDNN inferior a 50 ms se asocia con incremento de 5.3 veces del riesgo relativo de desarrollar arritmias ventriculares malignas en presencia de cardiopatía estructural. Un valor de SDNN superior a 100 ms se asocia con un valor predictivo negativo muy elevado. La disminución en la variabilidad del RR predice la muerte cardiaca pero con mayor potencia, la muerte de origen arrítmico.86 En la clínica de insuficiencia cardiaca del INCMNSZ se ha encontrado que la disminución de la variabilidad se correlaciona con la clase funcional de los enfermos. Por otro lado, los controles durante el seguimiento de los pacientes han mostrado una tendencia a la disminución de la variabilidad, lo que debería suponer un incremento en el riesgo de arritmias graves secundario a la progresión de la enfermedad aun en sujetos controlados y con mejoría clínica en la clase funcional (resultados aún no publicados).
El ECG de señal promediada tiene utilidad particular en los enfermos con cardiopatía isquémica.93 Esto se debe a que las áreas perinecróticas muestran retrasos en la conducción eléctrica ventricular que es posible detectar a través de electrocardiogramas con capacidad de amplificación, filtrado y promediado de las señales como postpotenciales tardíos o tempranos.93–95 En otros contextos patológicos su utilidad es más limitada, y de hecho, su primordial valor es como elemento con un buen valor predictivo negativo.93
La dispersión del QT generó gran interés inicial que no ha sido respaldado por los hallazgos posteriores.96–98 La diferencia entre el QT medido más largo y el más corto en las 12 derivaciones de un electro de superficie sugiere heterogeneidad en la repolarización y con ello en los periodos refractarios. Se había observado que a mayor dispersión, mayor riesgo de arritmias ventriculares, con sensibilidad de 67%, especificidad de 75%, valor predictivo positivo de 41% y valor predictivo negativo de 90%. Sin embargo, aun la medición automatizada del intervalo representa problemas técnicos importantes derivados de la dificultad para delimitar el final de la onda T, con lo que solamente las alteraciones importantes del valor de dispersión, superiores a 100 ms, pueden ser de utilidad.99–101
La alternancia de la onda T (AOT) es un marcador efectivo del riesgo de muerte súbita cardiaca.102 Este parámetro se describe como la variación de morfología y voltaje de la onda T de latido a latido. Se había observado de manera gruesa en pacientes con síndrome de QT largo congénito, sin embargo los cambios en el microvoltaje han mostrado utilidad: 28% de los pacientes con AOT positiva tienen arritmias ventriculares, mientras que 98% de los que no la tienen, no las presentan. Otro estudio encontró un riesgo relativo de 16.8 con sensibilidad de 93%. Para que la prueba sea positiva debe haber AOT sostenida de al menos 1.9 microvoltios, con una relación de alternancia (k) de 3. Este parámetro corresponde a la amplitud del pico de alternancia por encima del ruido de fondo medido en unidades de la desviación estándar del ruido. Estos criterios deben reunirse al menos durante un minuto en una derivación bipolar o en dos precordiales. Mediciones de dos a cinco minutos son suficientes.103–109
Se investigan otras herramientas no invasoras para intentar establecer el riesgo de arritmias ventriculares letales, sin embargo, algunas tienen una utilidad clínica limitada, otras no han sido evaluadas con un número suficiente de enfermos, y otras son experimentalmente atractivas, pero no han demostrado utilidad clínica.
El estudio electrofisiológico (EEF) tiene la desventaja de ser un procedimiento invasor, que debe ser limitado a poblaciones consideradas de alto riesgo.110 La estimulación eléctrica cardiaca para inducir arritmias debe ser llevada a cabo de manera cuidadosa para intentar reproducir la arritmia clínica y no provocar arritmias ventriculares que el paciente no presenta en otras condiciones.111–113 Un grupo en el que el EEF tiene particular utilidad es en los pacientes con cardiopatía isquémica, ya sea con fracciones de expulsión normales o deprimidas.112,114,115 En las cardiomiopatías no ha demostrado tanta reproducibilidad de los resultados.116–118 Sin embargo en trastornos como el síndrome de QT largo o el síndrome de Brugada, es imprescindible llevar a cabo el estudio como herramienta útil para hacer el diagnóstico y determinar la mejor modalidad de tratamiento.119–121
Actualmente ha quedado demostrado que el uso de antiarrítmicos no mejora la supervivencia,122,123 por lo que la utilidad del EEF como guía de la efectividad del tratamiento farmacológico es limitada, además, las herramientas de medición no invasoras tienen una sensibilidad y especificidad similares. Posiblemente la utilidad principal del estudio electrofisiológico en este momento sea la de conocer las características de las arritmias ventriculares inducidas, para hacer una programación eficiente de los dispositivos implantables de desfibrilación (Desfibrilador Automático Implantable: DAI).124–128
Terapias disponibles
El tratamiento del paro cardiaco es posiblemente uno de los renglones más frustrantes en la electrofisiología actual. Pese al advenimiento del DAI, que ha supuesto un gran avance en la prevención de la MSC, aún quedan muchas preguntas por responder.
Lo más relevante desde cualquier punto de vista es conseguir un adecuado nivel de prevención primaria para evitar las cardiopatías estructurales, como la isquémica, que son los principales responsables de la MSC. Aquí las campañas de salud cardiovascular tienen un papel primordial.
El siguiente aspecto de gran importancia, como quedó patente más arriba, es enseñar a la población general a administrar reanimación cardiopulmonar y a recurrir a desfibriladores automáticos externos que deben estar disponibles en cualquier lugar público.19–21,129 La optimización de los servicios de emergencia es también un eslabón fundamental.
Los fármacos antiarrítmicos, en particular los de clase I han mostrado desde el estudio CAST que no tienen utilidad en pacientes con cardiopatía estructural. La amiodarona no aumenta la mortalidad pero tampoco la sobrevivencia, como demuestran el EMIAT, el CAM I AT y recientemente el MUSTT.122,123,126 De cualquier manera, estos medicamentos no resuelven la prevención de la MSC en una población general. Las poblaciones seleccionadas, principalmente postinfarto parecen tener beneficios cuando se combina el antiarrítmico con un DAI, pero el éxito de la terapia recae fundamentalmente sobre el DAI.127 Los betabloqueadores tienen una clara utilidad en poblaciones de riesgo como isquémicos y pacientes en insuficiencia cardiaca, sin embargo son infrautilizados por razones que no son del todo claras.130,131
Actualmente se está intentando buscar un papel para los marcapasos y en particular para la resincronización biventricular, sin embargo este tipo de tratamiento, que amerita una revisión por sí solo, es de utilidad en pacientes muy específicos que deben ser seleccionados entre esas poblaciones de alto riesgo. La sobreestimulación ventricular homogeniza los potenciales de acción ventriculares y teóricamente disminuye el número de extrasístoles ventriculares y con ello el riesgo de taquiarritmias ventriculares. La resincronización ventricular en pacientes con cardiomiopatía dilatada (habitualmente isquémica), fracción de expulsión menor 35% y bloqueo de rama izquierda con QRS superior a 130 ms mejora la fracción de expulsión, disminuye la insuficiencia valvular mitral, y consigue incluso cierta regresión de los diámetros ventriculares en estos pacientes. Si se agrega un intervalo AV corto que disminuya la presión telediastólica ventricular, incluso con marcapasos bicamerales, la mejoría sintomática puede ser importante. Sin embargo es un recurso costoso y limitado a pacientes muy seleccionados, con un potencial de prevención para muerte súbita aún no establecido.132–135
La única estrategia que ha mostrado efectividad tanto en prevención primaria (MUSTT, MADIT136,137) como secundaria (AVID)138,139 es el DAI. Nuevamente se trata de poblaciones seleccionadas por un alto riesgo de taquiarritmias ventriculares, postinfarto en su mayoría,140 aunque hay series de pacientes con el síndrome de Brugada u otras alteraciones en los que el dispositivo modifica de manera importante la sobrevivencia.141,142
Las técnicas de ablación por radiofrecuencia han avanzado en cuanto al mapeo de los sitios de origen de las taquicardias, sin embargo este tipo de tratamiento requiere de varios aspectos. Tal vez el más importante es que la arritmia sostenida sea tolerada hemodinámicamente, porque no todos los centros cuentan con sistemas de mapeo que permitan rapidez y precisión. Otra limitante es que a veces las extrasístoles ventriculares que pueden mapearse no se originan exactamente en el mismo sitio que la taquicardia. Finalmente, para que la ablación sea efectiva se requiere de un istmo por el que la reentrada que origina la taquicardia tenga que pasar forzosamente. Si el circuito no es estable o tiene varias "salidas", la ablación es muy compleja o con una relación riesgo/beneficio muy desfavorable.143–145
Pese a la aparente carencia de utilidad de los fármacos, las combinaciones de éstos con algún dispositivo o terapia de ablación pueden ser de utilidad. Aunque los estudios como el MUSTT han mostrado que los beneficios en la supervivencia dependen esencialmente de los desfibriladores, la recurrencia de episodios arrítmicos es menor y de menor intensidad cuando se usa Amiodarona, con lo que se pueden evitar "tormentas eléctricas", es decir, arritmias incesantes que llevan a descargas repetidas del DAI.146
El futuro
El futuro debe traer avances significativos en la estratificación de riesgo con el hallazgo de nuevos métodos y la optimización de combinaciones de estudios para definir con precisión el riesgo relativo de cada enfermo en un grupo determinado de cardiopatía. En gran medida los avances terapéuticos dependerán de esta detección temprana, aunque en nuestro país aún hay mucho trabajo de educación por hacer.
La tecnología permite suponer que aparecerán dispositivos (DAI), combinados de terapia eléctrica que sean capaces de administrar una cierta dosis de medicamento antiarrítmico a nivel local, que tengan una mayor longevidad y sean cada vez más sencillos de implantar, sin embargo, el énfasis debe ponerse en la prevención de las cardiopatías que llevan a un corazón previamente sano a un extremo crítico en que un desequilibrio electrolítico o autonómico le imponga un reto que no será capaz de superar.
Referencias
1. Myerburg R, Castellanos A. Cardiac arrest and sudden cardiac death. En Braunwald E. ed. Heart disease: A textbook of cardiovascular medicine 4° ed. Philadelphia, Saunders Co.1992:756–89. [ Links ]
2. Mont L. Muerte súbita. Conferencia magistral, V curso de Cardiología para Médicos Internistas: Una visión dual. Septiembre 20 al 22, 2001, Instituto Nacional de Ciencias Médicas y Nutrición <<Salvador Zubirán>>. [ Links ]
3. Schatzkin A. Cupples L, Heeren T. Sudden death in the Framingham Heart Study: Differences in the incidence and risk factors by sex and coronary disease status. Am J Epidemiol 1984;46:341. [ Links ]
4. DEFIBRILAT Study group. Actuarial risk of sudden death while awaiting cardiac transplantation in patients with atherosclerotic heart disease. Am J Cardiol 1991;68:545–6. [ Links ]
5. Nagele H, Rodiger W. Sudden death and tailored medical therapy in elective candidates for heart transplantation. J Heart Lung Transplant 1999;18(9):869–76. [ Links ]
6. Deedwania P. Ventricular arrhythmias and sudden death in Heart Failure: Evaluation and management. 20th annual scientific sessions of the NASPE, Mayo 14 1999, http://www.medscape.com/medscape/cho/1999/NASPE/story.cfm?story_id–585 [ Links ]
7. Demirovic J. Risk factors in the incidence of sudden cardiac death and possibilities for its prevention. University of Belgrade Press, thesis 1985. [ Links ]
8. Deshpande S, Akhtar M. Muerte súbita cardiaca: La magnitud del problema. En Dunbar S, Ellenbogen K, Epstein A (eds.) Muerte súbita cardiaca, pasado presente y futuro. Medical trends (España) 1998, Futura Publishing co. 1997;pp 1–18. [ Links ]
9. Principales causas de mortalidad general, Estados Unidos Mexicanos 1999. Estadísticas vitales, capítulo de mortalidad: http://www.ssa.org.mx/ 11 de Nov 2001. [ Links ]
10. De Micheli A. El problema de la muerte súbita cardiaca. Parte I. Arch Inst cardiol ex 1999;69(4):367–70. [ Links ]
11. Iturralde P. El problema de la muerte súbita cardiaca. Parte II Enfoque actual del problema. Arch Inst Cardiol Mex 1999;69(4):371–4. [ Links ]
12. Zghaib A, Férez S. Isquemia asintomática y muerte súbita. Arch Inst Cardiol Mex, 1992;62(6):487–9. [ Links ]
13. Furukawa T, Rozanski J, Nogami A, Moroe K, Gosselin A, Lister J. Time dependent risk of and predictors for cardiac arrest recurrence in survivors of out–of–hospital cardiac arrest with chronic coronary artery disease. Circulation 1989;80:599–608. [ Links ]
14. Elosúa R, Guindo J, Viñolas X, Martínez Rubio A, Bayés Genis T, Bayés de Luna A. Clinical goals of risk stratification. En Malik M. (Ed) Risk of arrhythmia and sudden death. BMJ Books 2001, pp 3–10. [ Links ]
15. Mont L. Muerte súbita cardiaca: Causas y prevención. Medicine, En prensa. [ Links ]
16. Araya V, González A, Casanova J, Colín L, Kershenovich S, Iturralde P. Identificación de los pacientes con riesgo de arritmias malignas en el primer año postinfarto de miocardio. Arch Inst Cardiol Mex 1994;64(2):145–59. [ Links ]
17. De Vreede–Swagemakers J, Gorgels A, Dubois W. Out–of–hospital cardiac arrest in the 1990's: A population based study in the Maastricht area on incidence, characteristics and survival. J Am Coll Cardiol 1997;30:1500–8. [ Links ]
18. Bayés de Luna A, Coumel P, Leclerq J. Ambulatory sudden cardiac death: Mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J, 1989;117:151–9. [ Links ]
19. International Consensus. American Heart Association, International Liaison Committee on Resuscitation: Guidelines 2000 for cardiopulmonary resuscitation and emergency cardiovascular care. The automated external defibrillator: Key link in the chain of survival. Circulation Suppl, 2000; 102(8):I60–I76. [ Links ]
20. Marenco J, Wang P, Link M, Homoud M, Estes N. Improving survival from sudden cardiac arrest: the role of the automated external defibrillator. JAMA 2001 ;285(9):1193–200. [ Links ]
21. Kern K. Public access defibrillation: A review. Heart 1998;80(4)402–4. [ Links ]
22. Haerem J. Mural platelet microthrombi and major acute lesions of main epicardial arteries in sudden coronary death. Atherosclerosis, 1974;19:529–41. [ Links ]
23. Reichenbach D, Moss A, Meyer E. Pathology of the heart in sudden cardiac death. Am J Cardiol 1977;39:865–72. [ Links ]
24. Farb A, Burke A, Tang A, Liang T, Mannan P, Smialek J, et al. Coronary plaque erosion without rupture into a lipid core. A frequent cause of coronary thrombosis in sudden coronary death. Circulation 1996 Apr 1;93(7):1354–63. [ Links ]
25. Barron H, Lesh M. Autonomic nervous system and sudden cardiac death. J Am Coll Cardiol 1996 Apr;27(5):1053–60. [ Links ]
26. Schwartz P, Zipes D. Autonomic modulation of cardiac arrhythmias. En: Zipes D, Jalife J. Cardiac electrophysiology, from cell to bedside. 3a edición, 2000, Saunders Pub. Co. pp:300–14. [ Links ]
27. Schwartz P, La Rovere, M Vanoli E. Autonomic nervous system and sudden cardiac death. Experimental basis and clinical observations for post–myocardial infarction risk stratification. Circulation 1992;85(supl. I):I–177–91. [ Links ]
28. Gettes L. Electrolyte abnormalities underlying lethal ventricular arrhythmias. Circ 1992;85(suppl.I):170–176. [ Links ]
29. Multiple risk factor intervention trial research group. Multiple–risk factor intervention trial: Risk factor changes in mortality results. J Am Med Assoc 1982 ;248:1465–77. [ Links ]
30. Zipes D, Wellens H. Sudden cardiac death. Circulation 1998 Nov 24;98(21):2334–51. [ Links ]
31. Calkins H, Maughan W, Weissman H, Sugiura S, Sagawa K, Levine J. Effect of acute volume load on refractoriness and arrhythmia development in isolated chronically isolated canine hearts. Circulation 1989;79:687–97. [ Links ]
32. Slade A, Camm J. Risk Assessment and Prevention of Sudden Cardiac Death in Hypertrophic Cardiomyopathy Arch Mal Coeur et Vaiss 89 Spec No 1:37–49, 1996 Feb. [ Links ]
33. Almendral J, Villacastin J, Arenal A, Tercedor L, Merino J, Delcan J. Evidence favoring the hypothesis that ventricular arrhythmias have prognostic significance in left ventricular hypertrophy secondary to systemic hypertension. Am J Cardiol 1995 Nov 2;76(13):60D–63D. [ Links ]
34. Chang AC, McAreavey D, Fananapazir L. Identification of Patients With Hypertrophic Cardiomyopathy at High Risk for Sudden Death. Current Opinion in Cardiology 1995 Jan 10(1):9–15. [ Links ]
35. Varnava A, Elliott P, Baboonian C, Davison F, Davies M, McKenna W. Hypertrophic cardiomyopathy. Hystopathological features of sudden death in cardiac troponin T disease. Circulation 2001; 104:1380–84. [ Links ]
36. Cannan C, Reeder G, Bailey K. Natural history of hypertrophic cardiomyopathy. Circulation 1995;92:2488–95. [ Links ]
37. Fananapanazir L, Chang L, Leon M. Electrophysiologic abnormalities in patients with hypertrophic cardiomyopathy: A consecutive analysis in 155 patients. Circulation 1989;80:1259–68. [ Links ]
38. Saumarez R, Camm J, Panagos A. Ventricular fibrillation in hypertrophic cardiomyopathy is associated with increased fractionation of paced right ventricular electrograms. Circulation 1992;86:467–74. [ Links ]
39. Fuster V, Gersh B, Giuliani E. The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol 1981;47:525–31. [ Links ]
40. Tamburro P, Wilber P. Sudden death in idiopathic dilated cardiomyopathy. Am Heart J 1992;124:1035–45. [ Links ]
41. Guadalajara F, González S, Fernández B. Muerte súbita en insuficiencia cardiaca. Arch Inst Cardiol Mex 1999;69:80–88. [ Links ]
42. Kao W, Costanzo M. Sudden death in heart failure patients: effects of optimized medical therapy. J Heart Lung Transplant 2000 Aug;19(8 Suppl):S32–7. [ Links ]
43. O'Conor C, Gattis W, Shaw L, Cuffe M, Califf R. Clinical characteristics and long term outcomes of patients with heart failure and preserved systolic function. Am J Cardiol 2000;86:863–7. [ Links ]
44. Young J. Sudden cardiac death syndrome and pump dysfunction: the link. Heart Lung Transplant 2000 Aug;19(8 Suppl):S27–31. [ Links ]
45. Doval H, Null D, Grancelli H, Varini S, Soifer S, Corrado G et al. Non–sustained ventricular tachycardia in severe heart failure. Independent marker of increased mortality due to sudden death. Circulation 1996;94:3198–203. [ Links ]
46. Fitzsimmons P, McWhirter P, Peterson D, Kruyer W. The natural history of Wolff–Parkinson–White syndrome in 228 military aviators: A long term follow–up of 22 years. Am Heart J 2001:142:530–6. [ Links ]
47. Beckman K, Gallastegui J, Bauman J. The predictive value of electrophysiologic studies in untreated patients with Wolff–Parkinson–White syndrome. J Am Coll Cardiol 1990; 15:640–7. [ Links ]
48. Myerburg R. Sudden cardiac death in persons with normal (or near normal) hearts. Am J Cardiol 1997;79(6A):6–9. [ Links ]
49. Rajamani S, Anderson C, Anson B, January C. Pharmacological rescue of Human K channel Long QT mutations. Circulation 2002;105:2830–5. [ Links ]
50. Shimizu W, Antzelevitch C. Differential effects of Beta–adrenergic agonists and antagonists in LQT1, LQT2 and LQT3 models of the long QT syndrome. J Am Coll Cardiol 2000;35:778–86. [ Links ]
51. Lupoglazoff J, Denjoy I, Berther M, Neyroud N, Demay I, Richard P et al. Notched T waves on holter recordings enhance detection of patients with LQT2 (HERG) mutations. Circulation 2001;103:1095–101. [ Links ]
52. Brugada J, Mont L, Brugada R. Displasia arritmogénica del ventrículo derecho. Rev Esp cardiol 1997;50: 541–7. [ Links ]
53. Corrado D, Basso C, Thiene G. Sudden death. En: Nava A, Rossi A, Thiene G: Arrhythmogenic right ventricular cardiomyopathy/dysplasia. Elsevier Science 1997, 1a. ed. Pp 36–45. [ Links ]
54. Asensio E, Alvarez B, Lozano E, Farías A, Brugada R, Brugada P et al. Elevación del ST, bloqueo de rama derecha y muerte súbita: síndrome de Brugada. Arch Inst Card Mex 2000;70;301–311. [ Links ]
55. Brugada J, Brugada R, Antzelevitch C, Towbin J, Nademanee K, Brugada P. Long term follow–up of individuals with the electrocardiographic pattern of right bundle Branch block and St segment elevation in precordial leads V1 to V3. Circulation 2002;105:73–78. [ Links ]
56. Church T. Risk assessment and risk stratification in sudden cardiac death: A biostatistician's view. Pacing Clin Electrophisiol 1997;20(19 pt2):2520–2532. [ Links ]
57. Rodríguez F, Viñolas X. Muerte súbita (III): causas de muerte súbita. Problemas a la hora de establecer y clasificar los tipos de muerte. Rev Esp Cardiol 1999;52(11):1004–14. [ Links ]
58. Klein H, Auricchio A Reek S, Geller C. New primary prevention trials of sudden cardiac death in patients with left ventricular dysfunction: SCD–HEFT and MADIT–II. Am J Cardiol 1999;83(5B):91D–97D. [ Links ]
59. Madsen B, Rasmussen V, Hansen J. Predictors of sudden death and death from heart failure in patients with heart insufficiency are different. Ugeskr Laeger 1999;161(1):34–9 Resumen medline. [ Links ]
60. Carmona J, Basterra N. Prevención de muerte súbita en pacientes en espera de trasplante cardiaco. Rev Esp Cardiol 2000;53(5):736–45. [ Links ]
61. Herlitz J, Brandrup G, Karlsson T, Karlson B, Haglid M, Sjoland H. Predictors of death and other cardiac events within 2 years after coronary artery bypass grafting. Cardiology 1998;90(2) 110–4. [ Links ]
62. Green M, Ricci J, Wolfe K. The appropriate evaluation of the patient at risk for sudden death from ventricular arrhythmias. Can J Cardiol 2000;16 suppl C:13C–15C. [ Links ]
63. Goldberger J. Treatment and prevention of sudden cardiac death: effect of recent clinical trials. Arch Intern Med 1999;159(12)1281–7. [ Links ]
64. Giorberidze I, Saksena S, Krol R, Munsif A, Koletis T, Mathew P, et al. Risk stratification and clinical outcome of minimally symptomatic and asymptomatic patients with non–sustained ventricular tachycardia and coronary disease. A prospective single center study. Am J Cardiol 1997;80(5B):3F–9F. [ Links ]
65. The CAST investigators: Preliminary report: Effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989;321:406–12. [ Links ]
66. Myerburg R, Interian A, Mitrani R, Kessler K, Castellanos A. Frequency of sudden cardiac death and profiles of risk. Am J Cardiol 1997;80(5B)10F–19F. [ Links ]
67. Leier C, Alvarez R, Binkley J. The problem of ventricular dysrhythmias and sudden death mortality in heart failure: The impact of current therapy. Cardiology 2000;93(1–2):56–69. [ Links ]
68. Klingenheben T, Credner S, Gronefeld G, Zabel M, Li Y et al. Cardiac autonomic tone in risk stratification after myocardial infarct: Results of a prospective long term study of 411 consecutive patients. Z Kardiol1 999;88(6):400–9 8 (Resumen Medline). [ Links ]
69. Swartzch P. The autonomic nervous system and sudden death. Eur Heart J 1998;19 suppl F: F72–80. [ Links ]
70. Dries D, Dormanski M, Waclawiw M, Gersh B. Effect of antithrombotic therapy on risk of sudden coronary death in patients with congestive heart failure. Am J Cardiol 1997;79(7):909–13. [ Links ]
71. Madsen B, Rasmussen V, Hensen J. Predictors of sudden death from pump failure in congestive heart failure are different. Analysis of 24 hr holter monitoring, clinical variables, blood chemistry, exercise test and radionuclide angiography. Int J cardiol. 1997;58(2):151–62. [ Links ]
72. Nakata T, Miyamoto K, Doi A, Sasao H, Wakabayashi T, Kobayashi H et al. Cardiac death prediction and impaired cardiac sympathetic innervation assessed by MIBG in patients with failing and non– failing hearts. J Nucl Cardiol 1998;5(6):579–90. [ Links ]
73. Kubler W. ACE inhibitors in heart failure: Effect on mode of death. Eur Heart J 1997;18(1):3–4. [ Links ]
74. Windhagen B, Kadish A, Feinberg A. Application of noninvasive and invasive tests for risk assessment in patients with ventricular arrhythmias. Cardiol Clin 2000;18(2):243–63. [ Links ]
75. Abildstrom S, Torp–Pedersen C, Kober L. Left ventricular ejection fraction and wall motion score. En: Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1a edición, 2001, pp:57–64. [ Links ]
76. Kelly M, Thompson P, Quinlan M. Prognostic significance of left ventricular ejection fraction after acute myocardial infarction: A bedside radionuclide study. Br Heart J 1985;53:16–24. [ Links ]
77. Ong L, Green S, Reiser P, Morrison J. Early prediction of mortality in patients with acute myocardial infarction: A prospective study of clinical and radionuclide risk factors. Am J Cardiol 1986;57:33–8. [ Links ]
78. Kan G, Visser C, Koolen J, Dunning A. Short and long term predictive value of admission wall motion score in acute myocardial infarction. A cross sectional echocardiographic study of 345 patients. Br Heart J 1986;56:422–7. [ Links ]
79. Bigger J, Fleiss J, Kleiger R, Miller J, Rolnitzky L. The relationship among ventricular arrhythmias, left ventricular dysfunction and mortality in the two years after myocardial infarction. Circulation 1984;53:774–80. [ Links ]
80. Pedretti R, Etro M, Laporta A, Braga S, Caru B. Prediction of late arrhythmic events after acute myocardial infarction from combined use of non–invasive prognostic variables and inducibility of sustained monomorphic ventricular tachycardia. Am J Cardiol 1993;71:1131–41. [ Links ]
81. de Teresa E, Alzueta J, Jiménez M. Profiling risk from arrhythmic or hemodynamic death. Am J Cardiol 2000;86(suppl):126K–132K. [ Links ]
82. Szabo B, van Veldhuisen D, van der Veer N, Brouwer J, de Graeff P, Crijns H. Prognostic value of heart rate variability in chronic congestive heart failure secondary to idiopathic or ischemic dilated cardiomyopathy. Am J Cardiol 1997;97:978–980. [ Links ]
83. Cusack M, Redwood S. Exercise electrocardiography for the assessment of arrhythmias. En Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1a edición, 2001, pp: 144–54. [ Links ]
84. Mont L, Seixas T, Brugada P. Clinical and electrophysiologic characteristics of exercise–related idiopathic ventricular tachycardia. Am J Cardiol 1991;68:897–900. [ Links ]
85. Kleiger R, Stein P. Heart rate variability. En Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1a edición, 2001, pp:221–233. [ Links ]
86. Task force of the European Society of Cardiology and the North American Society Pacing and Electrophysiology. Heart rate variability. Standards of measurement, physiological interpretation and clinical use. Circulation 1996;93:1043–65. [ Links ]
87. Fauchier L, Babuty D, Cosnay P, Fauchier J. Prognostic value of heart rate variability for sudden death and major arrhythmic events in patients with idiopathic dilated cardiomyopathy. J Am Coll Cardiol 1999;33(5):1203–7. [ Links ]
88. Galinier M, Pathak A, Fourcade J, Androdias C, Curnier D, Varnous S, et al. Depressed low frequency power of heart rate variability as an independent predictor of sudden death in chronic heart failure. Eur Heart J 2000;21(6):475–82. [ Links ]
89. Shusterman V, Aysin B, Weiss R, Brode S, Gottipaty V, Schwartzman D et al. Dynamics of low frequency RR interval oscillations preceding spontaneous ventricular tachycardia. Am Heart J 2000;139(1):126–33. [ Links ]
90. Molgaard H, Hermansen K, Bjerregaard P. Spectral components of short term RR interval variability in healthy subjects and effects of risk factors. Eur Heart J 1994;9:1174–83. [ Links ]
91. Odemuyiwa O, Poloniecki J, Malik M. Temporal influences on the prediction of postinfarction mortality by heart rate variability: A comparison with the left ventricular ejection fraction. Br Heart J 1994;71:521–7. [ Links ]
92. Klingenheben T, Credner S, Gronefeld G, Zabel M, Li Y, Honhloser S. Cardiac autonomic tone in risk stratification after myocardial infarct: Results of a prospective, long term study of 411 consecutive patients. Z Kardiol 1999;88(6):400–9 (Resumen Medline). [ Links ]
93. Kulakowski P. Ventricular signal averaged electrocardiography. En Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1a edición, 2001, pp:167–79. [ Links ]
94. Breithardt G, Becker R, Seipel L, Abendroth , Ostermeyer J. Non–invasive detection of late potentials in man – A new marker for ventricular tachycardia. Eur Heart J 1981;2:1–11. [ Links ]
95. Breithardt G, Cain M, El Sheriff N and the Task force commitee between the European Society of Cardiology, the American Heart Association and the American College of Cardiology. Standards for analysis of ventricular late potentials using high resolution or signal averaged electrocardiography. Eur Heart J 1991;12:473–80. [ Links ]
96. Day C, McComb L, Campbell R. QT dispersion: An indication of arrhythmia risk in patients with long QT intervals. Br Heart J 1990;63:342–4. [ Links ]
97. Rautaharju P. QT and dispersion of ventricular repolarization: The greatest fallacy in electrocardiography in the 1990s. Circulation 1999; 18:2477–8. [ Links ]
98. Brendorp B, Elming H, Jun L, Kober L, Malik M, Jensen G et al. QT dispersion has no prognostic information for patients with advanced congestive heart failure and reduced left ventricular systolic function. Circulation 2001; 103:831–5. [ Links ]
99. Maron B, Leyhe M, Casey S, Gohman T, Lawler C, Crow R, et al. Assessment of QT dispersion as a prognostic marker for sudden death in a regional non–referred hypertrophic cardiomyopathy cohort. Am J Cardiol 2001 ;87(1):114–5. [ Links ]
100. Yi G, Poloniecki J, Dickie S, Elliott P, Malik M, McKenna W. Can the assessment of dynamic QT dispersion on exercise electrocardiogram predict sudden cardiac death in hypertrophic cardiomyopathy? Pacing Clin Electrophysiol 2000;23(11 pt 2): 1953–6. [ Links ]
101. Brooksby P, Batin P, Nolan J, Lindsay S, Andrews R, Mullen M et al. The relationship between QT intervals and mortality in ambulant patients with chronic heart failure. The United Kingdom heart failure evaluation and assessment of risk trial (UK HEART). Eur Heart J 1999;20(18):1335–41. [ Links ]
102. Rosenbaum D, Jackson L, Smith J, Garan H, Ruskin J, Cohen R. Electrical alternans and vulnerability to ventricular arrhythmias. N Engl J Med 1994;330:235–41. [ Links ]
103. Klingenheben T, Siedow A, Credner S, Gronefeld G, Zabel M, Yi Y et al. T wave alternans in microwave frequency as a new indicator of disordered ventricular repolarization: Pathophysiology, methodology, clinical results. Z Kardiol 1999;88(12):974–81 (Resumen Medline). [ Links ]
104. Gold M, Bloomfield D, Anderson K, El–Sherif N, Wilber D, Groh W et al. A comparison of T wave alternans, signal averaged electrocardiography and programmed ventricular stimulation for arrhythmia risk stratification. J Am Coll Cardiol 2000;36(7):2247–53. [ Links ]
105. Bloomfield D, Cohen R. Repolarization alternans. En Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1st edition, 2001, pp: 256–65. [ Links ]
106. Ikeda T, Sakata T, Mitsuaki T, Kondo N, Tezuka N, Nakae T et al. Combined assessment of T wave alternans and late potentials to predict arrhythmic events after myocardial infarction. A prospective study. J Am Coll Cardiol 2000;35(2):722–30. [ Links ]
107. Verrier R, Nearing B. Electrophysiologic basis for T wave alternans as an index of vulnerability to ventricular fibrillation. J Cardiovasc Electrophysiol 1994;5(5):445–61. [ Links ]
108. Rosembaum D, Albrecht P, Cohen R. Predicting sudden cardiac death from T wave alternans of the surface electrocardiogram: Promises and pitfalls. J Cardiovasc Electrophysiol 1996;7:1095–1111. [ Links ]
109. Verrier R, Stone P. Exercise stress testing for T wave alternans to expose latent electrical instability. J Cardiovasc Electrophysiol 1997;8:994–7. [ Links ]
110. Bachtvarov P. Electrophysiological study for risk stratification of cardiac patients. En Malik M: Risk of arrhythmia and sudden death. BMJ Books, 1a edición, 2001, pp:98–116. [ Links ]
111. Weaver W, Cobb L, Hallstrom A. Ambulatory arrhythmias in resuscitated victims of cardiac arrest. Circulation 1982;66:212–8. [ Links ]
112. Kim M, Bruckman D, Kirsh M, Kou W. Outcome of men with ischemic cardiomyopathy, asymptomatic non–sustained ventricular tachycardia and negative electrophysiologic study. Am J Cardiol 2000;85:119–21. [ Links ]
113. Wilber D, Garan H, Finkelstein D. Out–of hospital cardiac arrest, Use of electrophysiologic testing in the prediction of long term outcome. N Engl J Med 1988;318:19–24. [ Links ]
114. Multicenter Postinfarction Research Group. Risk stratification and survival after myocardial infarction. N Engl J Med 1983;309:331–6. [ Links ]
115. Moss A, Hall W, Cannom D for the Multicenter Automatic Defibrillator Trial (MADIT). Improved survival with an implanted defibrillator in patients with coronary disease in high risk for ventricular arrhythmia. N Engl J Med 1996;335:1933–40. [ Links ]
116. Elliott P, Sharma S, Varnava A, Poloniecki J, Rowland E McKenna W. Survival after cardiac arrest or sustained ventricular tachycardia in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1999;33:1596–601. [ Links ]
117. Milner P, DiMarco J, Lerman B. Electrophysiological evaluation of sustained ventricular tachyarrhythmias in idiopathic dilated cardiomyopathy. Pacing Clin Electrophysiol 1988; 11:562–8. [ Links ]
118. Turrito G, Ahuja R, Caref E, El–Sherif N. Risk stratification for arrhythmic events in patients with non–ischemic dilated cardiomyopathy and non–sustained ventricular tachycardia: Role of programmed ventricular stimulation and the signal averaged electrocardiogram. J Am Coll Cardiol 1994;24:1523–8. [ Links ]
119. Brugada J, Brugada P, Brugada R. The syndrome of right bundle branch block, ST segment elevation in V1 to V3 and sudden cardiac death – The Brugada Syndrome. Europace 1999;1:156–66. [ Links ]
120. Pinamonti B, Siinagra G, Camerini F. Clinical relevance of right ventricular dysplasia/cardiomyopathy. Heart 2000;83:9–11. [ Links ]
121. Surawicz B. Long QT. Good, bad indifferent and fascinating. ACC Current J Rev 1999;4:255–6. [ Links ]
122. Camm J, Julian D, Janse G. The European Myocardial Infarct Amiodarone Trial (EMIAT). Am J Cardiol 1993;72:95F–98F. [ Links ]
123. Epstein A, Bigger T, Wyse G, Romhilt W, Reynolds A, Hallstrom P. Events in the Cardiac Arrhythmia Suppression Trial (CAST): Mortality in the entire population enrolled. J Am Coll Cardiol 1991;18:14–9. [ Links ]
124. Benditt D, Benson D, Klein G, Pritzker M, Kriett J, Anderson R. Prevention of recurrent sudden cardiac death: Role of provocative electropharmacologic testing. J Am Coll Cardiol 1983;2:418–25. [ Links ]
125. Mitchell L, Sheldon R, Gillis A. Definition of predicted effective antiarrhythmic drug therapy for ventricular tachyarrhythmias by the electrophysiologic study approach: Randomized comparison of patient response criteria. J Am Coll Cardiol 1997;72:280–7. [ Links ]
126. Buxton E, Fisher D, Josephson M, for the Multicenter Unsustained Tachycardia Trial (MUSTT). Prevention of sudden death in patients with coronary artery disease: The Multicenter Unsustained Tachycardia Trial (MUSTT). Prog Cardiovasc Dis 1993;36:215–26. [ Links ]
127. Saeed M, Homoud M, Wang P, Estes M, Link M. Role of electrophysiologic testing in risk stratification for sudden cardiac death. J Invasive Cardiol 2001;13(11):758–62. [ Links ]
128. Olshansky B, Hartz V, Hahn E, Mason J, Weaver D and the ESVEM investigators. Location of death (in–hospital or out–of–hospital) and type of death (arrhythmic, non–arrhythmic, non–cardiac) after inducible sustained ventricular tachycardia or non–fatal cardiac arrest (the ESVEM trial). Am J Cardiol 2000;86:846–51. [ Links ]
129. Balady G, Chaitman B, Foster C, Froelicher E, Gordon N, Van Camp S. Automated external defibrillators in health/fitness facilities. Circulation 2002;105:1147–50. [ Links ]
130. Moser M. Beta blockers in the management of cardiovascular disease. http://www.medscape.com/Medscape/cardiology/TreatmentUpdate/2000/tu01/public/toc–tu01.html [ Links ]
131. Goldberger J. Treatment and prevention of sudden cardiac death. Effect of recent clinical trials. Arch Intern Med 1999;159:1281–7. [ Links ]
132. Leclerq C, Cazeau S, Ritter P, Alonso C, Gras D, Mabo P et al. A pilot experience with permanent biventricular pacing to treat advanced heart failure. Am Heart J 2000;140(6):862–70. [ Links ]
133. Cohen T, Klein J. cardiac resynchronization therapy for treatment of chronic heart failure. J Invasive Cardiol 2002;14(1):48–53. [ Links ]
134. Kay N, Bourge R. Biventricular pacing for congestive heart failure: Questions of who, what, where, why, how, and how much. Am Heart J 2000;140(6):821–3. [ Links ]
135. Kerwin W, Botvinick E, O'Connell W, Merrick S, DeMarco T, Chatterjee K et al. Ventricular contraction abnormalities in dilated cardiomyopathy: Effect of biventricular pacing to correct intraventricular dyssynchrony. J Am Coll Cardiol 2000;35(5):1221–7. [ Links ]
136. Moss A. Bakground, Outcome and clinical implications of the Multicenter Automatic Defibrillator Implantation Trial (MADIT). Am J Cardiol 1997;80(5B):28F–32F. [ Links ]
137. Gold R. Primary prevention of sudden cardiac death with implantable cardioverter defibrillators: Lessons learned from MADIT and MUSTT. Pacing Clin Electrophysiol 2000;23(11):1981–5. [ Links ]
138. The AVID investigators. A comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from near–fatal ventricular arrhythmias. N Engl J Med 1997;337:1576–83. [ Links ]
139. Steinberg J, Mattins J, Sadanandan S, Goldner B, Menchavez E, Domanski M et al. Antiarrhythmic drug use in the implantable defibrillator arm of the Antiarrhythmic Vs Implantable Defibrillators (AVID) study. Am Heart J 2001:142:520–9. [ Links ]
140. Sheldon R, Connolly S, Krahn A, Roberts R, Gent M, Gardner M et al. Identification of patients most likely to benefit from implantable cardioverter–defibrillator therapy. The Canadian Implantable Defibrillator Study (CIDS). Circulation 2000;101:1660–4. [ Links ]
141. Brugada P, Brugada R, Brugada J. Sudden death in high risk family members: Brugada Syndrome. Am J Cardiol 2000;86(9A):40K–43K. [ Links ]
142. Brugada P, Brugada R, Brugada J, Geelen P. Use of the prophylactic implantable cardioverter–defibrillator for patients with normal hearts. Am Heart J 1999;83(5B):98D–100D. [ Links ]
143. Cannom D. Matching cardiac rhythm management technology to patient needs: Pacing, ablation, implantable cardioverter–defibrillators. Am J Cardiol 2000;86(9A):58K–70K. [ Links ]
144. Fletcher R, Karasik P. Radiofrequency catheter ablation of ventricular tachycardia in patients with coronary artery disease. En: Singer I, Barold S, Camm J. Non–pharmacological therapy of arrhythmias for the 21st century. Futura Pub.Co. 1998 1a ed. pp:253–290. [ Links ]
145. Miles W, Olgin J. Ablation of idiopathic left ventricular tachycardia and right ventricular outflow tract tachycardia. En Singer I, Barold S, Camm J. Nonpharmacological therapy of arrhythmias for the 21st century. Futura Pub. Co. 1998 1a ed. pp:233–252. [ Links ]
146. Credner S,KlingenhebenT,Mauss O, Sticherling C, Honhloser S. Electrical storm in patients with transvenous implantable cardioverter–defibrillators. Incidence, management and prognostic implications. J Am Coll Cardiol 1998;32:1909–15. [ Links ]














