Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta médica de México
On-line version ISSN 2696-1288Print version ISSN 0016-3813
Gac. Méd. Méx vol.141 n.1 Ciudad de México Jan./Feb. 2005
Ejercicio clínico patológico
Hospital de Especialidades del Centro Médico Nacional Siglo XXI, IMSS
Hombre de 66 años con tumoración submandibular, fiebre y tos productiva
A 66 Year–Old male with a submandibular mass, fever and productive cough
José Angel Fonseca–Alva,* Brigette Carmen Tejeda–Huezo*
* Departamento de Medicina Interna. Hospital de Especialidades del Centro Médico Nacional Siglo XXI, IMSS.
Correspondencia y solicitud de sobretiros:
Departamento de Medicina Interna.
Hospital de Especialidades del Centro Médico Nacional Siglo XXI, IMSS.
Coordinador: Dr. Manuel de la Llata–Romero
Colaboradores: Dr. Juan Urrusti–Sanz
Dr. Jesús Aguirre–García
Dr. Roberto Sánchez–Ramírez
Presentación del caso
Hombre de 66 años de edad, ingresado al hospital por masa submandibular izquierda, fiebre y tos productiva. Inició su padecimiento 3 meses antes de su ingreso y se caracterizó por pérdida de 20 Kg., y anorexia, posteriormente se agregó tos productiva, con esputo hemoptoico, así como aumento de volumen en región submandibular izquierda, dolorosa al tacto, acompañada de disfagia a sólidos.
Entre sus antecedentes de importancia se refirió tabaquismo desde los 16 años de edad hasta la actualidad (una cajetilla diariamente), alcoholismo durante 7 años a base de destilados y fermentados semanalmente llegando hasta la embriaguez.
En la exploración física se encontró con una TA 110/70, FC 73x', FR 23x', T 36.5°C, ligera palidez generalizada de tegumentos, mal hidratado, cuello asimétrico por tumoración submandibular izquierda, dolorosa a la palpación, de consistencia firme, pulso carotídeo izquierdo disminuido en amplitud e intensidad, adenomegalia supraclavicular izquierda de 0.5 cm., de consistencia ahulada, no dolorosa, el resto de la exploración física fue normal.
Los cuadros del I al IV muestran los exámenes de laboratorio a su ingreso y durante su evolución, en donde sólo llamó la atención la elevación de la creatinina sérica; se inició tratamiento a base de analgésicos no esteroideos y rehidratación, mejorando la función renal.


La radiografía de tórax fue normal, un ultrasonido de cuello mostró imágenes redondeadas de contornos lobulados de predominio izquierdo de ecogenicidad heterogénea, de 56 mm en su diámetro máximo y del lado derecho de 42 mm de diámetro sugestivos de conglomerados ganglionares múltiples submandibulares.
Se realizó una tomografía axial computada simple y contrastada de cuello, la cual informó la presencia de estructuras vasculares ocluidas parcialmente por crecimiento ganglionar múltiple bilateral no delimitadas adecuadamente, de contornos irregulares, que refuerzen en su periferia con el medio de contraste más no en el centro, con dimensiones de 15 y 33 mm sugerentes de adenomegalias múltiples, además se observó disminución de la luz de la faringe, y pérdida de tejido óseo mandibular.

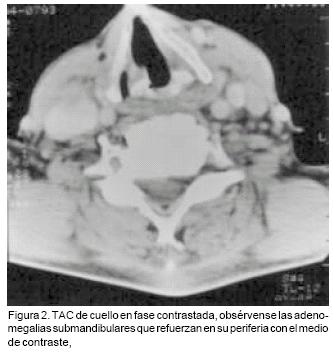
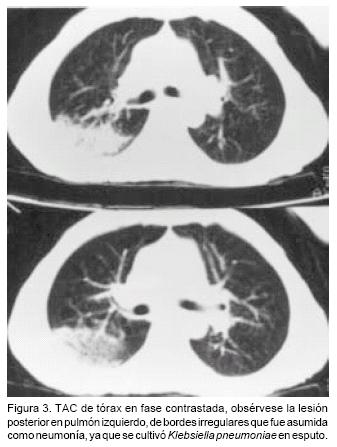

Comentario clínico
El caso corresponde a un hombre de 66 años de edad, que fue ingresado por crecimiento de múltiples adenomegalias submandibulares bilaterales, indoloras de consistencia firme, además de pérdida de 20 Kg., de peso corporal cuyo diagnóstico principal fue el de carcinoma epidermoide de primario en hipofaringe con metástasis ganglionares submandibulares.
Dentro de la valoración inicial del paciente con linfadenopatías cervicales se incluye un examen físico minucioso mediante el cual deberá identificarse si hay linfadenopatías regionales o generalizadas, lo cual dará la primera orientación diagnóstica acerca de las causas de las mismas, entendiéndose por linfadenopatías generalizadas cuando se evidencia crecimiento ganglionar en 3 o más áreas no contiguas. En el caso de nuestro paciente, éste contaba con adenopatías regionales ya que sólo se ubicaban en región submandibular, estando ausentes en región axilar e inguinal.
En el caso de las linfadenopatías regionales, el sitio más frecuentemente afectado es la región de la cabeza y el cuello, en donde las causas más frecuentes son de origen benigno del tipo infeccioso, tales como infecciones respiratorias, orales, dentales, mononucleosis infecciosa y otras infecciones virales y bacterianas. Otras causas son las de origen neoplásico y están constituidas por linfomas, cáncer metastásico de cabeza y cuello, de primario en mama, pulmón, tiroides, faringe y glándulas salivales, entre otras.
Además de la valoración clínica deberán interrogarse los antecedentes de mayor importancia, tales como exposición a agentes tóxicos, a factores de riesgo, infecciosos, transfusiones, tabaquismo, alcoholismo, factores ambientales y ocupacionales. En el presente caso el paciente sólo contaba con antecedentes de tabaquismo y alcoholismo intensos y crónicos, hecho que aunado a los hallazgos de adenomegalias y pérdida de peso, cuadros de hemoptisis ocasionales, nos llevó a considerar varios diagnósticos diferenciales.
Se procedió a tomar varios estudios de imagen ya descritos para determinar dimensiones, extensión y estructuras comprometidas por las adenopatías, tales como estructuras vasculares y de las vías aéreas, encontrándose datos de compromiso óseo con resorción ósea en región mandibular izquierda, con pérdida de piezas dentales, además de la presencia de linfadenopatías sólidas evidenciadas por ultrasonido que comprimían la arteria carótida izquierda y parte de la faringe.
Las causas que se consideraron para el diagnóstico diferencial del paciente fueron las infecciosas, las endocrinológicas y las neoplásicas.
El carcinoma epidermoide abarca desde el 80 hasta el 85% de todos los tumores del tracto aerodigestivo alto y afecta aproximadamente a 45 000 individuos por año. Representa el 5% de todas las neoplasias y constituye el 4º lugar de las neoplasias más frecuentes en hombres. La laringe es el sitio más común de origen, seguido por la cavidad oral, pulmón, esófago, recto y margen anal e hipofaringe.
Los síntomas y signos de los pacientes con cáncer de cabeza y cuello varían de acuerdo al sitio de la lesión y la extensión de la enfermedad. El crecimiento ganglionar cervical puede ser el primer hallazgo clínico de la enfermedad, y es particularmente frecuente en sitios silentes tales como base de la lengua, supraglotis y nasofaringe, las metástasis sistémicas son menos frecuentes (10%).
Para la realización del diagnóstico es necesario un examen físico exhaustivo de oídos nariz y garganta, además de ser necesaria la realización de panendoscopía para valorar el tracto aerodigestivo y estructuras asociadas tales como bronquios, esófago, laringe, faringe y cavidad oral. Sin embargo el diagnóstico definitivo se confirma mediante un examen histopatológico ya sea biopsia por aspiración con aguja fina (BAAF) o bien biopsia escisional, misma que posteriormente se realizaría, ya que nuestro paciente contaba con características clínicas, de edad y factores de riesgo como para sospechar etiología maligna de las linfadenopatías con las que se presentó, tales características son: edad mayor de 40 años, pérdida crónica e inexplicable de peso, linfadenopatías de consistencia firme, cervicales, fijas a planos profundos, no dolorosas, además del antecedente de alcoholismo y tabaquismo intensos, en sus estudios de laboratorio pueden asociarse como manifestaciones paraneoplásicas ya descritas en este tipo de neoplasias principalmente de primario en pulmón, faringe, laringe, etc. Tales manifestaciones paraneoplásicas fueron hipercalcemia y eosinofilia. Por lo que sería necesaria la realización de BAAF como siguiente paso diagnóstico.
La BAAF cuenta con una especificidad hasta del 98% cuando es acompañada o guiada por ultrasonido, con sensibilidad hasta del 89% y precisión diagnóstica hasta del 94.5% de acuerdo a algunas series de estudios que han conjugado estos 2 métodos, sin embargo también se han asociado a este procedimiento algunas complicaciones tales como el desarrollo de hematomas, hemorragia en el sitio del procedimiento, daño a nervios adyacentes e infección en el sitio de punción. Las reacciones asociadas vasovagales y las crisis convulsivas son raras.
Se preparó al paciente para realización de BAAF guiada por ultrasonido que fue reportada como carcinoma epidermoide metastásico, procediéndose a buscar el origen primario del carcinoma epidermoide. Entre los principales sitios descritos como focos primarios para el desarrollo de cáncer epidermoide se han descrito: pulmón, esófago, recto y cabeza y cuello. En ellos se incluyen faringe e hipofaringe que constituyen menos del 3% de los casos. Se tomaron estudios de imagen ya comentados, sin encontrarse evidencia del foco primario, sin embargo durante la broncoscopía se observó lesión sospechosa a nivel de hipofaringe tomándose biopsias de la misma que determinó cáncer epidermoide de primario en hipofaringe con metástasis a ganglios submandibulares.
Se trata así de una presentación muy rara del carcinoma epidermoide de primario en hipofaringe. El paciente fue enviado a Oncología donde recibió tratamiento a base de radioterapia durante 3 meses, posteriormente falleció. El índice de sobrevida de estos pacientes es de 3 meses posteriores al diagnóstico.
Referencias
1. Homer JJ, Greenman J, Stafford ND. Angiogenesis in head and neck squamous cell carcinoma. Clin. Otolaryngol. 2000; 25:169–80. [ Links ]
2. Mc Guitw Frederick. The neck mass. Medical Clinics of North America. 1999; 83:220–35. [ Links ]
3. Rice Dale H. Salivary gland disorders. Medical Clinics of North America 1999; 83:197–218. [ Links ]
4. Kanppe M, Louw M, Gregor R. Theo. Ultrasonography– guided fine– needle aspiration for the assessment of cervical metastases. Archives of Otolaryngology – head ad neck surgery. 2000; 126:1091–98. [ Links ]
5. Rothernberg Marc E. Eosinophilia. The New England Journal of Medicine. May 1998; 338:1592–1600. [ Links ]
6. Greenman J, Homer JJ, Stafford ND. Markers in cancer of the larynx and pharynx. Clin. Otolaryngol. 2000; 25:9–18. [ Links ]
7. Aivi A. Detection and a management of patients with head and neck cancer: an overview. Medscape Haematology–Oncology e journal. 1998; 1(3). [ Links ]
8. Forastiere A, Koch W, Trotti A, Sidransky D. Head and neck cancer. The New England Journal of Medicine. 2001; 345(26):1890–1900. [ Links ]
9. Mark J, Lie AK, Glattre E, et al. Human Papilloma virus infections as risk factor for Squamous cell carcinoma of the head and neck. New England Journal of Medicine. 2001; 344(15):1125–30. [ Links ]
10. Sanderson R, Ironside JAD. Squamous cell carcinomas of the head and neck. British Medical Journal. 2002; 325:822–27. [ Links ]
11. Wing Yuen P, Man M, Lam KY, Kwong LY. Clinicopathological significance of p16 gene expression in the surgical treatment of head and neck squamous cell carcinomas. Journal Clin, Pathol. 2002; 55:58–60. [ Links ]
12. Ikeguchi M, Sakatam T, Fukuda K, et. al. Correlation between cathepsin D expression and p 53 protein nuclear accumulation in Oesophageal Squamous cell carcinoma. J. Clin. Pathol. 2002; 545:121–126. [ Links ]
13. Posner Marshall R. Head and neck carcinoma: new directions for treatment. Medscape General Medicine. 2002; 4(3). [ Links ]
14. Smith RA, Glynn TJ. Epidemiology of Lung cancer. Radiologic Clinics of North America. 2000; 38(3). [ Links ]
15. Hyer JD, Silvestri G. Diagnosis and staging of Lung cancer. Clinics in chest medicine. 2002;1. [ Links ]
16. Patz EF, Goodman PC, Bepleer G. Screening for Lung cancer, New England Journal of Medicine. 2000; 343(22):1627–32. [ Links ]
17. Cerroni PK, Margiotta VP, Chimeni S. Gingival metastasis as first sign of an undifferentiated cacinoma of the Lung. Journal of Dermatology Surgery and oncology. 1994; 20(6):407–9. [ Links ]
18. Alandez J, Llanes F, Herrera JL. Metastatic Lung carcinoma involving periodontium. Report of a case. Jal of periodontology. 1995; 66(10):896–8. [ Links ]
19. Sanner JR, Rawin JE, Yang CH. Carcinoma of the lung metastatic to the gingiva: review of the literature and report of case. Journal of oral surgery. 1979; 37(2):103–6. [ Links ]
20. Chawla AK, Willet CG. Squamous cell carcinoma of the anal canal and anal margin. Haematology –Oncology Clinics of North America. 2001; 15(2). [ Links ]
21. Ellis GL, Jensen JL, Reingold IM, Barr RJ. Malignant neoplasms metastatic to gingiva. Oral surgery, Oral medicine, Oral Pathology. 1997; 44(2):238–45. [ Links ]
22. Hejna M, Raderer M, Czielinsky C. Inhibition of metastases by anticoagulants. Journal of the national cancer institute. 1999; 91(1):22–36. [ Links ]
23. Isaacson PG. The ciurrent status of Lymphoma classification. British Journal of Haematology. 2000; 109(2):258–66. [ Links ]
24. Wood MA. Rituximab: An Innovative therapy for non–Hodgkin's lymphoma. American Lournal of Health–System Pharmacy. 2001; 58(3):215–32. [ Links ]
















