Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.5 Ciudad de México sep./oct. 2004
Casos clínicos
Síndrome del ácido transretinoico. Reporte de un caso y revisión de la literatura
All–Trans acid Syndrome. Case Report and a Review of the Literature
Raúl Carrillo–Esper,* Roberto Carvajal–Ramos,** Vladimir Contreras–Domínguez,** César Hernández–Aguilar,** Lorena Romano–Estrada,** Carlos Melo–Martínez**
* Académico numerario, Academia Nacional de Medicina. Profesor titular de posgrado de medicina del enfermo en estado crítico, UNAM. Jefe de servicio de terapia intensiva, HCSAE PEMEX.
** Residentes de medicina del enfermo en estado crítico.
Correspondencia y solicitud de sobretiros:
Dr. Raúl Carrillo–Esper
HCSAE PEMEX,
Periférico Sur 4091.
Colonia Fuentes del Pedregal. Tlalpan.
56451684, ext. 51155.
Correo electrónico: seconcapcma@mail.medinet.net.mx
Resumen
Se describe el caso de una enferma con leucemia aguda promielocítica (LAP) que desarrolló síndrome del ácido transretinoico (SATRA) y se revisa la literatura. El SATRA se presenta en enfermos con LAP tratados con ácido transretinoico (ATRA). Tiene incidencia de 5% a 27% con mortalidad de hasta 29%. Es secundario al efecto del ATRA sobre la diferenciación de los promielocitos, lo que desencadena respuesta inflamatoria sistémica, daño endotelial con síndrome de fuga capilar y obstrucción de la microcirculación e infiltración tisular. Clínicamente se manifiesta con fiebre, hipotensión, insuficiencia respiratoria, renal y hepática, infiltrados pulmonares, derrame pleural y pericárdico, y edema generalizado. Eltratamiento es a base de suspensión del ATRA, medidas de apoyo y esferoides.
Palabras clave: ácido trans retinóico, síndrome del ácido trans–retinóico, respuesta inflamatoria sistémica, síndrome del ácido retinóico, leucemia aguda promielocítica.
Summary
We described a patient with acute promyelocytic leukemia (APL) who developed all–trans retinoic acid syndrome (ATRAS) and reviewed the literature. ATRAS presents in patients with APL treated with all–trans retinoic acid (ATRA). It has an incidence from 5%–27% with mortality of 29%. It is secondary to ATRA effect on promyelocyte differentiation, which causes systemic inflammatory response syndrome, endothelium damage with increase in capillary permeability, microcirculation obstruction, and tissue infiltration. ATRAS clinical manifestations are fever, hypotension, respiratory, renal and hepatic insufficiency, lung infiltrates, pleural and pericardic efussion, and generalized edema. Treatment is based on ATRA suspension, support measures, and steroids.
Key words: all–trans retinoic acid, all–trans retinoic acid syndrome, systemic inflammatory response syndrome, retinoic acid syndrome, acute promyelocytic leukemia.
Introducción
La leucemia aguda promielocítica (LAP) corresponde al subtipo M3 de las leucemias mieloides agudas de acuerdo a la clasificación francesa–americano–británica (FAB), y representa 10% de éstas. Se caracteriza por presentarse en gente joven, con bajas cuentas leucocitarias y cursar con elevada incidencia de coagulación intravascular diseminada. Morfológicamente se observan promielocitos hipergranulares con múltiples cuerpos de Auer, aunque también se han descrito variantes hipogranulares y microgranulares.1–5
El evento molecular que desencadena la LAP es la fusión del gen del receptor del ácido retinóico (RARa) que se encuentra en el cromosoma 17q21, a uno de los cuatro genes del cromosoma de la leucemia promielocítica (PML) que son: 1) PML–15q22,2) PLZF–11 q23,3) NPM–5q35 y 4) NuMA–11 q13. La fusión mas frecuente y que corresponde 99.9% de los casos de LAP es PML–15q22–RARa (PML–RARα), denominada translocación recíproca t (15;17).6–8
PML–RARα inhibe la transcripción de genes involucrados en la diferenciación y apoptosis de la serie mieloide durante la mielopoyesis a través de su interacción con corepresores nucleares (N–CoR) y desacetilasa de histonas (HDAC) que resulta en la integración del complejo RXRα–RARα/N–CoR/HDAC, el que induce leucemogénesis y hace a la LAP única en sus características genotípicas, inmunofenotípicas, moleculares y de respuesta al tratamiento.9
El ácido transretinoico (ATRA) es un potente inductor de diferenciación y crecimiento celular así como promotor de apoptosis a través de diferentes mecanismos moleculares como son la inhibición del complejo RXRα–RARα/ N–CoR/HDAC y su unión a receptores nucleares del ATRA (RN–ATRA), los cuales activan la expresión y transcripción de genes involucrados en la maduración celular y apoptosis, lo que hace que el uso terapéutico del ATRA a dosis elevadas combinado con quimioterapia sea uno de los mayores avances en el manejo de la LAP, la que es el subtipo de leucemia mieloide aguda con tasa más alta de curación.10–15
El uso de ATRA en los esquemas de manejo de LAP es generalmente bien tolerado, pero algunos enfermos desarrollan el síndrome del ácido transretinóico (SATRA) que fue descrito por primera vez en 1992 por Frankel.16
Después de revisar la literatura nacional no encontramos reportes de este síndrome por lo que el objetivo de este trabajo es describir el caso de una enferma con LAP que desarrolló SATRA y revisar la literatura.
Resumen de caso
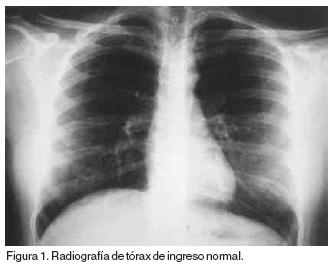
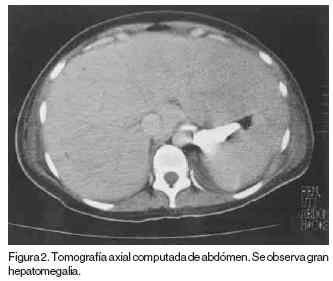
Enferma de 31 años con diagnóstico de leucemia aguda promielocítica M3 con translocación 15:17. La biometría hemática al ingreso con 1200 leucocitos, 800 neutrófilos, 400 linfocitos y 10% de promielocitos y la radiografía de tórax normal (Figura 1). La inducción de la remisión fue a base de ácido transretinóico (ATRA) a dosis de 45mg/m2, agregándose al quinto día arabinósido de citosina (Ara C) 200 mg IV c/24 hrs por siete días el darrubicina 20 mg IV c/24 hr por tres días. La respuesta terapéutica al ATRA y a la quimioterapia fue satisfactoria con remisión de la enfermedad. La cuenta leucocitaria en los primeros 20 días se mantuvo en promedio de 500 leucocitos totales con 20% de polimorfonucleares periodo durante el cual recibió cobertura antimicrobiana. A partir del día 20 del inicio del tratamiento se incrementó la cuenta leucocitaria para alcanzar a los 30 días 8300 leucocitos con 7800 neutrófilos sin blastos en sangre periférica, asociado a lo que se presentó cuadro caracterizado por: 1) fiebre, 2) insuficiencia respiratoria, 3) hepatomegalia e hiperbilirrubinemia de 7.2 mg/dl a expensas de bilirrubina directa, 4) edema, 5) oliguria e incremento de azoados (creatinina 1.6 mg, urea 120 mg). Se practicó ultrasonido de hígado y vías biliares en donde se corroboró la hepatomegalia; observándose vesícula biliar dilatada y de paredes delgadas, la tomografía axial computada de abdomen mostró hepatomegalia (Figura 2). La enferma evolucionó al deterioro por lo que ingresó a la Unidad de Terapia Intensiva (UTI).
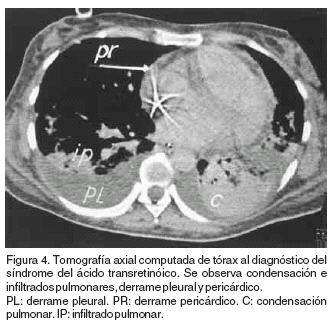
A su ingreso la enferma se encontraba en estado de choque con presión arterial de 80/50 mmHg, fiebre de 39°C, edema generalizado, oliguria, hipoxemia con índice de Kirby de 120. En la radiografía de tórax se observaron infiltrados pulmonares bilaterales y derrame pleural (Figura 3). Se practicó tomografía axial computada de tórax en donde se observó infiltrado y colapso pulmonar de predominio basal, derrame pleural bilateral y derrame pericardico (Figura 4). El ecocardiograma corroboró la presencia del derrame pericárdico sin efecto de taponamiento.

Ante la sospecha de proceso infeccioso y/o recaída de la leucemia se inició protocolo de estudio a base de: Hemocultivo, urocultivo, mielocultivo, cultivo y tinción de gram de secreción bronquial obtenida mediante broncoscopía con cepillo protegido y lavado bronquioloalveolar, panel para detección viral, reacción en cadena de polimerasa (RCP) para tuberculosis, toracocentesis con estudio citoquímico de líquido pleural, aspirado de médula ósea y depuración de creatinina.
Todos los cultivos se reportaron negativos. La búsqueda de bacterias, mycobacterias, hongos e inclusiones virales en la secreción bronquial y líquido pleural, fue negativa al igual que el panel antiviral y la RCP para tuberculosis. En la secreción bronquial y líquido pleural se observaron abundantes promielocitos en diferentes etapas de maduración. En el aspirado de médula ósea no se observó recaída de la leucemia. La depuración de creatinina fue de 34 ml/min. Con lo anterior se llegó al diagnóstico de síndrome del ácido transretinoico. (SATRA).
El manejo fue a base de suspensión del ATRA, esteroides (hidrocortisona 100 mg c/8 hr por 3 días seguido de 50mgc/8hr por 5 días), volumen, inotrópicos, vasopresores, ventilación mecánica con técnica de reclutamiento y protección alveolar. Con lo anterior revirtió el estado de choque, mejoró el intercambio gaseoso con incremento del índice de Kirby a 300; los infiltrados pulmonares y el derrame pleural desaparecieron (Figura 5). La Hepatomegalia revirtió y hubo descenso en los niveles de bilirrubinas. La depuración de creatinina se incrementó a 90 ml/min, se normalizaron los azoados, mejoró la diuresis y el edema con el uso de diurético. La evolución de la enferma fue satisfactoria, se extubó, se suspendieron inotrópicos y vasopresores. Se egresó al servicio de Hematología en donde se inició ciclo de quimioterapia de consolidación a la remisión con ATRA y Ara C sin que se presentara recaída del SATRA.

Discusión
Los retinoides son análogos de la vitamina A que regulan el crecimiento y diferenciación celulares, la apoptosisy la función inmunitaria. Las acciones de los retinoides son mediadas por su metabolito, el ácido trans–retinóico, el cual se fija a receptores nucleares específicos que activan la transcripción y expresión genética. Debido a su efecto pro–apoptótico e inductor de diferenciación celular por inhibición del complejo RXRα–RARα/N–CoR/HDAC, el ATRA es parte fundamental del tratamiento de la LAP combinado con arabinósido de citosina, antracíclicos y mitoxantrona, esquemaque induce remisiones completas en 92% de los casos y control de la coagulopatía. En las recaídas se ha utilizado con éxito el trióxido de arsénico combinado con ATRA.17–20
El SATRA es una complicación grave y potencialmente fatal del uso del ATRA en la LAP, su incidencia es de 5% a 27%, con mortalidad de 5% a 29%. Fue descrito por Frankel y posteriormente corroborado por De Botton, Fenaux, Kanamaru, Vahdat, Wiley, Avvisatti, Tallman, Cortes, Mandelliy Asou.16–28
Las manifestaciones del SATRA son secundarias a tres mecanismos fisiopatogénicos básicos: 1) respuesta inflamatoria sistémica, 2) daño endotelial con síndrome de fuga capilar y obstrucción de la microcirculación, 3) infiltración tisular. Estos son desencadenados por el efecto del ATRA sobre la diferenciación de promielocitos durante la cual hay síntesis y liberación de interleucinas (IL), proteasas de serina y expresión de moléculas de adhesión endotelial. LasIL 1,6,8 y el factor de necrosis tumoral (FNT) inducen respuesta inflamatoria sistémica intensa, hematopoyesis y activación leucocitaria. La IL1 y la catepsina G, que es una proteasa de serina, dañan al endotelio, incrementan la permeabilidad capilar e inducen la síntesis de moléculas de adhesión como son integrinas CD11a y CD11b, que interactúan con moléculas de adhesión intercelular y moléculas de adhesión celular vascular lo que favorece que promielocitos en diferenciación se adhieran al endotelio y migren al intersticio tisular. Los promielocitos expuestos al ATRA forman agregados en la microcirculación con obstrucción de ésta por su interacción con las moléculas de adhesión LFA1–ICAM2 (Figura 6).29–36 El SATRA se presenta de 2 a 47 días después de iniciado el tratamiento con ATRA (media de 11 días) y habitualmente se presenta en la fase de diferenciación e incremento de leucocitos y no necesariamente está relacionado a leucocitosis. En varios estudios no se ha encontrado concordancia entre ésta variable y el riesgo de desarrollar el síndrome. La mayoría de los autores correlacionan las dosis elevadas de ATRA que se emplean para el tratamiento de la LAP (45 mg/m2) con el desarrollo del síndrome, por éste motivo se han empleado esquemas con dosis denominadas "bajas". Castaigne demostró que dosis de 25 mg/m2 tenían el mismo efecto terapéutico pero no modificaron la incidencia y gravedad del SATRA. Chen con esquema de microdosis de 15 mg/m2 de ATRA demostró las mismas tasas de remisión y disminución en la incidencia del síndrome. Está en estudio si nuevos retinoides como el ácido 9–cis retinóico y el Am–80 tienen el mismo efecto terapéutico que el ATRA y menor riesgo de inducir SATRA.25,37–40

El SATRA se manifiesta clínicamente con: fiebre, fuga capilar con edema generalizado, insuficiencia respiratoria, infiltrados pulmonares, derrame pleural y pericárdico, vasodilatación, hipotensión, insuficiencia renal aguda e insuficiencia hepática. Histopatológicamente se caracteriza por la infiltración de promielocitos en diversos órganos como hígado, pulmón, riñon, etc., la cual puede llegar a ser masivay a nivel pulmonar con edema, hemorragia y exudados fibrinosos intraalveolares que son característicos del síndrome de insuficiencia respiratoria aguda (SIRA).41,42
El diagnóstico diferencial deberá ser con sepsis debido a que la mayoría de éstos pacientes se encuentra inmunodeprimida por el efecto de la enfermedad y de la quimioterapia, y a que las manifestaciones clínicas de una y otra entidades son las del SRIS y fallas orgánicas secundarias, para lo cual deberá de descartarse minuciosamente proceso infeccioso y determinación de procalcitonina.42,43
El tratamiento propuesto para el SATRA es a base de suspensión del ATRA, medidas de apoyo, esteroides y leucoféresis.
Suspensión del ATRA
La mayoría de los reportes lo recomiendan, pero hay autores que describen que el ATRA no necesariamente debe ser suspendido y que ésta medida dependerá de la gravedad de la enfermedad y del tiempo de inicio de los esteroides. De ésta manera, si el SATRA se diagnostica en sus fases iniciales y la respuesta inflamatoria sistémica y el involucro orgánico responden a esteroides, se puede continuar el tratamiento con ATRA.25
Medidas de apoyo
El SATRA se manifiesta con respuesta inflamatoria sistémica de diferentes grados de intensidad y disfunción orgánica, por lo que las medidas de apoyo dependerán de las fallas que se presenten.
1 Hipotensión y estado de choque: son secundarios a depleción de volumen intravascular por fuga capilar y vasodilatación, para lo cual el uso de volumen (cristaloides y coloides) y vasopresores es fundamental. En caso de que se presente disfunción contráctil del ventrículo izquierdo se indicará inotrópico.44
2 SIRA: la intubación y el apoyo ventilatorio mecánico con técnica de reclutamiento alveolar y protección pulmonar es el tratamientode elección. En niños con SIRA secundario a SATRA se ha utilizado la ventilación no invasiva con buenos resultados.45,46
3 Insuficiencia renal aguda: en sus fases iniciales es de tipo prerenal y responde al mejorar el volumen intravascular y la presión de perfusión renal. En su forma grave el SATRA cursa con necrosis tubular aguda, en estos casos se requiere de hemodiálisis y recientemente se ha descrito el uso de la técnica de reemplazo renal continuo en esta entidad.
Esteroides
Los esteroides son fundamentales en el manejo del SATRA porsu efecto inhibitorio y modulador de la función endotelial y del SRIS que son los fundamentos fisiopatológicos del SATRA. La dexametasona es el esteroide de elección a dosis de10 a 20mgc/12 hrs., la que dependerá de la gravedad de las manifestaciones. También está descrito el uso de metilprednisolona, prednisolona e hidrocortisona con buenos resultados.42,47,48
Leucoféresis
Cuando los leucocitos se incrementan a más de 50,000 / mm3 con el tratamiento con ATRA y hay manifestaciones de leucostasis asociados a los del SATRA, está reportado el uso de leucoféresis junto con terapia alquilante a base de hidroxiurea, sin embargo los resultados de esta terapia no son satisfactorios y se asocian a elevada mortalidad.21,49
Las medidas profilácticas recomendadas para disminuir la incidencia, gravedad y mortalidad del SATRA que han dado resultados satisfactorios son: 1) uso opoutuno de esteroides, 2) terapia combinada de ATRA con arabinósido de citosina y antracíclicos.42
Una vez controlado el SATRA, puede reiniciarse el tratamiento con ATRA en combinación con esteroides y quimioterapia, tomando en cuenta que aunque es bajo hay riesgo de recaída del síndrome.25
En conclusión, el SATRA como el descrito en este artículo es una complicación grave del tratamiento de la LAP con ATRA, es secundario a respuesta inflamatoria sistémica, lesión endotelial e infiltración tisular por promielocitos que se manifiesta con diversas fallas orgánicas. Debe diferenciarse de sepsis grave y choque séptico. El tratamiento es a base de suspensión del ATRA, esteroides y medidas de apoyo.
Referencias
1. Powell BL. Acute progranulocytic leukemia. Curr Opin Oncol 2001; 13:8–13. [ Links ]
2.Bennett J, Catovsky D, Daniel M, et al. Proposed revised criteria for the classification of acute myeloid leukemia. Ann Intern Med 1985; 103:626–629. [ Links ]
3. Stone RM, Mayer RJ. The unique aspects of acute promyelocytic leukemia. J Clin Oncol 1990; 8:1913–1921. [ Links ]
4. Neame PB, Soamboonsrup P, Leber B, et al. Morphology of acute promyelocytic leukemia with cytogenetic or molecular evidence for the diagnosis: characterization of additional microgranular variants. Am J Hematol 1997; 56:131–142. [ Links ]
5. Tallman MS, Hakimian D, Kwaan HC, et al. New insights into the pathogenesis of coagulation dysfunction in acute promyelocytic leukemia. Leuk Lymphoma 1993; 11:27–36. [ Links ]
6. Mattson JC. Acute promyelocytic leukemia: from morphology to molecular lesions. Clin Lab Med 2000; 20:83–103. [ Links ]
7. Melnick A, Licht JD. Deconstructing a disease: RARa, its fusion partners, and their roles in the pathogenesis of acute promyelocytic leukemia. Blood 1999; 93:31 67–321 [ Links ]5.
8. Mattel MG, Petkovich M, Mattel JF, et al. Mapping of the human retinoic acid receptor to the q21 band of chromosome 17. Hum Genet 1988; 80:186–188. [ Links ]
9. Wang ZG, Ruggero D, Ronchetti S, et al. PML is essential for multiple apoptoic pathways. Nat Genet 1998; 20:266–272. [ Links ]
10. Slack JL, Rusiniak ME. Current issues in the management of acute promyelocytic leukemia. Ann Hematol 2000; 79:227–238. [ Links ]
11. Tallman MS, Andersen JW, Schiffer CA, et al. All–trans–retinoic acid in acute promyelocytic leukemia. N Engl J Med 1997; 337:1021–1028. [ Links ]
12. Fenaux P, Le Deley MC, Castaigne S, et al. European APL 91 Group : Effect of all trans–retinoic acid in newly diagnosed acute promyelocytic leukemia. Results of a multicenter randomized trial. Blood 1993; 82:3241–3249. [ Links ]
13. Fenaux P, Chastang C, Chevret S, et al. European APL Group: A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94:1192–1200. [ Links ]
14. Sanz MA, Martin G, Rayon C, et al. A modified AIDA protocol with antracycline–based consolidation results in high antileukemic efficacy and reduced toxicity in newly diagnosed PML/RARa–positive acute promyelocytic leukemia. Blood 1999; 94:301 5–3021. [ Links ]
15. Mandelli F, Diverio D, Avvisati G, et al. Molecular remission in PML/RARa–positive acute promyelocytic leukemia by combined all–trans retinoic acid and idarubicin (AIDA) therapy. Blood 1997; 90:1014–1021. [ Links ]
16. Frankel SR, Eardley A, lauwers G, Weiss M, Warrell RP Jr. The "retinoic acid syndrome" in acute promyelocytic leukemia. Ann Intern Med 1992; 117:292–296. [ Links ]
17. Jonathan KM. The biologic basis for the use of retinoids in cancer prevention and treatment. Curr Opin Oncol 1999; 11:497–503. [ Links ]
18. Zhang P, Wang SY, Hu LH, et al. Arsenic trioxide treated 72 cases of acute promyelocytic leukemia. Chin J Hematol 1996; 2:58–60. [ Links ]
19. Shen ZX, Chen GQ, Ni JH, et al. Use of arsenic trioxide (As203) in the treatment of acute promyelocytic leukemia: II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood 1997; 89:3354–3360. [ Links ]
20. Kinjo K, Kizaki M, Muto A, et al. Arsenic trioxide (As203)–induced apoptosis and differentiation in retinoic acid–resistant acute promyelocytic leukemia model in hGM–CSF–producing transgenic SCID mice. Leukemia . 2000; 14:431 –438. [ Links ]
21. Frankel SR, Eardley A, Heller G, Berman E, et al. All–trans retinoic acid for acute promyelocytic leukemia. Ann Intern Med 1994; 120:278–286. [ Links ]
22. De Botton S, Dombret H, Sanz M, San Miguel J, et al. Incidence, clinical features, and outcome of all trans–retinoic acid syndrome in 413 cases of newly diagnosed acute promyelocytic Leukemia. Blood 1998; 8:2712–2718. [ Links ] 38.
23. Fenaux P, Le Deley MC, Castaigne S. Effect of all transretinoic acid in newly diagnosed acute promyelocytic leukemia. Results of a multicenter randomized trial. Blood 1993; 82:3241–3246. [ Links ]
24. Kanamaru A, Takemoto Y, Tanimoto M, Murakami H, et al. All–trans retinoic acid for the treatment of newly diagnosed acute promyelocytic leucemia. Blood 1995; 85:1202–1210. [ Links ]
25. Tallman MS, Andersen JW, Schiffer CA, Appelbaum FR. Clinical description of 44 patients with acute promyelocytic leukemia who developed the retinoic acid syndrome. Blood 2000; 95:90–95. [ Links ]
26. Vahdat L, Maslak P, Miller WH Jr, et al. Early mortality and the retinoic acid syndrome in acute promyelocytic leukemia: impact of leucocytosis, and dose chemotherapy, PML–RARa isoform, and CD13 expression in patients with all–trans retinoic acid. Blood 1994; 84:3843–3849. [ Links ]
27. Asou N, Adachi K, Tamura J, Kanamaru A, et al. Análisis of prognostic factors in newly diagnosed acute promyelocytic leukemia treated with all–trans retinoic acid and chemotherapy. Japan Adult Leukemia Study Group. J Clin Oncol 1998; 16;78–85. [ Links ]
28. Cortes JE, Kantarjian H, O'Brien S, Robertson LE, et al. All trans retinoic acid followed by chemotherapy for salvage of refractory or relapsed acute promyelocytic leukemia. Cancer 1994; 73:294–299. [ Links ]
29. Seale J, Delva L, Renesto P, et al. All–trans retinoic acid rapidly decrease cathepsin G síntesis and mRNA expresión in acute promyelocytic leucemia. Leukemia 1996; 10:95–101. [ Links ]
30. Di Noto R, Schiavone EM, Ferrara F, Manzo C, et al. All–trans retinoic acid promotes a differential regulation of adhesion molecules on acute myeloid blast cells. Br J Haematol 1996; 88:247–255. [ Links ]
31. Di Noto R, Schiavone EM, Ferrara F, Manzo C, et al. Expression and ATRA–driven modulation of adhesion molecules in acute promyelocytic leukemia. Leukemia 1994; 8(Suppl 2):S71–S76. [ Links ]
32. Dubois C, Schlageter MH, de Gentile A, et al. Modulation of IL–8, IL–1 b, and G–CSF secretion by all–trans retinoic acid in acute promyelocytic leukemia. Leukemia 1994; 8:1750–1757. [ Links ]
33. Marchetti M, Falanga A, Giovanelli S, Oldani E, et al. All–trans retinoic acid increases adhesion to endothelium of the human APML cell line NB4. Br J Haematol 1996; 93:360–366. [ Links ]
34. Larson RS, Brown DC, Sklar LA. Retinoic acid induces aggregation of the acute promyelocytic leukemia cell line NB4 by utilization of LFA–1 and ICAM–2. Blood 1997; 90:2747–2756. [ Links ]
35. Dedhra S, Robertson K, Gray V. Induction of expression of the aVb1 and aVb3 integrin heterodimers during retinoic acid–induced neuronal differentiation of murine embryonal carcinoma cells. J Biol Chem 1991; 266:21846–21851. [ Links ]
36. Zhang A, Taron G, Turner DC. Expression of integrin a1b1 is regulated by nerve growth factor and dexamethasone in PC12 cells: Functional consequences for adhesion and neurite growth. J Biol Chem 1993; 268:55–57. [ Links ]
37. Castaigne S, Lefebvre P, Chomienne C, et al. Efectiveness and pharmacokinetics of low–dose all–trans retinoic acid (25 mg/m2) in acute promyelocytic leukemia. Blood 1993; 82:3560–3563. [ Links ]
38. Chen GQ, Shen ZX, Wu F, et al. Pharmacokinetics and efficacy of low–dose all–trans retinoic acid in the treatment of acute promyelocytic leukemia. Leukemia 1996; 10:825–828. [ Links ]
39. Miller VA, Rigas JR, Benedetti FM, et al. Initial clinical trials of the retinoid receptor panagonist 9–cis retinoic acid. Clin Cancer Res 1996; 2:471–475. [ Links ]
40. Tobita T, Takeshita A, Kitamura K, et al. Treatment with a new synthetic retinoid, Am80, of acute promyelocytic leukemia relapsed from complete remission induced by all–trans retinoic acid. Blood 1997; 90:967–973. [ Links ]
41. Kakkar N. ATRA syndrome with extensive organ infiltration. Am J Hematol 2002; 71:62–64. [ Links ]
42. Fenaux P, De Botton S. Retinoic acid syndrome. Recognition, prevention and management. Drug Saf 1998; 18:273–279. [ Links ]
43. Gendrel D, Bohuon C. Procalcitonin as a marker of bacterial infection. Pediatr Infect Dis J 2000;19:679–688. [ Links ]
44. Boschini P. Síndrome del ácido retinóico. Patología de Urgencia 2001; 9:16–22. [ Links ]
45. Tommasino C, et al. Retinoic acid síndrome, severe respiratory insufficiency treated with CPAP. Minerva Anestesiol 2000; 66:555–559. [ Links ]
46. Cogliati A, Conti G, Tritapepe L, Canneti A, et al. Noninvasive ventilation in the treatment of acute respiratory failure induced by all–trans retinoic acid (retinoic acid syndrome) in children with acute promyelocytic leukemia. Pediatr Crit Care Med 2002; 3:70–73. [ Links ]
47. Nagafuji K, Eto T, Tokunaga Y, Hayashi S, et al. Retinoic acid syndrome during the treatment of acute myelomonocytic leukaemia with all–trans– retinoic acid and low–dose cytosine arabinósido. Br J Haematol; 100:610–611. [ Links ]
48. Miyoshi TK. Acute promyelocytic leukemia accompanied by retinoic acid syndrome with complications of acute myocardial infarction and cerebral infarction during treatment with all–trans retinoic acid. Rinsho Ketsueki 2002; 43:954–959. [ Links ]
49. Hwang WL, Gau JP, Chen MC, et al. Treatment of acute promyelocytic leukemia with all–trans retinoic acid: Succesful control of hyperleucocytosis and leucostasis syndrome with leukaphereses and hydroxyurea. Am J Hematol 1993; 43:323–324. [ Links ]














