Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.5 Ciudad de México sep./oct. 2004
Artículos de revision
Trasplante autólogo de médula ósea como tratamiento de enfermedades autoinmunes: mecanismos y resultados
Autologous Bone Marrow Transplantation as a Treatment for Autoimmune Disease: Mechanisms and Results
Marcos E. Garza–Madrid,* José R. Borbolla–Escoboza,* Manuel A. López–Hernández**
* Programa de trasplante de médula ósea, Hospital San José – Tec de Monterrey /Centro de Investigación y Extensión, Escuela de Medicina, ITESM, Campus Monterrey. Monterrey, Nuevo León, México.
** Servicio de Hematología, Centro Médico Nacional 20 de Noviembre, ISSSTE. México DF, México.
Correspondencia y solicitud de sobretiros:
Dr. José R. Borbolla Escoboza.
Escuela de Medicina, ITESM,
Lago de Texcoco 5119 Col. Lagos del Bosque
Monterrey, Nuevo León C.P. 64890
tel: 83331121,
Correo electrónico: borbolla@itesm.mx
Resumen
Las enfermedades autoinmunes se caracterizan por una respuesta del sistema inmune del individuo hacia tejidos propios. Una línea de investigación actual es el tratamiento de estas enfermedades y el desarrollo de tolerancia. Una de las opciones en la búsqueda del desarrollo de tolerancia es el trasplante autólogo de médula ósea: la variantes del trasplante de médula ósea que hace uso de células progenitoras hematopoyéticas propias. La posibilidad de usar este tipo de trasplante como tratamiento de enfermedades autoinmunes se originó en los hallazgos de remisiones de enfermedades autoinmunes coexistentes, enpacientes que eran trasplantados por enfermedades oncológicas. En esta revisiónpresentemos el fundamento teórico de este tratamiento, así como una recopilación de los estudios preclínicos y clínicos más relevantes en esta materia.
Aunque algún reporte inicial puso en duda la utilidad de dicho procedimiento, en general, los resultados son alentadores. Es necesario que más pacientes en diversos estadios de las enfermedades autoinmunes sean referidos a centros especializados de manera que sea posible recopilar la información de manera ordenada y sistemática, y se pueda arribar a un conocimiento sobre el papel que juega este tipo de tratamiento en las enfermedades autoinmunes.
Palabras clave: enfermedades autoinmunes, trasplante de médula ósea, lupus, artritis, esclerosis múltiple, esclerosis sistémica.
Summary
Autoimmune diseases are characterized by immune response against self antigens. One of the current research interests in this field is oriented toward development of tolerance. One of the newest options in the search for tolerance is autologous bone marrow transpiantation: a variant of bone marrow transplant in which the patient's own hematopoietic stem cells are reinfused after myeloablative therapy. The idea of using bone marrow transplant in treatment of autoimmune diseases derived from observing remission in autoinmune diseases in patients transplanted due to coexisting neoplastic disease. Although an isolated initial report of bone marrow transplant as treatment for autoimmune disease questioned the utility of this procedure, over all, results are encouraging. To compile information in a programmed and systematic manner, it is necessary to send more patients in all stages of immune diseases to specialized centers to be included in large multicenter randomized trials. In time, the role for this procedure in autoimmune diseases will become clear.
Keywords: Autoimmune diseases, bone marrow transplant, lupues, arthritis, multiple slcerosis, systemic sclerosis.
Introducción
Las enfermedades autoinmunes se caracterizan por una respuesta del sistema inmune del individuo hacia tejidos propios. Durante años estas enfermedades han sido tratadas por medio de medicamentos inmunosupresoras que idealmente detendrían el ataque contra los tejidos del paciente. Por desgracia dichos tratamientos inducen incapacidad del sistema inmune para generar una defensa adecuada en contra de patógenos, lo que obliga al médico a buscar un equilibrio entre el daño provocado por el sistema inmune y la inmunosupresión del paciente. Aunque la terapia inmunosupresora es eficaz en la mayoría de los pacientes, existe un porcentaje que continúa empeorando a pesar del tratamiento. Por esto actualmente la investigación para el tratamiento de las enfermedades autoinmunes se basa fundamentalmente en el desarrollo de tolerancia.1 Tolerancia es la incapacidad del sistema inmune para montar una respuesta contra antígenos propios.2
El mecanismo de identificación del sistema inmune específico o "adaptable" se ha estudiado ampliamente y todavía es objeto de controversia e investigación".1,3 Este es el mecanismo de la mayoría de las enfermedades autoinmunes, en las que existe producción de anticuerpos contra epítopos propios del paciente.
Hasta ahora se aceptan dos mecanismos que explican cómo el sistema inmune identifica los antígenos propios y ajenos. El primer mecanismo aceptado es el reconocimiento central (en el timo) de los antígenos propios. El segundo mecanismo es la inactivación periférica de los linfocitos autosensibles.3
Una de las opciones en la búsqueda del desarrollo de tolerancia es el trasplante autólogo de médula ósea. Con este procedimiento el clínico espera reiniciar el sistema inmune y colocarlo en un estado inactivo a partir del cual se recupere la tolerancia hacia los antígenos propios.4
Antecedentes
Identificación de los antígenos propios y desarrollo de tolerancia
En el desarrollo y función de los linfocitos T existen dos lugares donde ocurre la diferenciación de los antígenos propios de los ajenos. El primero de ellos es el timo. Cuando una célula del sistema hematopoyético se compromete hacia una diferenciación de linfocito T, migra hacia el espacio subcapsulardel timo, donde se lleva a cabo el arreglo genómico y la producción de su receptor de célula T (RCT).3 Una vez que se produce una cadena beta útil del RCT, el linfocito migra a la corteza. En este punto de su desarrollo los linfocitos T expresan tanto CD4, como CD8.1
En la corteza del timo, los linfocitos T son seleccionados positivamente dependiendo de la afinidad de su RCT con las moléculas del Complejo Principal de Histocompatibilidad (CM H) clase I y II. Estas moléculas son ligandos de los RCT. Los linfocitos que presentan afinidad para CMH clase I pierden el receptor CD4 y se convierten en Linfocitos T citotóxicos (CD8+). Los linfocitos con afinidad para el CMH clase II pierden en cambio el CD8 y se convierten en infocitos T ayudadores (CD4+).3 Los linfocitos que poseen un RCT funcional, con afinidad para CMH clase I o II, son seleccionados positivamente. El resto sufre apoptosis.2
Una vez que el linfocito T se ha diferenciado en una de sus subclases, pasa a la médula del timo. En la médula ocurre una selección negativa por medio de mecanismos coestimuladores.3 Las células epiteliales en la médula del timo presentan a los linfocitos T antígenos propios en las CMH. Aquellos que presentan afinidad excesiva para estos antígenos sufren apoptosis.2
La inactivación periférica de los linfocitos T ocurre simultáneamente con la presentación del antígeno. La vía de activación de los linfocitos requiere de dos estímulos en el nivel celular. El primero de ellos es llevado a cabo por la presentación del antígeno en las moléculas CMH clase I y II. Cuando se presenta un complejo antígeno–CMH a un RCT, se activa la primer señal para una respuesta inmune adaptable (señal 1). Sin embargo, este estímulo por sí mismo no es suficiente para iniciar una respuesta. Es necesario un segundo estímulo que puede serdado por otras moléculas de membrana de las células presentadoras de antígenos, o porcitocinas liberadas por el sistema inmune inespecífico (señal 2).1
Si no se presenta el segundo estímulo, el linfocito se inactiva o inicia apoptosis, dependiendo de las condiciones y estímulos secundarios que reciba. Los linfocitos T que reciben una señal 1, pero no una señal 2, se vuelven anérgicos. Dejan de responder a estímulos incluso si posteriormente se presenta una señal 2. A esto se le llama bloqueo coestimulatorio.1
Cuando los linfocitos T son estimulados, incrementan su producción de FAS la cual, cuando es estimulada por su ligando, inicia el proceso de apoptosis. El ligando de FAS es expresado por células presentadoras de antígenos, linfocitos T activados y células estromales de sitios inmunológicamente privilegiados.1
Por otra parte, los linfocitos T estimulados pueden ser suprimidos por medio de contacto con otras células, o sufrir desviación inmune; un proceso porel cual se genera tolerancia por medio de la estimulación con factores solubles de linfocitos T reguladores.1
Hay que recordar que la producción de anticuerpos por linfocitos B depende de su estimulación por medio de linfocitos T ayudadores, con las excepciones de estímulos provenientes de macromoléculas con múltiples epitopos iguales que permiten la activación del linfocito B por medio deunagran concentración de receptores de Ig activados.2
La teoría actual acerca de la activación del sistema inmune es que los linfocitos B periféricos se encuentran predominantemente en tejidos linfoides, lugar donde esperan la llegada de los antígenos. Cuando un linfocito B es estimulado por la unión de los receptores de célula B, que son fracciones variables de sus inmunoglobulinas montadas en un receptor transmembrana, con antígenos, éstos complejos son interiorizados a la célula y procesados. El resultado es la presentación del antígeno en moléculas del CMH clase II, que estimula a los linfocitos T ayudadores. Esta co–estimulación da como resultado la producción de inmunoglobulinas, la diferenciación hacia los diferentes tipos de estas y la variabilidad en su producción de la que es capaz el linfocito B para mejorar la respuesta inmune.3
Con base en el conocimiento actual sobre el mecanismo inmune, es muy posible que el sistema funcione en un balance constante entre selección clonal, activación, inhibición y ajustes a nivel de señales intracelulares.4 Dicho equilibrio permitiría al organismo mantenerse estable generando constantemente respuestas contra los antígenos exógenos mientras suprime el ataque contra los endógenos. La forma en la que este balance se mantiene es aún objeto de investigación.
Trasplante autólogo de células progenituras hematopoyéticas
Una de las variantes del trasplante de médula ósea es aquella que hace uso de células progenituras hematopoyéticas propias; esta variante se conoce como trasplante autólogo de células progenituras hematopoyéticas (TACPH). En enfermedades como la leucemia se le han descrito ventajas como la disponibilidad continua del donador, mejor tolerancia a la quimioterapia de acondicionamiento, reconstitución temprana del sistema inmune y la posibilidad de realizarla en pacientes de mayor edad. Del mismo modo se describen desventajas que, traducidas a las enfermedades autoinmunes, incluyen la falta de efecto injerto contra enfermedad autoinmune y la posibilidad de re–implantar células auto–reactivas.5
La obtención de las células progenituras hematopoyéticas ha pasado de ser sólo por aspiración de médula ósea, a la obtención de células hematopoyéticas por aféresis de sangre periférica (CHSP) o la sangre de cordón umbilical; razón por la cual cada vez con mayor frecuencia se usa el término trasplante de células progenitoras hematopoyéticas, más que el de trasplante de médula ósea.6
La terapia de acondicionamiento tiene como objetivo, en el trasplante autólogo, destruir las células residuales neoplásicas que pudieran persistir en el paciente. En el caso de las enfermedades autoinmunes, se trata de eliminar por completo las células del sistema inmunológico auto–reactivas. Como efecto secundario se encuentra, prácticamente siempre, la destrucción de las células hematopoyéticas del paciente. Se han utilizado múltiples quimioterapéuticos, el más común es la Ciclofosfamida, en diversos esquemas de tratamiento.4 Descubrir cuál es la mejor combinación para estos pacientes deberá ser objeto de estudios clínicos.
El TACPH es un proceso largo y no exento de riesgos. Pueden existir complicaciones infecciosas, pulmonares, tromboembólicas y toxicidades neurológicas, hepáticas y cardiacas que pueden poner en riesgo la vida de los pacientes.7,8 La tasa de utilización de la unidad de terapia intensiva se estima entre 7% y 40% de los pacientes que recibe un trasplante de células hematopoyéticas dependiendo del tipo de trasplante y factores de riesgo como edad, terapia de acondicionamiento y enfermedades subyacentes.8
Experiencia anecdótica y en animales de laboratorio
La posibilidad de utilizar el trasplante de médula ósea como tratamiento de enfermedades autoinmunes se originó de la observación de que, pacientes tratados con trasplante alogénico para enfermedades hematológicas y que simultáneamente padecían de trastornos autoinmunes, lograban remisión de su enfermedad reumática.9 Posteriormente se iniciaron estudios en el modelo animal más utilizado para el trasplante de médula ósea: el ratón. En este modelo se logró la cura de un amplio espectro de enfermedades autoinmunes como son lupus murino, púrpura trombocitopénica autoinmune, glomerulonefritis de cambios crecientes, entre otras.10 Con esta evidencia, en 1996, la Liga Europea Contra el Reumatismo (EULAR) y el Grupo Europeo para el Trasplante de Médula y Sangre (EBMT), publicaron un consenso que ha dictado la guía para la mayoría de los estudios clínicos en este campo.11
Bajo el consenso arriba mencionado, los estudios clínicos se han limitado, en su gran mayoría, a pacientes con enfermedad grave y en casos donde se encuentre en peligro la vida. Es posible, entonces que estas condiciones influyan en los resultados del trasplante de forma negativa, incrementándose la morbilidad y mortalidad del procedimiento por el estado funcional del paciente.
Con los estudios animales y clínicos de trasplante alogénico se ha descubierto la existencia de un efecto de Injerto contra Enfermedad Autoinmune (IcEA). Similar al efecto de Injerto contra Hospedero e Injerto contra Leucemia, el IcEA es una destrucción de los linfocitos T y B originales del paciente por el sistema inmune alogénico que se le ha infundido. Este efecto ha probado ser benéfico en estudios animales, donde quimerismos incompletos han resultado en prevención o cura de trastornos autoinmunes en ratones.10
El posible mecanismo de acción del TACPH sobre las enfermedades autoinmunes
Bajo el entendimiento del sistema inmune antes expuesto, parece lógico pensar que la célula o tejido blanco es destruida o dañada por un mecanismo como infección viral, traumatismo directo o algún otro desconocido aún. En el caso de los virus se cree que existen dos mecanismos principales: 1) mimetización molecular; 2) activación del observador. El primero señala que un anticuerpo puede no serían específico contra un antígeno viral y presentar una reacción cruzada contra un epítopo propio. El segundo es la activación de linfocitos T debido a una exposición de antígenos que normalmente nose encuentran expuestos o debido a la sobreactivación de los mecanismos de respuesta inmune.12
Una vez que el sistema inmune ha iniciado una reacción en contra de un antígeno propio, no se requiere de la persistencia del estimulo que lo inició.3 Por esto, aun cuando la infección o lesión que desencadenó el proceso autoinmune haya desaparecido, la enfermedad continúa. Aun no se ha descubierto porqué, si estas teorías son ciertas, no ocurre una enfermedad autoinmune en todos los pacientes que padecen de ciertas infecciones.12
Cuando se ha iniciado la destrucción del antígeno propio, los restos son transportados por células fagociticas a sitios linfoides periféricos donde son procesados y presentados a los linfocitos B. Los linfocitos B internalizan los nuevos antígenos, a los que nuncase habían expuesto porque se encontraban escondidos en tejidos periféricos, y los procesan y presentan al linfocito T, quien al recibir también una señal coestimuladora, activa en turno al linfocito B para que produzca anticuerpos autoinmunes. La continua destrucción del órgano diana perpetúa el estímulo para la producción de antígenos y la variabilidad en la producción de anticuerpos de los linfocitos B incrementa la especificidad y respuesta.
El trasplante de MO permitiría entonces reiniciar el proceso y detener el daño celular y con esto, parar el ciclo de producción de autoanticuerpos.4 Al detenerse la función inmune por completo de forma transitoria, habría tiempo para la reparación tisular y volverá "ocultar" los epítopos propios por un lado y generar nuevamente tolerancia de los antígenos propios en el nuevo sistema inmune. Bajo esta teoría, un trasplante en el que se destruyan los plasmocitos y linfocitos y en el que por algún tiempo exista tolerancia a todos los tejidos tendría mejores posibilidades de éxito.
Resultados clínicos
Si bien algún reporte inicial presentó pobres resultados con este procedimiento,13 en general los resultados son alentadores (Cuadro I). En el 2000 se publicaron los resultados almacenados en el registro de EULAR y EBMT hasta ese punto. Se reportó mortalidad del procedimiento de aproximadamente 9%. Se reportaron evoluciones al menos de tres meses en todas las enfermedades.
Esclerosis múltiple (EM)
La EM tiene una incidencia mundial aproximada entre 5 y 30 por 100,000 habitantes, dependiendo de la zona geográfica.15 La Sociedad Nacional de la Esclerosis Múltiple en los Estados Unidos de Norteamérica sugiere el inicio de la terapia con interferón beta o similar tan pronto como se presente una recaída o en casos selectos en pacientes de alto riesgo. Si esta terapia no funciona, se recomienda entonces terapia inmunosupresora.16 Un porcentaje de esta población no responde al tratamiento con inmunomoduladores e inmunosupresores, y es en esta población que se ha intentado el trasplante en estudios fase 1 y 2.15
Hasta el momento no es posible reparar el daño axonal de estos pacientes y en la mayoría de los pacientes que se han trasplantado la enfermedad ya se encuentra en una etapa avanzada. Apenas se comienza a investigar el desarrollo de terapias para remielinizar los axones dañados por la enfermedad.17 Es probable que una intervención más temprana tenga mejores resultados en la supervivencia y calidad de vida de estos pacientes.
En la literatura se encuentran los reportes de 139 pacientesque han sido incluidos en estudios para TACPH como tratamiento de esclerosis múltiple.4,18–24 (Cuadro II) De estos se trasplantaron y se les dio seguimiento a 130; 27 pacientes (20.8%) progresaron en su enfermedad, el resto mejoraron o se mantuvieron estables. Tomado como intención de tratamiento de los pacientes, tomando aquellos que no se trasplantaron como progresión de la enfermedad, tenemos progresión en 36 de 139 pacientes (25.9%). Cinco pacientes murieron debido al trasplante, por lo que la mortalidad relacionada al tratamiento es de aproximadamente 3.8%. El impacto sobre la calidad de vida y funcionalidad de los pacientes no se reporta en todos los trabajos, pero hay estudios que indican una mejora subjetiva de la calidad de vida y funcionalidad posterior al trasplante en estos pacientes.25,26

Lupus eritematoso sistémico (LES)
El LES se caracteriza por la pérdida de la tolerancia a múltiples antígenos propios. Se presenta con mayor frecuencia en mujeres en edad reproductiva con tasa mujen hombre de 9:1. Tiene una incidencia reportada en los Estados Unidos de América de 40 casos en 100,000 individuos.28 El tratamiento actual se basa en el uso de antiinflamatorios esteroideos o no, a la dosis terapéutica más baja y tratamientos coadyuvantes para las diferentes manifestaciones de la enfermedad como esteroidestópicos para la piel y ciclos de ciclofosfamida para la enfermedad renal.29 Aun con estos tratamientos un grupo de pacientes desarrolla enfermedad intratable y desarrolla etapas avanzados de nefropatía, manifestaciones del sistema nervioso central y cardiovasculares.30
En una revisión de la literatura, encontramos principalmente reportes de casos y algunos grupos aislados, que suman 28 pacientes tratados con TACPH antologo.31–40 (Cuadro III) De estos casosse reporta una falla del injerto como la única muerte relacionada al tratamiento35 lo que da una mortalidad de 3.6%. El único trabajo que reporta recaída es el de Traynor y colaboradores, que incluye al mayor número de pacientes, este autor reporta dos progresiones (0.08% total, 13% de los pacientes en ese estudio) sin embargo uno y otro casos los pacientes se encuentran en buen control y mejor estado clínico que previo al tratamiento.38

Artritis reumatoide (AR)
La AR es una poliartritis inflamatoria simétrica y afecta a aproximadamente 1% de la población. Su incidencia aumenta con la edad y es mayor en mujeres que en hombres a razón de 3 a 1,29 El tratamiento ideal sería aquel que permitiera detener los síntomas inflamatorios, reconstituir la función y prevenir el daño y las complicaciones sistémicas.41 Sin embargo, estos objetivos no se han logrado todavía. El tratamiento médico actual incluye AINES, esteroides y Medicamentos Antirreumáticos Modificadoras de la Enfermedad (MARME). Los MARME incluyen metotrexate, leflunomida, sulfasalazina, hidroxicloroquina y agentes biológicos como inhibidoresde TNF–alfa y receptores de 1L1,29 El MARME considerado como estándarde oro en el manejo de la AR es el Metotrexate y cada vez más reumatólogos en los EEUU lo recetan en combinación con otro medicamento del mismo tipo para el control de esta enfermedad.42 En estudios recientes, cuando se utiliza Metotrexate solo, se logra un ACR 20 (criterios del Colegio Americano de Reumatología para 20% de mejoría) en 60 a 75 por ciento de los pacientes que no ha recibido MARME a un año de tratamiento.41 Un estudio comparativo en pacientes que previamente han fallado a una terapia de Metotrexate por seis meses, a quienes se les agregó un bloqueador de los receptores de Factor de Necrosis Tumoral (TNFR:Fc), mostró que con esta combinación aproximadamente 70% de los pacientes que ha fallado a la terapia con Metotrexate, puede llegara ACR 20 a cinco meses de iniciado el tratamiento.43
Realizando una revisión de la bibliografía disponible encontramos un total de 80 pacientes incluidos para en estudios de TACPH para AR.44–53 (Cuadro IV) De estos pacientes, 74 recibieron trasplante; 27 (36.4%) no alcanzaron criterios de ACR 20 o fueron reportados como sin mejoría. Del total de los pacientes incluidos, tomando aquellos que no se trasplantaron como si hubieran progresado (intención de tratar), hubieron 33 progresiones (41.2%). Los pacientes incluidos en estudios que presentaron sus resultados en términos de ACR fueron 59; de estos, 19 (32.2%) lograron ACR 70 (criterios del Colegio Americano de Reumatología para 70% de mejoría) ornas.44,46,50,51,53
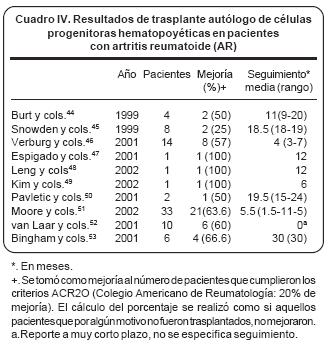
El estudio publicado por Moore y colaboradores51 reporta una tasa de ACR 70 de 39% y es el estudio con mayor número de pacientes publicado. Sin embargo, el seguimiento en este estudio es menor a un año, lo que podría explicar la alta tasa de mejoría comparada con el resto de los estudios, mientras que la proporción de pacientes que no llegaron a ACR20 es de aproximadamente la tercera parte; similar a lo reportado por los demás estudios.
Artritis Juvenil Idiopática (AJI)
La AJI, antes llamada Artritis Reumatoide juvenil, tiene una prevalencia aproximadade 30 a 150 por 100,000 habitantes y se calcula que entre 5 y 18 niños de cada 100,000 nacidos vivos desarrollan la enfermedad cada año.54 Aunque se tiene la idea de que se trata de una enfermedad benigna, estudios recientes han mostrado una tasa de remisión de solo el 33%.54 La evolución y tratamiento varía dependiendo del subtipo de AJI que se presente, siendo la enfermedad sistémica y la poliarticular las de peor evolución y mayor dificultad de tratamiento. En la mayoría de los casos el tratamiento inicial son AINES, seguido por Metrotexate; sin embargo sólo dos terceras partes de los pacientes responden a las dosis habituales de estos medicamentos. En los pacientes que no responden altratamiento habitual se usan esferoides sistémicos y comienzan a incorporarse los MARME utilizados en la AR, aunque la mayoría no están aprobados aún en esta población.55 Las principales complicaciones de dichos tratamientos, particularmente de los esferoides, es su efecto sobre el crecimiento. Actualmente se están llevando a cabo estudios controlados con dosis mayores de Metotrexate y con distintos MARME para el tratamiento de la AJI. En un estudio retrospectivo reciente con pacientes tomando AINES y MARME, se observó la evolución de los promedios de diferentes métodos de evaluación con mejorías significativas de entre 30 y 45% en los cuestionarios de salud infantil, pero no en el margen de movimiento o funcionalidad de las articulaciones ni la velocidad de sedimentación globular.56 Este mismo estudio reportó que, de 25 pacientes, 11 continuaron con enfermedad clínicamente activa, 13 se encontraban en remisión clínica pero aún recibiendo medicamentos y uno en remisión clínica sin uso de medicamentos.
En la literatura encontramos reporte de aproximadamente 40 casos de TACPH en pacientes con AJI, sin embargo sólo pudimos recabardatos de 26 pacientes,40,57–60 (Cuadro V) Dentro de estos pacientes se reportaron cinco que no mejoraron con el tratamiento. En el único estudio donde se reportaron más de 10 pacientes; dos de éstos fallecieron debido a síndrome de activación de macrófagos.59 Estas muertes proyectan una mortalidad global de aproximadamente 7.7% (11.1% en ese estudio) en este tratamiento.

Esclerosis Sistémica (ES)
La ES se caracteriza por una deposición excesiva de colágena, autoinmunidad y un daño vascular extenso que involucra varios órganos y sistemas. Losórganos afectados incluyen la piel, músculo, articulaciones, nervios, vasculatura, ríñones, corazón pulmones y el tracto intestinal.61 Las manifestaciones clínicas de esta enfermedad son variadas y dependen de los órganos afectados.62 No hay un tratamiento efectivo definido, sin embargo se han estado probando nuevos tratamientos desarrollados con base en el conocimiento de la patofisiología de la enfermedad. Básicamente se busca tratar el daño vascular, la autoinmunidade inflamación y la fibrosis.61 Se ha encontrado que en etapas tempranas de la enfermedad se encuentran infiltrados de linfocitos y células plasmáticas en biopsias de piel de pacientes con ES, sugiriendo que la activación del sistema inmune y el componente de autoinmunidad se encuentran en fases tempranas de la enfermedad.63
Se han reportado 73 pacientes para TACPH en ES.64–67 (Cuadro VI) De éstos, sólo en 68 se realizó el procedimiento. Las muertes relacionadas al tratamiento fueron 11 (16%) y las no relacionadas al tratamiento fueron 5 (7.3%). Esto da mortalidad global de aproximadamente 23.5% a un año. Progresaron 19 pacientes (26%), tomada como progresión una mejoría menor al 20%, muerte secundaria a progresión de la enfermedad y haber sido incluido en un estudio pero no haberse trasplantado por alguna razón y excluyendo las muertes relacionadas al tratamiento. La mayoría de éstas últimas fueron debidas a eventos como hemorragia o toxicidad orgánica directa.67

Discusión
Aunque reconocemos las limitaciones para la interpretación de los datos que aquí exponemos, dado que se tratan de estudios, no solamente pequeños, sino muy heterogéneos, hasta el momento es la información de la que disponemos.
Hasta ahora, el trasplante autólogo de médula ósea para tratar enfermedades autoinmunes se ha utilizado, en su inmensa mayoría, para tratar pacientes en quienes la terapia convencional no ha funcionado. Esto implica que la población trasplantada es una población casi siempre con enfermedades avanzadas. Esto quizá podría explicar la incrementada mortalidad de este procedimiento cuando se compara con aquella obtenida en pacientes hematológicos y oncológicos.
La posible reinfusión de células autorreactivas es una preocupación constante. La posibilidad de obtenerdichas células de la médula ósea es probablemente mayor que la de obtenerlas de sangre periférica, sin embargo, esta posibilidad no se puede despreciar. En algunos de los trasplantes se ha tratado de seleccionar las células CID34+.19,33,58 Esta práctica no se ha utilizado en estudios comparativos y no hay información suficiente para recomendaría de forma estandarizada.
Los pacientes que parecen tener mejores resultados son los de LES, con 88% de mejoría, seguidos por la AJI y la EM, con 73% y 71% de mejoría respectivamente. Los peores resultados parecen obtenerse en pacientes con ES y AR, con 59% y 58.8% de mejoría respectivamente.
Posibles explicaciones para esto son: en el caso de la ES, se sabe que el papel que juega la autoinmunidad es temprano en el desarrollo de la enfermedad.62 Este hecho limita la utilidad de un procedimiento como el TACPH porque, como comentamos anteriormente, la mayoría de los estudios se realiza en pacientes en etapas avanzadas y sus enfermedades han sido refractarias al tratamiento. Esto, aunado al el daño severo a diferentes órganos, hacen, probablemente que incremente la morbilidad y mortalidad del procedimiento, y podría ser la causa de que los resultados no sean tan buenos como en otras enfermedades.
También es importante hacer notar que los resultados publicados por EULAR y EBMT son diferentes a los del resto de los estudios publicados en la literatura, debido a que los primeros reportan dos casos con empeoramiento de su enfermedad posterior al trasplante y dos casos que se mantuvieron estables después del procedimiento, de un total de 33 pacientes (12%); teniendo el resto mejoría significativa (84.8%).14 En cambio, en los reportes que encontramos la mejoría fue de sólo 59%.64–67
Caso similar es el de los pacientes con AR, en quienes el TACPH se ha utilizado sólo en pacientes crónicos y refractarios al tratamiento convencional. Recordando que la justificación para este tipo de procedimiento es la oportunidad de interrumpir durante cierto periodo de tiempo la destrucción de los antígenos, creemos que es más probable que continúe cierto grado de destrucción de los tejidos y exposición de antígenos en el proceso crónico de estos pacientes, lo que disminuye las posibilidades de curación.
Hasta ahora, pese a que los pacientes que se han trasplantado se encuentran en fases avanzadas de su enfermedad y no responden al tratamiento convencional, con este procedimiento se ha logrado que aproximadamente un tercio de los pacientes con AR con muy pocas probabilidades de lograr mejoría clínica, lleguen a una mejoría de 70% bajo criterios de la ACR.44,46,50,51,53
La mortalidad más baja la ha presentado la AR, en la que no encontramos reportes de fallecimientos. Esto pudiera explicarse porque la gran mayoríade los pacientes que encontramos son reportes de casos y no grupos de pacientes en estudios clínicos. Sin embargo, en los grupos de 10 o más pacientes,45,50,51 tampoco se ha reportado un solo caso de muerte relacionada al procedimiento.
En el caso del LES, el único caso de muerte reportado durante el procedimiento fue una falla del injerto. La falta de estudios formales con inclusión de múltiples pacientes pudiera ser, como en los casos anteriores, una posible explicación de la baja mortalidad, aunque, como en el caso anterior, existe un estudio de 15 pacientes38 que tampoco reporta un solo caso de mortalidad.
En la EM y la AJI la mortalidad promedio que encontramos (3.8% y 7.7% respectivamente) en nuestra revisión comienza a parecerse más a la reportada en general por grupos como el EULAR y EBMT, de 9% aproximadamente.14
Finalmente, la ES presenta una mortalidad promedio relacionada con el tratamiento de 16% y mortalidad por progresión de la enfermedad de 7.3%. A diferencia de los datos que encontramos en LES y AR, la mayoría de los grupos que presenta pacientes con ES fueron reportados dentro de estudios bien diseñados y protocolizados, donde el TACPH fue realizado como último recurso en pacientes gravemente afectados y refractarios al tratamiento conocido.
Conclusiones
El trasplante autólogo de células progenitoras hematopoyéticas es un tratamiento experimental para las enfermedades autoinmunes.
Si bien la información con la que se cuenta es aún escasa para permitir hacer recomendaciones en un sentido o en otro respecto al uso de este procedimiento, existen, sin embargo, algunos resultados optimistas que sugieren que eventualmente este procedimiento pudiera convertirse en un recurso terapéutico para el manejo de algunas de estas enfermedades en algunas etapas clínicas.
Tal y como ha sucedido en otras modalidades de enfermedades, neoplásicas y no neoplásicas, en cuyo tratamiento el TACPH ha ido ocupando un lugar; es necesario que más pacientes en diversos estadios de las enfermedades autoinmunes sean referidos a centros especializados para ser evaluados para la realización de TACPH, de manera que, mediante protocolos comparativos y estandarizados de tratamiento, y en estrecho contacto con el reumatólogo o el inmunólogo clínico, sea posible recopilar la información de manera ordenada y sistemática, y se pueda arribara un conocimiento sobre el papel de este procedimiento en las enfermedades autoinmunes.
Referencias
1. Rotrosen D, Matthews JB, Bluestone JA. The immune tolerance network: a new paradigm for developing tolerance–inducing therapies. J Allergy Clin Immunol 2002; 110:17–23. [ Links ]
2. Huston DP. The biology of the immune system. JAMA 1997; 278:1804–1814. [ Links ]
3. Chaplin DD. The immune system: overview of the immune response. J Allergy Clin Immunol 2003; 111:5442–5459. [ Links ]
4. Burt RK, Slavin S, Burns WS, Marmont AM. Induction of tolerance in autoimmune diseases by hematopoietic stem cell transplantation: getting closer to a cure. Blood 2002; 99:768–784. [ Links ]
5. Martin TG, Linker CA. autologous stem cell transplantation for acute lymphocytic leukemia in adults. Hematol Oncol Clin North Am 2001; 15:121–143. [ Links ]
6. Hoffman R, Benz Jr EJ, Shattil SJ, et al. editores Hematology: basic principies and practice. Phildelphia: Churchill Livingstone; 2000. p. 2326–2334. [ Links ]
7. Armitage JO. Bone marrow transplantation. N Engl J Med 1994; 330:827–838. [ Links ]
8. Horak DA, Forman SJ. Critical care of the hematopoietic stem cell patient. Crit Care Clin 2001; 17:671–695. [ Links ]
9. Kozák T, Rychlik I. Developments in hematopoietic stem–cell transplantation in the treatment of autoimmune diseases. IMAJ 2002; 4:268–271. [ Links ]
10. Marmont AM. Historical perspectives, rationale and future directions for hematopoietic stem cell transplantation for severe autoimmune diseases. Haematologica 2002; 87(Suppl 8):24–27. [ Links ]
11. Tyndall A, Gratwohl A. Blood and marrow stem cell transplants in autoimmune disease A consensus report written on behalf of the European League Against Rheumatism (EULAR) and the European Group for Blood Marrow Transplantation (EBMT). Br J Rheumatol 1997; 36:390–392. [ Links ]
12. Vogel A, Manns MP, Strassburg CP. Autoimmunity and viruses. Clin Liver Dis 2002; 6:451–465. [ Links ]
13. Euler HH, Marmont AM, Bacigalupo A, et al. Early recurrence or persistence of autoimmune diseases after unmanipulated autologous stem cell transplantation. Blood 1996; 88:3621–3625. [ Links ]
14. Tyndall A, Gratwohl A. Immune ablation and stem cell therapy in autoimmune disease Clinical experience. Arthritis Res 2000; 2:276–280. [ Links ]
15. Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG. Multiple Sclerosis. N Engl J Med 2000; 343:938–952. [ Links ]
16. Medical Advisory Board of the National Multiple Sclerosis Society. Disease management consensus statement. New York: National Múltiple Sclerosis Society; 2002. [ Links ]
17. Halfpenny C, Benn T, Scolding N. Cell transplantation, myelin repair, and multiple sclerosis. Lancet Neurol 2002; 1:31–40. [ Links ]
18. Fassas A, Anagnostopobus A, Kazis A, et al. autologous stem cell transplantation in progresive múltiple sclerosis – an interim analysis of efficacy. J Clin Immunol 2000; 20:24–30. [ Links ]
19. Carreras E, Saiz A, Marín P, et al. CD34+ selected autologous peripheral blood stem cell transplantation for multiple sclerosis: report of toxicitv and treatment results at one year of follow–up in 15 patients. Haematologica 2003; 88:306–314. [ Links ]
20. Burt RK, Cohen BA, Rusel E, Spero K, Joshi A, Oyama Y, et al. Hematopoietic stem cell transplantation for progressive multiple sclerosis: failure of a total body irradiation–based conditioning regimen to prevent disease progression in patients with high disability scores. Blood 2003; 102:2373–2378. [ Links ]
21. Nash RA, Bowen JD, McSweeney PA, Sullivan KM, Pavletic S, Maravilla KR, et al. Treatment of severe multiple sclerosis (MS) with high–dose immunosuppressive therapy (HDIT) and autologous stem cell transplantation (SCT): 2 year follow–up. Blood 2002; 100 (Supl.1):3408. [ Links ]
22. Kozak T, Havdrova E, Pitha J, Gregora E, Pytlik R, Maaloufova J, et al. High dose immunosuppressive therapy with PBPC support in the treatment of poor risk multiple sclerosis. Bone Marrow Transplant 2000; 25:525–531. [ Links ]
23. Openshaw H, Lund BT, Kashyap A, Atkinson R, Sniecinski I, Weiner L, Forman S. Peripheral blood stem cell transplantation in multiple sclerosis with busulfan and cyclophosphamide conditioning: report of toxicity and immunological monitoring. Biol Blood Marrow Transplant 2000; (6):563–575. [ Links ]
24. Mancardi GL, Saccardi R, Filippi M, et al. Autologous hematopoietic stem cell transplantation suppresses Gd–enhanced MRI activity in MS. Neurology 2001;57:62–68. [ Links ]
25. Saccardi R, Mancardi G, Bacigalupo A, Di Bartolomeo P, Donelli A, Gualdandi F, et al. Autoiogous hematopoietic stem cell transplantation in secondary progressive MS: Clinical, instrumental findings and impact on quality of life. Blood 2002; 100(supl.1):3409. [ Links ]
26. Novik M, lonova T, Bisaga G, Melnickenko V. Chelombit L, Kishtovich A. Quality of life and EDSS dynamics in multiple sclerosis patients undergoing high dose chemotherapy and autoiogous stem cell transplantation. Blood 2002; 100(suppl 1):5481. [ Links ]
27. Openshaw H, Stuve O, Antel JP, Nash R, Lund BT, Weiner LP, et al. Multiple sclerosis flares associated with recombinant granulocyte colony–stimulating factor. Neurology 2000; 54:2147–2150. [ Links ]
28. Gaffney PM, Moser KL, Graham RR, Behrens TW. Recent advances in the genetics of systemic lupus erythematosus. Rheum Dis Clin North Am 2002; 28:111–126. [ Links ]
29. Brasington Jr RD, Kahl LE, Ranganathan P, Latinis KM, Velazquez C, Atkinson JP. Immunologic rheumatic disorders. J Allergy Clin Immunol 2003; 111:S593–601. [ Links ]
30. Petri M. Treatment of systemic lupus erythematosus: an update. Am Fam Physician 1998; 57:2753–2760. [ Links ]
31. Trysberg E, Lindgren I, Tarkowski A. Autologous stem cell transplantation in a case of treatment resistant central nervous system lupus. Ann Rheum Dis 2000; 59:236–238. [ Links ]
32. Fouillard L, Gorin NC, Laporte JP, Leon A, Brantus JF, Miossec P. Control of severe systemic lupus erythematosus after high–dose immunosuppressive therapy and transplantation of CD34+ purified autologous stem cells from peripheral blood. Lupus 1999; 8:320–323. [ Links ]
33. Musso M, Porretto F, Crescimanno A, Bondi F, Polizzi V, Scalone R, et al. Autologous peripheral blood stem and progenitor (CD34+) cell transplantation for systemic lupus erythematosus complicated by Evans syndrome. Lupus 1998; 7:492–494. [ Links ]
34. Marmont AM, van Lint MT, Gualandi F, Bacigalupo A. Autologous marrow stem cell transplantation for severe systemic lupus erithematosus of long duration. Lupus 1997; 6:545–548. [ Links ]
35. Shaughnessy PJ, Ririe DW, Ornstein DL, Kissack B, Bickford DJ, Molir R, et al. Graft failure in a patient with systemic lupus erythematosus (SLE) treated with high–dose immunosuppression and autologous stem cell rescue. Bone Marrow Transplant 2001; 27:221–224. [ Links ]
36. Brunner M, Greinix HT, Redlich K, Knobl P, Smolen J, Leitner G, et al. Autologous blood stem cell transplantation in refractory systemic lupus erythematosus with severe pulmonary impairment: a case report. Arthritis Rheum 2002; 46:1580–1584. [ Links ]
37. Ouyang J, Sun L, Yang Y, Chen B, Han X, Fan X. A pilot study in treatment of systemic lupus ervthematosus by autologus bone marrow transplant (Abstract). Shonghua Nei Ke Za Zhi 2001; 40:229–231. [ Links ]
38. Traynor AE, Barr WG, Rosa RM, Rodriguez J, Oyama Y, Baker S, et al. Hematopoietic stem cell transplantation for severe and refractory lupus. Analysis after five years and fifteen patients. Arthritis Rheum 2002; 46:2917–2923. [ Links ]
39. Burt RK, Traynor AE, Pope R, Schoeder J, Cohen B, Karlin KH, et al. Treatment of autoimmune disease by intense immunosuppressive conditioning and autologous hematopoietic stem cell transplantation. Blood 1998; 10:3505–3514. [ Links ]
40. Zintl F, Schiller I, Mueller A, Aumann V, Kentouche K, Fuchs D, et al. Treatment of children and adolescents with juvenile rheumatoid arthritis (JRA) and severe systemic lupus erythematosus (SLE) with high dose chemotherapy and autoiogous stem cell transplantation (Abstract). Blood 2002; 100 (supl.1):5479. [ Links ]
41. Boers M. Rheumatoid arthritis. Treatment of early disease. Rheum Dis Clin North Am 2001; 2:405–414. [ Links ]
42. O'Dell JR. Combinations of conventional disease modifying antirheumatic drugs. Rheum Dis Clin North Am 2001; 2:415–426. [ Links ]
43. Weinblatt ME, Kremer JM, Bankhurst AD, Bulpitt KJ, Fleishmann RM, Fox RI, et al. A trial of Etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving Methotrexate. NEJM 1999; 340:253–259. [ Links ]
44. Burt RK, Georganas C, Schroeder J, Traynor A, Stefka J, Schuening F, et al. Autoiogous hematopoietic stem cell transplantation in refractory rheumatoid arthritis. Arthritis Rheum 1999: 42:2281–2285. [ Links ]
45. Snowden JA, Biggs JC, Milliken ST, Fuller A, Brooks PM. A phase I/II dose escalation study of intensified cvclophosphamide and autoLogous blood stem cell rescue in severe, active rheumatoid arthritis. Arthritis Rheum 1999; 42:2286–2292. [ Links ]
46. Verburg RJ, Kruize M, van den Hoogen FH, Fibbe WE, Petersen EJ, Preijers F, et al. High–dose chemotherapy and autologous hematopoietic stem cell transplantation in patients with rheumatoid arthritis: results of an open study to assess feasibility, safety, and efficacy. Arthritis Rheum 2001; 44:754–60. [ Links ]
47. Espigado Tocino I, García López A, Valenzuela Castaño A, Rodríguez Fernández JM. Autotrasplante de progenitores hematopoyéticos en una paciente con artritis reumatoide. Med Clin 2001; 117:399–399. [ Links ]
48. Leng X, Zhao Y, Zhou D, Li T, Tang F, Zeng X, et al. Study of treatment of refractory rheumatoid arthritis with autoiogous peripheral blood stem cell transplantation (Abstract). Zhonghua Yi Xue Za Zhi 2002; 82(11):748–51. [ Links ]
49. Kim KC, Lee IH, Choi JH, Oh MR, Ahn MJ, Kim SY. Autoiogous stem cell transplantation in the treatment of refractan' rheumatoid arthritis. J Korean Med Sci 2002; 17:129–132. [ Links ]
50. Pavletic SZ, Odell JR, Pirrucello SJ, Ursick MM, Haire CE, Sharp JG, et al. Intensive immunoablation and autologous blood stem cell transplantation in patients with refractory rheumatoid arthritis the University of Nebraska experience. J Rheumatol Suppl 2001;64:13–20. [ Links ]
51. Moore J, Brooks P, Milliken S, Biggs J, Ma D, Handel M, et al. A pilot randomized trial comparing CD34–selected versus unmanipulated hemopoietic stem cell transplantation for severe, refractory rheumatoid arthritis. Arthritis Rheum 2002; 46:2301–2309. [ Links ]
52. Van Laar JM, Verburg RJ, Fibbe WE, Breedveld FC. Intensive immunosuppression and autologous stem cell transplantation for patients with severe rheumatoid arthritis: the Leiden experience. J Rheumatol Suppl 2001; 64;25–27 (Abstract). [ Links ]
53. Bingham SJ, Snowden J, McGonagle D, Richards S, Isaacs J, Morgan G, et al. Autoiogous stem cell transplantation for rheumatoid arthritis –interim report of 6 patients. J Rheumatol Suppl 2001; 64:21–24. [ Links ]
54. llowite NT. Current treatment of juvenile rheumatoid arthritis. Pediatries 2002; 109:109–115. [ Links ]
55. Hashkes PJ, Friedland O, Uziel Y. New treatments for juvenile idiopathic arthritis. IMAJ 2002; 4:39–43. [ Links ]
56. Tessel EM, van der Net J, Cuis W, Wulfraat NM. Outcome status in chudren with sustained polyarticular and systemic juvenile idiopathic arthritis. Rheumatology 2001; 40:225–226. [ Links ]
57. Brinkman DM, ten Cate R, Vossen JM, Smeets TJ, Kraan MC, Tak PP. Decrease in synovial cellularity and cvtokine expression after autologous stem cell transplantation in patients with juvenile idiopathic arthritis. Arthritis Rheum 2002; 46:1121–1123. [ Links ]
58. Nakagawa R, Kawano Y, Yoshimura E, Suzuya H, Watanabe T, Kanamaru S, et al. Intense Immunosuppression followed by purified blood CD34+ cell autografting in a patient with refractory juvenile rheumatoid arthritis. Bone Marrow Transplant 2001; 27:333–336. [ Links ]
59. Wulffraat M, de Kleer I, Brinkman D, ten Cate R, van der Net JJ, Rukers GT, et al. Autologous stem cell transplantation for refractory juvenile idiopathic arthritis: current results and perspectives. Transplantation Proceedings 2002; 34:2925–2926. [ Links ]
60. Wedderburn LR, Patel A, King D, Varsani H, Foster HE, Abinun MM. Long term follow up of immune repertory after severe immunosuppression and autologous stem cell rescue in children with juvenile idiopathic arthritis. American College of Rheumathology 2003 annual meeting. Abstract 142 [ Links ]
61. Lin ATH, Clements PJ, Furst DE. Update on disease modifying antirheumatic drugs in the treatment of systemic sclerosis. Rheum Dis Clin N Am 2003; 29:409–426. [ Links ]
62. Medsger TA Jr. Natural history of systemic sclerosis and the assessment of disease activity, severity, functional status, and psychological well being. Rheum Dis Clin N Am 2003; 29:255–273. [ Links ]
63. Furst DE, Tyndall A. Stem cell transplantation in systemic sclerosis: rationale and status report. IMA) 2000;2:935–937. [ Links ]
64. Mcsweeney PA, Nash PA, Sullivan KM, Storek J, Crofford U, Dansey R, et al. High–dose imminosuppressive therapy for severe systemic sclerosis: initial outcomes. Blood 2002; 100:1602–1610. [ Links ]
65. Farge D, Marolleau JP, Zohar S, Marjanovic Z, Cabane J, Mounier N, et al. Autologous bone marrow transplantation in the treatment of refractory systemic sclerosis: erly results from a French multicentre phase I–II study. Br J Haematol 2002; 119:726–739. [ Links ]
66. Lo Monaco A, Lanza F, Dabusti M, Padovan M, La Corte R, Castoldi G, et al. Autologous stem cell transplantation in a patient with diffuse systemic sclerosis. Reumatismo 2002;54:351–356. [ Links ]
67. Binks M, Passweg JR, Furst D, McSweeney P, Sullivan K, Besenthal C, et al. Phase I/II trial of autologous stem cell transplantation in systemic sclerosis: procedure related mortality and impact on skin disease. Ann Rheum Dis 2001: 60:548–549. [ Links ]














