Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta médica de México
On-line version ISSN 2696-1288Print version ISSN 0016-3813
Gac. Méd. Méx vol.140 n.4 Ciudad de México Jul./Aug. 2004
Historia y filosofía de la medicina
Causalidad en medicina
Causality in Medicine
Héctor Álvarez–Martínez,* Eduardo Pérez–Campos*
* Médico Internista, Hospital Regional Presidente Juárez, ISSSTE, Maestría en Ciencias, Facultad de Medicina UABJO. Oaxaca, Oaxaca
** Laboratorio de Patología Clínica Dr. Eduardo Pérez Ortega S.A de C.V., Unidad de Bioquímica e Inmunología ITO–UNAM. Oaxaca, Oaxaca
Correspondencia y solicitud de sobretiros:
Dr. Héctor Álvarez–Martínez,
Emilio Carranza 313. Col. Reforma,
68050. Oaxaca, Oaxaca, México.
Tel. (951)513 8774 y (951)520 0991.
E–mail : heloy_57@yahoo.com.mx; halvarezm@prodigy.net.mx
Resumen
El concepto de causalidad es parte de la vida común, pues el hombre desde siempre ha buscado el porqué de las cosas, como una forma de entender y adaptarse al mundo. En medicina, uno de los objetivos centrales de estudio es la identificación de los factores o agentes que causan las enfermedades, con el propósito de establecer tratamientos y sobretodo, para aplicar mediadas preventivas.
En este trabajo, realizamos una breve revisión de las posiciones filosóficas sobre la causalidad, los modelos biológicos de la misma, así como las herramientas utilizadas en epidemiología clínica para evaluar las asociaciones causales.
Palabra clave: Causalidad, revisión, medicina
Summary
The concept of causality is apart of every day life because man has always searched for the why of things as a way of dealing with and adapting to the world. In medicine, one of the central aims of study is identification of the factors or agents that cause disease with the intention of establishing treatments and especially, to apply preventive strategies. In this work, we conducted a brief review of the philosophical positions on causality, its biological models, as well as the tools used in clinical epidemiology to evaluate causal associations.
Key words: Causality, review, medicine
Introducción
Uno de los objetivos centrales de la medicina es la identificación de los factores o agentes que causan las enfermedades. La identificación de la causa es importante para establecer tratamientos y, sobre todo, para aplicar medidas preventivas. Al respecto, es importante considerar si la causa es única o múltiple. En el campo de las enfermedades infecciosas la causa suele ser sólo una por lo que la complejidad para determinar la relación causa–efecto es menor. En las enfermedades crónico–degenerativas, sin embargo, el marco teórico prevaleciente es la hipótesis multicausal o multifactorial, que afirma que la enfermedad se explica en función de la presentación organizada de conjuntos variables de factores de riesgo, que son las características que aumentan la probabilidad de que una persona sana desarrolle una enfermedad.
El factor de riesgo es causal cuando su presencia contribuye a explicar la ocurrencia de una enfermedad y constituye un marcador cuando sólo aumenta la probabilidad de que se presente el efecto, sin que su presencia ayude a explicar la ocurrencia del padecimiento.
Una causa se ha definido como un evento o un estado de la naturaleza que inicia o permite —sólo o en conjunto con otras —otra secuencia de eventos que resultan en un efecto. 1,2 También se define la causa como lo que se considera como fundamento u origen de algo,3 la razón, motivo u origen de algo4 o como el factor que es posible o conveniente alterar para producir, modificar o prevenir un efecto.
Posiciones filosóficas
El concepto de causalidad existe desde la vida común, pues es partede la mente humana buscar relaciones entre las cosas y particularmente entre las acciones y sus consecuencias, como un modo de entender el mundo y de aprender y adaptarse a él.
La noción de causalidad ha sido estudiada por los filósofos. Tales de Mileto ordenó el saber, elevándolo al nivel científico y buscando las causas más profundas de las cosas; dividió éstas en causas inmediatas y esenciales o últimas, con lo que se adentra al terreno de la filosofía.
Para Aristóteles, existen cuatro tipos de causas: una causa material, que es el sujeto u objeto en el que ocurren las cosas; una causa eficiente, que es el proceso en desarrollo; una causa formal y una causa final. Es evidente que estos conceptos se solapan y es común encontraresta visión finalista en muchos conceptos biológicos.5
Existen otras posiciones filosóficas, como la ontológica de Leibniz, que establece que la causalidad es un principio del ser, un aspecto fundamental e inseparable del mismo.
Para David Hume, la causalidad es la forma en que se expresan las leyes científicas basadas en una generalización de la experiencia y con capacidad predictiva. Hume pensaba que las observaciones eran una base débil para las inferencias causales y que el descubrimiento de las causas exigía un proceso intelectual que trasciende las impresiones de nuestros sentidos. Las características de esta relación causal son la contigüidad, la prioridad y la conjunción constante.6
Kant señala que "todo nuestro conocimiento comienza con la experiencia". Para Kant la causalidad es un a priori que se necesita para el conocimiento racional, en tanto que todo lo que ocurre supone algo previo y señala "todo cambio tiene que tener una causa".7
La mayoría de los filósofos ha pensado que la noción de causalidad es indispensable para la ciencia, siendo uno de sus objetivos más importantes encontrar causas y establecer relaciones causales entre los fenómenos o eventos. Esta posición ha sido cuestionada por Russell8 por considerarla circular. En el mismo sentido, Rosenblueth9 señala que en cuanto una ciencia, o el conocimiento científico de un problema, alcanza madurez, la noción de causa desaparece y jamás vuelve a reaparecer. En cuanto a la noción popular de causa, de concatenación necesaria, dice "La ciencia no usa estas interpretaciones de las relaciones causales. Las sustituye por leyes que expresan relaciones funcionales entre las variables. Muchas de estas leyes son simétricas y la noción de causa es en ellas, inaplicable.
Finalmente, Wartofsky MW, considera que el principio de causalidad es un concepto fundamental, que pertenece a las distintas imágenes del mundo, y a la interpretación de las formulas científicas contemporáneas.10
Elementos de la relación causal
En las relaciones causales pueden identificarse un elemento inicial o causa, un elemento final o efecto y la relación entre ambos. La definición del elemento inicial depende del modelo utilizado; las causas pueden ser acciones intencionales, no intencionales, atributos, constructos, etc. El efecto se define en términos de cambio con respecto a su situación previa o a lo que hubiera ocurrido si no hubiera habido causa. La relación entre ambos puede definirse como una función o condición. La relación condicional puede ser:
a) Necesaria y suficiente: Si A, entonces B y si B, entonces A.
b) Necesaria y no suficiente: Si A, entonces B o no B y si B, entonces A.
c) No necesaria y suficiente: Si A, entonces B y si B, entonces A o no A.
d) No necesaria y no suficiente: Si A, entonces B o no B y si B, entonces A o no A.
El cuarto caso (d), es el más frecuente en Biología y el más difícil de establecer.
Las características básicas de la relación causal son: la temporalidad, es decir, la causa precede al efecto; la dirección, o sea que la relación va de la causa al efecto y la asociación, que se entiende como una cuantificación de la constancia de la relación.
Modelos causales en Biología
El concepto de causalidad, recíproco al de azar, alude a la relación entre dos o más acontecimientos cuya ocurrencia consistente y secuencia de aparición permiten atribuir a uno de ellos la aparición del otro; es una interpretación de la naturaleza, no única pero dominante en el ámbito de la medicina. Son varios los modelos de causalidad propuestos en el área de la biología, de los cuales se resaltan los siguientes:
Modelo de Koch–Henle. Sugerido por Koch en 1882, a propósito de la tuberculosis y paradigmático en el estudio de las enfermedades infecciosas.11 Más que un modelo, es un conjunto de reglas de decisión que asumen los principios anteriores:
a) El microorganismo debe encontrarse siempre en los casos de enfermedad.
b) El microorganismo deberá poder ser aislado en cultivo, demostrando ser una estructura viva y distinta de otras que puedan encontrarse en otras enfermedades.
c) El microorganismo cultivado deberá ser capaz de producirla enfermedad en el animal de experimentación.
d) Es preciso recuperar el microorganismo a partir del animal e identificarlo.
Modelo de Austin Bradford–Hill. Se conocen como criterios de Bradford Hill, aunque estrictamente no son criterios, es paradigmático en el estudio de las enfermedades no infecciosas. Conlleva una relación causal no necesaria y no suficiente.12,13
1) Fuerza de asociación, medida con los índices estadísticos apropiados.
2) Congruencia entre distintos observadores, en diferentes lugares, tiempos y circunstancias.
3) Especificidad de las causas.
4) Temporalidad.
5) Gradiente biológico en la relación dosis–respuesta.
6) Plausibilidad biológica.
7) Coherencia con otros conocimientos.
8) Evidencia experimental.
9) Analogía con otras relaciones causales.
Modelo de Rothman. Tiene más contenido teórico y contempla las relaciones multicausales. Fue desarrollado en el ámbito de la epidemiología y es el más adaptado a los métodos estadísticos multivariantes. Define como causa a todo acontecimiento, condición o característica que juega un papel esencial en producir un efecto.14
Distingue entre causa componente, suficiente y necesaria. Sus características son:
a) Ninguna de las causas componentes es superflua.
b) No exige especificidad, pues un mismo efecto puede ser producido por distintas causas suficientes.
c) Una causa componente puede formar parte de más de una causa suficiente para el mismo efecto. Si una causa componente forma parte de todas las causas suficientes de un efecto se le denomina causa necesaria.
d) Una misma causa componente puede formar parte de distintas causas suficientes de distintos efectos.
e) Dos causas componentes de una causa suficiente se considera que tienen una interacción biológica, es decir, ninguna actúa por su cuenta. El grado de interacción puede depender de otras causas componentes.
En la Medicina sin embargo, interactúan diversos órdenes o niveles de organización, histórico, social, político, económico, cultural y técnico, que han permitido señalar un concepto de causalidad, denominado contextual, más dinámico, no lineal, multidireccional, cambiante y heterogéneo que determina la aparición de los daños a la salud.15
Evaluaciones causa–efecto en medicina
Una asociación puede definirse como la dependencia estadística que existe entre dos o más factores, donde la ocurrencia de un factor aumenta (o disminuye) a medida que varía el otro;16 sin embargo, la existencia de asociación no implica necesariamente causalidad. Una asociación causal (o relación de causa–efecto) se manifiesta cuando el cambio en la frecuencia o intensidad de la exposición es seguido por un cambio en la frecuencia o intensidad del efecto.17
En la terminología de las enfermedades no infecciosas o crónico–degenerativas, causa es equivalente a causa necesaria y factores de riesgo a causa suficiente (excepto la causa necesaria). Al suprimir la causa, el efecto se erradica; al eliminar el factor de riesgo, el efecto disminuye en frecuencia.
Las evaluaciones causa–efecto son tal vez las más difíciles de realizaren Epidemiología Clínica. Por muchos años fueron realizadas sin la utilización formal de datos, pero actualmente se cuenta con herramientas estadísticas acerca de los atributos cuantitativos de la evidencia y con decisiones científicas acerca de su calidad.
El razonamiento básico —aunque no único— para establecer una relación causal es la secuencia de eventos, esto es, la causa precede al efecto. Debe tenerse cuidado, sin embargo, para evitar la falacia circular: post hoc ergo propter hoc, es decir, si ocurre después de, luego es su causa. Una característica de la investigación científica para evitar el razonamiento post hoc es el uso de maniobras comparativas.18
De manera más específica, para concluir que dos o más factores tienen relación causa–efecto es necesario demostrar que la asociación entre ellos es válida y causal.
Asociación válida. Una asociación válida es una asociación real o verdadera, conlleva un efecto mínimo del azar y del sesgo, o de uno y otro.
El error aleatorio o azar es inherente a todas las observaciones y su importancia en el hallazgo de una asociación puede valorarse aplicando una prueba de significación estadística y expresarse en función del valor resultante de p. Por convención, un valor igual o menor que 0.05 es estadísticamente significativo y traduce una probabilidad atribuible al azar de 5% o menor. De aquí que una asociación con importancia estadística tenga altas probabilidades de ser real, dado que el efecto del azar se restringe a una probabilidad máxima de 5%.19
Otro instrumento para evaluar la influencia del azar es la determinación del intervalo de confianza a 95% (IC 95%). Esta medida refleja la información que se esperaría obtener en 95 de 100 repeticiones del mismo estudio.
Así, el IC 95% de una medida de asociación contiene, con 95% de seguridad, el valor real de esta medida. La información brindada por el valor p y el IC 95% es complementaria; en función del valorde p, una asociación que no es estadísticamente significativa tiene pocas probabilidades de existir y por tanto puede pasar inadvertida; sin embargo, el intervalo de confianza quizá no excluya la posibilidad de que exista dicha asociación y, adicionalmente, es posible que proporcione información sobre su magnitud. También es importante señalar que tanto el valor de p como el IC 95% son dependientes del tamaño de la muestra, de manera que a menor tamaño de muestra, mayor es el valor p y más amplio el intervalo.20 Los sesgos son errores sistemáticos e involuntarios, que se presentan cuando los componentes comparados no son lo suficientemente similares. Pueden ocurrir en cualquier fase del proceso de evaluación de una asociación; destacando los sesgos de selección, medición y confusión. Los de selección ocurren cuando los individuos estudiados difieren en características importantes con respecto de la población a la que se pretende extrapolar los hallazgos del estudio o de otro grupo de personas con las que se busca establecer comparaciones.21 Este tipo de sesgos afectan la validez externa de los resultados del estudio.
Los sesgos de medición ocurren si durante la fase de obtención de la información los investigadores utilizan, para cada uno de los grupos estudiados, criterios diferentes de recolección o interpretación de los datos o ambos.
La asociación entre dos factores puede afectarse por la coexistencia de otros, conocidos como factores de confusión. Estos factores se asocian tanto a la exposición (sin ser consecuencia de ella) como al efecto (independientemente de su asociación con la exposición), pero no constituyen un componente de la cadena de factores causantes del desenlace. Los sesgos de selección y de confusión no son mutuamente excluyentes y, a menudo, en un mismo estudio puede existir más de un sesgo.22
En resumen, los efectos del azar y el sesgo en la evaluación de una asociación están relacionados con el rigor metodológico del estudio. Los tipos de sesgo considerados provocan una comparación distorsionada dentro del modelo de razonamiento causa–efecto. A pesar de una buena comparación interna, los resultados pueden no ser extrapolados o generalizados externamente; esto ocurre cuando los grupos investigados tienen un montaje distorsionado de la gente que supuestamente representan.
Respecto a los diseños de investigación en medicina, tienen rigor metodológico decreciente en relación con la determinación de causalidad, a saber:
Ensayo clínico controlado o estudio clínico experimental. Se trata de estudios prospectivos en los que los sujetos de una muestra, similares o comparables, se asignan al azar (ensayo clínico aleatorizado) en dos o más grupos, para que reciban una exposición, manipulación o maniobra. El grupo que no recibe la maniobra principal o manipulación, se denomina control y posteriormente se determina quiénes desarrollaron el efecto y quiénes no. En condiciones ideales ni los individuos ni el investigador que mide el efecto conocen el objetivo y la hipótesis en estudio (doble ciego). La limitante principal de este modelo es que pocas veces puede realizarse en el proceso de investigación de causas o factores de riesgo de enfermedades, principalmente por razones éticas, o por el número de sujetos por estudiar y el tiempo de realización. Cuando se trata de evaluarla utilidad relativa de un tratamiento experimental el grupo control no necesariamente recibe un placebo pues puede recibir el mejor tratamiento vigente al momento del ensayo.23,24
Estudio de cohortes. Es también un diseño comparativo pero no recurre a la asignación aleatoria. Los sujetos de una muestra son clasificados según la exposición de interés en una cohorte expuesta y en una no expuesta y se observan (estudio observacional) suficientemente durante un período específico para determinar la frecuencia de aparición del efecto. Dependiendo de la relación entre el momento de inicio del estudio con el de la ocurrencia del evento se clasifican en prospectivos y retrospectivos. Una de las grandes ventajas con relación a la causalidad es que con este diseño se conoce claramente la secuencia temporal de exposición y enfermedad. Este estudio tampoco garantiza una distribución similar de características entre los grupos expuesto y no expuesto. Además, tiene también los inconvenientes del tamaño de la muestra y el seguimiento, por lo que puede ser muy costoso.25
Estudio de casos y controles. Se estudia un grupo de individuos que ya tuvieron el efecto y un conjunto de personas denominados controles que no lo muestran, para investigar retrospectivamente el antecedente de exposición a la causa o al factor de riesgo sospechado. La diferencia principal entre este diseño y el de cohortes estriba en la selección de los sujetos de estudio, sin embargo, el diseño de casos y controles tiene más posibilidades de comprometer la comparabilidad de uno y otro grupos, además de que, por utilizar la secuencia de efecto a exposición, existe dificultad para asegurar una secuencia temporal lógica, donde la exposición antecede al efecto.26 Es, por lo tanto, un diseño más fácil y rápido de efectuar, aunque metodológicamente más débil para la evaluación de causalidad.
Diseños transversales. Estos diseños nos dan una imagen instantánea de la coexistencia de la exposición y el efecto y tienen las mismas limitaciones metodológicas del estudio de casos y controles; además, tienen mayor dificultad para demostrar la secuencia temporal de causa y efecto.27,28
Estudios descriptivos. Son los menos recomendables para este efecto, pues en ellos se estudia en forma prospectiva un grupo de sujetos expuestos o bien, retrospectivamente, un conjunto de casos. No se tienen grupos controles o grupos de referencia con los cuales comparar.
Por lo que se ha expuesto, la selección de un diseño determinado de estudio depende de lo éticamente posible, de la disponibilidad de individuos o pacientes y de los recursos disponibles.
Comprobación del tipo de asociación. Para comprobar que la asociación es causal se deben considerar los siguientes aspectos, los cuales tienen importancia decreciente:
1.– Fuerza de asociación. Es la magnitud con que aumenta el riesgo de desarrollar un efecto cuando se presenta una exposición. A mayor incremento, más fuerza de asociación y es mayor la seguridad sobre la causalidad. Para evaluar la fuerza de asociación, con mayor frecuencia se usan el riesgo relativo (RR), el riesgo atribuible (RA) y la fracción etiológica (FE).
El riesgo relativo o razón de incidencia acumulada, establece la razón existente entre el riesgo de los expuestos (incidencia del efecto en los expuestos) y el riesgo de los no expuestos (incidencia del efecto en los no expuestos). Es la medida que refleja mejor la probabilidad de padecer la enfermedad en función de la exposición.
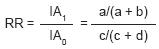
Donde lAi representa la incidencia acumulada o riesgo de enfermar entre los expuestos y lAo representa la incidencia acumulada o riesgo de enfermar en los no expuestos. Para los efectos de la ecuación anterior, a, b, c, d, se refieren al cuadro de contingencias de 2 X 2.29
Esta fórmula sólo es aplicable a los estudios prospectivos, ya sean experimentales o de cohorte, donde es posible estimar la incidencia del efecto.
En los estudios de casos y controles se utiliza una estimación indirecta del riesgo relativo, que se conoce como razón de productos cruzados (RPC) o razón de momios (RM) u odds ratio (OR).

Donde las letras a, b, c y d corresponden a los casilleros de la tabla de contingencias de 2 X 2 ya señalada.29 Estas tablas son concisas y fáciles de analizar estadísticamente cuando las variables analizadas son cualitativas30 (Cuadro I).
Un riesgo relativo o una razón de momios con valor de 1 se consideran nulos, porque reflejan una razón entre expuestos y no expuestos de 1:1. Si el valores menor de 1, la exposición está asociada de manera inversa con el evento, esto es, la exposición disminuye la posibilidad de desarrollar el evento (protector); si el RR o RM es mayor de 1, la exposición se encuentra asociada positivamente con el evento, lo que quiere decir que aumenta la probabilidad de desarrollarlo. Esta probabilidad es mayor a medida que el valor se aleja positivamente de la unidad.31 Es importante distinguir esta significación clínica de la significación estadística, porque la primera está dada por la magnitud del RR o RM y la segunda por la probabilidad (o valor p) de que el RR o RM encontrado sea real.
El riesgo atribuible (o diferencia de riesgos) permite distinguir el efecto absoluto de la exposición y expresa la proporción de individuos expuestos que, por efecto de la exposición, desarrollarán el efecto.

La fracción etiológica (o porcentaje de riesgo atribuible) permite estimar la proporción del riesgo o el efecto observado en los sujetos expuestos, que es atribuible a la exposición. Se calcula con la siguiente ecuación:

2. Congruencia. Se refiere a si la asociación entre la exposición y el evento de interés ha sido reproducida por investigadores diferentes, utilizando diseños diferentes en medios también diferentes. La mejor evidencia sobre la congruencia, para Sackett, proviene de los estudios de metaanálisis.32
3. Relación temporal. La exposición debe antecederal efecto. Esta relación puede ser notada fácilmente en los estudios prospectivos, pero no en los estudios de casos y controles, así como en los transversales. Además, en ocasiones no es fácil establecer la relación temporal, principalmente cuando el tiempo transcurrido entre la exposición y el desarrollo de las manifestaciones es largo.
4. Gradiente dosis–respuesta. A mayor magnitud o intensidad de exposición, debe esperarse que sea mayor la magnitud o intensidad del efecto. Este gradiente también puede ser entre el tiempo de exposición y el efecto.33
5. Credibilidad epidemiológica. Si existe asociación, cabe esperar que la distribución geográfica de la exposición sea paralela a la distribución del efecto.34 Si la exposición solamente se conoce para los grupos de población y no para los individuos de dichos grupos, los estudios utilizados son denominados estudios ecológicos o de riesgo agregado, en los cuales se valora la exposición media del grupo. Sin embargo, estos estudios raramente son definitivos por sí mismos (estudios incompletos), permiten formular hipótesis pero se requiere de estudios adicionales con mayor rigor metodológico para el establecimiento de la causalidad.35
6. Credibilidad biológica. Es la concordancia de la asociación con el conocimiento biológico que se tiene en la actualidad.
7. Especificidad. Significa que una sola exposición genera un solo efecto y viceversa. Esto no se aplica a los factores de riesgo.
8. Analogía. Es el criterio más débil de todos y se refiere a que la existencia de una relación causal análoga a la que se está considerando, puede apoyar la causa hipotética por un mecanismo similar.
Finalmente, puede señalarse que el establecimiento de la causalidad en medicina aún depara nuevas ideas, conceptos y estrategias, y para entender el estado actual de la evaluación de la causalidad, es conveniente citar textualmente el comentario de los integrantes del Departamento de Epidemiología Clínica y Bioestadística de la Universidad McMaster, quienes señalan que el diagnóstico de causalidad no es simplemente aritmético y las estrategias y tácticas para e valuarla son aún primitivas.34
Referencias
1. Garduño EJ. Causalidad. En: Halabe CJ, Lifshitz GA, López BJ, Ramiro HM, editores. El Internista. México: lnteramericana–McGraw–Hill;1997. pp. 1388–1392. [ Links ]
2. Beaglehole R, Bonita R, Kjellström T. Causalidad en epidemiología En: Epidemiología básica. Washington, D.C., USA: Organización Panamericana de la Salud;1994. pp. 75–86. [ Links ]
3. Clark P. ¿Cómo se establece la causalidad en medicina? En: Ramiro HM, Saita–Kamino O, editores. Temas de medicina interna. Epidemiología clínica. México: Interamericana–McGraw–Hill; 1994. pp. 265–73. [ Links ]
4. Gómez de Silva G. Breve diccionario etimológico de la lengua española. 2a ed. México: Fondo de Cultura Económica; 1998. pp. 156. [ Links ]
5. Aristóteles. Tratados de lógica (El Organón) Segundos Analíticos, Libro Segundo, Sección segunda. 9ª ed. México: Editorial Porrúa; 1993. pp. 203. [ Links ]
6. Hume D. Tratado de la naturaleza humana. 4ª ed. México: Editorial Porrúa; 1998. pp. 60–9. [ Links ]
7. Kant M. Crítica de la razón pura. 11ª ed. México: Editorial Porrúa; 2000. pp. 27–29. [ Links ]
8. Citado en Rosenblueth A. El principio de causalidad. La teleología. En: Rosenblueth A, editor. El método científico. México: Ediciones Científicas La Prensa Médica Mexicana, S.A. de C.V. CIEAIPN;1971. pp. 57–59. [ Links ]
9. Rosenblueth A. El principio de causalidad. La teleología. En: Rosenblueth A, editor. El método científico. México: Ediciones Científicas La Prensa Médica, Mexicana S.A. de C.V. CIEAIPN;1971. pp. 57–65 [ Links ]
10. Wartofsky MW. Introducción a la filosofía de la ciencia. Madrid. España; Alianza Editorial, SA:1968. pp. 379–408. [ Links ]
11. Fletcher RH, Fletcher SW, Wagner EH. Epidemiología clínica. Aspectos fundamentales. 2ª ed. México: Masson Williams (Wlkins España, SA;1998. pp. 237–257. [ Links ]
12. Bradford–Hill A. Ambiente y enfermedad: ¿asociación o causación? Bol Oficina Sanit Panam 1992;113:233–242. [ Links ]
13. Morabia A. Sobre el origen de los criterios causales de Austin Bradford Hill. Bol Oficina Sanit Panam 1992; 113:243–247. [ Links ]
14. Rothman KJ. Causes 1976. Am J Epidemiol 1995; 141:90–5. [ Links ]
15. Viniegra VL. ¿Deben ser las matemáticas el núcleo explicativo del conocimiento médico? Rev Invest Clin 2001; 53:93–103. [ Links ]
16. Vargas VF. Causalidad. En: Moreno AL, Cano VF, García RF, editores. Epidemiología clínica. 2ª ed. México. lnteramericana–McGraw–Hill;1994. pp. 131–142. [ Links ]
17. McMahon B, Pugh TF. Conceptos de causa. En: Principios y métodos de epidemiología México. 2ª ed. La Prensa Médica Mexicana; 1975. pp. 15–24. [ Links ]
18. Feinstein AR. An outline of cause–effect evaluations En: Clinical epidemiology the architecture of clinical research. W.B. Saunders Company;1985. pp. 39–52. [ Links ]
19. Dawson–Saunders B, Trapp, RG. Obtención de inferencias a partir de datos: Intervalos de confianza y pruebas de hipótesis. En: Bioestadistica médica. 2ª ed. México. El Manual Moderno; 1997. pp. 99–118. [ Links ]
20. Jenicek M. Valoración de la salud de los individuos y de las poblaciones, indicadores de salud. En: Epidemiología La lógica de la medicina moderna. España: Masson, S.A.;1996. pp. 56–57. [ Links ]
21. Castellanos–Olivares A, Vásquez–Márquez I, Wacher–Rodarte N. ¿Qué es un sesgo? En: Ramiro HM, Saita–Kamino O, editores. Temas de medicina interna, epidemiología clínica. México. lnteramericana–McGraw–Hill;1994. pp. 237–247. [ Links ]
22. Fletcher RH, Fletcher SW, Wagner EH. Epidemiología clínica. Aspectos fundamentales. 2ª ed. México: Masson Wlliams (Wilkins, España, SA;1998. pp. 7–10. [ Links ]
23. Calva–Mercado JJ. Estudios clínicos experimentales. Salud Publica Mex 2000; 42:349–58. [ Links ]
24. Hernández–Ávila M, Garrido–Latorre F, López–Moreno S. Diseño de estudios epidemiológicos. Salud Publica Mex 2000; 42:144–54. [ Links ]
25. Lazcano Ponce E, Fernández E, Salazar–Martinez E, Hernández–Avila M. Estudios de cohorte. Metodología, sesgos y aplicación. Salud Publica Mex 2000; 42:230–41. [ Links ]
26. Lazcano Ponce E, Salazar–Martinez E, Hernández–Avila M. Estudios epidemiológicos de casos y controles. Fundamento teórico, variantes y aplicaciones. Salud Publica Mex 2000; 43:135–50. [ Links ]
27. Moreno AL, Moreno AA. Diseños metodológicos en la investigación epidemiológica. En: Moreno AL, Cano VF, García RF, editores. Epidemiología clínica 2ª ed. México: lnteramericana–McGraw–Hill;1994. pp. 17–32. [ Links ]
28. Hernández B, Velasco–Mondragón HE. Encuestas transversales Salud Publica Mex 2000; 42:447–55. [ Links ]
29. Herrera Colmenares EF. Protocolo de la investigación científica. Oaxaca: Ed. de autor; 1995. pp. 60–63. [ Links ]
30. Juane S R, Hervada VJ. Medidas de frecuencias de las enfermedades. Medicine 2000; 48:27–31. [ Links ]
31. Moreno–Altamirano A, López–Moreno S, Corcho–Berdugo A. Principales medidas en epidemiología. Salud Publica Mex 2000; 42:337–348. [ Links ]
32. Sackett DL, Haynes RB, Guyatt GH, Tugwell P. Epidemiología clínica Ciencia básica para la medicina clínica. 2a ed. México. Editorial Médica Panamericana;1994. pp. 279–297. [ Links ]
33. Sales–Carmona VF. ¿Cómo se mide la asociación entre dos fenómenos? En: Ramiro HM, Saita–Kamino O, editores. Temas de medicina interna. Epidemiología clínica. México. lnteramericana–McGraw–Hill;1994. pp. 275–281. [ Links ]
34. Departamento de Epidemiología Clínica y Bioestadistica. Universidad McMaster, Hamilton–Ontario, Canadá. Cómo leer revistas médicas. IV. Establecer etiología o causalidad. [ Links ] Rev Invest Clin 1988; 40:91–98. [ Links ]
35. Borja–Aburto VH. Estudios ecológicos. Salud Publica Mex 2000; 42:533–538. [ Links ]














