Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.4 Ciudad de México jul./ago. 2004
Artículos de revisión
Aspectos moleculares del daño tisular inducido por la hiperglucemia crónica
Molecular Aspects of Chronic Hyperglycemia–Induced Tissue Damage
Margarita Díaz–Flores,* Luis Arturo Baiza–Gutman,** Miguel Ángel Ibáñez–Hernández,*** Dalila Pascoe–Lira,* Alberto M. Guzmán–Greenfel,**** Jesús Kumate–Rodríguez*
* Unidad de Investigación Médica en Bioquímica, Hospital de Especialidades, Centro Médico Nacional Siglo XXI.
** Laboratorio en Biología del desarrollo, Unidad de Morfología FES–IZTACALA. UNAM.
*** Laboratorio de Biomembranas, Departamento de Bioquímica. Instituto Politécnico Nacional.
**** Investigación Biomédica, Instituto Nacional de Enfermedades Respiratorias.
Correspondencia y solicitud de sobretiros:
Dra. Margarita Díaz–Flores.
Unidad de Investigación Médica en Bioquímica,
Coordinación de Investigación en Salud,
Centro Médico Nacional Siglo XXI,
Instituto Mexicano del Seguro Social.
Av. Cuauhtemoc 330, Col. Doctores,
06720 México, D.F.
Tel. 5513 4846.
E–mail: mardiaz2001@yahoo.com
Recepción versión modificada: 7 de enero de 2004
Aceptación: 5 de marzo de 2004
Resumen
El propósito de este trabajo es dar a conocer las bases moleculares de la fisiopatología de la diabetes mellitus, con el fin de prevenir la enfermedad o mejorar el tratamiento. La diabetes mellitus es una enfermedad compleja, donde la hiperglucemia crónica provoca complicaciones en distintos órganos. En esta condición aumentan las especies reactivas de oxígeno como resultado de su autooxidacción, por lo que su metabolismo propicia la acumulación de metabolitos como la fructosa, el sorbitol y las triosas fosfato. Éstos últimos generan α–oxoaldehídos reactivos con alta capacidad de unirse a proteínas y generar estrés oxidativo. Además, hay aumento de la síntesis de diacilgliceroles a partir de las triosas fosfato, las cuales activan a la pro teína cinasa C. Por otra parte, la alteración de la proporción normal entre los nucleótidos de niacinamida reducidos con respecto a los oxidados conduce a una baja eficiencia de los sistemas antioxidantes. Finalmente, estas desregulaciones metabólicas causan alteración en la transducción de la señal, en la expresión anormal de genes, además de daño tisular, lo que propicia complicaciones en los pacientes con diabetes.
Palabras clave: diabetes mellitus, AGES, estrés oxidativo, sorbitol, diacilglicerol, proteína cinasa C, hexosaminas, complicaciones crónicas.
Summary
The knowledge of the molecular basis of diabetes mellitus physiopathology will allow improvements in treatment or prevention of the disease.
Diabetes mellitus is a complex disease in which hyperglycemia leads to complications in several organs. In this condition, there is increase in reactive oxygen species (ROS) as a result of glucose autooxidation; its metabolism produces accumulation of metabolites such as fructose, sorbitol, and triose phosphate. The latter generates α oxoaldehydes with high capacity to produce protein glycation and oxidative stress. Moreover, there is an increase in synthesis of diacylglycerol from triose phosphate, which activates protein kinase C.
On the other hand, alteration of normal ratio between reduced and oxidized niacinamide nucleotides leads to low efficiency of antioxidative systems. Finally, this metabolic dysregulation causes altered signal transduction, abnormal gene expression, and tissue damage, resulting in development of diabetic complications.
Key word: Diabetes mellitus, AGES, oxidative stress, sorbitol, diacylglycerol protein kinase C, hexosamines, chronic complications.
Introducción
En la actualidad, la diabetes mellitus (DM) plantea un grave problema mundial de salud pública, debido a que na aumentado su incidencia y prevalencia, en particular en los países en vías de desarrollo o de reciente industrialización. En México, el registro realizado por la Encuesta Nacional de Salud 20001 estimó que existen alrededor de 3.6 millones de mexicanos mayores de 20 años que padecen DM; con prevalencia de 7.5%, ligeramente mayor en las mujeres que en los hombres a partir de los 50 años. En 1980 ocupó el noveno lugar como causa de muerte, para colocarse a finales de los 90, en el tercero y primer lugar en el grupo de 55 a 64 años. Estas alarmantes cifras se asocian a un cambio en la alimentación y disminución de la actividad física cotidiana.
El término de DM describe diferentes trastornos metabólicos que resultan de alteraciones en la secreción de insulina, en la respuesta periférico a la misma o en ambas; lo que conduce a un síndrome caracterizado por hiperglucemia crónica y alteraciones del metabolismo de carbohidratos, proteínas y lípidos. Hasta el momento se han descrito por lo menos cuatro variedades de la enfermedades,2 pero la gran mayoría de los casos corresponde a dos clases principales: la DM tipo 1 y la tipo 2. En la primera, la característica más relevante es la destrucción de las células β del páncreas, de manera que la producción de insulina es nula o insignificante. En la segunda, el rasgo principal es la resistencia de los teliidos periféricos a la acción de la insulina.3 como resultado de alteraciones en los eventos bioquímicos posteriores a la unión de la hormona con su receptor, y en casos menos frecuentes a alteraciones en el recepta. La DM tipo 2 es la más frecuente en la población mexicana, al igual que en la población mundial.
Uno de los aspectos aún no resueltos de la DM, a pesar de la vasta información disponible, es el origen de las complicaciones crónicas en órganos y sistemas sensibles afectados por la hiperglucemia. Los mecanismos de la fisiopatogenia propuestos son diversos, tal vez porque derivan del análisis de distintos puntos de vista de un mecanismo patogénico común, o bien, existen mecanismos específicos del tipo de tejido. Se considera que el principal factor de riesgo es la hiperglucemia crónica, por ello las primeras complicaciones crónicas de la DM son el resultado de las reacciones químicas y de la activación o alteración del metabolismo causado por el exceso de glucosa. Se ha postulado que la hiperglucemia puede causar complicaciones micro y macrovasculares asociadas a la diabetes mediante cinco mecanismos principales;4,5 acumulación y acción de productos de glicación avanzada,6–8 incremento en la actividad de la vía del sorbítol,9 aumento en la vía de las hexosamínas,10 activación de diversas isoformas de la proteína cinasa C,11 y aumento en el estrés oxidatívo.12,13 Cada uno de estos mecanismos moleculares merece especial atención y será tratado en esta revisión. Además, se enfatizará en las principales alteraciones metabólicas que se originan de ellos, todo encaminado a explicar parte de las causas de las complicaciones crónicas de la enfermedad y su clasificación, continuando con el análisis de los mecanismos mencionados.
Fisiopatología de la diabetes mellitus
Las manifestaciones clínicas de la DM son variadas y en muchas ocasiones inespecíficas, aunque la mayoría de los signos y de los síntomas están relacionados con la hiperglucemia sostenida o con la resistencia a la insulina. Las primeras manifestaciones de la diabetes tipo 2 tienden a aparecer durante la edad adulta, después de la tercera década de la vida, y son mucho más discretas que las que se presentan en la tipo 1; de hecho, un alto porcentaje de pacientes son asintomáticos y tan sólo exhiben altas concentraciones de glucosa en el plasma.
Las complicaciones en los pacientes con diabetes pueden ser agudas o crónicas. Es poco frecuente que la primera manifestación sea un cuadro agudo de descompensación (cetoacidosis o coma hiperosmolar). Al paciente diabético se le identifica cuando manifiesta alguna complicación crónica de la enfermedad, como la neuropatía diabética. En la actualidad tas complicaciones agudas han dejado de ser causa de muerte, por lo que el enfermo con DM tipo 2 tiene una vida más larga, pero debe enfrentarse a las complicaciones crónicas de la enfermedad. Estas complicaciones, dependiendo de si afectan los vasos capilares sanguíneos, pequeños o de mayor calibre, se clasifican en micro y macrovasculares, respectivamente. Las primeras se relacionan principalmente con daño al endotelio y músculo liso de microvasculatura y se manifiesta como nefropatía, retinopatía y neuropatía diabética. Este tipo de complicaciones emerge por influencias genéticas sobre las cuales se yuxtaponen trastornos metabólicos y hemodinámicos, que tiene como característica anatómica el engrasamiento de las membranas basases de los vasos capilares, b que posteriormente conduce a angiopatía oclusiva, hipoxia y daño del tejido. El aumento de estas complicaciones se correlaciona en la mayoría de loss casos con la severidad y duración de la hiperglucemia crónica. Por ejemplo, niveles posprandiales de glucosa superiores a 11 mM, se asocian frecuentemente con las complicaciones renales, de retina y neurologias, las que se pueden iniciar cinco o diez años después de manifestarse la enfermedad.14–16
Las complicaciones macrovasculares17 son las más comunes en la DM tipo 2, incluye a un grupo de trastornos que se caracterizan por ateroesclerosis y enfermedad isquémica del corazón en todas sus modalidades, y son una de las principales causas de muerte en el paciente diabético.
La hiperglucemia ha sido identificada como factor de riesgo autónomo, que causa daño cardíaco y conduce a la cardiomiopatia diabética, independiente de la presencia de enfermedad vascular. A diferencia de las complicaciones microvasculares, la asociación de ateroesclerosis con hiperglucemia no es tan congruente. En cambio, la hiperglucemia posprandial y la concentración de insulina en el suero sí predicen el riesgo de enfermedad ateroesclerótica.18 Frecuentemente los factores de riesgo para estas enfermedades (obesidad, hipertensión y dislipidemia), anteceden al diagnóstico de DM hasta por ocho o más años. En comparación con los no diabéticos, el enfermo diabético tiene de dos a cuatro veces más probabilidades de presentar infarto al miocardio, así como otros trastornos asociados con la ateroescierosis.
En gran medida las complicaciones de la diabetes inducida por la hipergiucemia, se originan por cambios químicos y funcionales de las proteínas, alteración en la expresión de los genes y daño del endotelio.19 Al parecer la disfunción del endotelio es la causa principal de las complicaciones vasculares, porque en este tejido se presenta un desequilibrio en la producción de sustancias vasoactivas, que consiste en la disminución de la producción de vasodilatadores como el óxido nítrico, y en el aumento de la liberación de vasoconstrictores como la endotelina–1 (ET–1). Asimismo, hay aumento en la liberación de factores procoagulantes. En conjunto estas alteraciones pueden explicar, en parte, la mayor incidencia de ateroesclerosis e hipertensión en este tipo de pacientes. Pero además, en el endotelio y en otras células se incrementa la expresión del inhibidor del activador del plasminógeno–1 (PAI–1), de proteínas de la matriz extracelular, citocinas y factores del crecimiento [entre los que se encuentran: el factor de crecimiento del endotelio vascular (VEGF), el factor de crecimiento transformante β (TGF β) y el factor de necrosis tumoral α (TNF α)]. Lo anterior provoca alteraciones celulares y orgánicas, dependiendo del lugar donde se producen.
Así, la sobreproducción del VEGF en la retina facilita la ruptura de la barrera de permeabilidad vascular, migración de leucocitos, inflamación y la neovascularización patológica, lo que propicia la aparición de la retinopatía diabética proliferativa, una de las causas principales de ceguera en los países industrializados.20
El aumento en la expresión de proteínas de la matriz extracelular (fibronectina, laminina y colágena tipo IV) y de PAI–1 está involucrado en el engrosamiento de la membrana basal de vasos capilares sanguíneos en glomérulos y retina, y en la expansión de la matriz mesangial en riñon,21 responsables en parte de la retinopatía y nefropatía diabéticas. Estas anormalidades son resultado de la acumulación de componentes de matriz extracelular, ya sea por aumento en su producción, por alteraciones en su degradación o por incremento de factores de crecimiento como el TGF(3. La disminución en la degradación de la matriz extracelular en el paciente diabético se debe en gran medida a la sobreproducción del PAI–1, el cual inhibe la activación de las metaloproteinasas.22
Alteraciones metabólicas en la diabetes mellitus
Acumulación y acción de productos de glicación avanzada
Louis–Camille Maillard, en 1912, fue el primero en señalar la importancia de las modificaciones de las proteínas inducidas por carbohidratos en la patología humana.23 Estas modificaciones son producidas durante la hiperglucemia crónica y son causadas por la interacción de la glucosa y de otros carbohidratos —como la fructosa y la glucosa–6–fosfato o sus derivados— con las proteínas, ácidos nucleicos, y lípidos, para formar productos de glicación avanzada, conocidos como AGE o AGEs7 (por sus siglas en inglés, advanced glycalion end products).
Este proceso, es conocido como glicación y está asociado con el envejecimiento que se acelera con la diabetes, y se inicia con la reacción de los grupos carbonilos de los carbohidratos con los grupos amino de las proteínas, en especial con el amino terminal y el ε–amino de residuos de lisina, dando origen a los productos tempranos de glicación, también llamados de Ámadori o fructosamina. A partir de ellos y por cambios o transposiones moleculares y oxidaciones, se forman compuestos α–dicarbonilos (α–oxoaldehídos) como la 3–desoxiglucosona,24 el metilglioxal y el glioxal, los que son conocidos como recursores de los AGEs; éstos son más reactivos que sus predecesores y al combinarse simultáneamente con dos grupos reactivos de las proteínas, forman puentes cruzados entre ellas muy estables; produciendo su agregación, y pérdida en sus funciones biológicas. Las proteínas ricas en aminoácidos básicos (L–lisina y L–arginina) son especialmente susceptibles a la glicación.
La 3–desoxiglucosona se puede formar también directamente por la autooxidación de la glucosa catalizada por metales, en este proceso se produce el radical superóxido, precursor de otras especies reactivas de oxígeno. El metilglioxal y el glioxal derivan principalmente de intermediarios de la glucólisis26 como el gliceraldehído–3–fosfato y la dihidroxiacetona fosfato, que se acumulan a consecuencia de la hiperglucemia. Las concentraciones de metilglioxal y 3–desoxiglucosona se elevan en el plasma del modelo animal con hiperglucemia y en el paciente diabético.26,27 La formación intracelular de AGEs es más rápida que la extracelular, por lo que se ha propuesto que la alta concentración intracelular de glucosa desencadena la producción de AGEs intra y extracelularmente.28
Diversos estudios han constatado que la formación de los AGEs aumenta en una proporción mayor a la de la glucemia, este hecho sugiere que incluso elevaciones moderadas resultarían en la acumulación substancial de estos productos de glicación avanzada en los pacientes diabéticos. De igual manera, períodos cortos de hipergiucemia, como ocurre con las alteraciones de la tolerancia a la glucosa, pueden ser suficientes para fomentar su formación. Este proceso se encontró en la hemoglobina de los pacientes. No obstante, a partir de los productos de Amadori, la glicación puede proceder independientemente de la glucemia. Estas reacciones son irreversibles y las modificaciones sólo desaparecen con la degradación de la proteína modificada. Los AGEs son compuestos muy variados estructuralmente, entre otros podemos encontrar a la hidroximidazolona, puentes cruzados de bis (lisina)imidazolio, derivados de monolisina (N–ε–(carboximetil)–lisina), argipirimidina y pentosidina.
Las proteínas modificadas por los AGEs pueden encontrarse en el plasma, en el compartimiento intracelular y en la matriz extracelular; especialmente en la pared arterial, el mesangio glomerular, las membranas básales glomerulares, los vasos capilares sanguíneos, la vasculatura retiniana, el cristalino, el perineurum y las fibras nerviosas mielínbas y amielínicas. La acumulación de los AGEs ocurre más frecuentemente en proteínas de larga vida. Además se han encontrado AGEs en diversas proteínas, entre ellas la colágena de distintos tipos, las del citoesqueleto, la mielina y las histonas. De esta manera modifican al ensamble del citoesqueleto y a la función reguladora de la matriz extracelular sobre las células.
Los AGEs afectan no sólo por alterar la estructura y función de las proteínas, sino también por su acción con receptores específicos.29 Se han descrito receptores para los AGEs en numerosas células, incluyendo a los monocitos, a los macrófagos, a las células endoteliales, a las células mesangiales, a los pericitos, a los podocitos, a las neuronas periféricas y a la microglía. La lista de las moléculas capaces de ligar a los AGEs incluye a los receptores I y II, al receptor de AGEs (RAGE), a la oligosacaril transferasa (AGE–RI), a. la fosfoproteína 80K–H (AGE–R2) y la galectina–3 (AGE–R3). Las proteínas gibadas que se unen a estos receptores inducen diversos eventos como la producción de especies reactivas de oxígeno (ERO), estado proinflamatorio; proliferación de células (como los macrófagos) y las del endotelio y músculo liso arterial; la activación de factores de transcripción como el NFκB; así como la expresión de diversos péptidos y proteínas (incluyendo a factores de crecimiento, citocinas, proteínas de matriz extracelular y PAI–1). En los macrófagos estimulan la producción de la interleucina–1, el factor de crecimiento–1, el factor de crecimiento tumoral α y el factor estimulante de colonias de granulocitos (IL–1, GF–1, TNF α y GC–SF, respectivamente, por sus siglas en inglés), en tanto en los glomérulos inducen el aumento de la síntesis de la colágeno tipo IV.
La respuesta inducida por la unión de los AGEs a su receptor RAGE es mediada a través de la producción de ERO, que a su vez, activan in vivo e in vitro al factor de transcripción sensible al estado óxido–reductivo el NFκB 30 De acuerdo con b anterior se ha encontrado que las células mononucleares de sangre periférico provenientes de pacientes con mal control de la glucemia o con nefropatía diabética aumenta la activación de este factor,31 mientras que el control de la hipergiucemia o el uso de antioxidantes como el ácido α–lipoico disminuye su activación.
Durante algunos años se pensó que los AGEs se formaban solamente en las macromoléculas extracelulares de larga vida; debido a que la velocidad de formación de los AGEs por la glucemia es lenta, y las proteínas intracelulares con una velocidad de recambio de minutos u horas no tendrían tiempo suficiente para acumularse después de ser modificadas. Sin embargo, se ha demostrado in vivo,31 que los AGEs aparecen y se pueden acumular en las histonas de los hepatocitos. Resultados análogos se han encontrado en las células β de los islotes de Langerhans, las que comparten con los hepatocitos el mismo transportador de glucosa (GLUT 2) independiente de insulina. Esta glicación intracelular refleja el aumento de metabolites intermediarios (glucosa–6–fosfato y gliceraldehído–3–fosfato) inducido por la hipergiucemia, que son mucho más reactivos que la glucosa. De esta manera la formación de los AGEs en los ácidos nucleicos puede producir efectos dañinos en la proliferación celular y en la expresión génica. En resumen, la glicación es un fenómeno importante en el desgaste del tejido del paciente diabético.
Incremento en la actividad de la vía del sorbitol
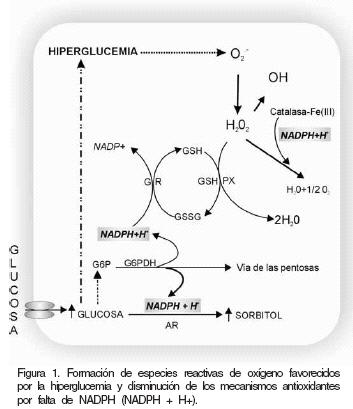
La glucosa intracelular tiene varias alternativas metabólicas dependiendo de los requerimientos de la célula. En los órganos y tejidos que no requieren insulina para la captación de glucosa y en los cuales se presentan principalmente las complicaciones crónicas en condiciones de hipergiucemia (riñon, retina, cristalino, corazón y sistema nervioso central). La ruta preferencial de conversión de la glucosa es la vía del sorbitol, también conocida como la vía de los polioles. En ella, la glucosa es transformada por la acción secuencial de dos enzimas: la aldosa reductasa (AR) y la sorbitol deshidrogenasa (SDH). La primera es la responsable de la reducción irreversible de la glucosa en sorbitol y requiere como coenzima a la nicotinamida adenina dinucleótido fosfato reducido (NADPH). Esta enzima controla la vía, y se activa al estar en contacto con altos niveles de glucosa.33 Debido a lo anterior aumenta la concentración de sorbitol y disminuye la disponibilidad de NADPH.
La SDH, segunda enzima, cataliza la transformación del sorbitol en fructosa con la concomitante formación de nicotinamida adenina dinucleótido reducido (NADH). Esta reacción es el punto crítico de la vía, con repercusión en las complicaciones diabéticas, tanto por la acumulación de los productos formados (NADH y fructosa), como por su reversibilidad.
A continuación analizaremos las consecuencias de las alteraciones en la concentración de metabolites causadas por la activación del sorbitol.
Consecuencias del consumo de NADPH
La caída en la concentración de NADPH afecta negativamente la actividad de otras enzimas que también lo requieren, como la óxido nítrico sintasa (NOS), la glutatión reductasa (GR), la catalasa y la NADPH oxidasa. Algunas de ellas participan en los mecanismos antioxidantes; por lo tanto, el agotamiento de NADPH explicaría, en parte, la deficiencia de los sistemas antioxidantes en el paciente diabético como el dependiente del glutatión y de la catalasa.
Para que el glutatión realice su acción como principal antioxidante intracelular en respuesta a especies reactivas de oxígeno (anión superóxido, radical hidróxilo y peróxidos orgánicos e inorgánicos) es requisito indispensable que mantenga su forma reducida (GSH),34 por acción de la glutatión reductasa, sobre la forma oxidada (GSSG), lo que requiere del consumo de NADPH. Por otra parte, la activación de la catalasa35 también depende de NADPH (Figura 1).
Efectos de la acumulación de la fructosa
La transformación bioquímica de la fructosa que afecta al organismo inicia en la mayoría de los tejidos, excepto en el hígado, con su fosforilación por una hexocinasa específica, dando lugar a la fructosa–6–fosfato que se metaboliza en la ruta glucolítica (Figura 2). De esta manera, la vía de los polioles y la glucólisis se acoplan; como ha sido descrito durante la isquemia y la perfusión del tejido cardiaco, así como de los glomérulos en ratas diabéticas,36,37

La glucólisis es uno de las principales rutas que propicia la oxidación de la glucosa, que convierte una molécula de azúcar en dos moléculas de piruvato, dos de ATP y dos equivalentes reductores en forma de NADH. Este proceso implica 10 reacciones catalíticas, desde la activación de la glucosa hasta la formación del piruvato. Las cinco primeras constituyen una fase de consumo de energía donde se sintetizan azúcares fosfato a expensas de la conversión de ATP en ADP, y el sustrato se rompe en dos carbohidratos fosforilados de tres carbonos (triosas fosfato). Las cinco últimas reacciones generan energía; porque las triosas–fosfato se convierten en compuestos ricos en ella y donan grupos fosfato para la síntesis de ATP a partir de ADP.
La oxidación del gliceraldehído–3–fosfato (G3P) catalizada por la enzima gliceraldehido–3–fosfato deshidro–genasa (G3PDH) es de las reacciones más importantes de la glucólisis, por que en ella se forma el primer intermediario de alta energía y un par de equivalentes reductores en forma de NADH.
El acoplamiento entre la glucólisis y la vía del sorbitol conduce a diversas alteraciones metabólicas, entre ellas:
a) Acumulación de intermediarios de la glucólisis, principalmente el G3P y la dihidroxiacetona fosfato (DHAP), ambos altamente reactivos con la capacidad de glicar proteínas y generar estrés oxidativo. Como se mencionó anteriormente originan precursores de productos de glicación avanzada.
b) Aumento de la relación NADH/NAD+. El aumento de esta relación se explica por dos mecanismos: por la actividad de la segunda enzima de la vía del sorbitol (SDH) y el desequilibrio entre la velocidad de oxidación del G3P a 1,3 bis–fosfo–glicerato (1,3BPG) y la velocidad de reducción del piruvato a lactato. La primera reacción produce NADH y la segunda lo consume; sin embargo, durante la hiperglucemia la primera es favorecida.33
c) Inhibición de la G3PDH. Esta enzima desempeña un papel fundamental en la génesis de las complicaciones diabéticas. Cuando la concentración intracelular de la glucosa es alta su actividad es inhibida, razón por la cual se acumulan las triosas fosfato con las consecuencias descritas. Son múltiples las causas que reducen su actividad entre ellas:
Aumento en su degradación debido a la disociación de sus cuatro subunidades, causado por las concentraciones altas de NADH generadas en la vía del sorbitol.39
• Oxidación de sus grupos tiol (SH) necesarios para su actividad, como consecuencia del estrés oxidativo.40
• Disminución de su expresión debido a la reducción de insulina, hormona que regula la transcripción del gen de la enzima.41
• La acumulación de aldehidos que inhiben a la enzima.42
• Decremento de NAD+ necesario para que actúe.
• Glicación de la enzima.43
De este análisis se puede especular que la G3PDH está involucrada en el estrés oxidativo de las células durante la diabetes.
En el hígado la fosforilación de la fructosa depende de otra enzima, la fructocinasa, la cual la convierte en fructosa–1–fosfato, que cuando es fragmentada por una enzima específica, la aldolasa B da origen a la DHAP y al glicerol. La presencia de la aldolasa B explica la facilidad con que la fructosa administrada por vía oral se convierte en lípidos, ya que sus productos DHAP y glicerol, se transforman en sn glicerol–3–fosfato, a partir del cual se sintetizan triacilgliceroles (síntesis de novo). La acumulación de triacilgliceroles conduce a la activación de la proteína cinasa C.
Otro compuesto derivado de la fructosa es la fructosa–3–fosfato, la cual se acumula en los cristalinos y eritrocitos de ratas diabéticas."Este producto cuando se hidroliza produce 3–desoxiglucosona", ambos tienen la propiedad de glicar proteínas.41 Es evidente que el aumento de la fructosa–3–fosfato y su hidrólisis contribuye a la glicación de proteínas, efecto que depende de la concentración de la 3–desoxiglucosona, de la velocidad de hidrólisis de la fructosa–3–fosfato y de la eficiencia de algún mecanismo de desintoxicación para la 3–desoxiglucosona. La depuración de fructosa–3–fosfato en el cristalino y el eritrocito es a través de 3–desoxifructosa o del ácido 2–ceto–3–desoxiglucónico.
Efectos de la acumulación del sorbitol
Las células animales tienden a mantener su volumen normal, inicialmente acumulando sales de sodio y potasio, posteriormente captando agua. Sin embargo, esta fase de osmorregulación es temporal, debido a que después de un tiempo prolongado las células en general y, en particular, las de la médula renal, necesitan mecanismos adicionales para regular su osmolaridad; por lo que acumulan osmolitos orgánicos que provienen del medio o de la síntesis intracelular. Los solutos orgánicos osmóticamente activos se conocen como solutos compatibles o solutos no perturbadores. El sorbitol, la glicerofosforilcolina y el inositol (polioles) pertenecen a este grupo de compuestos que tienden a acumularse en una gran variedad de organismos expuestos a un ambiente alto en sales. Si bien, la acumulación de sorbitol puede ser benéfica en la médula renal, éste y otros polioles normalmente no se concentran en otros tejidos y cuando esto ocurre puede producir daño celular. Así, la acumulación de sorbitol debido a su incapacidad para difundir con facilidad al exterior, conduce a un aumento de estrés osmótico en las células, y esto es especialmente importante para explicar el daño a nivel de cristalino.46 Además los estudios realizados en ratas diabéticas han asociado el exceso de sorbitol en los cristalinos con el desarrollo de cataratas.47
El estrés osmótico en los cristalinos se origina debido a que la acumulación del sorbitol provoca que la célula se hinche, alterando la permeabilidad de la membrana y promoviendo cambios bioquímicos asociados con la formación de la catarata. Con base en estas observaciones y en estudios de células en cultivo y modelos experimentales, se ha postulado que el estrés osmótico es iniciado por la AR. Esta hipótesis se ve apoyada por el hecho de que el uso de inhibidores de la AR previenen o retardan significativamente la formación de.cataratas.48 Sin embargo, la acumulación de sorbitol no es suficiente para explicar el origen de la neuropatía, retinopatía y nefropatía diabéticas, porque la concentración de sorbitol en estos órganos es mucho menor que la observada en los cristalinos, a menos que la acumulación del sorbitol sea muy alta en pequeños compartimientos de estas células.
La inhibición de las dos enzimas de la vía de los polioles podría ser una alternativa terapéutica para el tratamiento de las complicaciones diabéticas. Sin embargo, Tilton y colaboradores49 han considerado que podría ser más importante inhibir a la SDH que a la AR, dado que esto evitaría la acumulación de fructosa, de NADH y de metabolitos que favorecen el aumento de productos de glicosilación avanzada relacionados con el estrés oxidativo, la resistencia a la insulina y alteraciones enzimáticas. También proponen que el estrés osmótico ocasionado por el aumento de sorbitol, podría contrarrestarse por la disminución de bs desequilibrios redox y metabólico que resultan de la oxidación del sorbitol a fructosa.
Activación de la vía de las hexosaminas
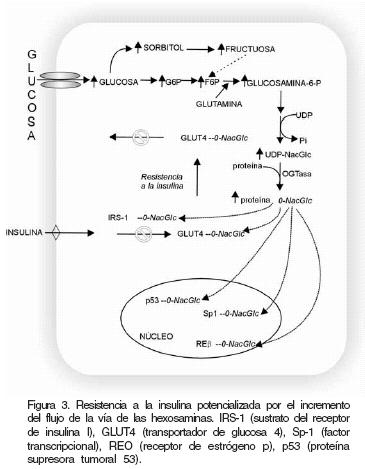
La fructosa vía sorbitol contribuye en la activación de la vía de las hexosaminas, debido a que la formación de la glucosamina–6–fosfato proviene exclusivamente de la fructosa–6–fosfato y la glutamina, mediante una reacción irreversible catalizada por la glutamina: fructosa–6–fosfato amidotransferasa (GFA), enzima que regula la vía. La glucosamina–6–fosfato a través de tres reacciones subsecuentes, finalmente da origen a la UDP–N–acetilglucosamina y a la UDP–N– acetilgalactosamina, que se utilizan en la formación de las glicoproteínas y los proteoglicanos. El aumento del flujo a través de esta vía está relacionado con algunos efectos de la diabetes, contribuye en parte a la estimulación de la expresión de genes como los del TGF , y del inhibidor del activador del plasminógeno–1 (PAI–1).51 También participa en la inducción de la resistencia a la insulina por lípidos o por hipergiucemia.52
La resistencia de ciertos tejidos a responder a la acción de la insulina es una característica distintiva de ciertas patologías como la DM tipo 2. No obstante que los mecanismos celulares y moleculares responsables de este fenómeno no son del todo entendidos, se ha asociado a la activación de vía de las hexosaminas con el desarrollo de la resistencia a la insulina.53
Mediante el uso de infusbnes de glucosamina, se ha podido demostrar que hay una correlación entre los incrementos tanto de la UDP–N– acetilglucosamina como de la actividad de la GFA, y la insuficiencia de la captación de glucosa en los tejidos adiposo y muscular.54 Quizá la evidencia más contundente al respecto provenga del modelo transgénico,55 ya que cuando se sobreexpresa la enzima GFA, se propicia el aumento de intermediarios de esta vía y disminuye la inducción por la insulina de la traslocación de los transportadores de glucosa (GLUT 4) a la membrana celular.
Se han propuesto varias hipótesis para explicar el mecanismo por el cual la activación de las hexosaminas induce resistencia a la insulina. Una de ellas gira en torno a la glucosamina como responsable de impedir la acción de la insulina, al inhibir la fosforilación y la activación para el sustrato del receptor de insulina–1 (IRS–1), proteína de señalización postreceptor de insulina. Otra propuesta más compleja, sugiere que algunas de las proteínas que participan en la acción de la insulina, como los IRS y el transportador GLUT4, pueden ser modificadas a nivel postraduccbnal56 por la adición de la N–acetilglucosamina. Estos residuos de serina y/o treonina requieren de ser fosforilados para que la insulina ejerza su acción; sin embargo, al unirse la N–acetilgiucosamina, el proceso de fosforilación no se realiza y con ello la acción de la insulina disminuye. El enlace que se forma entre las proteínas de señalización y la N–acetilglucosamina es del tipo "O–"glicosídico (O–NaGlc). Existen evidencias de que la incorporación de N–acetilglucosamina en residuos de serina y treonina puede afectar varios procesos celulares al inhibir la fosforilación de proteínas en estos residuos.57 En apoyo a lo anterior, Patti y colaboradores58 observaron que las infusiones de glucosamina producían un aumento de las uniones O–NaGlc en IRS–1 e IRS–2 en músculo esquelético. Es factible que a consecuencia de ello se alteren eventos tempranos en la vía de señalización de la insulina, ya sea en forma global o en sitios específicos, disminuyendo finalmente la fosforilación de IRS y el transporte de glucosa dependiente de la hormona. La glucosaminilación del transportador GLUT4 altera su afinidad a la glucosa, disminuye su actividad y estabilidad, y modifica su distribución celular; lo cual puede conducir a la falla o al desarreglo del sistema de transporte de la glucosa (Figura 3).
Activación de la proteína cinasa C
La acumulación de DHAP y G3P promueve la producción de diacilgliceroles (DAG), y la subsecuente activación de la proteína cinasa C (PKC), mismos que también afectan la homeostasis vascular.59
La PKC pertenece a la familia de las serinas/treoninas fosfocinasas, y presenta por lo menos 11 isoformas (α β1, β2, γ δ ε ζ η, θ λ μ), codificadas por 10 genes diferentes. Estas proteínas se clasifican en cuatro clases: las convencionales o clásicas (α β1, β2 y γ), las dependientes de Ca2+ y fosfolípidos; las nuevas isoformas independientes de Ca2+ (ε, η, θ, μ) las atípicas ( ζ y λ) y las independientes de Ca2+ y fosfolípidos (μ).
El DAG es un activador natural de la PKC y su producción aumenta en las células del endotelio, la retina y los glomérulos renales durante las complicaciones diabéticas en modelos animales y en el humano.60 En células vasculares en cultivo, concentraciones altas de glucosa (22 mM) causan el aumento en el contenido de DAG, alcanzando un máximo al tercer y quinto día de inicio del tratamiento. Además, los niveles elevados de DAG se mantienen de manera crónica en animales diabéticos.
El DAG puede formarse también a partir de fosfoinosítidos por la acción de la fosfolipasa C. Sin embargo, durante la diabetes su aumento es principalmente por la síntesis de novo a partir de intermediarios glucolíticos,61 en particular de la dehidroxiacetona fosfato. Otros posibles activadores de la PKC son el metilglioxal,62 la glucosamina,63 y las ERO.64 Todos ellos se generan debido a alteraciones metabólicas que se presentan en la diabetes.
Las alteraciones celulares y funcionales atribuidas a la activación de la PKC son muy variadas, y dependen de la función de esta enzima en los mecanismos de transducción de señales y en su participación en la regulación de la expresión de diversos genes, incluyendo a los de proteínas de matriz extracelular (fibronectina y colágeno tipo IV), del PAI–1 y del TGF p y su receptor.65 Su activación induce la expresión de los genes antes señalados en células mesangiales en cultivo o en glomérulos de ratas diabéticas. Además, afecta la producción de sustancias vasoactivas, por una parte deprime la producción de óxido nítrico y por otra estimula la expresión de la ET–1,66 lo que conduce a la disminución del flujo sanguíneo de la retina, los nervios periféricos y el riñon, en el modelo de diabetes experimental.
En la retina, el decremento del flujo sanguíneo puede llevar a una hipoxia local, que induce la expresión del VEGF, que a su vez aumenta la permeabilidad del endotelio y la formación de microaneurismas. In vitro, la interacción de ET–1 y VEGF incremento la permeabilidad vascular debido a un desarreglo de la actina F y a un desajuste en las uniones de los endotelios, pudiendo ser esto una posible explicación de la patología ocular.
Se piensa que los genes de las proteínas de matriz extracelular tienen secuencia consenso en su región promotora, la que interactúa con factores transcripcionales modulados por la PKC. Uno de estos factores es el activador de proteínas (AP–1), que media la inducción de la transcripción en respuesta a activadores de la PKC, como son los esteres de forbol y el DAG, uniéndose a elementos conservados del DNA conocidos como elementos de respuesta. Los genes para la fibronectina y la laminina contienen esta secuencia de unión para el AP–1 en su promotor. La activación de la PKC por la hiperglucemia disminuye la degradación de la matriz extracelular al causar la sobreexpresión del inhibidor del PAI–1.
Aumento del estrés oxidativo
Muchos de los cambios metabólicos causados por la hiperglucemia producen estrés oxidativo debido al aumento en la formación de ERO y a la disminución de los sistemas de defensa antioxidantes.30,67 En condiciones de hiperglucemia las ERO se generan principalmente durante la autooxidación de la glucosa y en diferentes reacciones oxidativas que acompañan a la glicación de proteínas, lípidos y ácidos nucleicos. Existen resultados contradictorios cuando se analizan metabolites o enzimas antioxidantes, dependiendo de los tejidos o sistemas que se estudien; sin embargo, en general se ha observado un declive en ellos, lo que es consecuencia de la disminución en la disponibilidad del NADPH y del glutatión reducido; así como del daño oxidativo de las enzimas involucradas.
El estrés oxidativo está íntimamente vinculado a la glicación, por lo cual la acción combinada de estos dos procesos se conoce como glucooxidación. Las ERO conducen también a modificaciones estructurales de las proteínas, originando compuestos en ocasiones similares a los productos de glicación. Además, los compuestos resultantes de la lipoperoxidación, como el malondialdehído, se pueden unir a las proteínas y amplificar el daño inducido por la glucooxidación.
La generación de las ERO se encuentra aumentada tanto en la diabetes tipo 1 como en la 2, y en modelos experimentales, aun antes de que las complicaciones diabéticas sean evidentes; por ello, se ha sugerido que el surgimiento de la diabetes, el desarrollo de resistencia a la insulina y de las complicaciones tardías de la diabetes, están estrechamente asociados al estrés oxidativo. Las ERO contribuyen a la resistencia a la insulina, debido a que interfiere con las vías de señalización inducida por esta hormona y evitan la traslocación del transportador de glucosa GLUT 4 a la membrana plasmática. El mecanismo por el que contribuyen a las complicaciones de la diabetes es parcialmente conocido y se piensa que actúan por la modificación oxidativa de macromoléculas y por la activación del factor de transcripción NFkB,30 lo que conduce a la expresión alterada de genes. En concordancia con esta hipótesis, se ha encontrado que en pacientes diabéticos el empleo de antioxidantes como el ácido lipoico reduce la activación del NFκB
Conclusiones
Las complicaciones en los pacientes con diabetes son consecuencia de la hiperglucemia y la resistencia a la insulina, y probablemente la forma en que la primera induce el daño en diversos tejidos u órganos depende de las características metabólicas de los mismos.
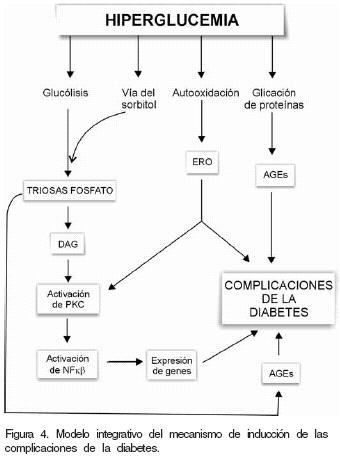
Las alteraciones metabólicas inducidas por la hiperglucemia intervienen conjuntamente en el desarrollo de la enfermedad (Figura 4), por lo que es difícil evaluar cuál es más importante. El uso de inhibidores de la AR en animales y humanos indica que la vía de los polioles está implicada en la neuropatía diabética, sin embargo pudiera tener poca relevancia en el daño en la retina, el riñon y el músculo. Esto tal vez se deba a la limitada eficiencia y efectos adversos de las drogas; pero se espera que al inhibir la vía de los polioles, la glucosa sea canalizada a la glucólisis, donde se favorece la acumulación de triosas y formación de los precursores de glicación, lo que causa en gran medida las complicaciones asociadas a la enfermedad. Hasta el momento se han evaluado clínicamente diferentes inhibidores de la AR: el Alrestatin de gran toxicidad y con una respuesta pobre en el tratamiento de la neuropatía diabética. El sorbinil, efectivo en prevenir la formación de la catarata; y mejorar la conducción nerviosa, pero con efectos cutáneos colaterales que determinaron su retirada del mercado.68 El stabil, mostró resultados más alentadores en animales, pero no se pudieron reproducir en el ser humano. Bimoclobol otra alternativa en el tratamiento de la retinopatía diabética, los resultados fueron desalentadores por la formación de productos tóxicos al inhibir la AR. El tolrestat y zenarestat causaron disfunción hepática69 y toxicidad renal,70 respectivamente. Entre las drogas mas actuales está el fidarestat,71 diseñado para el tratamiento de la neuropatía y su eficiencia se atribuye a una rápida distribución en los tejidos, unión selectiva a la AR, un metabolismo limitado, ausencia de efectos farmacológicos y no presenta efectos sobre enzimas hepáticas que metabolisan drogas. Otra alternativa terapéutica probada clínicamente y en el modelo experimental es el uso de dosis altas de tiamina o su análogo benzotiamina (S–benzoil piridoxamina fosfato), que previenen la acumulación de triosas, la formación de AGEs y el desarrollo de la neuropatía diabéticas.5
La formación acelerada de AGEs al parecer desempeña una función más general en la patogenia de las complicaciones diabéticas; su administración conduce al engrosamiento de la membrana basal arterial, a la disfunción vascular compleja, a la expansión del mesangio, a la glomeruloesclerosis y a la proteinuria,13 mientras que inhibidores de su formación (aminoguanidina y piridoxamina) impiden parcialmente las manifestaciones de la retino, nefro y neuropatías diabéticas en animales y humanos.21
También el bloqueo del receptor RAGE inhibe el desarrollo de la nefropatía y la ateroesclerosis, y mejora la cicatrización en individuos diabéticos.7
Por otra parte, inhibidores de la proteína cinasa C disminuyen la disfunción vascular que conduce a la retino y neuropatía diabéticas.11 Es probable que cuando la concentración intracelular de glucosa sea alta, al metabolizarse por la vía del sorbitol y la glucólisis, se favorezca la acumulación de metabolites y las condiciones que desencadenen la glicación, la activación de la proteína cinasa C y aumento del estrés oxidativo. Todos ellos en conjunto conducen a la alteración en la estructura y funcionalidad de las proteínas, además de la expresión de genes así como base de las anormalidades tisulares que conducen al desarrollo de las complicaciones de la diabetes. El estudio de los mecanismos moleculares del origen de las complicaciones diabéticas permitirá encontrar nuevas opciones terapéuticas para su prevención y tratamiento.
Referencias
1. Secretaría de Salud. Encuesta Nacional de Enfermedades Crónicas. México: Secretaría de Salud; 2000. [ Links ]
2. Kahan R. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20:1183–1193. [ Links ]
3. Leboviz HE. Type 2 diabetes: an overview. Clin Chem 1999;45(8 pt 2):1339–1345. [ Links ]
4. Browniee M. Biochemistry and molecular cell biology of diabetic complications. Nature 2001; 414(6865):813–820. [ Links ]
5. Thomaly PJ, Jahan I, Ng R. Suppression of the accumulation of triosaphosphates and increased formation of methylglyoxal in human red blood celis during hypergtycaemia by thiamine in vitro, J Biochem 2001; 129:543–549. [ Links ]
6. Méndez JD. Productos finales de glicación avanzada y complicaciones crónicas de la diabetes mellitus. Gac Med Mex 2003; 139:49–54. [ Links ]
7. Uirich P, Cerami A. Protein glycation, diabetes, and aging. Recent Progr Horm Res 2001; 56:1–21. [ Links ]
8. Thomalley PJ. Glycation in diabetic neuropathy: characteristics, consequences, causes and therapeutic options. Int Rev Neurobiol 2002; 50:37–57. [ Links ]
9. Gabbay KH. Hyperglycaemia, polyol metabolism, and complications of diabetes mellitus. Annu Rev Med 1975; 26:521–536. [ Links ]
10. Marshall S, Bacote V, Traxinger RR. Discovery of a metabolic pathway mediating glucose induced desensitization of the glucose transport system. Role of hexosamine biosynthesis in the induction of insulin resistance. J Biol Chem 1991; 1266(8):4706–4712 [ Links ]
11. Koya D, King GL. Protein kinase C activation and the development of diabetic complications. Diabetes 1998; 47(6):859–866. [ Links ]
12. Baylies JW, Thorpe SR. Role of oxidative stress in diabetic complications: a new perspectiva on an old paradigm. Diabetes 1999;48(1):1–9. [ Links ]
13. Maritim AC, Sanders RA, Watkins JB 3rd. Diabetes, oxidative stress, and antioxidants: a review. J Biochem Mol Toxicol 2003; 17(1):24–38. [ Links ]
14. Turner R. The U.K. Prospective Diabetes Study. A review. Diabetes Care 1998; 21(3):C35–C38. [ Links ]
15. Clark CJ, Lee D. Prevention and treatment of the complications of diabetes mellitus. N Engl J Med 1995; 332:1210–1217. [ Links ]
16. Fore W. Noninsulin–dependent diabetes mellitus. The prevention of complications. Med Clin North Am 1995; 79(2):287–298. [ Links ]
17. American Diabetes Association. Consensus Statement: Role of cardiovascular risk factors in prevention and treatment of macro–vascular disease in diabetes. Diabetes Care 1993; 16(Suppl 2):72–78. [ Links ]
18. Cai L, Kang YJ. Oxidative stress and diabetic cardiomyopthy: a brief review. Cardiovasc Toxicol 2001; 1(3):181–193. [ Links ]
19. De Vriese AS, Verbeuren TJ, Van de Voorde J, Lameire NH, Vanhoutte PM. Endotelial dysfunction in diabetes. Br J Pharmacol 2000; 1130(5):963–974. [ Links ]
20. Morauski CJ, Skinner SL, Stubbs AJ. The renin–angiotensin system influences ocular endothelial cell proliferation in diabetes: transgenic and interventional studies. Am J Pathol 2003; 162(1):151–160. [ Links ]
21. Stitt A, Gardiner TA, Alderson NL, Canning P, Frizzell N, Duffy N, Boyle C, Januszewski AS, Chachich M, Baynes JW, Thorpe SR, Anderson NL. The AGE inhibitor pyridoxamine inhibits development of retinopathy in experimental diabetes. Diabetes 2002; 51(9):2826–2832. [ Links ]
22. Zorina SG, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis. The good, the bad and the ugty. Circ Res 2002; 90:251–262. [ Links ]
23. Monnier VM, Sel DR, Odetli P. Mailand reaction and oxidative stress are interrebted stochastic mechanisms of aging. Poli G, Albano E, Danzari UM, editores, fies radicals: from basic science to medicine. Basel, Suiza: Birkháuser Veriag;1993. [ Links ]
24. Niwa T. 3–deoxygiucosone: metabolism, analysis, biological activity, and clinical implication. J Chromatogr B Biomed Sci Appl 1999;731 (1 ):23–26. [ Links ]
25. Best L, Thomally PJ. Trioses and related substances: tools for the study of pancreatic beta cell function. Biochem Pharmacol 1999; 57(6):583–588. [ Links ]
26. Wells–Xnecht KJ, Lyons TJ, McCance DR, Thorpe SR, Feather MS, Baynes MJ. 3–deoxyfructose concentrations are increased in human plasma and urine in diabetes. Diabetes 1994; 43(9):1152–1156. [ Links ]
27. Yamada H, Miyata S, kjaki N, Yatabe H, Miyauchi Y, Ohara T, Sakai M, Soda H Oimomi M, Kasuga M. Increase in 3–deoxyglucosone leveLs in diabetic rat plasma. Specific in vivo determination of intermediate and advanced Maillard reaction. J Biol Chem 1994;69(32):20275–20280. [ Links ]
28. Degenhardt TP, Thorpe SR, Baynes JW. Chemical modification of proteins by methygiyoxal. Cell Mol Biol 1998; 44(7):1139–1145. [ Links ]
29. Thornalley P. Cell activation by glycated proteins. AGE receptors, receptor recognition factors and functional classification of AGES. Cell Mol Biol 1998; 44:1013–1023. [ Links ]
30. Mohamed AK, Bierhaus A, Schiekofer S, Ziegier R, Nawroth PP. The role of oxidatwe stress and NF–kappaB activation in late diabetic complications. Biofactors 1999;10(2–3):157–167. [ Links ]
31. Hofmann MA, Schiekofer S, Iserman B, Kanitz M, Henkeis M, Joswing M, Treuch A, Marcos M, Weiss T, Borcea V, Abdel Khalek AK, Amiral J, Tritschier H, Ritz E, Wahi P, Ziegier R, Bierhaus A, Nawroth PP. Peripheral blood mononuclear cells isolated from patients with diabetic nephropathy show increased activation of the oxidative–stress sensitive transcription factor NF–kappa B. Diabetologia 1999: 42(2):222–232. [ Links ]
32. Giardino I, Edeistein D, Browlee M. BCI–2 expression or antioxidants prevent hypergtycemia–induced formation of intracellular advanced gtycatbn end products in bovine endothelial cells. J Clin Invest 1996; 97(6):1422–1428. [ Links ]
33. Hodgkinson AD, Sondergaard KL, Yang B, Cross DF, Miiiward BA, Demaine AG. Aldose redactase expression is induced by hyperglycemia in diabetic nephropathy. Kidney Int 2001; 60(1):211–218. [ Links ]
34. Meister A. Biochemistry of glutathione. En: De D, Greenberg, editores. Metabolism of sulfur compounds. New York: Academic Press;1975. pp. 101–188. [ Links ]
35. Diplock AT. Antioxidants and free radical scavengers. En: Rice–Evans CA, Burdon RH. Elsevier Science LLM , editores. Free radical damage and its control. Amsterdam, Holanda: Elsevier Science BV 1994; 99:113–130. [ Links ]
36. Trueblood N, Ramasamy R. Aldose reductase inhibition improves altered glucose metabolism of isolated diabetic rat hearts. Am J Physiol 1998; 275(1 Pt 2):H75–H83. [ Links ]
37. Gabbay KH. Hyperglycemia, potyol metabolism, and complicantions of diabetes mellitus. N Engl J Med 1975; 521–536. [ Links ]
38. Fukase S, Sato S, Mori K, Secchi EF, Kador PF. Polyol pathway and NADPH–dependent reductases in dog leukocytes. J Diabetes Complications 1996; 10(6):304–313. [ Links ]
39. Knecht E, Roche E. The reduction–oxidation status may influence the degradation of glyceraldehyde–3–phosphate dehydrogenase. FEBS Lett 1986; 206(2):339–342. [ Links ]
40. Morgan PE, Dean RT, Davis MJ. Inhibition of glyceraldehyde–3–phosphate dehydrogenase by peptide and protein peroxides generated by singlet oxygen attack. Eur J Biochem 2002; 269:1916–1925. [ Links ]
41. Alexander MC, Lomato M, Nasrin N, Ramaika C. Insulin stimulates giyceraldehyde–3–phosphate dehydrogenase gene expression through cis–acting DNA sequences. Proc Nati Acad Sci USA 1988: 185:5092–5096. [ Links ]
42. Novotny MV, Yancey MF, Yanuy MF, Stuart R, Weisler D, Peterson RG. Inhibition of glycotytic enzymes by endogenous aldehydes: a possible relation to diabetic neuropathies. Biochim Biophys Acta 1994; 1226(2):145–150. [ Links ]
43. Beisswenger PJ, Howeil SK, Smith K, Szwergofd BS. Glyceraldehyde–3– phosphate dehydrogenase activity as an independent modifier of methylglyoxal levels in diabetes. Biochim Biophys Ada 2003; 1637(1):98–106. [ Links ]
44. Szwergold BS, Kappier F, Brown TR. Identification of fructose 3– phosphate in the lens of diabetic rats. Science 1990; 247(4941 ):451 –454. [ Links ]
45.Kusunoki H, Miyata S, Ohara T, Liu BF, Uriuhara A, Kojima H, Suzuki K, Miyazaki H, Yamashita Y, Inaba K, Kasuga M. Relation between serum 3–deoxyglucosone and development of diabetic microangiopathy. Diabetes Care 2003; 26(6):1889–1894. [ Links ]
46. Burg M, Kador PF. Sorbitol, osmoregulation, and the complications of diabetes, J Clin Invest 1988; 81(3):635–640. [ Links ]
47. Lee AY, Chung SS. Contributions of polyol pathway to oxidative stress in diabetic cataract. FASEB J 1999; 13(1)–23–30. [ Links ]
48. Naruse K, Nakamura J, Hamada Y, Nakayama M, Chaya S, Komori T, Kato K, Kasuya Y, Miwa K, Hotta N. Aldose reductase inhibition prevents glucose–induced apoptosis in cultured bovine retinal microvascular pericytes. Exp Eye Res 2000; 71(3):309–315. [ Links ]
49. Tilton RG, Chang K, Nyengaard JR, Van den Enden M, Ido Y, Williamson JR. Inhibition of sorbitol dehydrogenase. Effects on vascular and neural dysfunction in streptozocininduced diabetic rats. Diabetes 1995; 44(2):234–242. [ Links ]
50. Koim–Litty V, Sauer U, Nertich A, Lehmann R, Schieicher ED. High glucose– induced transforming growth factor beta 1 production is mediated by the hexosamine pathway in porcine glomerular mesangial cells. J Clin Invest 1998; 101(1):160–169. [ Links ]
51. Du XL, Edeistein D, Rossetti L, Fantus IG, Goldeberg H, Ziyadeh F, Wu J, Brownlee M. Hyperglycemia–induced mitochondrial superoxide overproduction activases the hexosamine pathway and induces plasminogen activator inhibitor– 1 expression by increasing Spl gycosilation. Proc Natl Acad Sci USA 2001; 97(22):12222–12226. [ Links ]
52. Hawkins M, Barzilai N, Liu R, Hu M, Chen W, Rossetti L. Role of the glucosamine pathway in fat–induced insulin resistance. J Clin Invest 1997; 99(9):2173–2182. [ Links ]
53. McClain DA, Crook ED. Hexosamines and insulin resistance. Diabetes 1996; 45(8):1003–1009. [ Links ]
54. Baron AD, Zhu JS, Garvey WT, et al. Glucosamine induces insulin resistance in vivo by affecting GLUT 4 translocation in skeletal muscie. J Clin Invest 1995; 96:2792–2801. [ Links ]
55. Hebert LF, Danieis MC, Zhou J, Crook ED, Turner RL, Simmons ST, Neklkjh JL, ZHU JS, Baron AD, McCiain DA. Overexpression of glutamine: fructose–6– phosphate amidotransferase in transgenic mice leads to insulin resistance. J Clin Invest 1996; 98:930–936. [ Links ]
56. Liu K, Paterson AJ, Chin E, Kudbw JE. Glucose stimulates protein modification by O–linked GicNAc in pancreatic beta celis: linkage of O–linked GlNAc to beta cell death. Proc Nati Acad Sci USA 2000; 97(6):2820–2825. [ Links ]
57. Welis L, Vosseller K, Hart GW. Giycosylation of nucleocytopiasmic proteins: signal transduction and 0–GlcNAc. Science 2001; 291 (5512):2376–2378. [ Links ]
58. Patti ME, Virkamaki A, Landoker EJ, Kahn CR, Yki–Jarvinen H. Activation of the hexosamine pathway by glucosamine in vivo induces insulin resístanse of eariy postreceptor insulin signaling events in skeletal muscie. Diabetes 1999;48(8):1562–1571. [ Links ]
59. Yuan SY, Ustinova EE, Wu MH, Tinsiey JH, Xu W. Korompai FL, Taulman AC. Protein kinase C activation contributes to microvascular barrier dysfunction in the heart at earty stages of diabetes. Circ Res 2000;87(5):412 - 17. [ Links ]
60. Chibber R, Ben–Mahmud BM, Kohner EM, et al. Protein kinase C beta 2– dependent phosphorylation of core 2 GlcNAc–T promotes leukocyte–endothelial cell adhesion: a mechanism underlying capillary occiusion in diabetic retinopathy. Diabetes 2003; 52(6):1519–1527. [ Links ]
61. Wolf BA, Williamson JR, Easom RA, Chang K, Sherman WR, Turk J. Diacylglycerol accumulation and microvascular abnormalities induced by elevated glucose levels. J Clin Invest 1991; 87:31–38. [ Links ]
62. Godbout JP, Pesavento J, Hartman ME, Manson SR, Freund GG. Methylglyoxal enhances cisplatin–induced cytotoxicity by activating protein kinase C delta. J Biol Chem 2002; 277(4):2554–2561. [ Links ]
63. Filippis A, Ciark S, Proietto J. Increased flux through the hexosamine biosynthesis pathway inhibits glucose transport acutely by activation of protein kinase C. Biochem J 1997; 1324(Pt 3):981–985. [ Links ]
64. Scivittaro V, Ganz MB, Weiss MF. AGEs induce oxidative stress and activate protein kinase C–beta(11) in neonatal mesangial cells. Am J Physiol Renal Physiol 2000; 278(4):F676–F683. [ Links ]
65. Lindschau C, Quass P, Halier H, et al. Glucose–induced TGF–beta 1 and TGF– beta receptor expression in vascular smooth muscle cells is mediated by protein kinase Caipha. Hypertension 2003;42(3):335–341. [ Links ]
66. Park JY, Takahara N, Gabriele A, Chou E, Naruse K, Sazuma K, Yamauchi T, Ha SW, Meier M, Rhodes CJ, King GL Induction of endothelin–1 expression by glucose: an effect of protein kinase C actuation. Diabetes 2000; 49(7):1239– 1248. [ Links ]
67. Gugiiucci A, Menini T. The poiyamines spermine and spermidine protect proteins from structural and functional damage by AGE precursors; a new role for old molecules? Life Sci 2003; 72(23):2603–2616. [ Links ]
68. Jaspan JB, Towie VL, Maselli R, Herokl K. Clinical studies with an aldose reductase inhibitor in the automatic and somatic neuropathies of diabetes. Metabolism 1986–135:83–92. [ Links ]
69. Foppiano M, Lombardo G. Worldwide pharmacovigilance systems and tolrestat withdrawal. Lancet 1997; 349:399–400. [ Links ]
70. Davids J, editor: Pfizer suspends zenarestat. Scrip 2000; 2584:24 (October 18 th). [ Links ]
71. Nigishi H, Toyota T, Sakamoto N. Clinical efficacy of fidarestat, a novel aldose reductase inhibitor, for diabetic peripheral neuropathy. Diabetes Care 2001; 24: 1776–1782. [ Links ]
72. Wendt TM, Tanji N, Guo J, Kislinger TR, Qu W, Lu Y, Bucciarefli LG, Rong LL, Mosher B, Markowitz GS, Stein G, Bierhaus A, Liliensiek B, Arnold B, Naeroth PP, Stem DM, D'Agati VD, Schmidt AM. RAGE drives the development of glomerulosclerosis and implicates podocyte actuation in the pathogenesis of diabetic nephropathy. Am J Pathol 2003; 162(4):1123–1137. [ Links ]














