Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.3 Ciudad de México may./jun. 2004
Artículos originales
Asociación del alelo HLA–DQB1*0501 del complejo mayor de histocompatibilidad con cáncer gástrico en México
Association of the HLA–DQB*0501, Allele of the major Histocompability Complex with Gastric Cancer in Mexico
Roberto Herrera–Goepfert,* Joaquín Zúñiga,** Angélica Hernández–Guerrero,*** Tatiana Rodríguez–Reyna,** Norma Osnalla,** Jorge Ruíz–Morales,** Gilberto Vargas–Alarcón,**** Jesús K. Yamamoto–Furusho,** Alejandro Mohar– Betancourt,***** Rogelio Hernández–Pando,****** Julio Granados**
* Departamento de Patología, Instituto Nacional de Cancerología.
** Departamento de Inmunología y Reumatología, Instituto Nacional de Ciencias Médicas y de la Nutrición, Salvador Zubirán
*** Departamento de Endoscopía, Instituto Nacional de Cancerología.
**** Sección de Biología Celular, Departamento de Fisiología, Instituto Nacional de Cardiología, Ignacio Chávez.
***** Dirección de Investigación, Instituto Nacional de Cardiología e Instituto de Investigaciones Biomédicas, UNAM.
****** Sección de Patología Experimental, Departamento de Patología, Instituto Nacional de Ciencias Médicas y de la Nutrición, Salvador Zubirán.
Correspondencia y solicitud de sobretiros:
Dr. Roberto Herrera Goepfert,
Departamento de Patología,
Instituto Nacional de Cancerología
Av. San Fernando #22 Col. Sección XVI, Tlalpan
México, D.F.,C.P. 14080
Teléfono: 5628–0466 Fax: 5573–4662
e–mail: rhgoepfert@yahoo.com.mx
Recepción versión modificada: 23 de julio de 2003
Aceptación: 25 de julio de 2003
Resumen
El cáncer gástrico está relacionado con factor es ambientales y propios del huésped. La infección por Helicobacter pylori es un factor ambiental preponderante y se ha propuesto además que, algunos genes del complejo mayor de histocompatibilidad confieren susceptibilidad o resistencia para las enfermedades gástricas relacionadas con dicha infección.
Con el propósito de conocer la distribución y frecuencia de algunos genes HLA–DQ del complejo mayor de histocompatibilidad en sujetos mexicanos con enfermedades gástricas, se estudiaron 20 pacientes con cáncer gástrico y 40 pacientes con gastritis crónica asociada con Helicobacter pylori. Los diagnósticos fueron confirmados con biopsias. Se utilizaron para fines comparativos, 99 individuos sanos. La genotipificación de los alelos HLA se realizó mediante la técnica de reacción en cadena de la polimerasa.
Los pacientes con cáncer gástrico tuvieron mayor frecuencia de los alelos HLA–DQA1 *0601 (p = 0.003; RM = 20.9; LC 95% = 2.11–506.2) y HLA DQB 1*0501, éste último en comparación a los pacientes con gastritis crónica (p =0.04; RM = 3.58; LC 95 % = 1.05–12.5) e individuos sanos (p = 0.002; RM = 4.5; LC 95% = 1.59–12.7).
En conclusión, nuestros resultados sugieren que además de la infección por Helicobacter pylori, hay marcadores de la región HLA–DQ que son determinantes inmunogenéticamente en la susceptibilidad para desarrollar cáncer gástrico.
Palabras clave: HLA, HLA–DQ5, adenocarcinomagástrico, gastritis, Helicobacter pylori.
Summary
Etiology of gastric cancer is related to environmental and host factors, Helicobacter pylori infection is the main environmental factor, but it has been also proposed that some major histocompatibility complex genes are related to susceptibility and resistance to develop Helicobacter pylori–as so dated gastric diseases.
The aim of this study was to study distribution and frequency of some HLA–DQ genes, among Mexican patients harboring gastric diseases. We studied 20 subjects suffering from gastric cancer and 40 subjects harboring Helicobacter pylori–associated chronic gastritis. Diagnosis was confirmed by biopsy. HLA genotyping was performed by a polymerase chain reaction procedure. Ninety nine healthy individuals were also utilized for comparative purposes.
Patients with gastric cancer displayed high frequency of HLA–DQA 1 *0601 (p = 0.003; OR = 20.9, 95% CL = 2.11–506.2) and HLA–DQB 1*0501 alleles, the latter when compared to patients with chronic gastritis (p = 0.04; OR = 3.58, 95% CL = 1.05–12.5) and to healthy individuals (p = 0.002; OR = 4.5, 95% CL =1.59–12.7).
According to our results, in addition to Helicobacter pylori infection, there are immunogeneic markers of the HLA–DQ region, which are determinant in confering susceptibility for gastric cancer.
Keywords: HLA, HLA–DQ5, gastric adenocarcinoma, gastritis, Helicobacter pylori.
Introducción
El cáncer gástrico está relacionado con diversos factores entre los que sobresale la infección por Helicobacter pylori (H. pylori).1 También, la susceptibilidad inherente a cada individuo en términos de calidad en la respuesta inmune, tiene un papel determinante en la carcinogénesis gástrica. Entre los factores genéticos de riesgo para la infección por H.pyloriy el cáncergástrico se han descrito entre otros, algunos genes del complejo mayor de histocompatibilidad (CMH).2
En las poblaciones japonesa y caucásica se han relacionado algunas moléculas del CMH con la infección por H. pylori. El alelo HLA (Human Leukocyte Antigen) DQAT0102 tiene frecuencia baja en pacientes con infección por H. pylori y gastritis atrófica, comparado con pacientes que tienen gastritis superficial, así como controles normales.3 Este hallazgo parece indicar que dicho alelo puede contribuir a la resistencia para la gastritis atrófica asociada con H. pylori y como consecuencia, al carcinoma gástrico. Su ausencia podría considerarse como un factor de riesgo genético específico para estas enfermedades. Así mismo, el alelo HLA–DQBT0401 se ha encontrado como marcador de susceptibilidad para gastritis atrófica.4
Por otro lado, hay estudios que han demostrado asociación entre el adenocarcinoma gástrico y el alelo HLA–DQB1 *0301, aún en ausencia de la infección por H. pylori.5 Sin embargo, el alelo HLA–DQB1 *0301 también está involucrado con cáncer cérvico–uterino, linfoma–leucemia HTLV–1 y melanoma.6–10 El alelo HLA–DQB1 *0301 es relativamente común en la población mexicana y está asociado con HLA–DRB1 *1402, *1101 y *1305 (Vargas–Alarcón G, comunicación personal). Aún más, en un estudio realizado en Taiwan el alelo HLA–DQBT0301 tuvo por el contrario, efecto protector.11 En este mismo estudio, los autores encontraron asociación entre el alelo HLA–DQB1 *0602 y cáncer de la porción proximal del estómago, predominantemente en hombres.11 Finalmente, otros autores no han encontrado relación alguna entre alelos HLA de las regiones DQA y DQB y cáncer gástrico con infección por H. pylori.12
El propósito de este estudio es investigar en un grupo de pacientes mexicanos con cáncer gástrico y gastritis crónica, la distribución y frecuencia de algunos genes HLA del CMH.
Pacientes y Métodos
Pacientes. Se incluyeron en forma consecutiva, pacientes que acudían al Instituto Nacional de Cancerología por presentar sintomatología gástrica y quienes por interrogatorio dirigido, negaron la ingestión de medicamento alguno en el transcurso del mes previo a la consulta médica. Se les practicó estudio endoscópico y se obtuvieron biopsias de la mucosa gástrica que fueron procesadas de manera convencional. La clasificación histológica de la gastritis se realizó con los criterios propuestos por el Sistema Actualizado de Sydney13 y la de los carcinomas, de acuerdo con Lauren.14 Se colectaron además en tubos que contenían anticoagulante EDTA, 5ml de sangre fresca. Se excluyeron los sujetos en los que el procedimiento endoscópico no fue satisfactorio y aquellos que rechazaron la venopunción. Finalmente, se eliminaron los pacientes cuyas biopsias o muestras de sangre fueron inadecuadas o insuficientes. El estudio se llevó a cabo de acuerdo con los lineamientos de la Declaración de Helsinki y fue aprobado por los Comités de Ética e Investigación de la Institución. Se solicitó también, el consentimiento informado de cada uno de los pacientes.
Con fines comparativos, se utilizó un grupo control de 99 individuos sanos, sin evidencia clínica de gastritis crónica, enfermedad ácido–péptica, cáncer gástrico, y/o historia personal o familiar de enfermedades autoinmunes.
Métodos. El ácido desoxirribonucleico (ADN) genómico se extrajo de la sangre venosa con técnicas estandarizadas.15,16
Amplificación del ADN genómico. La tipificación de HLA–DQA1 y DQB1 se llevó a cabo mediante el procedimiento de reacción en cadena de la polimerasa (PCR), para lo que se utilizó polimerasa Taq de ADN polymerase (Promega, Madison, Wl, USA) e hibridación con sondas de oligonucleótidos con secuencias especificas (PCR–SSOP). Los iniciadores de lectura utilizados para la amplificación de los genes HLA–DQ fueron DQAAMP–A, DQAAMP–B, DQBAMP–A y DQBAMP–B y se construyeron en un sintetizador automatizado de ADN–SM (Beckman, Palo Alto, Ca. USA), de acuerdo con la información referida en el 12° Taller Internacional de Histocompatibilidad.
Hibridación en punto–mancha. El 5% del ADN amplificado fue desnaturalizado en hidróxido de sodio al 0.4 mol/L durante 10 minutos, neutralizado en acetato de amonio al 1 mol/L y transferido a una membrana Hybond–N (Amersham, Amersham, Bucks, Reino Unido). Los filtros fueron pre–hibridados a 42°C por 30 minutos en una solución que contenía 6X SSPE (30X SSPE: NaCI al 4.5 mol/L, NaH2PO4 al 0.3 mol/L, EDTA 30 mmol/L, pH = 7.4), 5X de solución Denhard (albúmina de suero bovino al 2%, polivinilpirrolidona 40 al 2%, Ficoll 400 al 2%), laurel–sarcosino al 0.1 % y SDS al 0.02%. Posteriormente, las sondas de oligonucleótidos marcadas con digoxigenina di–desoxi–uridin–trifosfato (Dig–11 –ddUTP) fueron añadidas e hibridadas a 42°C por 3 horas. Los filtros fueron lavados dos veces en SSPE 2X, SDS al 0.1% a temperatura ambiente por 10 minutos, una vez en solución TMAC (Tris–HCI al 50 mmol/L, pH = 8.0, cloruro de tetrametilamonio 3 mol/L, EDTA2 mmol/l, SDS al 0.1 %) también a temperatura ambiente por 10 minutos, y dos veces a 60°C por 10 minutos. Los puntos fueron revelados utilizando el juego de reactivos para la detección de ácidos nucleicos Dig (Boehringer Mannheim Biochemical, Mannheim, Alemania).
Sondas de oligonucleótidos. La información de las secuencias y especificidades de los oligonucleótidos DQA1 y DQB1 proviene del 12° Taller Internacional de Histocompatibilidad (París, Francia, 1996). La construcción de oligonucleótidos fue hecha utilizando la técnica de cianoetil fosforamidita en un sintetizador automatizado Beckman de ADN–SM, de acuerdo con las recomendaciones del proveedor.
Análisis estadístico. Las diferencias entre las proporciones fueron evaluadas con la prueba ji–cuadrada de Mantel–Haenszel que combina tablas de contingencia de 2 x 2, contenida en el programa estadístico EPIINFO. Si el número en cualquier celdilla era menor de 5, se aplicó entonces, la prueba exacta de Fisher. Los valores de p iguales o menores que 0.05 se consideraron estadísticamente significativos. Se utilizó además, la razón de momios (RM) con intervalos de confianza del 95% (IC 95%), para estimar riesgos.
Resultados
Se analizaron las biopsias gástricas y se tipificaron los loci DQA1 y DQB1 en 20 pacientes con cáncer gástrico y 40 individuos con gastritis crónica.
Características clínicas. En el grupo de cáncer gástrico, ocho eran del género femenino con edad promedio de 53 años (28–76) y 12 del género masculino, con edad promedio de 63 años (38–78). Dieciocho casos fueron adenocarcinomas, 12 de tipodifuso y seis de tipo intestinal; un caso más fue linfoma primario de tipo MALT y el último correspondió a un leiomiosarcoma primario del cuerpo gástrico. De los individuos con gastritis crónica, 28 eran del género femenino con edad promedio de 54 años (25–87) y 12 del género masculino, con edad promedio de 63 años (36–85). Histológicamente, se demostró en todos los casos de gastritis, actividad en grados variables, así como la presencia de microorganismos en las fovéolas, que morfológicamente correspondían a H. pylori. Tipificación del HLA–DQA1 y DQB1. Se obsevó una frecuencia significativamente aumentada del alelo HLA–DQA1 *0601 en el grupo de pacientes con cáncer gástrico (p= –0.003; RR= 20.9; IC 95% = 2.11 –506.2) (Cuadro I). El cuadro II muestra la distribución del locus HLA–DQB1 en pacientes con cáncer gástrico, gastritis crónica en individuos sanos. El alelo HLA–DQB1*0501 no tuvo aumento significativo en el grupo de pacientes con gastritis crónica asociada con Heilcobacter pylori, en comparación con los individuos sanos.
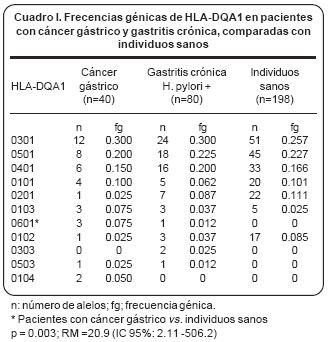

De manera muy interesante, el alelo HLA–DQB1 *0501 se encontró aumentado en el grupo de cáncer gástrico, en comparación tanto con el grupo de los pacientes con gastritis crónica (p= 0.04; RR 3.58; IC 95% = 1.05–12.5) como con el de los individuos sanos (p= 0.002; RR= 4.5; IC 95% =1.59–12.7), (Cuadro II). El análisis de haplotipo no mostró diferencias significativas (datos no mostrados).
Discusión
En este estudio se observó un incremento notable en la frecuencia génica de los alelos HLA–DQAT0601 y DQBT0501, en los pacientes con cáncer gástrico. Sin embargo, la asociación entre cáncer gástrico y el alelo HLA–DQA1 *0601 debe interpretarse con cautela, porque el número de alelos es pequeño y el intervalo de confianza 95% es muy amplio.
De manera sobresaliente, se observó una frecuencia elevada del alelo HLA–DQBT0501 en pacientes con cáncer gástrico. Este hallazgo sugiere fuertemente que el HLA–DQB1 *0501 es un alelo relevante en la susceptibilidad de la población mexicana para desarrollar cáncer gástrico. En otros grupos étnicos, el adenocarcinoma gástrico está asociado con el alelo HLA–DQB1*0301;5sin embargo, este alelo también se ha relacionado con otras neoplasias malignas, incluido el carcinoma cérvico–uterino.5–7 Aún más, la asociación del alelo HLA–DQBT0501 con cáncer gástrico parece ser independiente de la infección por H. pylori a pesar de que el adenocarcinoma y el linfoma gástricos primarios se han relacionado estrechamente con H. pylori,1,17,18dicho alelo no resultó frecuente en el grupo de pacientes con gastritis crónica asociada con H. pylori.
Varios estudios han establecido la correlación entre los alelos HLA–DQ y enfermedades gástricas asociadas con H. pylori.3–5,19 En pacientes con infección por H. pylori y úlceras duodenal y gástrica, el alelo HLA–DQAT0301 puede contribuir a la susceptibilidad para adquirir la infección, en contraste con el alelo HLA–DQA1 *0102 que parece tener un efecto protector.19,20 En nuestro estudio, no encontramos asociación alguna que sugiera resistencia a la infección o al cáncer, probablemente, por el tamaño pequeño de la muestra analizada.
Nuestros hallazgos sugieren que el alelo HLA–DQB1 *0501 es un marcador genético específico para cáncer gástrico y sustenta la hipótesis de que el alelo HLA–DQBT0301, no contribuye de forma especial a la susceptibilidad para desarrollar cáncer gástrico en pacientes mexicanos; aún más, el HLA–DQBT0301 es un alelo común en la población mexicana sana. Estas diferencias entre grupos raciales, podrían reflejar mecanismos distintos de la misma asociación patogénica.
Se han propuesto al menos dos mecanismos para explicar la asociación entre el alelo HLA–DQB1 *0301 y el adenocarcinoma gástrico en la población caucásica: 1) desequilibrio genético (de eslabonamiento o enlace) y 2) alteraciones en el reconocimiento de la presentación de antígenos. De cualquier manera, el mecanismo fisiopatológico parece ser independiente de la infección por H. pylori. Con respecto a nuestros resultados, no puede soslayarse la posibilidad cíe la participación de un locus HLA–DQ vecino aún no caracterizado, en la secuencia de cambios inducidos durante la infección por H. pylori.
Por otro lado, algunos de los mecanismos patogénicos que desencadenan gastritis crónica, atrofia, metaplasia intestinal, displasia y adenocarcinoma gástrico, implican directamente a las moléculas clase II del CMH como receptores que pueden iniciar la señal para que las células epiteliales gástricas presenten apoptosis; la muerte celular programada en este caso, puede deberse también al aumento en la producción de interferón–gamma por linfocitos Th1, en presencia de infección por cepas H. pylori cagA–positivas.21 Estos cambios podrían explicar la interacción necesaria entre H. pyloriy la respuesta del huésped, en la aparición y el desarrollo de las enfermedades gástricas. Sin embargo, el papel de la apoptosis y la hiperplasia de la mucosa gástrica no está completamente entendido. Algunos autores proponen que H. pylori induce apoptosis por inhibición de la progresión del ciclo celular de G1 a S, lo que da como resultado la hiperproliferación compensatoria de las células epiteliales.22 Otros apoyan la participación directa del microorganismo en la proliferación celular;23 además de estos mecanismos, la respuesta del huésped aumenta la expresión de receptores para H. pylori en las células epiteliales y como consecuencia, los linfocitos B locales producen auto–anticuerpos con la formación de complejos antígeno–anticuerpo y la activación del complemento. Entre los receptores para H. pylori se cuentan también, moléculas clase II del CMH.21
Recientemente, se ha sugerido que los cambios inducidos a largo plazo por H. pylori en la mucosa gástrica –folículos linfoides, atrofia, metaplasia intestinal y eosinofila local– constituyen el terreno propicio para que se desarrollen tanto adenocarcinomas como linfomas primarios.24 Sin embargo, 5% o menos de los pacientes infectados desarrolla en el término de 10 años, una neoplasia gástrica maligna.1 Esto implica que además de la infección por H. pylori, se requiere de la participación de cofactores que predispongan al desarrollo de cáncer y en este caso, el alelo HLA–DQBT0501 podría ser un candidato ideal, en la población mexicana.
En conclusión, nuestros resultados sugieren que además de otros factores involucrados en el mecanismo de transformación neoplásica en la mucosa gástrica, hay marcadores de la región HLA–DQen la población mexicana, que son factores inmunogenéticos determinantes en la susceptibilidad para desarrollar cáncer gástrico.
Referencias
1. Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido Taniyama K, Sasaki N, Schlemper RJ. Hellcobacter Pylori infection and development of gastric cancer. N Engl J Med 2001; 345:784–789. [ Links ]
2. González CA, Sala N, Capellá G. Genetic susceptibility and gastric cancer risk. Int J Cancer 2002; 100:249–260. [ Links ]
3. Azuma T, Ito S, Sato F, Yamazaki Y, Miyaji H, Ito Y, Suto H, Kuriyama M, Kato T, Kohli Y. The role of the HLA–DQA1 gene in resistance to atrophic gastritis and gastric adenocarcinoma induced by Helicobacter pylori infection. Cancer 1998; 15:1013–1018. [ Links ]
4. Sakai T, Aoyama N, Satonaka K, Shigeta S, Yoshida H, Shinoda Y, Shirasaka D, Miyamoto M, Nose Y, Kasuga M. HLA–DQB1 locus and the development of atrophic gastritis with Helicobacter pylori infection. J Gastroenterol. 1999; 34(Suppl 11):24–27. [ Links ]
5. Lee JE, Lowi AM, Thompson WA, Lu M, Loflin PT, Skibber JM, Evans DB, Curley SA, Marisfield PF, Revielle JD. Association of gastric adenocarcinoma with the class II gene DQB1*0301 Gastroenterology 1996; 111:426–432. [ Links ]
6. Wank R, Thomssen C. High risk of squamous cell carcinoma of the cervix for women with HLA–DQw3. Nature 1991; 352:723–725. [ Links ]
7. Wank R, Schendel DJ. HLA antigens and cervical carcinoma (lett). Nature 1992; 356:22–23. [ Links ]
8. Helland A, Borresen AL, Kaern J, Ronningen KS, Thorsby E. HLA antigens and cervical cancer (lett). Nature 1992 356:23. [ Links ]
9. Uno H, Kawano K, Matsuoka H, Tsuda K. HLA and adult T cell leukaemia: HLA–, linked genes controlling susceptibility to human T cell leukemia virus type I. Clin Exp Immunol 1988; 71:211–216. [ Links ]
10. Lee JE, Revielle JD, RossMI, Platsoucas CD. HLA–DQB1*0301 association with increased cutaneous melanoma risk. Int J Cancer 1994; 59:510–513. [ Links ]
11. Wu MS, Hsieh RP, Huang SP, Chang YT, Lin MT, Chang MC, Shun CT, Sheu JC, Lin JT. Association of HLA–DQB1(*)0301 and HLA–DQB1(*)0602 with Different Subtypes of Gastric Cancer in Taiwan Jpn J Cancer Res 2002: 93:404–410. [ Links ]
12. Perri F, Piepoli A, Quitadamo M, Quarticelli M, Merla A, Bisceglia M. HLA–DQA1 and –DQB1 genes and Helicobacter pylori infection in Italian patients with gastric adenocarcinoma. Tissue Antigens 2002; 59:55–57. [ Links ]
13. Dixon MF, Genta RM, Yardley JH, Pelayo C, and the Participants in the International Workshop on the Histopathology of Gastritis, Houston 1994. Classification and Grading of Gastritis. The Updated Sydney System. Am J Surg Pathol 1996; 20:1161–1181. [ Links ]
14. Lauren P. The two histological main types of gastric carcinoma: diffuse and so–called intestinal type carcinoma. Acta Pathol Microbiol Scand 1965; 64:31–49. [ Links ]
15. Davis RW, Thomas M, Cameron J, St John TP, Padgett RA. Rapid DNA isolation for enzymatic and hybridization analysis. Methods Enzymol 1980: 65:404–411. [ Links ]
16. Miller SA, Dykes KK, Plesky HF. A single salting out procedure for extracting DNA from human nucleated cell. Nucleic Acids Res 1988; 16:1215. [ Links ]
17. The Eurogast Study Group. An international association between Helicobacter pylori infection and gastric cancer. Lancet 1993; 341:1359–1362. [ Links ]
18. Wotherspoon AC, Ortiz–Hidalgo C, Falson MR, Isaacson PG. Helicobacter pylori associated gastritis and primary B–cell gastric lymphoma. Lancet 1991; 338; 1175–1176. [ Links ]
19. Azuma T, Konishi J, Tanaka Y, Hirai M, Ito S, Kato T, Kohli Y. Contribution of HLA–DQA gene to host's response against Helicobacter pylori (letter). Lancet 1994; 343:542–543. [ Links ]
20. MC. Connell RB. Peptic ulcer: early genetic evidence families Twins, and markers In: Rotter Jl, Samloff M, Rimoin DL. The genetics and heterogeneity of common gastrointestinal disorders. New York: Academic, 1980: 31–41. [ Links ]
21. Fan X, Crowe SE, Behar S, Gunasena H, Ye G, Haeberle H, Van Houten N, Gourley WK, Ernst PB, Reyes VE. The effect of class II major histocompatibiltty complex expression on adherence of Helicobacter pylori and induction of apoptosis in gastric epithelial cells: a mechanism for T helper cell type 1–mediated damage. J Exp Med 1998; 18:1659–69. [ Links ]
22. Shirin H, Sordillo EM, Oh SH, Yamamoto H, Delohery T, Weinstein IB, Moss SF. Helicobacter pylori inhibits the G1 to S transition in AGS gastric epithelial cells. Cancer Res 1999; 59:2277–2281. [ Links ]
23. Guindi M. Role of Helicobacter pylori in the pathogenesis of gastric carcinoma and progression of lymphoid nodules to lymphoma. Can J Gastroenterol 1999; 13:224–227. [ Links ]
24. Herrera–Goepfert R, Arista–Nasr J, de Alba–Campornanes A Pathologic features of the gastric mucosa adjacent to primary MALT–lymphomas. J Clin Gastroenterol 1999; 29:266–269. [ Links ]














