Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta médica de México
On-line version ISSN 2696-1288Print version ISSN 0016-3813
Gac. Méd. Méx vol.140 n.2 Ciudad de México Mar./Apr. 2004
Ejercicio clínico patológico
Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán"
Coordinador:
Dr. Manuel de la Llata Romero
Colaboradores:
Dr. Juan Urrusti Sanz
Dr. Jesús Aguirre García
Dr. Roberto Sánchez Ramírez
Hombre de 75 años de edad con disfagia,
debilidad generalizada y dermatosis
Alberto Rubio Tapia*, Sagrario Trinidad Hernández**, Luis Uscanga Domínguez***
*Departamento de Gastroenterología.
**Departamento de Anatomía Patológica.
***Dirección de Enseñanza, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Correspondencia y solicitud de sobretiros: Dr. Alberto Rubio Tapia. Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", Vasco Quiroga 15, Tlalpan 14000, México, D.F. e-mail: betortmd@hotmail.com
Resumen del caso
Hombre de 75 años de edad, originario de Veracruz, casado, campesino. Sin antecedentes relevantes.
Inició su padecimiento cinco meses antes del ingreso al Instituto con edema palpebral y eritema violáceo en párpados superiores; eritema máculo-papular en frente, cuello, hombros, tórax superior y en superficie extensora de antebrazos. Dos meses después se agregó dificultad para iniciar deglución, sialorrea, regurgitación faringonasal y tos postprandial. Un mes previo al ingreso presentó debilidad muscular progresiva, simétrica, proximal, con dificultad para levantarse de la posición sentada, subir escaleras y elevar los brazos arriba de la cabeza. Dos semanas después, la debilidad empeoró e incluso requirió asistencia para caminar. Al interrogatorio intencionado refirió pérdida ponderal de 10 Kg en seis meses. A la exploración física: temperatura 37.2°C, pulso 88, frecuencia respiratoria 20 y presión arterial 130/70 mmHg. Presentaba edema palpebral y rash en heliotropo, además del signo del chal . El ritmo cardiaco era regular y no se identificó soplo alguno. La exploración abdominal resultó normal. No se identificó edema periférico ni signo de Gottron. El tacto rectal no mostró alteraciones, la prueba de guayaco fue negativa. Se detectó debilidad proximal en extremidades superiores e inferiores (fuerza,2/5); la fuerza distal era normal. Los reflejos de estiramiento muscular estaban presentes. La sensibilidad, las pruebas cerebelosas y los pares craneales se encontraron normales.
Estudios realizados
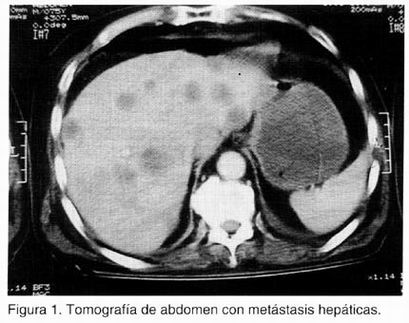
Se realizaron exámenes de laboratorio (Cuadro I). El electromiograma reveló complejos de corta duración, baja amplitud y polifásicos en potenciales de acción durante actividad y fasciculación con ondas de lesión durante el reposo. La TAC mostró evidencia de enfermedad metastásica hepática (Figura 1). Se realizó panendoscopia que mostró una lesión gástrica infiltrativaulcerada (Bormann tipo 3). El diagnóstico histopatológico fue de carcinoma gástrico de tipo adenoescamoso.
Comentario clínico
La dificultad para iniciar la deglución, la sialorrea, la tos postprandial y el reflujo faringonasal, son síntomas típicos de disfagia orofaríngea. Este tipo de disfagia implica la incapacidad para la transferencia del bolo alimenticio de la boca al esófago superior. Puede deberse a un trastorno en la fase preparatoria, oral, faríngea o esofágica del acto de la deglución. Las causas son numerosas, entre las más frecuentes tenemos: disfunción del esfínter esofágico superior, lesiones estructurales (inflamatorias, neoplásicas, compresión extrínseca) y enfermedades neuromusculares.
La disfagia orofaríngea puede ser la manifestación inicial de estas patologías o presentarse como parte de un complejo sintomático sistémico. 1 La presencia de debilidad muscular proximal simétrica y la elevación de las enzimas musculares es característica de las miopatías inflamatorias, que son un grupo de enfermedades que se originan por la inflamación no supurativa del músculo esquelético, y que son causa bien conocida de disfagia orofaríngea por afección del músculo estriado esofágico o de los músculos faríngeos necesarios para la deglución 2 El diagnóstico diferencial incluye miastenia gravis y síndrome de Eaton-Lambert, padecimientos que no se acompañan de elevación de enzimas musculares debido a que la alteración se encuentra en la placa neuromuscular y no son procesos inflamatorios musculares primarios; la ausencia de afección de los músculos extraoculares es un signo clínico de gran importancia para descartar miastenia, ya que esta enfermedad se caracteriza por involucro ocular temprano. Otras enfermedades que deben descartarse son las miopatías no inflamatorias y las enfermedades neurodegenerativas. La electromiografía es invaluable para diferenciar los procesos miopáticos de los neuropáticos. El estudio electromiográfico apoya el diagnóstico de miositis si se demuestra un patrón miopático caracterizado por complejos de corta duración, polifásicos, de baja amplitud, incremento de potenciales de inserción, ondas de lesión y fasciculación. Una vez corroborado el diagnóstico de miopatía inflamatoria, es indispensable definir el tipo específico de enfermedad: polimiositis, dermatomiositis, miositis con cuerpos de inclusión y otros procesos inflamatorios primarios de músculo poco frecuentes. La miositis con cuerpos de inclusión generalmente es asimétrica y provoca debilidad distal. Es necesaria la realización de biopsia muscular, ya que es diagnóstica con la demostración histológica de los característicos cuerpos de inclusión. Este tipo de miopatía no se asocia con otras enfermedades de la colágena ni con neoplasias malignas. La presencia en este paciente de daño cutáneo con lesiones típicas, como son el eritema en heliotropo y el signo del chal, son invaluables para el diagnóstico clínico de dermatomiositis. Esta enfermedad es de etiología autoinmune y se caracteriza por la presencia de auto-anticuerpos, los más frecuentes son los anticuerpos antinucleares (ANAs) y el factor reumatoide. Otros auto-anticuerpos menos frecuentes tienen utilidad en casos específicos, como los anticuerpos anti-Jo1 que se encuentran positivos en el síndrome antisintetasa (miositis, fenómeno de Raynaud, manos de mecánico y daño pulmonar). En este caso se encontró positividad exclusivamente para ANAs. Debido a que estos padecimientos son infrecuentes, es importante reconocer las principales manifestaciones clínicas para complementar el estudio de estos enfermos con exámenes de laboratorio y gabinete adecuados para establecer el diagnóstico correcto e iniciar el tratamiento específico; con esta finalidad se han establecido criterios diagnósticos, los más utilizados son los descritos por Bohan y Peter: 3
1) Debilidad muscular proximal.
2) Incremento en niveles séricos de enzimas musculares (principalmente CPK-creatininfosfocinasa).
3) Presencia de lesiones cutáneas típicas como son: rash en heliotropo, pápulas de Gottron, eritema malar, poiquilodermia en áreas expuestas al sol, y cambios periungueales-cuticulares.
4) Hallazgos electromiográficos típicos (potenciales de acción de baja amplitud, polifásicos, de corta duración; fibrilación, incremento en potenciales de inserción y descargas espontáneas de alta frecuencia)
5) Hallazgos en biopsia muscular que demuestren lesión inflamatoria y degenerativa.
El diagnóstico de polimiositis se basa en la presencia de los criterios uno, dos, cuatro y cinco, y el diagnóstico de dermatomiositis requiere de los cinco criterios mencionados.
Los pacientes con miositis tienen un riesgo incrementado de tener o desarrollar neoplasias malignas, principalmente los pacientes con dermatomiositis. Esta asociación es reconocida como un síndrome paraneoplásico. Los cánceres vistos en pacientes con dermatomiositis reflejan los encontrados en la población general de la misma edad que los pacientes al momento del diagnóstico, excepto por la elevada frecuencia de cáncer de ovario. 4 La presencia de velocidad de sedimentación globular por arriba de 35 mm/hr se asocia significativamente con el desarrollo o presencia de tumor maligno. 5 La experiencia sugiere que los clínicos deben realizar una búsqueda minuciosa para detectar cáncer oculto en pacientes con dermatomiositis, principalmente en los que la enfermedad se diagnostica después de los 60 años. El reto para los médicos es la detección temprana del cáncer, cuando las posibilidades de tratamiento curativo son mayores. Los tumores frecuentemente asociados con miopatias primarias son: ováricos, broncogénicos, de mama, gastrointestinales y enfermedades mieloproliferativas. En el caso que presentamos se encontró enfermedad metastásica en hígado. El hígado es el blanco más frecuente en la diseminación tumoral a distancia, debido a que recibe doble circulación sanguínea (vena porta y arteria hepática) y a la presencia de fenestraciones en los sinusoides que facilitan la penetración de las células malignas al parénquima hepático. Las metástasis hepáticas se originan frecuentemente en sitios primarios del sistema portal (tumores del tracto gastrointestinal), broncogénicos y cáncer de mama. Sin embargo, se ha descrito amplia variedad de sitios primarios y el involucro hepático ocurre en 40% de las neoplasias malignas. En pacientes con metástasis hepáticas, el siguiente paso es determinar el origen primario del tumor, ya que el pronóstico y el tratamiento son diferentes, dependiendo del sitio y estirpe histológica del mismo. En este paciente se encontró un carcinoma adenoescamoso gástrico como lesión primaria, con lo que se estableció el diagnóstico definitivo de dermatomiositis paraneoplásica. El tratamiento de elección en pacientes con dermatomiositis son los corticoesteroides y en casos refractarios se utilizan fármacos inmunosupresores (azatioprina, 6-mercaptopurina o metotrexate). 6 La respuesta inicial es igual en pacientes con dermatomiositis asociada a cáncer y la no asociada a cáncer. Sin embargo, la sobrevida de pacientes con dermatomiositis paraneoplásica fue de sólo 10% a seis años, mientras que en los pacientes con dermatomiositis no asociada a cáncer fue del 73.6% a sies años. 7 En los pacientes en los que la neoplasia puede ser tratada con fines curativos, la miopatía inflamatoria puede controlarse mejor, o incluso desaparecer, y está bien descrita la reaparición de los síntomas cutáneos o musculares acompañando a la recidiva tumoral. En los pacientes con tumores en estadio clínico avanzado, el manejo debe incluir el específico para la neoplasia y el necesario para controlar las manifestaciones de la dermatomiositis. En nuestro paciente el tratamiento incluyó nutrición enteral total, hidrocortisona 100 mg cada seis horas y quimioterapia paliativa (5-FU+etopósido). Una semana después, la debilidad mejoró, los niveles séricos de CPK disminuyeron a 205 U/L y fue dado de alta con manejo a base de prednisona 60 mg al día, teniendo adecuada tolerancia a la vía oral. Desafortunadamente, el cáncer se encontró en etapa avanzada con pocas posibilidades de curación.
Comentario anatomopatológico
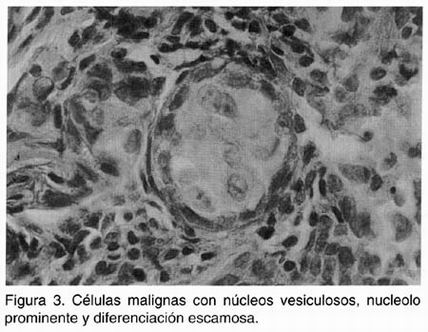
Las biopsias gástricas tomadas para búsqueda del tumor primario mostraron metaplasia intestinal difusa (figura 2) y un tumor gástrico maligno de tipo adenoescamoso (Figura 3). Este tipo de tumor del estómago es muy raro y su incidencia es menor al 1% entre los tumores malignos de este órgano. 8 La variante histológica más común de tumor maligno gástrico es el adenocarcinoma, que constituye alrededor de 90%. Otros menos frecuentes son el linfoma, responsable del 5% y los tumores estromales, que se observan en 2% de los pacientes. La patogénesis de los tumores gástricos es multifactorial. Se ha postulado que hay una secuencia de cambios premalignos histológicos que implican la progresión de gastritis atrófica a metaplasia intestinal y finalmente al desarrollo de adenocarcinoma, sin embargo, es claro que estos cambios histológicos son necesarios, pero no suficientes, para el desarrollo de neoplasias gástricas malignas. Es interesante, que en este caso se encontró metaplasia intestinal difusa en áreas adyacentes al tumor. Este cambio histológico es considerado lesión premaligna y en poblaciones con alta incidencia de esta anormalidad existe un incremento de 25 veces en el riesgo de adenocarcinoma gástrico, en comparación con poblaciones de baja incidencia. La relación de metaplasia intestinal con el desarrollo de carcinoma adenoescamoso no está definida. La característica histológica fundamental del carcinoma adenoescamoso es la coexistencia de células neoplásicas de adenocarcinoma y de tipo escamoso. El componente glandular del carcinoma adenoescamoso puede ser bien o mal diferenciado. Las características histológicas del componente escamoso son idénticas a los tumores de esta naturaleza vistos en otros órganos (ejemplo esófago, pulmón). No está claro en que células se originan estos cambios. Se considera que puede ser en áreas de metaplasia epidermoide, en epitelio escamoso ectópico o bien en alguna célula madre mucosa no diferenciada. 9 El carcinoma gástrico adenoescamoso usualmente involucra profundamente la capa muscular propia y se caracteriza por invasión vascular temprana. Es por esto que aquellos limitados a la mucosa o submucosa son extremadamente raros, habiéndose comunicado sólo ocho casos en la literatura mundial. 10 Por tanto, no sorprende que en el caso actual se hayan encontrado lesiones metastásicas en el hígado al momento del diagnóstico. El pronóstico de los pacientes con enfermedad avanzada (estadio IV) es malo a corto plazo y las modalidades terapeúticas se limitan al aspecto paliativo.

Referencias
1. American Gastroenterological Association Medical Position Statement on Management of Oropharyngeal Dysphagia. Gastroenterology 1999;116:452-476. [ Links ]
2. Yacici Y, Kagen LJ. Clinical presentation of the idiopathic inflammatory myopathies. Rheum Dis Clin North Am 2002;28:823-32. [ Links ]
3. Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med 1975;292:344-347. [ Links ]
4. Hill CL, Zhang Y, Sigurgeirsson B, et al. Frequency of specific cancer types in dermatomyositis and polymyositis: a population-based study. Lancet 2001;357:96-100. [ Links ]
5. Amerio P, Girardelli CR, Proietto G, et al. Usefulness of erythrocyte sedimentation rate as tumor marker in cancer associated dermatomyositis. Eur J Dermatol 2002;12(2):165-169. [ Links ]
6. Oddis CV. Idiopathic inflammatory myopathy: managment and prognosis. Rheum Dis Clin North Am 2002;28:979-1001. [ Links ]
7. Wakata N, Kirihara T, Saito E, et al. Polymyositis and dermatomyositis associated with malignancy: a 30-year retrospective study. Int J Dermatol 2002;41:729-734. [ Links ]
8. Luk GD. Tumors of the stomach. In: Sleisenger & Fordtran's gastrointestinal and liver disease. 6th ed. Feldman M, Scharschmidt BF, Sleisenger MH, editors. W.B. Saunders Company, 1998. p. 733-57. [ Links ]
9. Ruck P, Wehrmann M, Campbell M, et al. Squamous cell carcinoma of the gastric stump. A case report and review of the literature. Am J Surg Pathol 1989:13:317-324. [ Links ]
10. Yoshida K, Manabe T, Tsunoda T, et al. Early gastric cancer of adenosquamous carcinoma type: report of a case and review of literature. Jpn J Clin Oncol 1996;26(4):252-257. [ Links ]














