Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta médica de México
On-line version ISSN 2696-1288Print version ISSN 0016-3813
Gac. Méd. Méx vol.140 n.2 Ciudad de México Mar./Apr. 2004
Artículo original
Prevención de la encefalopatía hipóxico-isqúemica
mediante Fenobarbital en forma temprana y a dosis alta
Arturo Vargas Origel*, J. Oscar G. Espinosa García**, Esmeralda Muñiz Quezada*, Martín Arturo Vargas Nieto**, Gilberto Aguilar García***
*Unidad de Investigación en Epidemiología Clínica.
**Departamento de Neonatología, Hospital de Gineco-Pediatría, IMSS.
***Laboratorio Clínico, Hospital Aranda de la Parra. León, Gto.
Correspondencia y solicitud de sobretiros: Dr. Arturo Vargas Origel. San Javier 311. Col. La Martinica. 37500, León, Guanajuato, México.
Teléfono (014) 7633276. e-mail: drarturo@todito.com
Recepción versión modificada: 30 de mayo de 2003
Aceptación: 18 de noviembre de 2003
Resumen
Objetivo: evaluar la utilidad del Fenobarbital (Fb), administrado en forma temprana y a dosis alta, en la prevención de la encefa-lopatía hipóxico-isquémica (EHI), secundaria a asfixia perinatal (APN).
Material y métodos: mediante un ensayo clínico al azar, se asignaron a recién nacidos (RN) de término o postérmino con APN, a un grupo experimental (A) o al control (B); a los del primero se le administró Fb a 40 mg/Kg iniciado en la primera hora de edad, y a los del grupo B sólo en caso de crisis convul-sivas, a dosis habitual; el resto del tratamiento fue similar. Se evaluó la frecuencia de EHI, según la clasificación de Sarnat, así como otras complicaciones de la APN. Se midieron los signos vitales en uno y otro grupos y los niveles séricos de Fb en el grupo A. Se utilizaron las pruebas estadísticas de t o de U Mann-Whitney, X 2 cuadrada o probabilidad exacta de Fisher. Se obtuvo consentimiento informado de los padres.
Resultados: fueron 37 RN en el grupo A y 36 en el B, similares en proporción de sexos, edad gestacional y gasometría inicial, el peso fue mayor en el grupo A (p < 0.05). El diagnóstico de APN se hizo por pH < 7.00 y uno o dos de los criterios usados de asfixia, en la mayoría de los neonatos. Hubo diferencia respecto al momento de inicio y la cantidad total del Fb, entre los grupos. La EHI se presentó en 5/37 (13.5%) niños del grupo A y en 8/36 (22.2%) del B; las crisis convulsivas, o estadio II de EHI, se observaron en 4/37 (10.8%) y 4/36 (11.1%), respectivamente, sin diferencia en estas proporciones, ni en la frecuencia de otras complicaciones. La aplicación del Fb no originó efectos adversos en los signos vitales y todos los RN que lo recibieron tuvieron niveles séricos adecuados y sólo uno mostró niveles tóxicos.
Discusión: no hubo diferencia significativa en la frecuencia global de EHI ni en la de convulsiones, o estadio II de EHI, entre los neonatos que recibieron Fb y a los que se no se les aplicó; por lo anterior, y aunque no hubo efectos colaterales, no se recomienda su empleo con este fin. Se plantea la necesidad del seguimiento de estos recién nacidos para valorar los efectos del Fb a largo plazo, ya que pudiera tener efecto favorable sobre el desarrollo psicomotor.
Palabras clave: Asfixia perinatal, neonato, fenobarbital
Summary
Objective: to assess usefulness of high-dose early phenobarbital therapy for prevention of hypoxic-ischemic encephalopathy (HIE) secondary to perinatal asphyxia (PNA).
Material and Methods: by means of a randomized clinical trial, asphyxiated full-term or post-term newborn infants were divided in two groups: Group A was the experimental group, while group B was the control group. Infants in group A received phenobarbital, 40 mg/kg, during the first 60 min after birth. Infants on group B received phenobarbital at conventional doses, only if there was clinical evidence of seizures; otherwise, treatment was similar in both groups. We estimated frequency of HIE according to Sarnat classification and also rate of post-asphyxial complications in other organs. Phenobarbital levels were measured in Group A. Statistical tests used were Student t, Mann-Whitney U, X 2 , or Fisher. Informed consent was obtained from parents of each infant.
Results: 37 infants belonged to Group A, while Group B was composed of 36 infants. Both groups were similar in sex, gestational age and cord gases. Birth weight was higher in Group A (p<0.05). Diagnostic criteria for PNA a cord pH <7.00 plus one or two criteria of commonly used parameters for asphyxia. There was a difference in total dose of phenobarbital and time of initial dose in both groups. HIE was present in 13.5% (5/37) of group A, and 22.2% (8/36) of group B. Seizures (Stage II of HIE) occurred in 10.8% (4/37) and 11.1% (4/36), respectively, without significant statistical difference. There was also no difference in rate of post-asphyxial, non-brain complications in both groups. There were no side effects or changes in vital signs associated with use of phenobarbital. Only one infant had toxic phenobarbital serum levels.
Discussion: there was no significant difference in the overall frequency of HIE, nor in the incidence of seizures or stage II of HIE in both groups. According to these results and even though there were no side effects, we think Phenobarbital is not useful for these purposes. Long-term follow-up of the treated infants is justified, since Phenobarbital might have a beneficial effect on neuro-behavioral development.
Key words: Perinatal asphyxia, infant newborns, phenobarbital
Introducción
La asfixia perinatal (APN) se define como la presencia de hipoxemia, hipercapnia y, fundamentalmente acidosis metabólica al nacer. 1 Este problema conlleva mortalidad neonatal elevada, desde 2.4% hasta 40%, 2-5 la que en experiencia propia es de 22%.4 Puede tener varias complicaciones, dentro de las que destaca la encefalopatía hipóxico-isquémica (EHI), tanto por su mortalidad como por el riesgo de secuelas a largo plazo; esta complicación se presenta, tomando en cuenta sus tres estadios, en 48% a 68.4% de los recién nacidos (RN) asfixiados, en la unidad es de 46%, y de 28% si se toma en cuenta sólo los del estadio II o con crisis convulsivas como manifestación clínica. 4
La EHI es un proceso evolutivo que se inicia desde el período de hipoxia periparto y continúa en la etapa de recuperación, después de la resucitación, debido a la formación de radicales libres derivados de oxígeno y al fenómeno de oxigenación-reperfusión. 1,6 En el sistema nervioso central la APN condiciona falla de la energía celular, acidosis y neurotoxicidad por glutamato y óxido nítrico, formación de radicales libres derivados de oxígeno, acumulación de calcio intracelular e hiperoxidación de lípidos; esto lleva a disrupción de los componentes estructurales de la célula y muerte de la misma por apoptosis. 1,6,7 No hay una terapéutica específica y se discute acerca de la efectividad de los tratamientos preventivos. 1-3,6-11 Así, desde hace 20 años se han estudiado a los barbitúricos como protectores neuronales y se ha sugerido que su administración en la APN, antes o después de la lesión, reduce el daño cerebral secundario; esto parece deberse a una disminución del metabolismo oxidativo y, por tanto, del consumo de oxígeno cerebral, así como descenso más lento de las reservas de energía y reducción importante del glutamato que es un neurotransmisor excitatorio. 1-3,6,8-11
El Fb es el barbitúrico más utilizado en el período neonatal, se considera el tratamiento de elección de las crisis convulsivas neonatales de cualquier origen, incluyendo las debidas a EHI, y tiene mínimos efectos secundarios. 2,3,8-10 Hay controversia en relación a su papel en la prevención de la EHI, con las dosis convencionales aplicadas al niño o incluso a la madre antes de que nazca el producto. 3,8 Un estudio reciente en RN a término con APN grave, demostró que la aplicación del Fb profiláctico a dosis elevadas, 40 mg/Kg, y en forma temprana, se asociaba a un mejor desarrollo neurológico de los niños a los tres años de edad. En la etapa aguda de la EHI, los autores esperaban una disminución de las crisis convulsivas hasta en 50% y aunque rechazaron la hipótesis de trabajo, por sólo encontrar disminución de 27%, ellos mismos señalan que esta disminución puede ser importante y más aún, el efecto a largo plazo. 3
Esta falta de respuesta, tomando en cuenta sólo las crisis convulsivas, quizá se debió a la aplicación relativamente tardía del Fb ya que en promedio se inició a las 5.8 ± 2.9 h de edad. 3 Lo anterior tiene relación con el concepto de ventana terapéutica, el que se define como el intervalo, después de la resucitación de un paciente con hipoxia-isquemia, durante el cual una medida terapéutica puede ser eficaz para reducir la gravedad del daño cerebral. En los organismos adultos, por la lentitud del proceso, este periodo se extiende de horas a días, sin embargo en la etapa neonatal el proceso es muy rápido y no debe prolongarse el inicio de la intervención más de cuatro a seis horas. 1,6,9,10,12
Por lo anterior se decidió evaluar la utilidad del fenobarbital, aplicado en forma aun más temprana y a dosis alta, como tratamiento preventivo de la EHI en los recién nacidos a término con APN, con la hipótesis de que disminuiría en 30% la frecuencia de crisis convulsivas.
Material y métodos
Mediante un ensayo clínico al azar se estudiaron recién nacidos a término o postérmino que padecieran asfixia perinatal. Se consideró de término de las 37 a 42.6 semanas de gestación y postérmino al de 43 semanas o más. La edad gestacional se calculó por la fecha de última menstruación (FUM) o por el método de Capurro. 13 Si la diferencia entre los dos métodos fue de dos semanas o menos, quedó como válida la de la FUM, si resultó mayor se dejó la calculada por Capurro. La APN se definió por alguno de los siguientes puntos: 2,3,5 a) pH de arteria umbilical igual o menor de 7.0, en los primeros 15 minutos de edad, b) exceso de base igual o mayor de -15 mEq/L, c) Apgar de tres o menos a los cinco minutos, d) falla para iniciar la respiración espontánea a los 10 minutos de vida. No se incluyeron niños con alteraciones congénitas mayores, datos de infección congénita, traumatismo craneal obstétrico o depresión neonatal por medicamentos maternos. Se excluyeron a los RN que fallecieron en las primeras 48 horas o los que recibieron bloqueadores neuromusculares.
A los RN se les dividió, mediante números al azar, en grupo experimental (A) o grupo control (B). El primero recibió Fenobarbital a 40 mg/Kg, iniciado en la primera hora de edad, con bomba de infusión, a pasar en una hora, diluido en 10 ml de solución glucosada a 5%. El grupo control no recibió placebo y sólo se le administró Fb, a dosis inicial de 20 mg/Kg, en caso de convulsiones; si persistían, a los 60-120 minutos se administraron dos dosis mas de 10 mg/Kg, hasta un total de 40 mg/Kg. Se utilizó dosis de sostén en caso de crisis convulsivas en los pacientes del grupo experimental, o si éstas recurrían en los del grupo control, a pesar de las dosis iniciales de Fenobarbital administradas.
El resto del tratamiento fue similar para uno y otro grupos e incluyó: a) ayuno mínimo por 24 h, b) soluciones IV a 70 ml/Kg/d para las primeras 24-48 h, c) corrección de acidosis con bicarbonato a criterio del médico tratante, d) uso de antimicrobianos de acuerdo a antecedentes.
Se calificó el grado de EHI de acuerdo a los criterios de Sarnat en tres estadios: El I se definió por estado de conciencia normal o hiperalerta, irritabilidad, taquicardia, pupilas dilatadas, hipertonía e hiperreflexia osteotendinosa (OT); el II por presencia de crisis convulsivas, estupor, bradicardia, miosis, Moro y succión disminuidas; el III por estupor profundo o coma, flacidez, disminución o ausencia de reflejos OT y de Moro, crisis convulsivas, en particular, tipo de descerebración. 13,14 Se descartó hipocalcemia e hipoglucemia como causa de las convulsiones.
Las otras alteraciones de los órganos blanco de la APN se definieron así: a) sistema renal por oliguria, hematuria o retención de azoados; b) respiratorio por alteraciones clínicas, radiológicas o necesidad de oxígeno suplementario, c) cardiovascular por la presencia de hipotensión o cardiomegalia en la radiografía, d) alteraciones metabólicas en las primeras 72 h: hipocalcemia por calcio sérico < 8 mg/dL, hipoglucemia o hiperglucemia por glucosa < 40 mg/dL o > 125 mg/dL, respectivamente y e) aparato digestivo por la aparición de íleo o enterocolitis necrosante. 4,5,13
En el grupo A se midieron los niveles séricos de Fb a las 6, 12, 24, 72 y 120 h después de la dosis inicial, a través de inmunoanálisis enzimático. 15 También se vigilaron, mediante monitoreo electrónico continuo, la frecuencia cardiaca y la respiratoria, la tensión arterial, la saturación de oxígeno y gasometrías seriadas. Se compararon los valores iniciales con los obtenidos a los 30 minutos, una, dos, seis, 12 y 24 horas después de la administración del Fb, o en sus tiempos equivalentes en el grupo control.
El análisis estadístico se hizo con las pruebas de t de Student o de Mann-Withney para diferencia de medias y X 2 o probabilidad exacta de Fisher para diferencia de proporciones, aceptando como significativo una p < 0.05. 16 El tamaño de muestra se calculó tomando en cuenta una frecuencia global de crisis convulsivas de 30% en niños con APN y disminución esperada de 30%, con el tratamiento, un valor alfa de 0.05 (de una cola) y un valor beta de 0.20, lo que resultó en 33 pacientes. 17
Aspectos éticos. El protocolo fue aprobado por el Comité de Investigación del Hospital y se solicitó consentimiento informado de los padres para el ingreso de los neonatos al estudio.
Resultados
En el cuadro I se muestran las características generales de los 73 recién nacidos, de los que se asignaron 37 al grupo experimental (Grupo A) y 36 al control (Grupo B). Los grupos fueron similares en proporción de sexos, edad gestacional, calificación de Apgar a los 5 minutos y valores iniciales de la gasometría de arteria umbilical, de la que el pH del grupo A fue 6.96 ± 0.11 y del B, 6.97 ± 0.10; el peso fue mayor en el grupo experimental, 3.5 ± 0.6 Kg vs. 3.2 ± 0.5 Kg (p < 0.05). La dosis inicial del Fenobarbital en los pacientes del grupo A se aplicó a las 0.88 h en promedio y fue de 40 mg/Kg; del grupo B sólo 5/36 pacientes lo requirieron y se aplicó en promedio a las 9.2 h, a dosis inicial de 26 mg/Kg; con diferencia significativa en el tiempo de aplicación y las dosis inicial y total del barbitúrico (p < 0.001). Se necesitaron dosis adicionales de Fb en 2/37 pacientes del grupo experimental y 3/5 del grupo B; mientras que 1/37 del grupo A y ninguno del B ameritaron dosis de sostén, sin diferencia en estas proporciones. No hubo ninguna defunción en los dos grupos de estudio.
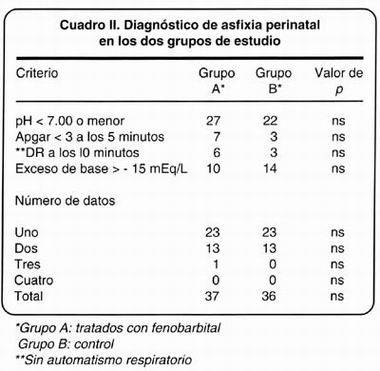
El diagnóstico de APN (Cuadro II) se hizo por pH < 7.00 en 27/37 neonatos del grupo A y en 22/36 del B, mientras que por déficit de base > -15 mEq/L, fueron 10 y 14 niños, respectivamente. De los cuatro datos del criterio diagnóstico de APN, 23 niños de cada grupo tuvieron uno solo, 13 neonatos de cada grupo cubrieron dos datos y no hubo pacientes con los cuatro criterios, sin diferencia significativa en estas proporciones.
En el cuadro III se muestran los datos respecto a EHI la cual se presentó en un total de 5/37 (13.5%) neonatos del primer grupo y en 8/36 (22.2%) del control, con predominio del estadio II de Sarnat (4/37 y 4/36, respectivamente), sin diferencia estadística significativa al comparar su frecuencia global o por estadios. El estado neurológico clínico al egreso fue normal, en 36/37 neonatos del grupo A y en 34/36 controles; el resto presentó anormalidad por hipotonía.

En el cuadro IV se muestra el resto de las complicaciones, que tampoco mostraron diferencia significativa entre los grupos. Ocho pacientes del grupo A y siete del B tuvieron datos de alteración renal, de los que predominó oliguria y retención de azoados. Hubo dificultad respiratoria en 24 pacientes de cada grupo y necesidad de oxígeno suplementario en 33/37 y en 30/36, con un promedio de 72 horas de duración. Del área cardiovascular 2/37 neonatos del grupo A y 4/36 del control tuvieron alteración, cuatro por cardiomegalia en la radiografía, sin disfunción, y dos pacientes con hipotensión.

En la figura 1 se muestra la evolución de los niveles séricos del Fenobarbital del grupo A, cuyas cifras promedio respectivas a las 6, 12, 24, 72 y 120 h fueron, en (µg/mL, 30.9, 30.3, 30.1, 27.7 y 25.8. Todos los RN tuvieron niveles terapéuticos (15-40 < µg/mL) a las seis horas excepto uno que estuvo abajo del límite inferior y también sólo uno presentó niveles superiores a 50 (µg/mL, considerado en margen de toxicidad.

En el cuadro V se muestran los valores de frecuencia cardiaca, respiratoria, tensión arterial media (TAM) y de la gasometría (pH, PaO 2 y PaCO 2 ), al inicio y dos horas después de aplicado el Fb en el grupo experimental y, en tiempos similares, en el grupo control. En ambos hubo aumento significativo, de las frecuencias cardiaca y respiratoria, así como del pH y PaO 2 , y descenso de PaCO 2 , mientras que la TAM se mantuvo sin cambios. De los pacientes a quienes se les aplicó Fenobarbital sólo uno de cada grupo presentó tanto hipotensión como depresión respiratoria, que fueron leves y transitorias.
Discusión
Dado que la frecuencia de convulsiones, o estadio II de EHI, fue de 10.8% en el grupo A y 11.1% en el B, no se pudo demostrar la hipótesis de trabajo que había planteado que la administración temprana del Fenobarbital, a dosis de 40 mg/Kg, disminuiría en 30% su incidencia. Aunque en el grupo A la frecuencia global de EHI fue menor respecto al control, 5/37 (13.5%) contra 8/36 (22.2%), en forma respectiva, esta diferencia tampoco resultó significativa. En la EHI, lo más importante es evitar las crisis convulsivas o estadio II debido a que estos pacientes representan el verdadero problema, tanto en su manejo como en el pronóstico a largo plazo, porque, junto con los del estadio III, pueden mostrar secuelas neurológicas. 3,12,13,18 El no haber podido demostrar diferencia quizá se deba a la frecuencia tan baja de crisis convulsivas en los pacientes de los grupos, de hecho por experiencia publicada y propia se esperaba que fuera alrededor de 30% 3,4 y sobre esta cifra se calculó el tamaño de la muestra. Era de esperarse que tampoco hubiera diferencia en las complicaciones de otro tipo, debido a que el efecto básico del Fb es de protección neuronal. 3,6,9,19,20
Un problema básico en APN es predecir cual de los neonatos asfixiados va a tener manifestaciones de EHI. En fecha reciente Perlman diseñó una escala de riesgo para convulsiones en RN con asfixia que tomó en cuenta el Apgar menor de 6 a los cinco minutos, la necesidad de intubación en la sala de partos y pH umbilical menor de 7; la presencia simultánea estos tres factores dio una sensibilidad de 80% y especificidad de 98% para predecir la aparición posterior de crisis convulsivas. 21 Es probable que fuera mejor un criterio de este tipo para la inclusión de los pacientes al estudio con Fenobarbital y podría plantearse para uno posterior.
En el trabajo previo con Fenobarbital tampoco se mostró diferencia significativa respecto a las convulsiones, aunque su frecuencia resultó 27% menor en el grupo tratado; 3 el hallazgo importante fue que los pacientes que lo recibieron tuvieron un desarrollo psicomotor significativamente mejor a los tres años de edad y los autores especulan que puede ser por el efecto neuroprotector del barbitúrico. Por lo anterior, a los pacientes del estudio actual también se les deberá realizar este seguimiento.
Respecto a la toxicidad del medicamento, fue prácticamente nula y similar en los dos grupos de estudio. Un trabajo reciente, retrospectivo y con dosis menor, encontró una frecuencia de convulsiones significativamente mayor y tendencia a mayor mortalidad en los neonatos que recibieron el fenobarbital. 19 Con los datos del presente estudio y los publicados previamente, 2,3,9,10 de un mejor diseño que el referido, debe aceptarse que la toxicidad del fenobarbital es mínima y que se puede aplicar cuando exista ya la indicación, como tratamiento curativo y no preventivo, como sería la presencia de crisis convulsivas. 1,18,20 Si bien su administración es segura, tanto por efectos clínicos como por niveles séricos, es cuestión de otro diseño saber si, en caso de crisis convulsivas, debe administrarse de inmediato la dosis total del fenobarbital (40 mg/Kg) o la dosis fraccionada como se recomienda hasta ahora. 13
Aunque no era el objetivo del artículo, llama la atención la ausencia de mortalidad en nuestros pacientes y la menor frecuencia de complicaciones, en especial de EHI, respecto a un trabajo previo de la misma unidad. 4 La población parece similar e incluso el criterio de APN fue mas rígido ya que en el presente estudio se pidió un pH igual o menor de 7.00 mientras que en el anterior fue 7.10. Pudo influir el que se usaran, además del pH, otros tres criterios para definir APN como Apgar menor de tres a los cinco minutos, incapacidad para iniciar la respiración a los 10 minutos o exceso de base mayor de -15 mEq/L; sin embargo, aún evaluando sólo los del criterio de APN por pH, la frecuencia de EHI y la mortalidad son menores, lo que puede hablar de una mejor atención de los pacientes que la realizada hace seis años.
Del estudio actual se puede concluir que el uso profiláctico del Fenobarbital, temprano y a dosis elevadas, no disminuye la frecuencia global de la EHI ni de las crisis convulsivas, por lo que no debe usarse con este fin; esto lo apoyaría también los resultados de un metanálisis de los anticonvulsivantes para prevenir morbimortalidad en el RN con asfixia. 20 A las dosis utilizadas, el uso del Fb no tiene riesgos importantes y puede usarse cuando haya una indicación aceptada del mismo. La morbimortalidad por asfixia perinatal en nuestra unidad ha disminuido. Por estudios previos, se considera conveniente el seguimiento de los pacientes con APN tratados con Fenobarbital, para valorar si tienen mejor desarrollo psicomotor.
Referencias
1. Vanucci RC, Perlman JM. Interventions for perinatal hypoxic-ischemic encephalopathy. Pediatrics 1997;100:1004-1014. [ Links ]
2. Ruth V, Virkola D, Paetau R, Raivio K. Early high-dose phenobarbital treatment for prevention of hypoxic-ischemic brain damage in very low birth weight infants. J Pediatr 1988;112:81-816. [ Links ]
3. Hall RT, Hall FK, Daily DK. High-dose phenobarbital therapy in term newborn infants with severe perinatal asphyxia: a randomized, prospective study with three-year follow-up. J Pediatr l998;132:345-348 [ Links ]
4. Aldana VC, Romero MS, Vargas OA, Hernández AJ. Complicaciones agudas en neonatos de término con asfixia perinatal severa. Gin Obstet Mex 1995;63:123-127. [ Links ]
5. Van den Berg PP, Nelen WLDM, Jongsma HW, et al. Neonatal complications in newborns with an umbilical artery pH < 7.00. Am J Obstet Gynecol l996;175: 1152-1157. [ Links ]
6. Hammerman C, Kaplan M. Ischemia and reperfusion injury. The ultimate pathophysiologic paradox. Clin Perinatol 1998;25:757-777. [ Links ]
7. Tan S, Parks DA. Preserving brain function during neonatal asphyxia. Clin Perinatol 1999;26:733-747. [ Links ]
8. de Haan HH, Gunn AJ, Williams CE, Heymann MA, Gluckman PD. Magnesium sulfate therapy during asphyxia in near-term fetal lambs does not compromise the fetus but does not reduce cerebral injury. Am J Obstet Gynecol 1997;176:18-27. [ Links ]
9. Goldberg RN, Moscoso P, Bauer CR, ety al. Use of barbiturate therapy in severe perinatal asphyxia: a randomized controlled trial. J Pediatr 1986;109:851-856. [ Links ]
10. Donn SM, Grasela TH, Goldstein GW. Safety of a higher loading dose of phenobarbital in the term newborn. Pediatrics 1985;75:1061-1064. [ Links ]
11. Saugstad OD. Role of xanthine oxidase and its inhibitor in hypoxia: reoxygenation injury. Pediatrics 1996;98:103-107. [ Links ]
12. Ekert P, Perlman M, Steinlin M, Hao Y. Predicting the outcome of postasphyxial hypoxic-ischemic encephalopathy within 4 hours of birth. J Pediatr 1997;131:613-617. [ Links ]
13. Jasso L. Neonatología práctica. 4ª ed. México: El Manual Moderno; 1995. p. 86. [ Links ]
14. Caballero S, Vázquez P, Moreno M, Gómez-Pellico M, Castro P. Encefalopatía hipóxico-isquémica. Medicine l995;6:11-24. [ Links ]
15. Saunders GH, Penry JK. Phenobarbital/primidone: therapeutic use and serum concentration monitoring. In: Taylor WJ, Finn AL, editores. Individualizing drug therapy: practical applications of drug monitoring, New York: Gross, Townsend, Frank. Inc; 1981. p. 49-62. [ Links ]
16. Dawson-Saunders B. Bioestadística médica. México: El Manual Moderno; 1993. p. 115-41, 165-86. [ Links ]
17. Hulley SB, Cummings SR. Designing clinical research. An epidemiological approach. 1 st ed. Baltimore, MD, USA: William and Wilkins; 1993. p. 232. [ Links ]
18. Hill A, Volpe JJ. Neurological and neuromuscular disorders. In: Avery GB, Fletcher MA, Mac Donald MG, editors. Neonatology, pathophysiology and management of the newborn. 5 st ed. Philadelphia, PA, USA: Lippincott; 1999. p. 1231-1252. [ Links ]
19. Ajayi OA, Oyaniyi OT, Chike-Obi UD, Ugonna D. Adverse effects of early phenobarbital administration in term newborns with perinatal asphyxia. Trop Med Int Health 1998;3:592-595. [ Links ]
20. Evans DJ, Levene MI. Anticonvulsants for preventing mortality and morbidity in full term newborns with perinatal asphyxia. The Cochrane Library 2001;1:1-14. [ Links ]
21. Perlman JM, Riser R. Can asphyxiated infants at risk for with neonatal seizures be rapidly identified by current high risk markers?. Pediatrics 1996;97:456-462. [ Links ]














