Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.1 Ciudad de México ene./feb. 2004
Artículos de revisión
Neumonía por Pneumocystis carinii en niños infectados por el virus de inmunodeficiencia humana (VIH)
Pneumonia Due to Pneumocystis carinii in HIV–Infected Children
José Juan Morales–Aguirre,* Claudia Patricia Villalobos–Acosta,* Víctor Hugo Linares–Salas,* Ana María Solís–Ortega,*Demóstenes Gómez–Barreto,** Miguel Cashat–Cruz*
* Departamento de Epidemiología Hospital Infantil de México Federico Gómez.
** Departamento de Infectología Hospital Infantil de México Federico Gómez.
Correspondencia y solicitud de sobretiros:
Dr. José Juan Morales Aguirre.
Departamento de Epidemiología.
Hospital Infantil de México Federico Gómez.
Calle Dr. Márquez 162, Colonia Doctores,
Delegación Cuauhtémoc.
C.P. 06720. México D.F.
Recepción versión modificada 05 de junio del 2003;
Aceptación 04 de julio del 2003
Resumen
La introducción de nuevos agentes antirretrovirales y el desarrollo de nuevos esquemas de profilaxis antimicrobiana contra agentes oportunistas, ha conducido a una mejor calidad de vida en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). Estos nuevos esquemas de tratamiento han cambiado la epidemiología de las infecciones oportunistas que, previo al uso de terapia antirretroviral (AR V) altamente activa, se presentaban con una elevada frecuencia en los niños infectados por el VIH. Específicamente, la neumonía por Pneumocystis carinii (PCP) ocurría en 12 al 40% de estos pacientes y estaba asociada con una elevada mortalidad. Actualmente, el uso de la terapia antirretroviral combinada y la administración de esquemas de profilaxis han resultado en una disminución importante en los casos de PCP. Sin embargo, en países en vías de desarrollo como el nuestro, la terapia altamente activa y la administración de estas profilaxis no están al alcance de todos los pacientes, por lo se encuentran en alto riesgo de presentar infecciones oportunistas, sobre todo producidas por Pneumocystis carinii, las cuales pueden acortar y afectar notablemente su supervivencia. El propósito de este articulo es hacer una revisión de la neumonía debida al Pneumocystis carinii, con especial énfasis, en las características epidemiológicas, clínicas y terapéuticas de la enfermedad en niños con VIH/SIDA.
Palabras clave: Pneumocystis carinni, neumonía, VIH, niños
Summary
Introduction of new antiretroviral agents and development of new prophylaxis schedules against opportunistic microorganisms have allowed increase in survival as well as better quality of life in HIV–infected patients. These new treatment schedules have changed the epidemiology of opportunistic infections that previous to use of highly active antiretroviral therapy (HAART), fomerly occurred with high frequency in HIV–infected children. Specifically, pneumonia due to Pneumocystis carinii formerly occurred in 12 to 80% of these patients and was associated with high mortality. Currently, with use of combined antiretroviral therapy (ART) and prophylactic treatments important reduction of PCP has been observed. However, despite these benefits ART is not yet available for many patients from several developing countries who are at risk for opportunistic infections, mainly due to Pneumocystis carinii. which can affect life expectancy. Therefore, the purpose of this paper was a review of epidemiologic, clinical, and therapeutic characteristics of P. carinii pneumonia in HIV–infected children.
Key words: Pneumocystisis carinni, pneumonia, HIV, Children
Introducción
Pneumocystis carinii descubierto en 1909 por Carlos Chagas, quien inicialmente lo catalogó como un tripanosoma. Varios años después, Delanoe y Delanoe reportaron que P. carinii pertenecía aun género diferente al propuesto por Chagas. En la década de los años 40 se identificó en Europa una rara neumonía intersticial de células plasmáticas que se presentó en niños prematuros y desnutridos y fue en 1952 cuando Vanek y Jirovek1 identificaron al Pneumocystis carinii como causa de esta enfermedad. A pesar de que la neumonía por P. carinii incrementó paulatinamente su frecuencia como causa de muerte en los pacientes inmunocomprometidos o inmunodeficientes, sólo desde hace 20 años cobró importancia como agente patógeno. A principios de la década de los 80, la presentación de un brote de neumonía por Pneumocystis carinii, en los Estados Unidos de América (EUA), en cinco hombres homosexuales, previamente sanos y sin ningún otro factor de riesgo, fue el detonador para el inicio del estudio epidemiológico de la infección por el virus de la inmunodeficiencia humana (VIH).2Apartirde ese momento, la neumonía por P. carinii se considera como un marcador de SIDA2,3 y desde entonces, nuevos avances en la identificación, diagnóstico, tratamiento y profilaxis de la infección por P. carinii han producido una reducción importante en la morbilidad y mortalidad asociadas a este microorganismo.
Epidemiología
La neumonía por Pneumocystis carinii antes de la epidemia del VIH era una infección que se observaba con poca frecuencia, a finales de los años 60 y principios de los 70 sólo se habían reportado en promedio, 100 casos por año en los EUA, principalmente en pacientes con inmunodeficiencias congénitas o con neoplasias.4 Después de iniciada la epidemia de SIDA en 1982, se incrementó el número de neumonías asociadas a este microorganismo, los cuales llegaron a sumar de 20,000 a 50,000 casos/año.5,6 Diversos estudios previos a la terapia antirretroviral altamente activa (TARAA) demostraron que la PCP ha sido una de las infecciones oportunistas más comunes en niños infectados por el VIH, de acuerdo con un meta–análisis realizado con 13 ensayos desarrollados entre 1988 y 1998 en 3331 niños, se observó que los cinco eventos infecciosos principales fueron: las infecciones bacterianas serias con una densidad de incidencia de 15.1 eventos por 100 personas/ año (p/a), herpes zoster con 2.9 p/a, la infección diseminada por Mycobacterium avium con 1.8 p/a, la neumonía por Pneumocystis carinii con 1.3 p/a y la candidiasis esofágica con 1.2 p/a.7 De acuerdo a lo descrito en la literatura la mayor parte de los casos pediátricos de neumonía por Pneumocystis carinii se han presentado en niños menores de un año con predominio en el grupo de 3 a 6 meses,8–9 la incidencia en Estados Unidos de Norteamérica fue de 12 a 39%,1,8,10–13 similar a la reportada en Europa, 12 a 40%.14,15 En contraste, en adultos se ha estimado que la neumonía por Pneumocystis carinii se podría presentarse hasta en 80% de los pacientes infectados por el VIH que no reciben profilaxis.16
A partir de 1990 algunos estudios comenzaron a reportar una importante reducción en la incidencia de PCP en niños infectados por VIH17 Abrams y cols reportaron que en la ciudad de New York se declararon 60–90 casos anuales durante el periodo de 1987–1993, pero desde 1994 el número de casos disminuyó, en 1997 sólo se notificaron 15 casos en niños.18,19 Los autores establecieron diversos factores que pudieron influir en esta disminución, entre ellos: a) identificación temprana de mujeres embarazadas infectadas por el VIH e implementación en ellas de profilaxis para prevenir la transmisión perinatal del VIH de madre a hijo, b) aplicación de profilaxis contra PCP en forma universal a menores de un año independientemente de su cuenta de células CD4+, y c) avances en el tratamiento antirretroviral. Paralelamente, es interesante mencionar que la profilaxis contra P. carinii en los niños infectados se incrementó en los países desarrollados de 17 a 27% al inicio de la década de los años 90, a un 84 – 100% durante 1996–1997.18,20,21
Sin embargo, poco se sabe de la epidemiología de PCP en países en desarrollo. En Tailandia se reportó una prevalencia de 16% y la implementación reciente de un programa de profilaxis la redujo a 7%, en este estudio el porcentajedecoberturaprofilácticafuede72%.22 También existen pocos datos sobre la incidencia de PCP en niños en África; es interesante mencionar que en los primeros años de la epidemia se consideraba que la neumonía por Pneumocystis carinii era una entidad rara en países africanos,23 en años más recientes algunos estudios postmortem sugieren que esta infección se presentó en 16 a 52% de los niños fallecidos en Costa de Marfil, Zimbabwe y Sudáfrica.24–27 En niños africanos menores de 6 meses que fallecen Pneumocystis carinii se encuentra en 51 %.27 La prevalencia reportada en Sudáfrica por Zar y cols., es de 9.9%, en este estudio se observó que los niños que desarrollaron neumonía por Pneumocystis carinii no recibían profilaxis con trimetoprim–sulfa–metoxazol,28 la mortalidad en el grupo de niños que desarrolló PCP fue de 47% , cifra muy similar a la reportada en países desarrollados en los inicios de la epidemia.29–31 En otro estudio realizado en Sudáfrica se observó que de los niños infectados por VIH en 12% se diagnosticó PCP, la mortalidad en este grupo fue de 42%.32 En Malawi se observó PCP en 11% de los niños infectados por VIH con una mortalidad de 62%.33
En México, la poca información epidemiológica existente en población pediátrica se ha obtenido en nuestra Institución. En un estudio realizado por Morales y cols, en una cohorte histórica de 140 niños antes de la introducción de la terapia altamente activa, se diagnosticó neumonía por Pneumocystis carinii en 16 niños (11%). En 1998 inicio el programa Nacional de tratamiento antirretroviral gratuito a niños y mujeres embarazadas implementado por la Secretaría de Salud, el cual permitió asegurar que todos los niños diagnosticados con infección por VIH recibieran tratamiento antirretroviral. Además la posibilidad de administrar esquemas de profilaxis contra infecciones oportunistas ha influido en forma muy significativa en la incidencia de nuevos casos.34 Esto es importante mencionar, porque en un estudio posterior Villalobos y cols, observaron que los niños que habían recibido terapia con uno o dos inhibidores de proteasa más dos análogos de nucleósidos no desarrollaron eventos de infección por Pneumocystis carinii.35 Cabe señalar que no existen otros estudios epidemiológicos realizados en niños en nuestro país.
Mortalidad y supervivencia
Al inicio de la epidemia la supervivencia observada en niños después del diagnóstico de PC P variaba entre 1 y 11 meses. En e 20 a 53% de los niños infectados por VIH que fallecieron al inicio de los años 90, se demostró la presencia de Pneumocystis carinii, en estudios postmortem;8,12,29,36–40 en estos años la supervivencia era de 2.1 años. Es a mediados de los años 90 que la incidencia de PCP disminuye en forma muy importante, inclusive algunos autores reportaron una frecuencia de cero;20,21 esta situación tuvo un gran impacto en la supervivencia, tanto que en 1996 ésta alcanzaba los 9.4 años con una probabilidad de 75% deque un niño superar a los 5 años de edad20,12,41 esto gracias al advenimiento de la profilaxis antimicrobiana y de los esquemas de terapia altamente activos.42
La mortalidad debida a neumonía por Pneumocystis carinii (PCP) en niños antes del uso de inhibidores de la proteasa (I P) era de 31 a 87%9,24–26,29,37,38,43 y en adultos era de 12 a 43%.44–46
Estudios realizados en adultos demuestran que el inicio del tratamiento antirretroviral (ARV) antes o durante la hospitalización del evento de neumonía por Pneumocystis carinii se asocia con una menor mortalidad; sin embargo, no se tiene información específica en niños hospitalizados.47,48 Por otra parte, existen pocos estudios que hayan evaluado la supervivencia de los niños por el tipo de tratamiento antirretroviral. Martino y cols, en una cohorte de 1142 niños observaron un riesgo relativo de muerte de 0.77(IC95%0.55,1.08)en los niños que recibieron tratamiento antirretroviral con monoterapia, de 0.7 (IC95% 0.42,1.17) con doble terapia y de 0.29(IC95%0.13,0.67) con terapia triple con IP, en comparación con pacientes sin tratamiento antirretroviral. Se ha observado que la sobrevida de los niños infectados por vía perinatal mejoró desde 1996 como consecuencia de la introducción de la TARAA.49 En México, Llopiz y cols realizaron un estudio similar en 221 niños que asistieron a la Clínica de Inmunodeficiencias/ VIH–SIDA (CLINDI) del Hospital Infantil de México en el período de 1988 a 2001 y encontraron que la supervivencia incrementó en forma significativa en aquellos niños que recibieron esquemas con 3 y 4 antirretrovirales en comparación con los niños que no recibieron tratamiento, monoterapia o doble terapia antirretroviral.50
Patogénesis y microbiología
Desde su descubrimiento hasta fines de la década de los 80 se consideraba que Pneumocystis carinii era un protozoario, esto con base en: 1) morfología y mecanismos de invasión semejantes a los protozoarios, 2) nula efectividad de los antimicóticos, 3) sensibilidad a fármacos antiprotozoarias. A pesar de que presentaba características que lo clasificaban como hongo, la hipótesis del protozoario permaneció hasta 1988, cuando los análisis de DNA demostraron que P carinii es un hongo, si bien raro porque carece de ergosterol en la membrana citoplásmica y es de difícil crecimiento en medios de cultivo.51–53
Los estudios bioquímicos han mostrado que la pared celular de P. carinii es rica en carbohidratos, particularmente glucosa, mañosa y b–1,3,glucano,54 la fracción neutra lipídica de P. carinii incluye la presencia de fitoesteroles, que también se encuentran en plantas y hongos. Dado que Pneumocystis sp. no sintetiza esteróles, no es susceptible a la mayoría de los agentes antimicóticos.55–57 Sin embargo, P. carinii sí es sensible a la equinocandina y papulocandina, debido a que estos agentes antifúngicos bloquean la síntesis de β–1,3, glucano e inhiben el desarrollo de la forma quística del parásito. Esto último, aunado a otras características como la presencia de genes separados que codifican para la sintasa de dihidropteroato y la reductasa de dihidrofolato, la presencia de glucanos en su pared celular, la presencia de mitocondrias pobremente desarrolladas y la diseminación aérea de la infección, apoyan la asignación taxonómica de P. carinii como un hongo.54,55
Las principales fases del desarrollo de este microorganismo son: la forma vegetativa pequeña o de trofozoíto pleomórfico de 1 a 4 mm, la forma de quiste de 5 a 8 mm que tiene una pared gruesa y hasta ocho cuerpos intraquísticos y el prequiste que es un estado intermedio. El ciclo vital de P carinii comprende una replicación asexuada de la forma vegetativa y una reproducción sexuada de la forma quística que termina al liberarse los cuerpos intraquísticos. Nose ha descubierto un estado intracelular. Ultraestructuralmente, P carinii posee un sistema de organelos primitivos, pero se conocen pocos datos sobre su metabolismo.57
Existen más de 50 isoformas de P carinii identificadas mediante la tipificación de la región espaciadora transcrita interna del gene del RNA ribosomal.58 El paciente se coinfecta con múltiples cepas de P. carinii en cerca de 20 a 30% de los casos de neumonía asociada a este microorganismo.59,60 La variabilidad en los aislados de P. carinii se demostró en varios casos de recurrencia, lo cual sugiere que ésta puede deberse a la infección por otras cepas más que a la reactivación de P carinii latentes adquiridos previamente. Recientemente la identificación de diferencias en las secuencias de DNA de Pneumocystis carinnii de diferentes hospederos llevó a la conclusión de que se trata de diferentes especies, por lo que el Pneumocystis carinii que causa enfermedad en humanos ahora se llama Pneumocystis jiroveci.61
Aunque el modo de transmisión no es del todo conocido, parece ser que P. carinii se trasmite por vía aérea.62,63 Una vez que llega a los alveolos, el trofozoíto se une al neumocito tipo 1, lo cual constituiría el evento inicial de la infección. Este proceso está mediado por varios factores, como las proteínas extracelulares (fibronectina) y el receptor de la mañosa. Conforme el sistema inmunitario del huésped se debilita, P. carinii se extiende lentamente y rellena gradualmente los alvéolos, el microorganismo prolifera extracelularmente en el espacio alveolar y con el tiempo lo llena causando hipoxemia, por lo que el paciente desarrolla alcalosis respiratoria con disminución en la complianza pulmonar, la capacidad pulmonar total y en la capacidad de difusión de oxígeno.64 Este fenómeno se acompaña de un aumento en la permeabilidad alveolo–capilar, disminución de los fosfolípidos, aumento de las proteínas A y D del agente tensioactivo (surfactante) y lesión de las células tipo I.65,66
Manifestaciones clínicas
El curso de la infección por Pneumocystis carinii en niños es variable, el inicio puede ser insidioso siguiendo un curso de 3 o más semanas, o fulminante y rápidamente progresivo, el cual se desarrolla en pocos días. El curso insidioso es más común en recién nacidos prematuros o en lactantes marasmáticos. Característicamente en los niños infectados por VIH se manifiesta una tetrada de hallazgos clínicos: taquipnea, disnea, tos y fiebre que se instalan en un periodo del a 4 semanas, la fiebre puede estar ausente, o bien, ser de bajo grado.67,68 Los lactantes y escolares infectados por VIH usualmente tienen un curso agudo y al momento del diagnóstico presentan fiebre en 79%, tos en 86%, disnea y taquipnea en un 88%, y un gradiente alveolar mayor de 30 mm Hg en el 95% de los casos.69 El examen clínico muestra: taquicardia, dificultad respiratoria, taquipnea, fiebre, retracción costal difusa y en ocasiones, cianosis y estertores pulmonares, aunque la auscultación de los pulmones no proporciona datos específicos.29,70 La neumonía por P. carinii se caracteriza por una rápida y progresiva hipoxemia, el examen de gases muestra una disminución de la tensión de oxígeno (PaO2) y una elevación en el gradiente de la presión de oxígeno alveoloarterial (P(A–a)O2); Bye y cols en su estudio observaron que este gradiente era hasta de 56 mm/Hg.29
La neumocistosis se puede presentar en forma extrapulmonar afectando ganglios linfáticos, bazo, hígado y médula ósea, estos casos se han asociado con el uso de pentamidina en aerosol como profilaxis en adultos; es importante destacar que de 90 casos reportados en adultos 62% tenía el antecedente de haber usado pentamidina en aerosol.71 La neumocistosis extrapulmonar en niños infectados por el VIH es un evento raro, Chen y cols., reportan un caso de Pneumocistosis extrapulmonar en un niño infectado por VIH el cual se manifiesto como masa mediastinal;72 hasta 1999 se habían reportado sólo siete casos de neumocistosis extrapulmonar en pacientes seronegativos a VIH.
Diagnóstico
El diagnóstico se debe sospechar en todo niño con infección por VIH y dificultad respiratoria, infiltrado intersticial e hipoxemia. La radiografía de tórax generalmente muestra un infiltrado bilateral intersticial; sin embargo, pueden presentarse formas atípicas como infiltrado unilateral, cavitación, derrames y nodulos.73 La radiografía de tórax tiene una sensibilidad de 61 a 100%, y ésta puede ser normal en 11 a 39% de los casos. La combinación de la radiografía de tórax y la medición de la capacidad de difusión pulmonar para el monóxido de carbono tienen un valor predictivo positivo del 97.5%. Otro método diagnóstico lo constituye el rastreo con galio que ofrece mayor sensibilidad y especificidad diagnóstica que los estudios radiográficos convencionales; sin embargo, se requieren más ensayos para poder establecer su utilidad real.71 El estudio de los gases arteriales revelará hipoxemia (con gradiente alvéoloarterial de oxígeno mayor de 30 mm Hg) y elevación de la deshidrogenasa láctica (DHL) sérica mayor a 1000–2000 UI/dL, aunque este hallazgo no es especifico de PCP (ver algoritmo).73
El diagnóstico definitivo requiere de la identificación del microorganismo obtenido de tejido pulmonar o de secreciones del tracto respiratorio. La biopsia transbronquial de pulmón y la biopsia a cielo abierto son los métodos diagnósticos más sensibles y específicos; sin embargo, muchos autores prefieren obtener el espécimen usando lavado bronquio–alveolar por broncoscopia flexible, debido a que los pacientes producen poca secreción y ésta, generalmente, contiene un bajo número de microorganismos.45,74 El P. carinii se puede teñir por los métodos de Giemsa, Gram–Weigert, metenamina de plata o Gomori y azul de toluidina, la tinción con metenamina de plata es el estudio más específico. Debido a la dificultad para identificar al microorganismo, en todo paciente con sospecha de neumonía por P carinii, y en quien las tinciones realizadas resulten negativas, es necesario utilizar otros métodos diagnósticos con mayor sensibilidad como las tinciones fluorescentes con anticuerpos monoclonales, especialmente la tinción con el anticuerpo monoclonal 2G2, que pone en evidencia la presencia de quistes y de trofozoítos que superan por mucho al número de quistes.75 Afortunadamente, desde hace algunos años, la introducción de métodos moleculares ha permitido la detección de P. carinii por métodos más sensibles que las tinciones tradicionales y que los métodos con anticuerpos fluorescentes. El primer estudio que utilizó la reacción en cadena de la polimerasa (PCR) para identificar P. carinii fue llevado a cabo por Wakefield y cols., en 1990,76 desde entonces, esta prueba se ha constituido como la principal herramienta diagnóstica para identificar al P. carinii y actualmente existen varios métodos que utilizan una gran variedad de genes blanco presentes en el parásito (por ejemplo, la secuencia del gen de la glucoproteína principal de membrana y al rRNA mitocondrial).76,78 Algunos estudios recientes que usan PCR para identificar P. carinii mostraron resultados positivos en pacientes en quienes las tinciones habían resultado negativas.79
Tratamiento:
El fármaco de elección para el tratamiento de neumonía por P. carinii es el Trimetoprim–sulfametoxazol (TMP–SMX), que se administra por vía intravenosa a una dosis de 20 mg/kg/día repartido en 4 dosis durante 21 días, cuando exista una notable mejoría clínica es posible cambiar a una formulación por vía oral.68,80,81
Como alternativa de tratamiento el uso depentamidina 4 mg en una dosis diaria por vía IV durante 21 días, se reserva para niños que no toleren TMP–SMX, ya sea por efectos adversos o por falla terapéutica. De acuerdo con algunos autores, si no existe mejoría después de 5–7 días de terapia con TMP–SMX el tratamiento debe cambiarse porpentamidina.19,68,82 Otras opciones de tratamiento pueden ser: dapsona–trimetoprim, atovaquona, clindamicina–primaquina y trimetrexate–leucovorin, combinaciones que han sido aprobados para su uso en adultos, pero que no se han evaluado en niños; sin embargo estos medicamentos podrían ser una alternativa en niños cuando el tratamiento con TMP–SMX y pentamidina falle.
Uso de corticosteroides en pacientes infectados por Pneumocystis carinii
La terapia adjunta con corticosteroides ha demostrado ser eficaz en adultos, ya que acelera la recuperación y previene el desarrollo de falla respiratoria y muerte en pacientes con neumonía por Pneumocystis carinii, se recomiendan su uso en presencia de hipoxemia de moderada a severa.83–85 Aunque no se han realizado ensayos clínicos controlados en niños con PCP que recibieron corticosteroides además del tratamiento antibiótico, en una revisión retrospectiva McLauglin y cols reportaron una mejoría significativa (de 11 a 91%) en la sobrevida de niños que recibieron corticosteroides.86 Sleasman y cols reportaron una disminución en la mortalidad de los niños con PCP en quienes se utilizaron corticosteroides.87 El criterio para su uso es un gradiente alvéoloarterial de más de 35 mm/Hg o una presión arterial de oxígeno (PaO2) menor de 70 mm/ Hg, con una fracción inspirada de oxígeno, (FIO2) de 21 %. En estos casos, aunque no existe una dosis claramente establecida en niños, se aconseja utilizar prednisona a dosis de 2–4mg/kg/día dividido en 4 tomas (o utilizar dosis equivalentes de otros corticosteroides) por 7–10 días, seguidos por una disminución gradual de la dosis durante los siguientes 10 a 14 días.88 Debe tenerse en cuenta que la potencia de la prednisona es 5 veces la del cortisol y que se deberá ser muy cuidadoso por la eventual supresión del eje hipotálamo–hipófisis–suprarrenal, sobre todo al momento de retirar los corticosteroides, para prevenir el desarrollo de una crisis suprarrenal.
Profilaxis en niños
Con base en su importancia, se definen los términos de profilaxis primaria y secundaria contra Pneumocystis carinii:.
Profilaxis primaria: es la administración de antibióticos para evitar que se presente la enfermedad en un paciente que nunca ha padecido neumocistosis.
Profilaxis secundaria: es la administración de antibióticos para prevenir nuevos eventos de infección en un paciente que ya ha presentado al menos un evento infeccioso de neumocistosis.
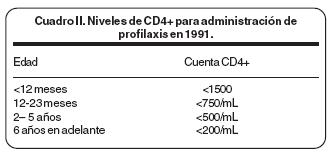
La neumonía por Pneumocystis carinii es una infección oportunista con una notable trascendencia histórica en el ámbito de la prevención. En 1991 un grupo de expertos desarrolló las primeras guías para la profilaxis contra PCP en niños infectados por VIH. Estas guías recomendaban iniciar profilaxis en niños infectados por VIH con niveles de CD4+ en inmunosupresión grave (Cuadro II). Después de implementarlas no se observó una reducción en la incidencia de PCP en niños infectados por VIH en Europa y Estados Unidos de Norteamérica.9 Entre los factores que contribuyeron a la pobre eficacia de estas guías se cuentan a) la incapacidad de identificar la infección por VIH en los niños expuestos, ya que la gran mayoría se diagnosticaban al momento que presentaban el evento de neumonía y b) la pobre cobertura en la profilaxis de los niños expuestos, ya que sólo se administraba a niños con cuentas de células CD4+ por debajo de 1500/uL. En un estudio realizado por Simonds y cols., se observó que en 59% de los niños que había desarrollado infección por Pneumocystis carinii no se había diagnosticado la infección por VIH previamente y que sólo 30% de los niños que se conocían infectados por VIH en EUA recibía profilaxis.9 Aunque la neumonía por Pneumocystis carinii se observaba en adultos con inmunosupresión grave con cuentas de células CD4+ menores a 200/ml, algunos niños que desarrollaron PCP presentaban cuentas de células CD4+ por arriba de 1500/ ml, éste último es el nivel crítico para administrar profilaxis en menores de un año.14,89,90 Estos datos llevaron a los Centers for Disease Control and Prevention (CDC) a una segunda reunión y elaboración de una guía actualizada de profilaxis contra PCP; en esta nueva guía se enfatizan algunos puntos: a) la importancia de acelerar el diagnóstico en las madres embarazadas, con el fin de iniciar la profilaxis en los niños expuestos antes del período de alto riesgo, b) iniciar profilaxis a todos los niños expuestos a las 4–6 semanas de vida, independientemente de la cuenta de linfocitos CD4+, administrando la profilaxis durante todo el primer año o antes si se descarta la infección por VIH en el niño, en el caso de que la cuenta de células CD4+ sea menor a 750/mL durante el primer año entonces la profilaxis continua hasta los dos primeros años de vida, y c) en niños de 1 –5 años con cuentas de CD4+ <500/ml y en mayores de 6 años con <200/ml se administra profilaxis (Cuadro III),91,92 en los niños mayores de 1 año que iniciaron esquemas antibióticos para profilaxis primaria ésta se deberá suspender cuando el niño logre una cuenta de linfocitos CD4 mayor a 15%. La eficacia de esta nueva guía para la profilaxis PCP para niños infectados por VIH ha sido bien documentada en varios estudios,10,42,93 por lo cual continúa vigente hasta la fecha.91,94 Cabe señalar que ONUSIDA recomienda que en países africanos se administre la profilaxis hasta la edad de 15 meses.95 Sin embargo, científicos como Graham SM han manifestado que aplicar un programa de profilaxis en todos los niños hijos de madres VIH (+), tendría algunos inconvenientes en países africanos debido a que la exposición de trimetoprim– sulfametoxazol pudiera provocar resistencia contra antibióticos usados en la malaria como sulfadoxine–pirimetamina, un antibiótico estrechamente relacionado con TMT–SMX que ha reemplazado a la cloroquina como antibiótico de primera línea en el tratamiento contra malaria. Esta hipótesis surge porque in vitro se ha demostrado una resistencia cruzada entre trimetoprin y pirimetamina y también entre sulfametoxazol y sulfadoxina.96

El impacto en la reducción de la mortalidad y morbilidad de infecciones oportunistas como PCP secundario al advenimiento de la TARAA está documentado en niños y adultos;35,97,98 aunque esta situación posiblemente se deba a que tanto en adultos como en niños, se experimenta una reconstitución inmune después de la cual puede suspenderse la profilaxis primaria.99,100 Con respecto a la profilaxis secundaria, ésta se puede suspender en adultos bajo tratamiento ARV que logren cuentas de células CD4+ mayores de 200/mm3 por un período mínimo de 3 meses de haber iniciado el tratamiento ARV;97,101–104 sin embargo, la seguridad de suspender la profilaxis secundaria en niños infectados por VIH que están recibiendo tratamiento antirretroviral altamente activo y que han tenido una reconstitución inmune, no ha sido establecida. Así, los niños que tengan historia previa de neumonía por Pneumocystis carinii deberán recibir quimioprofilaxis de por vida, por el riesgo de recurrencias.94
Aunque trimetoprim–sulfametoxazol es considerado el régimen profiláctico más efectivo, con aceptable tolerancia y bajo costo,105 la elección de un régimen de tratamiento alternativo para niños que no toleran TMP/SMX es un tema de controversia, esquemas con dapsona oral y pentamidina aerolizada se han utilizado en múltiples estudios en adultos y han mostrado ser similares a TMP/ SMX en eficacia;106,107 sin embargo, la información en niños es escasa.
Dapsona: es un fármaco usado como alternativa en profilaxis contra PCP en individuos que no toleran TMP/ SMX, sin embargo, existen pocos datos sobre su farmacocinética, toxicidad y eficacia en niños.108–110 McInstosh y cols evaluaron la toxicidad y eficacia de dapsona administrada en dosis semanal de 4 mg/kg, comparada con dosis diaria de 1 ó 2 mg/kg en 94 niños intolerantes a TMP/SMX, en ambos esquemas se observó la misma frecuencia de exantemas alérgicos (17%), la toxicidad hematológica fue mayor con la dosis diaria (2mg/kg) que con la dosis semanal, los eventos de PCP se observaron más frecuentemente en la dosis diaria (1 mg/kg) con una incidencia de 22 eventos por 100 personas/año, en el grupo de 2mg/kg la incidencia fue de cero y en la dosis semanal fue de 9.5 casos por 100 p/a. Mirochnicky cols., también demostraron que la dosis de 1 mg/kg/día se asoció a una alta tasa de PCP y que los niveles séricos alcanzados con esta dosis son inadecuados y que con la dosis semanal los niveles séricos se habían eliminado por completo antes de terminar la semana.110 En conclusión, aunque la dosis semanal tiene menos efectos hematológicos esta ventaja desaparece, porque se observan más casos de PCP que con la dosis diaria de 2 mg/kg.111 A pesar de la ausencia de información definitiva en niños, se hicieron recomendaciones sobre el uso de dapsona como profilaxis desde 1991,89 estas recomendaciones se modificaron en 199591 y con base en los resultados preliminares del estudio de Mclntosh y cols., la recomendación actual es administrar 2 mg/kg/día, cabe mencionar que no existían ensayos de dosis semanal en niños antes del estudio de Mcintosh y cols.
Otra alternativa para resolver el problema de reacción de hipersensibilidad a TMP/SMX es la desensibilización, ésta fue sugerida inicialmente por Finegold en 1986 y aplicada por Gluckstein y cols., en 1988.112 El procedimiento de desensibilización sugerido por Gluckstein y cols., se ha aplicado con éxito en niños.113
El uso de TMP/SMX o dapsona está contraindicado como profilaxis contra PCP en pacientes que padezcan deficiencia de glucosa–6 fosfato deshidrogenasa (G6PD); una alternativa sería el uso de pentamidina en aerosol para niños mayores de 5 años o atovaquona.91,114
Pentamidina: el isotionato de pentamidina (20 mg/mL) se administra por nebulizador ultrasónico y la dosis recomendada en niños mayores de 5 años es de 300mg, administrada de manera mensual. Existen pocos estudios que demuestren la utilidad de pentamidina en aerosol en menores de 5 años, Principi y cols., demostraron que es bien tolerada en niños desde los 4 meses, en este estudio las dosis administradas fueron de 120 mg/mes ó 60 mg cada 15 días, después de un período de inducción de 60 mg/semanal por 4 semanas; sólo observaron algunos efectos indeseables como: tos, broncoespasmo y cefalea.115
Atovaquona: aunque este medicamento es una opción en el tratamiento profiláctico en pacientes adolescentes y adultos con intolerancia al TMP/SMX, no está autorizado su uso en niños, aunque existe evidencia de que es seguro y eficaz.116,117 La dosis recomendada en niños es de 30 mg/kg/día, aunque se han utilizado en niños de 3 a 24 meses dosis de 45 mg/kg/día. En combinación con azitromicina, atovaquone ha demostrado una eficacia similar a TMP/SMX, para prevenir infecciones oportunistas como PCP.118
Eventos adversos de fármacos usadas en el tratamiento de PCP
TMP/SMX: supresión de médula ósea (neutropenia, trombocitopenia o aplasia), anemia megaloblástica, hepatotoxicidad, pancreatitis, exantema cutáneo, síndrome de Steven–Johnson. Ocasionalmente puede causar alteración del estado mental, convulsiones y agitación. Se ha observado que aunque este medicamento tiene varios efectos colaterales, los niños lo toleran mejor que los adultos.68,80,81
Dapsona: exantema cutáneo, prurito, metahemoglobinemia, anemia hemolítica, éstas dos últimas en pacientes con deficiencia de glucosa–6 fosfato deshidrogenasa(G6PD).19,94
Pentamidina: tos, broncoespasmo, pancreatitis, riesgo incrementado de neumocistosis extrapulmonar cuando se administra por inhalador en aerosol, también se pueden observar: toxicidad renal, hipotensión, hipoglucemia, neutropenia y arritmias cardiacas.19,68,82
Atovaquona: diarrea, exantema cutáneo, intolerancia gastrointestinal.
Conclusiones
Con el advenimiento de la terapia antirretroviral altamente activa, la incidencia de la infección por Pneumocystis carinni disminuyó en forma dramática en niños con VIH/ SIDA. Sin embargo, debido a que esta terapia no está al alcance de todos ya que cierto porcentaje de niños no logra una reconstitución inmunológica adecuada, es necesario recomendar el uso de profilaxis en todos los pacientes menores de un año infectados por el VIH y en mayores de un año con una cuenta de células CD4+ menor a 15%.Con esto, se logrará disminuir la incidencia de neumonía por P. carinii, porque una vez instalada la infección pulmonar, la mortalidad es elevada aun con tratamiento adecuado. Actualmente, existen métodos diagnósticos con muy alta sensibilidad y especificidad que permiten identificar eficazmente este microorganismo. Sin embargo, estos avances no se encuentran al alcance de todos, por lo que en un paciente con factores de riesgo se debe tener un alto índice de sospecha y juicio clínico para realizar el diagnóstico lo más pronto posible con los métodos disponibles e iniciar el tratamiento apropiado. Por otro parte, gracias a la reconstitución inmune que logran los pacientes, esto secundaria al tratamiento altamente activo, en la actualidad es posible suspender la terapia de profilaxis primaria en niños y adultos, aunque la profilaxis secundaria sólo se puede suspender en adultos que logran una reconstitución inmune con la terapia ARV, aún no existe suficiente evidencia científica para recomendar suspender la profilaxis secundaria en niños.
Referencias
1. Saunders–Laufer D, DeBruin W, Edelson PJ. Pneumocystis carinii infection in HIV–infected children. Pediatr Clin North Am 1991; 38:69–88. [ Links ]
2. Gottlieb MS, Schroff R, Schanker HM, et al. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men. N Engl J Med 1981; 305:1425–31. [ Links ]
3. Masur H, Michelis MA, Greene JB, et al. An outbreak of community–acquired Pneumocystis carinii pneumonia. N Engl J Med. 1981; 305:1431–38. [ Links ]
4. Walzer PD, Pel DP, Krogstad DJ, et al. Pneumocystis carinii pneumonia in the United States. Ann Intern Med. 1974; 80:83–93. [ Links ]
5. Frame P. Pneumocystis carinii infection and AIDS. In: Crowe S, Hoy J, Mills J, editors. Management of the HIV–infected patient. New York: Cambridge University Press; 1996 pp. 298–315. [ Links ]
6. Dohn M, Baugman R, Vigdorth E, et al. Equal survival for first, second, and third episodes of Pneumocystis carinii pneumonia in AIDS patients. Arch Intern Med 1992; 152:2465–70. [ Links ]
7. Dankner WM, Lindsey JC, Levin MJ, et al. Correlates of opportunistic infections in children infected with the human immunodeficiency virus managed before highly active antiretroviral therapy. Pediatr Infect Dis J 2001; 20:40–8. [ Links ]
8. Simonds RJ, Oxtoby MJ, Caldwell MB, et al. Pneumocystis carinii pneumonia among US children with perinatally acquired HIV infection. JAMA 1993; 270:470–3. [ Links ]
9. Centers for Disease Control and Prevention. Guidelines for prophylaxis against Pneumocystis carinii pneumonia for children infected with HIV. MMWR 1991; 40:1–13. [ Links ]
10. Thea DM, Lambert G, Weedon J, et al. Benefits of primary prophylaxis before 18 months of age in reducing the incidence of Pneumocystis carinii pneumonia and early death in a cohort of 112 HIV–infected infants. Pediatrics 1996; 97:59–64. [ Links ]
11. Centers for Disease Control and Prevention. HIV/AIDS Surveillance Report 1997; 9(1):1–37. [ Links ]
12. Scott GB, Hutto C, Makuch RW, et al. Survival in children with perinatally acquired HIV type 1 infection. N Engl J Med 1989; 321:1791–96. [ Links ]
13. The European Collaborative Study Group. Children born to women with HIV–1 infection: Natural history and risk of transmission. Lancet 1991; 337:253–60. [ Links ]
14. The European Collaborative Study Group. CD4 T Cell count as predictor of Pneumocystis carinii pneumonia in children born to mothers infected with HIV. Br Med J 1994; 308:437–40. [ Links ]
15. Gibb DM, Davidson CF, Holland FJ, et al. Pneumocystis carinii pneumonia in vertically acquired HIV infection in the British Isles. Arch Dis Child 1994; 70:241–4 [ Links ]
16. Masur H, Lane HC, Kovacs JA, et al. Pneumocystis pneumonia: From bench to clinic. Ann Intern Med 1989; 111:813. [ Links ]
17. Simpson B, Shapiro ED, Andiman WA. Prospective cohort study of children born to human immunodeficiency virus–infected mothers, 1985 through 1997: trends in the risk of vertical transmission, mortality and acquired immunodeficiency syndrome indicator diseases in the era before highly active antiretroviral therapy. Pediatr Infect Dis J 2000;19:618–24. [ Links ]
18. Abrams EJ, Weedon J, Bertolli J, et al. Aging cohort of perinatally human immunodeficiency virus–infected children in New York City. Pediatr Infect Dis J 2001; 20:511–17. [ Links ]
19. Abrams EJ. Opportunistic infections and other clinical manifestations of HIV disease in children. Pediatr Clin North Am 2000; 47:79–108. [ Links ]
20. Barnhart HX, Caldwell MB, Thomas P, et al. Natural history of human immunodeficiency virus disease in perinatally infected children: an analysis from the pediatric spectrum of disease project. Pediatrics 1996; 97:710–16. [ Links ]
21. Johann–Liang R, Cervia JS, Noel GJ. Characteristics of human immunodeficiency virus–infected children at the time of death: an experience in the 1990s. Pediatr Infect Dis J 1997; 16:1145–50. [ Links ]
22. Chokephaibulkit K, Wanachiwanawin D, Chearskul S, et al. Pneumocystis carinii severe pneumonia among human immunodeficiency virus–infected children in Thailand: the effect of a primary prophylaxis strategy. Pediatr Infect Dis J 1999; 18:147–52. [ Links ]
23. Abouya YL, Beaumel A, Lucas S, et al. Pneumocystis carinii pneumonia: an uncommon cause of death in African patients with acquired immunodeficiency syndrome. Am Rev Respir Dis 1992; 145:617–20. [ Links ]
24. Lucas SB, Peacock CS, Hounnou A, et al. Disease in children infected with HIV in Abidjan, Cote d'lvoire. Br Med J 1996; 312:335–8. [ Links ]
25. Ikeogu MO, Wolf B, Mathe S. Pulmonary manifestations in HIV seropositive and malnutrition in Zimbabwe. Arch Dis Child 1997; 76:124–8. [ Links ]
26. Jeena PM, Coovadia HM, Chrystel V. Pneumocystis carinii and cytomegalovirus infections in severely ill HIV–infected African infants. Ann Trop Paediatr 1996; 16:361–8. [ Links ]
27. Chintu C, Mudenda V, Lucas S, et al. Lung diseases at necropsy in African children dying from respiratory illnesses: a descriptive necropsy study. Lancet 2002; 360:985–90. [ Links ]
28. Zar HJ, Dechaboon A, Tech DM, et al. Pneumocystis carinii pneumonia in South African children infected with human immunodeficiency virus. Pediatr Infect Dis J 2000; 19:603–7. [ Links ]
29. Bye MR, Bernstein LJ, Glaser J, Kleid D. Pneumocystis carinii pneumonia in children with AIDS. Pediatr Pulmonol 1990; 9:251–3. [ Links ]
30. Notterman DA, Greenwald BM, Di Maio–Hunter et al. Outcome after assisted ventilation in children with acquired immunodeficiency syndrome. Crit Care Med 1990; 18:18–20. [ Links ]
31. Marolda J, Pace B, Bonforte RJ, et al. Outcome of mechanical ventilation in children with acquired immunodeficiency syndrome. Pediatr Pulmonol 1989; 7:230–4. [ Links ]
32. Zar HJ, Hanslo D, Tannenbaum E, et al. A etiology and outcome of pneumonia in human immunodeficiency virus–infected children hospitalized in South Africa. Acta Paediatr 2001; 90:119–25. [ Links ]
33. Graham SM, Mtitimila El, Kamanga HS, et al. Clinical presentation and outcome of Pneumocystis carinii pneumonia in Malawian children. Lancet 2000; 355:369–73. [ Links ]
34. Morales AJ, Cashat CM, Avila FC. Characteristics of a cohort of HIV–infected children in Mexico. 36⢠IDSA 1998, 21–24 November, 1998. Denver, Colorado, USA. [ Links ]
35. Villalobos AC, Morales AJ, Nandi LM, et al. Trends in infectious diseases and mortality in a cohort of HIV–infected children under ART in Mexico. Abstract 786. 39th Annual Meeting of the Infectious Diseases Society of America. IDSA 2001, San Francisco, California, USA. [ Links ]
36. Connor E, Bagarazzi M, McSherry G, et al. Clinical and laboratory correlates of Pneumocystis carinii pneumonia in children infected with HIV. JAMA 1991; 265:1693–7. [ Links ]
37. Falloon J, Eddy J, Wiener L, Pizzo PA. Human immunodeficiency virus infection in children. J Pediatr 1989; 114:1–30. [ Links ]
38. Rogers MF, Thomas PA, Starcher ET, Noa MC, et al. Acquired immunodeficiency syndrome in children: Report of the Centers for Diseases Control National Surveillance 1982 to 1985. Pediatrics 1987; 79:1008–14. [ Links ]
39. Pauline T, Tejinder S, Rosalyn W, et al. Trends in survival for children reported with maternally acquired immunodeficiency syndrome in New York City 1982–1989. Pediatr Infect Dis J 1992; 11:34–39. [ Links ]
40. Turner BJ, Denison M, Eppes SC, et al. Survival experience of 789 children with the acquired immunodeficiency syndrome. Pediatr Infect Dis J 1993; 12:310–20. [ Links ]
41. Krasinski K, Borkowski W, Holzman RS. Prognosis of human immunodeficiency virus infection in children and adolescents. Pediatr Infect Dis J 1989; 8:216–20. [ Links ]
42. Maldonado YA, Araneta RG, Hersch AL, et al. Pneumocystis carinii pneumonia prophylaxis and early clinical manifestation of perinatal human immunodeficiency virus type 1 infection. Pediatr Infect Dis J 1998; 17:398– 402. [ Links ]
43. Bernstein LJ, Bye MR, Rubinstein A. Prognostic factors and life expectancy 75. in children with acquired immunodeficiency syndrome and Pneumocystis carinii pneumonia. AJDC 1989; 143:775–8. [ Links ]
44. Haverkos HW. Assesment of therapy for Pneumocystis carinii pneumonia: PCP Therapy Project Group. Am J Med 1984; 76:501–8. [ Links ]
45. Murray JF, Felton CP, Garay SM, et al. Pulmonary complications of the acquired immunodeficiency syndrome. N Engl J Med 1984; 310:1682–8. [ Links ]
46. Wharton JM, Coleman DL, Wofsy CB, et al. Trimethoprim/Sulfamethoxasole or pentamidine for Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. Ann Intern Med 1986; 105:37–44. [ Links ]
47. Sax PE. Antiretrovirals and PCP survival. AIDS Clin Care 2003: Available at: http://www.medscape.com/viewarticle/449287 [ Links ]
48. Morris A. Improved survival with highly active antiretroviral therapy in HIV–infected patients with severe Pneumocystis carinii pneumonia. AIDS 2003; 17:73–80. [ Links ]
49. Martino M, Tovo PA, Balducci M, et al. Reduction in mortality with availability of antiretroviral therapy for children with perinatal HIV–1 infection. JAMA 2000; 190–7. [ Links ]
50. Llopiz MA, Cashat CM, Morales AJ, Moreno MH, Gomez BD. Survival trends of HIV pediatric patients in Mexico: a treatment scheme comparison and the impact of HAART therapy (1986–2001). WePeC6062 XIV International AIDS Conference 2002 Barcelona, España Julio 7–12 2000. [ Links ]
51. Edman JC, Kovacs JA, Masur H, et al. Ribosomal RNA sequences shows Pneumocystis carinii to be member of the fungi. Nature 1988; 334:519–22. [ Links ]
52. Stringer SL, Stringer JR, Blaser MA, et al. Pneumocystis carinii; sequence from ribosomal RNA implies a close relationship with fungi. Exp Parasitol 1989; 68:450–61. [ Links ]
53. Pixley F, Wakerfield A, Baerji S, et al. Mitochondrial gene sequences show fungal homology for Pneumocystis carinii. Mol Microbiol 1991; 5:1347–51. [ Links ]
54. Furrer H, Egger M, Opravil M, et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV–1–infected adults treated with combination antiretroviral therapy. N Engl J Med 1999; 340:1301–1306. [ Links ]
55. Walzer PD. Pneumocystis carinii: Recent advances in basic biology and their clinical application. AIDS 1993;7:1293. [ Links ]
56. Sringer JR. Pneumocystis carinii: What is it exactly?. Clin Microbiol Rev 1996; 9:489–98. [ Links ]
57. Cushion MT. Analyses of the developmental stages of Pneumocystis carinii, in vitro. Lab Invest 1988; 58:324–331. [ Links ]
58. Lee CH, Helweg–Larsen J, Tang X, et al. Update on Pneumocystis carinii f sp. Hominis typing based on nucleotide sequence variations in internal transcribed spacer regions of rRNA genes. J Clin Microbiol 1998;36:734–741. [ Links ]
59. Beard CB, Carter JL, Keely SP, et al. Genetic variations in Pneumocystis carinii isolates from different geographic regions. Emerg Infect Dis 2000; 6:265–272. [ Links ]
60. Nahimana A, Blanc DS, Francioli P, et al. Typing of Pneumocystis carinii f sp. Hominis by PCR–SSCP to indicate a high frequency of co–infections. J Med Microbiol 2000; 49:753–758. [ Links ]
61. Stringer JR, Beard CB, Miller RF, Wakef ield AE. A new name (Pneumocystis jiroveci) for Pneumocystis from humans. Emerg Infect Dis 2002; 8:1–10. [ Links ]
62. Hughes WT. Natural mode of acquisition for de novo infection with Pneumocystis carinii. J Infect Dis 1982; 145:842–8. [ Links ]
63. Vogel P, Miller CJ, Lowenstime LL, Lackner AA. Evidence for horizontal transmission of Pneumocystis carinii pneumonia in simian immunodeficiency virus–infected rhesus macaques. J Infect Dis 1993; 168:836–43. [ Links ]
64. Walzer P, Kim C, Cushion M. Pneumocystis carinii. In: Walzer P, Genta R, editors. Parasitic infections in the compromised host. New York: Marcel Dekker; 1989. pp 83–178. [ Links ]
65. Sternberg Rl. Pneumocystis carinii alters surfactant protein A concentrations in bronchoalveolar lavage fluid. J Lab Clin Med 1995; 125:462. [ Links ]
66. Walzer PD. Infections for Pneumocystis carinii In: Harrison principios de medicina interna ch. 211. 14th edition Ed Mc Graw Hill; 1996 pp.1330–1332. [ Links ]
67. Dutz W. Pneumocystis carinii pneumonia. Pathol Annu 1970; 5:309–41. [ Links ]
68. Hughes WT. Pneumocystis carinii pneumonia: new approaches to diagnosis, treatment and prevention. Pediatr Infect Dis J 1991; 10:391–9. [ Links ]
69. Hanson C, Shearer T. AIDS and other acquired immunodeficiency diseases. In: Feigin RD, Cherry JD (editors) Textbook of pediatric infectious diseases, 4th. ed. ch. 80. W.B. Saunders Co.; pp. 954–979. [ Links ]
70. Hughes WT. Pneumocystis carinii pneumonia, in Pizzo PA, Wilfer CM (eds) Pediatric AIDS: The challenge of HIV infection in infants, children and adolescents (eds) Philadelphia PA, Williams and Wilkins, 1994, pp:405–418. [ Links ]
71. Raviglione M. Extrapulmonar pneumocystosis: the first 50 cases. Rev Infect Dis 1990; 12:1127–38. [ Links ]
72. Chen A, Zaidi AKM, Mueller BV, et al. Pneumocystis carinii presents as a mediastinal mass in a child with acquired immunodeficiency syndrome. Pediatr Infect Dis J 1999; 18:827–31. [ Links ]
73. Huang L, Stansell J, Osmond D, et al. Performance of an algorithm to detect Pneumocystis carinii pneumonia in symptomatic HIV–infected persons. Chest 1999; 115:1025–1032. [ Links ]
74. Bye MR, Bernstein LJ.Shah K, et al. Diagnosis lavage in children with AIDS. Pediatr Pulmonol 1987; 3:425–8. [ Links ]
75. Kovacs J, Ng V, Masur H, et al. Diagnosis of Pneumocystis carinii pneumonia: improved detection in sputum with use of monoclonal antibodies. N Engl J Med 1988; 318:589–93. [ Links ]
76. Wakefield AE, Pixley FJ, Banerji S, et al. Amplification of mitochondrial ribosomal RNA sequences form Pneumocystis carinii DNA of rat and human origin. Mol Biochem Parasitol 1990; 43:69–76. [ Links ]
77. Lu JJ, Chen CH, Bartlett MS, et al. Comparison of six different PCR methods for detection of Pneumocystis carinii. J Clin Microbiol 1995; 33:2785–88. [ Links ]
78. Olsson M, Elvin K, Lofdahl S, Linder E. Detection of Pneumocystis carinii DNA in sputum and bronchoalveolar lavage samples by polymerase chain reaction. J Clin Microbiol 1993; 31:221–6. [ Links ]
79. Sing A, Trebesius K, Roggenkamp A, et al. Evaluation of diagnostic value and epidemiological implications of PCR for Pneumocystis carinii in different immunosuppressed and immunocompetent patient groups. J Clin Microbiol 2000; 38:1461–1467. [ Links ]
80. Chanock SJ, Luginbuhl LM, Mcintosh K, et al. Life–threatening reaction to trimethoprim/sulfamethoxazole in pediatric human immunodeficiency virus infection. Pediatr Infect Dis J 1994; 93:519. [ Links ]
81. Rieder MJ, King SM, Read S. Adverse reaction to trimethroprim–sulfamethoxazole among children with human immunodeficiency virus infection. Pediatr Infect Dis J 1997; 16:1028. [ Links ]
82. Chaisson R, Bishai W. The management of Pneumocystis carinii, toxoplasmosis, and HSV infections in patients with HIV disease. HIV Clin Manage 1999; 7:1–29. [ Links ]
83. Bozzette S, Sather F, Chiu J, et al. A controlled trial of early adjunctive treatment with corticosteroids for Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. N Engl J Med 1990; 323:1451–1457. [ Links ]
84. Montaner J, Lawson L, Levitt N, et al. Corticosteroids prevent early deterioration in patients with moderately severe Pneumocystis carinii pneumonia and the acquired immunodeficiency syndrome. Ann Intern Med 1990; 113:14–20. [ Links ]
85. Gagnon S, Boota AM, Fischi MA, et al. Corticosteroids as adjunctive therapy for severe Pneumocystis carinii pneumonia in the Acquired immunodeficiency syndrome. N Engl J Med 1990; 323:1444. [ Links ]
86. McLaughlin GE, Virdee SS, Schleien CL, et al. Effect of corticosteroids on survival of children with acquired immunodeficiency syndrome and Pneumocystis carinii–related respiratory failure. J Pediatr 1995; 126:821–4. [ Links ]
87. Sleasman JW, Hemenway C, Klein AS, et al. Corticosteroids improve survival of children with AIDS and Pneumocystis carinii pneumonia. Am J Dis Child 1993; 147:30. [ Links ]
88. American Academy of Pediatrics. Infecciones por Pneumocystis carinii. En: Pickering LK, Peter G, Baker CJ, Gerber MA, MacDonald NE, Orenstein WA, Patriarca P, editors. Red Book. Enfermedades Infecciosas en Pediatría. Informe del Comité de Enfermedades Infecciosas de la American Academy of Pediatrics. Ed. Médica Panamericana;. 25ª Edición. Buenos Aires, Argentina 2001; pp. 452–456. [ Links ]
89. Israele V, Wittek A, Courville T, et al. Pneumocystis carinii pneumonía in infants with CD4 counts greater than 2000 cells/mm3 (abstract POB3855). Presented at the VIII International Conference on AIDS. Amsterdam The Netherlands July, 1992. [ Links ]
90. Kovacs A, Fredrick T, Church J, et al. CD4 T–Lymphocyte counts and Pneumocystis carinii pneumonia in pediatric HIV infection. JAMA 1991; 265:1698 [ Links ]
91. Centers for Disease Control and Prevention.1995 Revised Guidelines for children infected with or perinatally exposed to human immunodeficiency virus. MMWR 1995; 44 (RR–4):1–11. [ Links ]
92. Grubman S, Simonds RJ. Preventing Pneumocystis carinii pneumonia in human immunodeficiency virus–infected children: new guidelines for prophylaxis. Pediatr Infect Dis J 1996; 15: 165–8. [ Links ]
93. Rigaud M, Pollack H, Leibovitz E, et al. Efficacy of primary chemoprophylaxis against Pneumocystis carinii pneumonia during the first year of life In Infants Infected with human immunodeficiency virus type 1. J Pediatr 1994; 125:476. [ Links ]
94. USPH/IDSA Guidelines for the prevention of opportunistic Infection In persons Infected with human Immunodeficiency virus 2001. [ Links ]
95. UNAIDS Provisional WHO/UNAIDS Secretariat recommendations on the use of cotrimoxazole prophylaxis in adults and children living with HIV/ AIDS In Africa. Geneva Switzerland: UNAIDS; 2000. [ Links ]
96. Graham SM. Prophylaxis against Pneumocystis carinii pneumonia for HIV– exposed infants In Africa. Lancet 2002; 360:1966–8. [ Links ]
97. Ledergerber B, Mocroft A, Reiss P, et al. Discontinuation of secondary prophylaxis against Pneumocystis carinii pneumonia in patients with HIV Infection who have a response to antiretroviral therapy. N Engl J Med 2001; 344:168–74. [ Links ]
98. Ledergerber B, Egger M, Erard V, et al. AIDS–related opportunistic illnesses occurring after Initiation of potent antiretroviral therapy. The Swiss HIV Cohort Study. JAMA 1999; 282:2220–6. [ Links ]
99. Powderly WG, Landay A, Lederman MN. Recovery of the immune system with antiretroviral therapy: the end of opportunism? JAMA 1998; 280:72–7. [ Links ]
100. Cohen SJ, Slieker WA, Rijkers GT, et al. Early recovery of CD4+ lymphocytes In children on highly active antiretroviral therapy. AIDS 1998; 12:2155–9. [ Links ]
101. US Public Health Service and Infectious Disease Society of America. 1999 USPHS/IDSA Guidelines for the prevention of opportunistic infections in persons infected with human immunodeficiency virus. MMWR 1999; 48:4–10. [ Links ]
102. Weverling GJ, Mocroft A, Ledergerber B, et al. Discontinuation of Pneumocystis carinii pneumonia prophylaxis after start of highly active antiretroviral therapy In HIV–infection. Lancet 1999; 353:1293–98. [ Links ]
103. Trikalinos TA, loannidis PA. Discontinuation of Pneumocystis carinii prophylaxis in patients infected with human Immunodeficiency virus: a meta–analysls and decision analysis. Clin Infect Dis 2001; 33:1901–9. [ Links ]
104. Lopez BQ, Miro JM, Peña JM, et al. A Randomized trial of the discontinuation of primary and secondary prophylaxis against Pneumocystis carinii pneumonia after highly active antiretroviral therapy in patients with HIV infection. N Engl J Med 2001; 344:159–67. [ Links ]
105. Simonds RJ, Hughes WT, Feinberg J, Navin TR. Preventing Pneumocystis carinii pneumonia in persons infected with human immunodeficiency virus. Clin Infect Dis 1995; 21(Suppl):S44–S58. [ Links ]
106. loannidis JPA, Cappelleri JC, Skolnik PR, et al. Meta–analysls of the relative efficacy and Toxicity of Pneumocystis carinii prophylactic regimens. Arch Intern Med 1996; 156:177–88. [ Links ]
107. Bucher HC, Griffith L, Guyatt GH, Opravil M. Meta–analysls of prophylactic treatments against Pneumocystis carinii pneumonia and Toxoplasma encephalitis in HIV–lnfected patients. J Acquin Immun Defic Syndr Hum Retrovirol 1997; 15:104–14. [ Links ]
108. Mirochnick M, Michaels M, Clarke D, et al. Pharmacokinetics of dapsone in children. J Pediatr 1993; 12:806–9. [ Links ]
109. Gatti G, Loy A, Casazza R, et al. Pharmacokinetics of dapsone in humani immunodeficiency virus–infected children. Antimicrob Agents Chemother 1995; 39:1101–6. [ Links ]
110. Mirochnick M, Cooper E, Capparelli E, et al. Population Pharmacokinetics of dapsone in children with human immunodeficiency virus infection. Clin Pharmacol Ther 2001; 70:24–32. [ Links ]
111. Mcintosh K, Cooper E, Xu J, et al. Toxicity and efficacy of dally vs weekly dapsone for prevention of Pneumocystis carinii pneumonia in children infected with human immunodeficiency virus. Pediatr Infect Dis J 1999; 18:432–9. [ Links ]
112. Gluckstein D, Ruskin J, Nielsen D. Oral desensitization to trimethoprim/ sulfamethoxazole in hypersensitive AIDS patients. IV International Conference on AIDS. Stockholm, Sweswn June 12–16, 1988; abstract 7176. [ Links ]
113. Rudin CH, Gunthard J, Zumsteg U. Successful desensitization to trimethoprim/sulfamethoxazole in a young infant with AIDS. Pediatr AIDS HIV Infect Fetus Adolesc 1995;6:212–4. [ Links ]
114.Centers for Disease Control and Prevention. 1999 USPHS/IDSA Guidelines for the prevention of opportunistic infections in persons infected with human immunodeficiency. MMWR 1999; 48(RR10):1–59. [ Links ]
115. Principi N, Marchisio P, Onorato J, et al. Long term administration of aerosolized pentamldine as primary prophylaxis against Pneumocystis carinii pneumonia in infants and children with symptomatic human Immunodeficiency virus infection. The Italian Pedlatric Collaborative Study Group on Pentamldine. J Acquir Immune Defic Syndr Hum Retrovirol 1996; 12:158–163. [ Links ]
116. Hughes W, Dorenbaum A, Yogev R, et al. Phase 1 safety and Pharmacokinetics study of micronized atovaquone in human immunodeficiency virus–infected infants and children. Pediatric AIDS Clinical Trials Group. Antimicrob Agents Chemother 1998; 42:1315–8. [ Links ]
117. Ngo LY, Yogev R, Dankner WM, et al. Pharmacokinetics of azithromycin administered alone and with atovaquone in human immunodeficiency virus–infected children. The ACTG 254 Team. Antimicrob Agents Chemother 1999; 43:1516–9. [ Links ]
118. Dankner W, Yogev R, Hughes W, Xu J. The Pediatric ACTG 254 Team. Phase II/III, randomized, double–blind trial to compare atovaquone plus azithromycin to TMP/SMX in the prevention of multiple opportunistic pathogen infections (MOPPS) in HIV–lnfected children. Program and Abstract of Advancing Children's Health 2000: A Joint Meeting of the Pediatric Academic Societies and the American Academy of Pediatric; May 12–16, 2000; Boston, MA, USA, abstract 1531. [ Links ]














