Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta médica de México
versión On-line ISSN 2696-1288versión impresa ISSN 0016-3813
Gac. Méd. Méx vol.140 no.1 Ciudad de México ene./feb. 2004
Artículos originales
Factores de riesgo de mortalidad en el hijo de madre toxémica***
Mortality Risk Factors in the Child of a Toxemic Mother
Manuel Gómez–Gómez,*,** Cecilia Danglot–Banck,*,** Guadalupe Silvia García–de la Torre,** Abdiel Antonio–Ocampo,** Arturo Fajardo–Gutiérrez,** Maria Luisa Sánchez–García,* Elias Ahumada–Ramírez*
* Pediatra Neonatólogo, Hospital de Gineco–Obstetricia, Centro Médico La Raza, Instituto Mexicano del Seguro Social.
** Maestría en Ciencias Epidemiología, Universidad Nacional Autónoma de México, México, Distrito Federal, México.
*** Este artículo es un homenaje a la memoria del Dr. Eduardo Jurado García, uno de los fundadores de la neonatología en México
Correspondencia y solicitud de sobretiros:
Dr. Manuel Gómez Gómez,
Parque Zoquiapan 25, Col. del parque,
CP 53398, Naucalpan de Juárez,
Estado de México
Correo electrónico: mangomez38@hotmail.com
Recepción versión modificada 09 de octubre del 2002;
Aceptación 02 de diciembre del 2002
Resumen
Objetivo. Determinar los factores de riesgo de mortalidad en el hijo de madre toxémica.
Material y métodos. Estudio de casos y controles en hijos de toxémicas, de producto único, de 28 a 42 semanas de gestación; los casos fueron los fallecidos y los controles los sobrevivientes.
Resultados. Fueron 57 casos y 114 controles. Los factores de riesgo significativos: eclampsia (RM= 4.25, IC95% 1.76–10.39, p= 0.0002), desprendimiento placentario (RM= 8.13, IC95% 2.29–31.4, p= 0.00007), anestesia general (RM= 5.32, IC95% 1.74–16.51 p= 0.0005), síndrome de dificultad respiratoria (RM= 23.68, IC95% 3.31–478 p= 0.00004), ventilación mecánica (RM= 334, IC95% 42.63–7084, p=0.000000001), hemorragia peri–intraventricular (RM= 64.57, IC95% 8.36–1361, p = 0.0000001), insuficiencia renal aguda (RM= 26.13, IC95% 5.21–177, p= 0.0000002 ) y hemorragia pulmonar (RM= 8.40, IC95% 2.71–27.11, p= 0.000006). Se detectaron como factores protectores: alta escolaridad materna (RM= 0.110, IC95% 0.01–0.66, p= 0.02), desnutrición in útero (RM= 0.39, IC95% 0.18–0.84, p= 0.008) y taquipnea transitoria del recién nacido (RM= 0.021, IC95% 0.00–0.15, p= 0.00000001
Conclusiones. Los factores de riesgo maternos fueron: eclampsia, desprendimiento placentario, anestesia general y muerte materna; en el producto: síndrome de dificultad respiratoria, ventilación mecánica y hemorragia peri–intraventricular. Es interesante el hallazgo de los factores de protección.
Palabras clave: factores de riesgo, mortalidad, toxemia del embarazo, hijo de madre toxémica, estudio de casos y controles, estudios epidemiológicos
Summary
Objective. To determine risk factors of mortality in the infant of a toxemic mother.
Material and Methods. A case–controls study, single products only, of 28–42 weeks of gestation; cases were either stillborn and neonatal deaths. Where controls were survivors.
Results. There were 57 cases and 114 controls. Significant risk factors were: eclampsia (OR= 4.25, 95%CI 1.76–10.39, p =0.0002), placental detachment (OR = 8.13,95%CL 2.29–31.4, p= 0.00007), general anesthesia (OR= 5.32, 95%CI 1.74–16.51, p=0.0005), respiratory distress syndrome (OR= 23.68, 95%CI 3.31–478 p= 0.00004), mechanic ventilation (OR= 334, 95%CI 42.63–7084, p= 0.000000001), peri–intraventricular hemorrhage (OR = 64.57, 95%CI 8.36–1361, p= 0.0000001), acute renal failure (OR=2613, 95%CI 5.21–177, p=0.0000002) and pulmonary hemorrhage (OR= 8.40, 95%CL 2.71–27.11, p= 0.000006). We observed as protective factors: high maternal educational level (OR=0.110, 95%CI 0.01–0.66, p= 0.02), intrauterine malnutrition (OR= 0.39, 95%CL 0.18–0.84, p= 0.008) and transient tachypnea of the newborn (OR= 0.021, 95%CI0.00–0.15,p= 0.00000001).
Conclusions. We found as maternal risk factors: eclampsia; premature placental detachment; general anesthesia, and maternal death, in the newborns they were respiratory distress syndrome, mechanical ventilation and peri–intraventricular hemorrhage. The finding of protection factorsis unteresting.
Key words: risk factors, mortality, toxemia of pregnancy, infant of toxemic mother, case and control studies, epidemiologic studies
Introducción
La toxemia del embarazo es un síndrome de causa desconocida que se caracteriza por edema, hipertensión arterial y proteinuria después de la vigésima semana de gestación.1 Cuando la enfermedad progresa y hay convulsiones se habla de eclampsia, cuya gravedad puede condicionar fallecimiento materno (0.5–17%) y del producto (10–37%).2–5
Se considera como fetopatía toxémica (FT) al conjunto de alteraciones que presenta el recién nacido que proviene de una madre con toxemia. Estas alteraciones pueden repercutir sobre el crecimiento, desarrollo y homeostasis del producto en la vida fetal, durante el trabajo de parto o en la etapa neonatal.6
Se puede decir que a nivel mundial la toxemia se presenta en 5–9% de los embarazos7,8 y de éstos es cinco a seis veces más frecuente en primigestas;5se ha observado también en 14–20% de las gestaciones múltiples; en 30% de las mujeres con alteraciones uterinas graves y en 25% de las pacientes con hipertensión o nefropatía crónica.2
Respecto a eclampsia una revisión en los Estados Unidos de Norteamérica9entre 1979y 1986y en Inglaterra10 en 1992, muestran que ocurre un caso en cada 2,000 embarazadas.
La toxemia se presenta en la última parte del embarazo con mayor frecuencia conforme avanza la gestación y se estima que cerca de la mitad de los casos ocurren en embarazos de término11 y que una tercera parte de los casos de eclampsia ocurren en el puerperio.5
Se estima que en México 8% de las mujeres que se embarazan cursan con algún grado de toxemia. En los anuarios estadísticos de mortalidad12 la toxemia ocupa el primer lugar como causa de muerte materna, con 400–500 casos anuales registrados, que si se considera que hay una subestimación de 50%,13 en la realidad ocurren el doble de muertes maternas por esta causa. En el Departamento de Pediatría del Hospital en los últimos años la FT ha progresado de 13% de los ingresos en 1992 al 37.4% en 1996 y en 1998 se integró el síndrome de FT en 1896 recién nacidos vivos (30% de los ingresos).14
La etiología de la toxemia hasta el momento es desconocida pero se sabe que el síndrome ocurre sólo en el ser humano. El defecto básico es la falta de invasión o la invasión incompleta del trofoblasto a las arterias espirales, que ocurre al momento de la implantación por lo que puede considerarse un defecto adquirido.2
En el cuadro I se presentan los grados clínicos de toxemia de acuerdo a López Llera.5 Los casos graves, que ameritan internamiento reciben múltiples medicamentos entre los que destacan: sulfato de magnesio, alfametildopa, alcaloides de la rawolfia, diuréticos, etc. Con frecuencia en nuestro medio son mujeres que llegan en coma, con eclampsia, muchas veces ya en trabajo de parto avanzado y sin haber acudido previamente a atención prenatal. En muchas ocasiones se presentan con trabajo de parto prematuro o la gravedad del cuadro materno obliga a interrumpir el embarazo.5,6,15,16
Se acepta que en los casos leves no hay repercusiones significativas sobre el producto. Cuando la toxemia es de moderada a grave la repercusión es variable, desde una evolución sin problemas, con un crecimiento y desarrollo adecuados para la edad gestacional hasta causar el fallecimiento fetal.5,6,15,16
El objetivo del presente reporte es identificar los factores asociados a mortalidad del hijo de madre con toxemia del embarazo en una cohorte de un hospital de un tercer nivel de atención.
Pacientes y métodos
Tipo de estudio: es un estudio observacional analítico, de casos y controles, anidado en una cohorte, prolectivo, con casos incidentes; se eligieron dos controles porcada caso. Población de estudio: hijos de madres con toxemia del embarazo atendidas en el Hospital de Gineco–Obstetricia del Centro Médico Nacional La Raza, Instituto Mexicano del Seguro Social, en México, Distrito Federal, Periodo de estudio: del primero de enero al 31 de diciembre de 1998.
Selección de los casos
Criterios de inclusión: que fuesen producto único de la concepción; con el antecedente materno de toxemia; de 28 a 42 semanas de gestación; con alta por fallecimiento, sea muerte fetal (óbito fetal o mortinato) o hasta 28 días después de su nacimiento.
Criterios de exclusión: paciente incluidos en el estudio cuyos familiares no aceptaron la entrevista o en los que los datos registrados estuvieran incompletos. Selección de los controles
Criterios de inclusión: que fuesen producto único de la concepción; con antecedentes maternos de toxemia; de 28 a 42 semanas de embarazo; seguidos desde el nacimiento hasta los 28 días de vida o hasta su alta hospitalaria (lo que ocurriese primero); supervivencia. Criterios de exclusión: paciente incluidos en el estudio cuyos familiares no aceptaron la entrevista o en los que los datos de la entrevista estuvieran incompletos.
Variables de estudio
Variable dependiente: defunción del niño nacido de madre con toxemia
Variables independientes: se dividieron en:
De la madre: edad, estado civil, escolaridad, nivel socioeconómico, ocupación, enfermedad crónica concomitante; obesidad.
Del embarazo: número de gesta, número de consultas prenatales, complicaciones en el primer, segundo y tercer trimestres del embarazo, grado y tiempo de evolución de la toxemia, complicaciones atribuidas a ésta, incluido el fallecimiento materno, vía de nacimiento y la anestesia utilizada en la madre.
Del parto: tipo de parto (eutócico o distócico ya sea fórceps o cesárea).
Del producto: sexo, calificación de Apgar al minuto y cinco minutos, valoración de Silverman–Andersen, peso, talla y perímetro cefálico, armonía del crecimiento (mediante el índice de Miller), valoración de la edad de gestación (mediante la nueva valoración de Ballard) y la clasificación de estos recién nacidos de acuerdo a su situación en las curvas de peso de Jurado–García.
Se registraron los diversos síndromes que presentaron los recién nacidos durante el internamiento, con énfasis en aquellos que requirieron manejo con ventilación mecánica. Se anotaron también los días de estancia hospitalaria y, en los casos, la causa de la defunción.
Variables maternas
Se determinaron las condiciones de la vivienda de acuerdo a Bronfman y col.17 Se consideró como ingreso familiar mensual a la percepción económica o ingresos que tiene el jefe de familia y los demás miembros económicamente activos en caso de que los hubiera.17 En base a condiciones de vivienda y al ingreso familiar mensual se construyó el medio socioeconómico. Se consideró como bueno cuando el ingreso familiar mensual fue mayor a 10,000 pesos, la casa propia, con todos los servicios urbanos y sin hacinamiento; se consideró como malo si la casa era rentada, con carencia de servicios urbanos, hacinamiento y los ingresos familiares mensuales menores a 2,000 pesos. Cuando la situación fue intermedia entre estos dos extremos se consideró como regular.
Se siguió la Clasificación Internacional Uniforme de Ocupaciones.18 De acuerdo a la recomendación del Grupo Nacional de Consenso en Obesidad19 se consideró obesidad cuando el resultado del índice de masa corporal fue mayor a 27. Como dato importante se tomaron los registros de peso al inicio del embarazo actual.
La atención prenatal se calificó en base al numero de visitas al médico durante el embarazo. Se consideró como una atención prenatal mala, si sólo llega a atenderse del parto y no se detectaron ni trataron las complicaciones; regular, cuando hubo de dos a cinco consultas prenatales, se logró documentar adecuadamente la gradación de la toxemia y hubo la oportunidad de corregir las posibles complicaciones del embarazo y buena, cuando hubo seis o más consultas prenatales, se hicieron determinaciones periódicas de laboratorio y ultrasonido y se previnieron o corrigieran las posibles complicaciones con oportunidad.20 Para la gradación de la toxemia se siquieron las recomendaciones de López Liera.5
Variables del producto
Para la calificación de Apgar21 se estableció la siguiente escala de graduación: Apgar >7: no hay asfixia; Apgar7: asfixia leve; Apgar5–6: asfixia moderada; Apgar<5: asfixia grave. Se aplicó la valoración de Silverman–Andersen.22 Para la valoración de la edad gestacional se utilizó la nueva valoración de Baílard y col.23 De acuerdo a la edad gestacional y peso al nacimiento se buscó la ubicación en las curvas de crecimiento intrauterino de Jurado–García y col.24
Diagnósticos sindromáticos
La encefalopatía hipóxica aguda se clasificó de acuerdo a los criterios de Sarnat, modificados por Finer.25 La terminología utilizada en el diagnóstico de la dificultad respiratoria fue la de Gómez y col.26 El criterio de hiperbilirrubinemia seguido fue el de Jasso.27 El criterio de hipoglucemia fue el de Cornblath y Schwartz.28 El criterio de hipocalcemia fue el de Tsang y col.29 La hemorragia periintraventricular se clasificó mediante el estudio ultrasonográfico transfontanelar de acuerdo a Papile y col.30 Para los fines del estudio sólo se evaluó su presencia. Se siguieron los criterios establecidos para el diagnóstico de hipertensión pulmonar.31 Se consideró anemia neonatal a la disminución del hematócrito por debajo de 40%.32 Se estableció septicemia neonatal de acuerdo a Mancilla.33
Análisis estadístico
La información se capturó en computadora personal; para el análisis se obtuvieron las frecuencias simples de las diferentes variables. Como medida de asociación se utilizó a la razón de momios (RM) y el intervalo de confianza al 95%, utilizando el paquete SPSS versión 8.34 El nivel de significancia considerado como válido fue con una p< 0.05. Se controlaron las posibles variables de confusión y se modelaron los datos significativos con regresión logística.
Resultados
Para una mejor claridad sólo se presentan los datos más relevantes.
Análisis simple (frecuencias de exposición).
En la figura 1 se presentan las estadísticas del Departamento de Pediatría. De los 19 óbitos portoxemia durante el lapso de estudio se descartaron dos por inmadurez y cuatro por ser gemelares, de manera que la muestra se integró con 13 casos. En el cuadro II se presentan las características principales de los óbitos.
De los 54 casos de muerte neonatal por toxemia se descartaron seis por gemelaridad y cuatro por la presencia de malformaciones congénitas mayores (dos con hidrocefalia, uno con drenaje venoso anómalo infradiafragmático y uno con labio leporino y paladar hendido y displasia frontonasal), así, para el estudio fueron útiles 44 casos. De ellos 27 fueron masculinos (61 %) y 17 femeninos (39%), relación M/F 1.58/1.
La edad materna en los casos fue en promedio de 26.79 ± 6.45, con límites de 17 a 44 años. En los controles fue en promedio de 27.24 ± 5.84, con límites de 15 a 43 años. Fueron menores de 20 años ocho casos (14%) y diez (8.8%) mujeres del grupo control; de 20 a 30 años de edad 32 casos (56.1 %) y 76 controles (66.7%) y mayores de 30 años 17 casos (29.8%) y 28 (24.6%) madres del grupo control.
De acuerdo a estado civil, predominó el estar casada con 42 casos (73.7%) y 90 controles (78.9%); fueron solteras tres del grupo casos (5.3%) y cuatro controles (3.5%) y en unión libre 12 casos (21%) y 13 controles (11.4%). De acuerdo a escolaridad fue menor a siete años (primaria) en 20 casos (35.1 %) y 22 controles (19.3%); de 7 a 15 años (intermedia) en 36 casos (63%) y 77 controles (67.5%) y mayor de 15 años (licenciatura) en un caso (1.7%) y en 15 controles (13%). En el cuadro III se presenta la ocupación materna.
Respecto a la paridad en los casos fue el primer embarazo en 24 (42%), de 2–5 en 30 (52.6%), y más de cinco en tres (5.3%). De los controles fue el primer embarazo en 55 (48.2%), de 2–5 en 56 (49.1 %) y más de cinco en tres (2.6%).
Hubo obesidad materna en 12 casos (21.5%) y en 17 controles (14.9%); de acuerdo a la distribución de IMC fue menor a 20 en dos casos (3.51 %) y ocho controles (7%); de 20 a 27 en 43 casos (75.4%) y 89 controles (78%); de 27 a 30 en siete casos (12.3%) y 13 controles (11.4%) y mayor a 30 en cinco casos (8.8%) y cinco controles (3.5%).
El número de visitas prenatales fue bueno en cinco casos (8.8%) y 18 controles (15.8%); regular en 32 casos (56.1%) y 76 controles (66.7%) y malo en 20 casos (35.1 %) y 20 controles (17.5%).
En los casos el grado de toxemia fue leve en uno (1.8%) y grave en 56 (98.2%), 19 de ellas (33.3%) con eclampsia. En los controles las 114 pacientes fueron con toxemia grave, 12 de ellas con eclampsia (10.5%) El tiempo de evolución de la toxemia en los casos fue menor a una semana en 23 (40%), de una a dos semanas en 17 (30%) y mayor a dos semanas en 17 (30%); en los controles fue con menos de una semana de evolución en 58 (51 %), de una a dos semanas en 24 (21 %) y mayor a dos semanas en 32 (28%). Durante el embarazo, no hubo otra complicación además de la toxemia en 27 casos (47%) y en 82 controles (72%). En el cuadro IV se presentan las otras complicaciones durante el embarazo.
La vía de nacimiento fue mediante cesárea en 54 casos (94.7%) y en los 114 controles. Tres casos (5.3%), todos ellos mortinatos, fueron obtenidos por vía vaginal. La anestesia utilizada fue el bloqueo peridural en 45 (79%) casos y en 108 controles (95%); se utilizó anestesia general en 12 casos (21%) yen seis controles (5.3%).
El sexo de los productos en los casos fue masculino en 36 (63%) y femenino en 21 (37%) para una razón IW F 1.71 y en los controles fue masculino en 70 (61%) y femenino en 44 (39%) para una razón M/F de 1.59.
De acuerdo a la calificación de Apgar al minuto del nacimiento se observó que en 17 casos (38.6%) y 19 controles (16.7%) fue <5; entre 5–7 en 22 casos (50%) y 70 controles (61.4%) y >7 en cinco casos (11.4%) y 25 controles (21.9%). El Apgara los cinco minutos fue <5 en cinco casos (11.4 %) y no hubo esta calificación en ningún control; fue entre 5–7 en 24 casos (54.5%) y en 27 controles (23.7%) y fue >7 en 15 casos (34.1 %) y 87 controles (76.3%).
De acuerdo a edad gestacional y peso al nacimiento los casos fueron clasificados en las curvas de crecimiento intrauterino de Jurado–García como de término y con peso adecuado dos (3.5%) ;pretérmino con peso adecuado 32 (56.1 %) y de pretérmino con peso bajo 23 (40.4%). De los controles dos (1.8%) fueron de término con peso bajo; 46 (40.3%) de pretérmino con peso adecuado y 66 (57.9%) de pretérmino con peso bajo. Cincuenta y cuatro (95%) casos y la totalidad de los controles fue de peso subnormal (<2,500g). Se apreció desnutrición in utero en 23 casos (40.4%) y 68 controles (59.6%).
Hubo encefalopatía hipóxica aguda en 26 casos (59%) y 32 controles (28%), de éstos fue de grado leve en dos casos y nueve controles; de grado moderado en siete casos y 14 controles y de gravedo severo en 17 casos y nueve controles.
Hubo complicaciones respiratorias en los 44 casos de muerte neonatal (síndrome de dificultad respiratoria 41, aspiración de meconio 2, taquipnea transitoria del recién nacido 1) y en 73 controles (64%) (síndrome de dificultad respiratoria 13, aspiración de meconio 1, taquipnea transitoria del recién nacido 59); fue necesario el uso de ventilación mecánica en 43 de los 44 casos(97.7%) y en 13 de los controles (14.4%) (Cuadro V). El cuadro VI se refiere a la presentación de otras complicaciones.
La duración de la estancia hospitalaria en los casos fue de 8.93 ± 9.63, con límites de uno a 30 días; en los controles fue en promedio de 31.52 ± 16 días, con valores extremos de cuatro a 70 días (se aclara que aunque el compromiso fue vigilar en los 28 días posteriores al nacimiento en la práctica se siguieron a todos los casos y controles hasta el alta hospitalaria).
Análisis bivariado
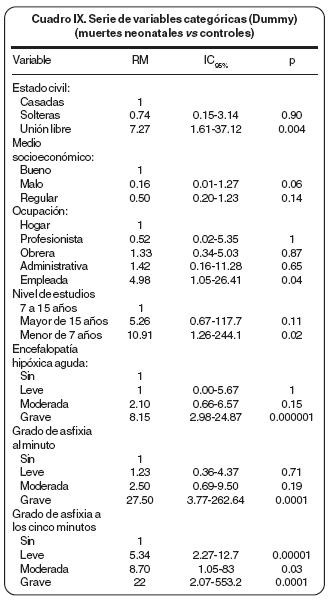
En el cuadro VII se presentan los resultados al análisis bivariado que fueron altamente significativos, de los cuales los dos últimos que se anotan son protectores. Con el objeto de un análisis con mayor detállese compararon las muertes neonatales (n= 44) con los controles (Cuadros VIII y IX).
Análisis multivariado
En el método directo se obtuvieron siete variables significativas, dos de ellas protectoras. Hubo colinearidad entre asfixia severa al minuto, asfixia grave a los cinco minutos y el uso de ventilación mecánica, por lo que se eliminaron las dos valoraciones de asfixia grave (al minuto y cinco minutos).
Posteriormente se procedió a la regresión logística por el método de Stepwise Backward, que fue eliminando variables y hubo colinearidad entre síndrome de dificultad respiratoria y asfixia grave a los cinco minutos (r= 78.7); entre síndrome de dificultad respiratoria y asfixia grave al minuto (r= 61 .2); entre asfixia grave al minuto y asfixia grave a los cinco minutos (r= 90.6), por lo que se retiró asfixia severa a los cinco minutos y anestesia general, que dejó de ser significativa. Finalmente se procedió a efectuar el modelo con las muertes neonatales (n=44) vs los controles (Cuadro X).
Cada modelo de regresión logística fue validado con la prueba de Hosmer–Lemeshow de bondad de ajuste obteniéndose para el primer modelo (enter) una X2 de 8.330, con 8 grados de libertad y una significancia de 0.402; para el segundo modelo (Backward) una X2 de 1.415, con 5 grados de libertad y una significancia de 0.923 y para el tercer modelo (muertes neonatales vs controles) una X2 de 3.694 con 2 grados de libertad y una significancia de 0.915. No se puede rechazar la hipótesis nula, por lo que se puede decir que los modelos resultantes son significativos y el coeficiente de regresión logística es diferente de 0 en cada uno de los casos.
Discusión
La toxemia del embarazo hasta la fecha es un síndrome de etiología desconocida que se presenta en el último trimestre del embarazo con hipertensión, edema y proteinuria; es la principal causa de mortalidad perinatal al ser responsable de trabajo de parto prematuro, desnutrición in útero, desprendimiento de placenta y otras complicaciones que en casos graves pueden llevar al fallecimiento del producto, ya sea in útero o al poco tiempo del nacimiento y en casos extremos puede ser también causa de fallecimiento materno.
Friedman y col.35 comentan que habitualmente en el embarazo hay una adaptación entre los tejidos maternos y fetales, lo que lleva a una tolerancia inmunológica, con cambios morfológicos y bioquímicos en la circulación general y uteroplacentaria. En la toxemia hay una mala adaptación inmunológica que condiciona un trastorno en la invasion del trofoblasto a las arterias espirales. La invasión incompleta con implantación deficiente del trofoblasto inhibe la dilatación de los vasos, lo que disminuye el flujo sanguíneo materno al espacio intervelloso, lo que reduce la perfusión y produce hipoxia. Se cree que el trofoblasto mal perfundido produce una sustancia hasta ahora desconocida, al parecer radicales libres,36–38 ocaciona disfunción y daño endotelial y lleva al síndrome clínico de la toxemia. Las células endoteliales dañadas liberan endotelina, un potente vasoconstrictor y producen una menor cantidad de óxido nítrico. Estos cambios, asociados con el daño endotelial llevan a vasoconstricción progresiva y agregación plaquetaria. Con el daño endotelial y la atenuación de la vasodilatación que ocurre habitualmente en el embarazo se observa una disminución en la tasa de filtración glomeruiar y del flujo plasmático renal, una liberación impedida de aldosterona y una mayor sensibilidad a angiotensina, lo que puede llevara hipertensión, edema y proteinuria.
El trabajo epidemiológico más extenso en toxemia del embarazo fue realizado en 1978 por Chesley39 y en las siguientes dos décadas se han publicado numerosas investigaciones clínicas y epidemiológicas, que han permitido aclarar algunos de los misterios que rodean a la toxemia.
Se ha estudiado ampliamente la asociación entre edad materna y el riesgo de toxemia. En una revisión de estudios publicados hasta 1980,40 se concluyó que el riesgo de toxemia se incrementa con el aumento en la edad materna. Las mujeres mayores de 35 años tienen de dos a cuatro veces mayor riesgo de toxemia que las de menor edad.41–43 Este efecto de la edad es más prominente entre personas de raza negra y en las multíparas y también se ha demostrado que la edad menor a 20 años, después de ajustar por paridad, no es por sí misma un factor de riesgo.41–43 La mayor incidencia de toxemia en la embarazada de mayor edad puede ser explicada en parte por la mayor incidencia de hipertensión arterial crónica aunque otros estudios han demostrado que la edad materna avanzada tiene un efecto independiente.44 Con la edad la colágena reemplaza de una manera progresiva el músculo normal en las paredes de las arterias del miometrio, de manera que a los 17–19 años las lesiones escleróticas de las arterias intramiometriales son del 11%, de los 20–29 años son del 37%, de los 30–39 años son del 61 % y en las mayores de 39 años llega hasta el 83%.45 Estos cambios no se alteran cuando se ajusta por paridad. Estas lesiones disminuyen la expansión intraluminal de las arterias y en consecuencia restringen el flujo placentario. Estos cambios atrofíeos en la microvasculatura de la mujer mayor también pueden producir una vascularización defectuosa de la decidua. La mala perfusión y la mala vascularización pueden tener un papel importante en la hipoxia placentaria y en el desarrollo de la toxemia.45 Los resultados del presente estudio muestran una diferencia significativa como factor de riesgo de mortalidad en casos y controles en el grupo de edad de 20–30 años. No hubo asociación cuando se compara este grupo con las mayores de 30 años ni con las menores de 20 años, aunque aquí el escaso tamaño muestral (ocho casos y tres controles) puede influir en los resultados.
La toxemia ocurre principalmente en la primípara (cerca del 50% de la casuística), que tiene de cuatro a cinco veces mayor riesgo de presentarla en comparación con la multípara.2 En ésta última se considera que la gravedad es menor y en la mayoría se trata de casos recurrentes. En las biopsias renales se han observado las lesiones histológicas típicas en 71 % de las primíparas y en 14% de las multíparas.45 No hubo resultados significativos en cuanto a la paridad aunque se observó quede los casos, en las primíparas 29% tuvieron eclampsia en comparación de 39% en las multíparas y de los controles, las primíparas presentaron 19% de eclampsia en comparación con 10% de las multíparas, lo que es acorde con lo reportado en la literatura.2,3
Está bien documentado que la mujer obesa que se embaraza presenta mayor incidencia de toxemia.2,3,45,47 En un estudio prospectivo48 se demostró que mujeres con un índice de Quetelet (IMC) mayor de 25.8 tienen un riesgo mayor de toxemia en comparación con aquellas con un índice de 18.9 a 25.8 (RM= 2.7, IC95% 1.2–6.2), mientras que la comparación con mujeres con un índice menor a 18.9 no fue significativa (RM 0.43, IC95% 0.13–1.4). En un estudio de casos y controles con toxemia grave se encontró que un IMC mayor a 32.3 presentó un riesgo aumentado de toxemia (RM= 3.5, ICg5% 1.7–7.5). Aunque se desconoce la causa básica se ha propuesto que la mujer obesa tiene un gasto cardiaco basal elevado y que éste se eleva aún más con el embarazo lo que puede rebasar la capacidad de vasodilatación compensatoria, de tal manera que desarrolla hipertensión como una manera de mantener el aumento en el flujo sanguíneo, lo que exacerba la lesión endotelial y lleva a las manifestaciones habituales de la toxemia.49 También es posible que la hiperlipidemia de la mujer obesa incremente la producción del peróxido lípido endotelial.49
La obesidad materna no es un factor de riesgo de mortalidad significativo, incluso cuando se desglosó por grupos de peso (menor de 50, de 50 a 70 y mayor a 70 Kg).
Dentro de los factores sociodemográficos en los que se incluyeron: estado civil, número de visitas prenatales, nivel socioeconómico, escolaridad y trabajo u ocupación materna los resultados en la literatura son contradictorios.16,50 Sin embargo, hay una tendencia a mayor frecuencia de toxemia, y de parto pretérmino, en la mujer de bajo nivel socioeconómico.48,50 En el presente estudio cuando el estado civil fue unión libre se observó una RM= 7.27, IC95% 1.61–37.12, p= 0.004; cuando el nivel socioeconómico se consideró malo la RM= 8.0, IC95% 1.02–170.24, p= 0.03; cuando el trabajo materno fue como empleada la RM=4.98, IC95% 1.05–26.41, p= 0.04; no hubo diferencia para las otras variantes del estado civil, de la ocupación materna ni para el número de visitas prenatales aunque predominaron claramente el estar casada (alrededor 80% de la casuística). Reconocemos que la población de la Institución es "privilegiada" ya que el requisito de derechohabiencia en la totalidad de casos y controles asegura que el Jefe de la Familia al menos tenga un ingreso de un salario mínimo. En el presente estudio predominó el nivel socioeconómico bajo (79% de los casos y 65% de los controles); la ocupación materna fundamental fue el hogar (70% en los casos y 60% en los controles) y el deficiente número de las visitas prenatales (más del 90% en los casos y más 80% en los controles). En donde los resultados fueron altamente significativos fue en la escolaridad materna ya que el riesgo de una escolaridad menor a siete años fue de 10.91, IC95% 1.26–244.1, p= 0.02 y hubo un factor protector de la alta escolaridad (RM= 0.12, IC95% 0.00–0.81, p= 0.01). De tal manera que en la mujer toxémica no se aprecia el perfil obstétrico ideal que sería mujer en edad óptima para la procreación (de los 18 a los 35 años), de buen nivel socioeconómico, con adecuado número de visitas prenatales, de una alta o buena escolaridad.
Las complicaciones durante el embarazo en la mujer toxémica se pueden dividir en dos grandes grupos: 1. Las complicaciones propias del embarazo como son la infección urinaria, las inserciones anormales de placenta, infección, ruptura prematura de membranas, y 2. Las complicaciones propias de la toxemia, entre las que se incluyen la evolución hacia las formas graves como son la eclampsia y el síndrome de Hellp y la presentación de un desprendimiento prematuro de una placenta que está insertada normalmente.32
En el estudio no hubo diferencia estadísticamente significativa entre los casos y controles en lo que se refiere a infección de vías urinarias, la presentación de placenta previa y la ruptura prematura de membranas. Tampoco hubo diferencia en la presentación de síndrome de Hellp y en cambio sí hubo una diferencia altamente significativa con eclampsia (RM= 4.25, IC95% 1.76–10.39, p= 0.0002) y el desprendimiento prematuro de placenta normoinserta (RM= 8.3, IC95%2.29–31.44, p= 0.00007).
Se recomienda como vía de nacimiento para los hijos de madres toxémicasa la cesárea bajo anestesia general. Así se evita el trabajo de parto y se obtiene un feto en mejores condiciones, en el que no se agudiza el sufrimiento fetal crónico por el trabajo de parto. También se prefiere la vía vaginal cuando el trabajo de parto está muy avanzado o en caso de óbito.5,6,16,51,52 En la serie el 95% de los casos y 100% de los controles fueron obtenidos por cesárea dejando la vía vaginal en tres casos (5%) en que había fallecido el producto. En la Unidad se utiliza como procedimiento anestésico más frecuente el bloqueo peridural con preferencias a la anestesia general, porque no produce hipotensión; cuando se requirió anestesia general ésta mostró un efecto negativo (RM= 5.32, IC95%1.74–16.91, p= 0.0005).
Respecto al sexo de los productos se confirma que cerca de dos terceras partes de la toxemia se presenta, en hombres y una tercera parte en mujeres, situación similar a otros estudios reportados.53,54 Se ha publicado que la toxemia tiene una mayor gravedad en casos de sexo masculino pero los resultados en el estudio no fueron significativos (RM 1.08, IC95% 0.53–2.19, p= 0.82).
La valoración de Apgar publicada en 195221 por la Dra. Virginia Apgar como un método rápido de evaluación del estado clínico del recién nacido, valora: frecuencia cardiaca, esfuerzo respiratorio, tono muscular, irritabilidad refleja y coloración. Inicialmente fue promovido con el fin de evaluar el estado general del recién nacido al minuto del nacimiento.55–57
Posteriormente Drague y col.58 sugirieron una evaluación a los cinco minutos para apreciar la eficacia de la reanimación neonatal. Es conveniente comentar que el tono muscular, el color y la irritabilidad refleja son dependientes de la madurez fisiológica por lo que un prematuro sano sin evidencia de hipoxia, acidemia o depresión cerebral puede tener una calificación de Apgar baja sólo por la prematurez. También puede ser afectado por medicamentos administrados a la madre y por condiciones propias del recién nacido que cursen con disminución del tono y del esfuerzo respiratorio, que se deben de tener en cuenta para la adecuada valoración .59,60 Revisiones posteriores indican que es útil en la detección de asfixia pero no estima su duración ni intensidad por lo que deben de utilizarse otros estudios complementarios para mejorar su validez, entre los que se incluyen la gasometría, con pH. PaO2y PaCO2.59,60
Los resultados del estudio fueron significativos para asfixia grave al minuto (Apgar <5) que se presentó en 39% de los casos y 17% de los controles (RM= 27.50, IC95%3.77–2672, p= 0.0001) y a los cinco minutos 11 % de los casos todavía tuvo un valor menor de cinco y en los controles no hubo pacientes con esta calificación. Resultó significativo en los tres grados (leve con RM= 5.34, IC95% 2.27–12.17, p= 0.00001, moderada con RM=8.70, IC95J 1.05–83, p= 0.03 y grave con RM= 22, IC95% 2.07–553, p= 0.001), en donde además se apreció un gradiente progresivo de riesgo.
Con base en nuestros resultados se puede decir que cuando la asfixia es grave al minuto del nacimiento ya hay una diferencia significativa y cuando hay asfixia a los cinco minutos el riesgo es significativamente mayor en los tres grados (leve–moderada–grave) con un gradiente directo, lo que quiere decir que a mayor asfixia hay una mayor razón de momios de complicaciones.
Respecto al peso la nacimiento, 95% de los casos y la totalidad de los controles fueron de peso subnormal (<2,500g), con un 10% menores de 1,000 g, 40% menores a 1,500 g y 50% entre 1500–2500 g. Cuando se valoró la edad gestacional cerca del 60% de los casos fueron prematuros extremos en comparación con 40% en los controles, mientras que la prematurez moderada predominó en 60% de los controles y menos del 40% de los casos. Cuando de acuerdo a edad gestacional y peso al nacimiento se clasificaron en las curvas de crecimiento intrauterino de Jurado Garcia24 fueron de pretérmino y con peso bajo 40% de los casos en comparación con 58% de los controles y pretérmino con peso adecuado 56% de los casos y 40% de los controles.
Está bien establecido el efecto de la toxemia materna sobre la frecuencia de desnutrición in útero3,5,50,52 y también se ha observado que es causa de nacimiento prematuro.61-63 Este evento se presentó en el 96% de los casos y en el 98% de los controles. Se define como retraso en el crecimiento intrauterino cuando el feto no ha alcanzado el crecimiento potencial para una edad gestacional dada, puede estar condicionado por uno más factores causales.64 Depende de un corte arbitrario en la centila 3 ó 10 del peso correspondiente para la edad gestacional. Más del 70% de los casos están dados por factores constitucionales como la raza, paridad, peso o talla maternas. En un estudio de 1,650 desnutridos in utero.65 Se demostró una relación directa entre una colocación en las centilas inferiores y el aumento en la mortalidad perinatal. Se puede decir que el corte en la centila 5 de peso para la edad gestacional se define como de una alta probabilidad de tener un feto comprometido. Se considera que la tasa de mortalidad perinatal se incrementa ocho veces si el feto queda en la centila 3 a 10 y es mayor de 20 veces si queda por debajo de la centila 3, por lo que se puede decir que el concepto de desnutrición in utero como responsable de una mayor mortalidad perinatal y neonatal está bien establecido.66
Uno de los hallazgos interesantes de este estudio es el efecto protector para mortalidad en el hijo de madre toxémíca de la desnutrición intrauterina. Cuando se compararon óbitos y muertes neonatales (n=57) vs controles (RM=0.46,IC95% 0.23–0.92p=0.001) la diferencia fue significativa, igual que cuando se compararon solo las muertes neonatales (n=44) vs los controles (RM= 0.39, IC95% 0.18–0.84 p= 0.008).
Respecto a las complicaciones respiratorias, se conoce que el peso bajo condiciona más del 50% de las muertes neonatales y que el síndrome de dificultad respiratoria por deficiencia del factor surfactante pulmonar es la causa más común responsable de esas muertes.67,68 De los casos, 93% cursó con membrana hialina (RM= 22.68, IC95%3.31 –478, p= 0.00004) y cerca del 5% con aspiración de meconio, el factor común fue que se requirió asistencia mecánica a la ventilación (RM=334.08, IC95% 42.63–7084, p 0.00000001). Se apreció como un factor importante la complicación con hemorragia pulmonar (RM= 8.40, IC95% 2.71–27.11, p= 0.000001) en una tercera parte de los casos y la complicación con hipertensión pulmonar de un 11 %. En contraste, en los controles el principal proceso respiratorio fue la taquipnea transitoria del recién nacido (52%), se complicaron con hemorragia pulmonar el 5%, requirieron asistencia mecánica a la ventilación el 11 %, no hubo hipertensión pulmonar y no hubo alteración respiratoria en 36%.
Por cerca de 30 años se ha considerado que el hijo de madre toxémica tiene una maduración pulmonar acelerada como respuesta al estrés intrauterino.68 Esta creencia se basa en parte en estudios con animales en donde la disminución de la oxigenación uterina se asocia con niveles elevados de hormonas de estrés y con un reforzamiento en la maduración pulmonar.69 La clínica también apoya esta aseveración, incluso en nuestro estudio previo6 de 100 neonatos hijos de madre toxémica atendidos en un servicio de prematuros, en 30 de ellos hubo dificultad respiratoria, 20 por taquipnea transitoria del recién nacido y 10 por neumonía por aspiración de meconio, no hubo casos de membrana hialina. En la presente serie la menor edad gestacional de ambos grupos, con una tercera parte del total con membrana hialina de tal gravedad que ameritó asistencia mecánica a la ventilación sugiere que por la toxemia no hay maduración pulmonar antes de las 32 semanas de gestación y que el síndrome de dificultad respiratoria en estos productos es similar al que se presenta en el prematuro que no es hijo de madre toxémica. Un hallazgo interesante como efecto protector de mortalidad es el diagnóstico de taquipnea transitoria del recién nacido, con resultados altamente significativos (RM= 0.021, IC95%0.00–0.15,p=0.00000001).
La septicemia en el neonato que inicialmente se comporta como un factor de riesgo significativo (RM= 3.12, IC95% 1.13–8.64, p= 0.01, con el corrimiento de la regresión logística se torna en factor protector para mortalidad tanto en el modelo final por el método directo (beta–2.25, RM= 0.10, IC95%0.025–0.441 ,p= 0.002) como en el "stepwise backward" (beta=–1.91, RM=0.14, IC95% 0.029–0.747, p=0.04), situación que es plausible desde el punto de vista clínico por la maduración pulmonar acelerada que se presenta en estos pacientes.26,33
Respecto a las otras complicaciones que presentaron los neonatos en la serie, la ictericia, hipoglucemia, hipocalcemia tuvieron un patrón de comportamiento similar, tanto en casos como en controles, al del prematuro hijo de madre sin toxemia.70 Es notable la ausencia de otras complicaciones en 43% de los casos y en la mitad de los controles.
Por definición el hijo de madre toxémica es un homigénito sometido a hipoxia crónica, que puede presentar desde el punto de vista clínico varios órganos de choque, el principal el cerebro con encefalopatía hipóxica aguda, síndrome que se detectó en 60% de los casos nacidos vivos y en menos de 30% de los controles, diferencia estadísticamente significativa (RM= 3.70, IC95% 1.69–8.18, p=0.0002), con mayor significancia en la forma severa (RM= 8.15, IC95% 2.58–24.87, p=0.000001). Patrón similar de comportamiento tuvo la insuficiencia renal aguda que se presentó en una tercera parte de los casos y en menos del 2% de los controles (RM=26.13, IC95%5.21–176.79,p=0.0000002).
La anemia se observó con una mayor frecuencia en la presente serie, con 30% en los casos en comparación con el 10% en los controles (RM=3.56, IC95% 1.36–9.42, p=0.003). La explicación para ello es que independientemente de la gravedad, la presencia de sangrados (intraventricular) y la toma de productos de laboratorio para su vigilancia y control (biometrías, gasometrías, etc) son factores significativos.
La presentación de hemorragia perintraventricular en un neonato prematuro en estado crítico es un evento desfavorable que frecuentemente condiciona mortalidad, se presentó en cerca de 40% de los casos y sólo en un control, esta diferencia es altamente significativa (RM= 64.57, IC95% 8.36–1361, p= 0.0000001). Los resultados son similares a los informados en la literatura71–74 en donde los defectos de base son la poca edad gestacional y la presentación de hipoxia importante.
Finalmente, en el análisis multivariado se obtuvieron tres modelos de variables que al actuar en conjunto explican el fallecimiento del producto hijo de madre toxémica. Cuatro variables maternas fueron significativas: presentación de eclampsia, el desprendimiento prematuro de placenta normoinserta, el uso de anestesia general y la propia muerte materna; del producto quedaron en primer lugar el síndrome de dificultad respiratoria, la necesidad de ventilación mecánica y la hemorragia peri–intraventricular. Finalmente es conveniente comentar el hecho de que la alta escolaridad materna, el observar desnutrición in utero y la presencia de taquipnea transitoria del recién nacido tienen un efecto protector para mortalidad, que resultó altamente significativo.
Referencias
1. Gant NF, Worley RJ. Hipertensión en el embarazo. Conceptos y tratamiento. México: El Manual Moderno; 1982. [ Links ]
2. Zuspan FP. Nuevos conceptos en el conocimiento de las enfermedades hipertensivas durante el embarazo. Panorama actual. Clin Perinatol 1991; 18:637–43. [ Links ]
3. Zhang J, Zeisler J, Hatch MC, Berkowitz G. Epidemioiogy of pregnancy–induced hypertension. Epidemiol Rev 1997;19:218–32. [ Links ]
4. Tañer CE, Hakverdi AU, Aban M, Erden AC, Ozelbaykal U. Prevalence, management and outcome in eclampsia. Int J Gynecol Obstet 1996;53:11–5. [ Links ]
5. López–Llera MM. La toxemia del embarazo. Lecciones básicas. 2a. ed. México: Editorial Limusa; 1990. [ Links ]
6. Gómez–Gómez M, Cruz–Bolaños JA, Jiménez–Balderas EA, Tudón–Garcés H. Recién nacido hijo de madre toxémica (fetopatía toxémica). Bol Med Hosp Infant Mex 1985; 42:179–87. [ Links ]
7. Sibai BM, Caritis SN, Thorn E. Prevention of preeclampsia with low–dose aspirin in healthy nulliparous pregnant women. N Engl J Med 1993;329:1213–8. [ Links ]
8. Carroli G, Duley L, Belizan JM. Calcium supplementation during pregnancy: a systematic review of randomized controlled trials. Br J Obstet Gynecol 1994; 101:753–8. [ Links ]
9. Saftlas AF, Olson DR, Frank AL. Epidemioiogy of preeclampsia and eclampsia in the United States 1979–1986. Am J Obstet Gynecol 1989;163:460–5. [ Links ]
10. Douglas KA, Redman CW. Eclampsia in the United Kingdom. Br Med J 1994; 309:1395–400. [ Links ]
11. Lindberg BS. Epidemioiogy of hypertension during pregnancy. Int J Technol Asses Health Care 1992; 8(Supll):57–62. [ Links ]
12. Mortalidad 1996. México: Subsecretaría de Planeación. Dirección General de Estadística e Informática, 1998. [ Links ]
13. Reyes–Frausto S, Lezana–Fernández MA, García–Peña MC, Bobadilla–Fernández JL. Maternal mortality regionalization and trend in Mexico (1937–1995) Arch Med Res 1998;29;165–72. [ Links ]
14. Ahumada–Ramírez E, Sánchez–García L. Informe estadístico anual del Departamento de Pediatría, Hospital de Gineco–Obstetricia #3, Centro Médico La Raza. México: Instituto Mexicano del Seguro Social; 1999. [ Links ]
15. Sánchez–Rangei JP, Mendoza–Meixueiro F, Zavala–Martínez E, Gómez–Gómez M. Atención del parto pretérmino. En: Gómez–Gómez M, editor. Temas selectos sobre el RN prematuro. México: Distribuidora y Editora Mexicana; 1996 pp.121–50. [ Links ]
16. Gómez–Gómez M. Fetopatía toxemica. En: Gómez–Gómez M, editor. Temas selectos sobre el RN prematuro. México: Distribuidora y Editora Mexicana; 1996 pp. 104–9. [ Links ]
17. Bronfman M, Guiscafré H, Castro V, Castro R, Gutiérrez G. La medición de la desigualdad: una estrategia metodológica. Análisis de las características socioeconómicas de la muestra. Arch Invest Med 1988;19:351–60. [ Links ]
18. Clasificación Internacional Uniforme de Ocupaciones. Berna, Suiza: Organización Internacional del Trabajo, 1968. [ Links ]
19. Gushiken R, González–Barranco J. Importancia de la valoración del paciente con obesidad. Rev Endocrinol Nutr 1995; 3:13–6. [ Links ]
20. Nuñez–Maciel E, editor. Obstetricia y ginecología. 3a. ed. México: Méndez Cervantes; 1997. [ Links ]
21. Apgar V. A proposal for a new method of evaluation of the newborn infant. Curr Res Anesth Analg 1953; 32:260–7. [ Links ]
22. Silverman WA, Andersen DH. A controlled clinical trial of effects of water mist on obstructive respiratory signs: death rate and necropsy findings among premature infants. Pediatrics 1956;17:1–10. [ Links ]
23. Ballard JL, Ichovry JC, Weding K, Wang L, Elders–Walshman BL, Lift R. New Ballard score, expanded to include extremeiy premature infants. J Pediatri 1991; 119:417–23. [ Links ]
24. Jurado–García E, Abarca–Arroyo A, Osorio–Roldán C, Campos–Ordaz R, Saavedra–Mújica A, Alvarez de los Cobos J, Parra–Jiménez S. El crecimiento intrauterino. Bol Med Hosp Infant Mex 1970; 27:163–78. [ Links ]
25. Finer NN, Robertson CM, Richards RT, Pinneli LE, Peters KL. Hypoxic ischemic encephalopathy in term neonates: perinatal factors and outcome. J Pediatr 1981 ;98:112–7. [ Links ]
26. Gómez–Gómez M, Danglot–Banck C, Udaeta–Mora E. Diagnóstico diferencial de la dificultad respiratoria en el recién nacido. En: Gómez–Gómez M, Danglot–Banck G, editores. Temas de actualidad sobre el recién nacido. México. Distribuidora y Editora Mexicana; 1997. pp.363–76. [ Links ]
27. Jasso–Gutiérrez L. Neonatología práctica. 4a. ed. México: Manual Moderno; 1995. [ Links ]
28. Cornblath M, Schwartz R. Disorders of carbohydrate metabolism in infancy. 2nd ed. Philadelphia, PA, USA: WB Saunders Company, 1976. [ Links ]
29. Tsang RC, Steichen JJ, Brown DR. Homeostasis perinatal del calcio: hipocalcemia y desmineralización ósea en el período neonatal. Clin Perinatol 1977;4:385–403. [ Links ]
30. Papile LA, Burstein J, Burstein R. Incidence and evaluation of subependymal hemorrhage. A study of infants with birth weights less than 1,500g. J Pediatr 1978; 92:529–34. [ Links ]
31. Manual de Normas y Procedimientos de Pediatría Perinatal. Subdirección General Médica. México: Instituto Mexicano del Seguro Social; 1987:222–5. [ Links ]
32. Oski FA, Naiman Jl. Hematologic problems in the newborn. 2a. ed. Philadelphia, PA. USA: WB Saunders Company; 1972. [ Links ]
33. Mancilla–Ramírez J. Sepsis neonatal. En: Gómez–Gómez M, Danglot–Banck C, editores. Temas de actualidad sobre el recién nacido. México: Distribuidora y Editora Mexicana; 1997: 219–41. [ Links ]
34. SPSS 8.0 for Windows. Chicago: SPSS Inc., 1997. [ Links ]
35. Friedman SA, Taylor RN, Roberts JM. Pathophysiology of preeclampsia. Clin Perinatol 1991; 18:661–82. [ Links ]
36. Zeeman GG, Dekker GA. Pathogenesis of preeclampsia: a hypothesis. Clin Obstet Gynecol 1992; 35:317–37. [ Links ]
37. Halliwell B. Free radicals, antioxidants, and human disease: curiosity, cause or consequence? Lancet 1994; 344:721–4. [ Links ]
38. de Groot CJM, O'Brien TJ, Taylor RN. Biochemical evidence of impaired trophoblastic invasion of decidual stroma in women destined to have preeclampsia. Am J Obstet Gynecol 1996;175:24–9. [ Links ]
39. Chesley LC. Hypertensive disorders in pregnancy. New York: Appleton Century Crofts, 1978. [ Links ]
40. Hansen JP. Older maternal age and pregnancy outcome: a review of the literature. Obstet Gynecol Surv 1986; 41:726–42. [ Links ]
41. Savitz DA, Zhang J. Pregnancy–induced hypertension in North Carolina, 1988 and 1989. Am J Public Health 1992;82:675–9. [ Links ]
42. Seidman DS, Samueloff A, Mor–Yosef S. The effect of maternal age and socio–economic background on neonatal outcome. Int J Gynecol Obstet 1990; 33:7–12. [ Links ]
43. Bobrowski RA, Bottoms SF. Underappreciated risks of the elderly multípara. Am J Obstet Gynecol 1995; 172:1764–70. [ Links ]
44. Naeye RL. Maternal age, obstetric complications, and the outcome of pregnancy. Obstet Gynecol 1983; 61:210–6 [ Links ]
45. McCartney CP. Pathological anatomy of acute hypertension of pregnancy. Circulation 1964; 30(Suppl 1):37–52. [ Links ]
46. Ruge S, Andersen T. Obstetric risk in obesity: an analysis of the literature. Obstet Gynecol Surv 1985; 40:57–60. [ Links ]
47. Tilton Z, Hodgson Ml, Donoso E. Compilations and outcome of pregnancy in obese women. Nutrition 1989; 5:95–9. [ Links ]
48. Sibai BM, Gordon T, Thorn M. Risk factors for preeclampsia in heaithy nulliparous women: a prospective multicenter study. Am J Obstet Gynecol 1995; 172:642–8. [ Links ]
49. StoneJL, LockwoodCJ,BerkowitzGS. Risk factors for severe preeclampsia. Obstet Gynecol 1994; 83:357–61. [ Links ]
50. Berkowitz GS, Papiernik E. Epidemiology of preterm birth. Epidemiol Rev 1993; 15:414–43. [ Links ]
51. Flores–Nava G, Joachin–Roy H. Evaluación del neonato en estado crítico, hijo de madre con preeclampsia/eclampsia (toxemia del embarazo). Ginecol Obstet Mex 1997; 65:56–8. [ Links ]
52. Flores–Nava G, Lino–Araujo MC, López–Padilla M. Morbilidad y mortalidad en neonatos de madres con preeclampsia severa. Rev Mex Pediatr 2002; 69:14–8. [ Links ]
53. López–Llera MM. Eclampsia and fetal sex. Int J Gynecol Obstet 1990; 33:211–3. [ Links ]
54. Soriano–Sánchez AR, Valdéz–Macho JE, Valdés–Estrada H, Lara–González AL. ¡El sexo del feto determina la severidad de la preeclampsia–eclampsia? Ginecol Obstet Mex 1996; 64:18–20. [ Links ]
55. Apgar V, Holaday DA, James LS, Weisbrot IM, Berrien C. Evaluation of the newborn infant: second report. JAMA 1958; 168:1985–8. [ Links ]
56. Catlin EA, Carpenter MW, Brann BS. The Apgar score revisited: influence of gestational age. J Pediatr 1986; 109:865–8. [ Links ]
57. Nelson KB, Ellenberg JH. Apgar scores as predictors of chronic neurologic disability. Pediatrics 1981; 68:36–44. [ Links ]
58. Drage JS, Kennedy C, Schwartz BK. The Apgar score an index of neonatal mortality: a report from the collaborative study of cerebral palsy. Obstet Gynecol 1964; 24:222–30. [ Links ]
59. American Academy of Pediatrics. Use and abuse of the Apgar score. Pediatrics 1996; 98:534–7. [ Links ]
60. Fernández–Carrocera LA, Flores–Támez E, Salinas–Ramírez V, Bravo–Cabrera Z, Venta–Sobero JA, Udaeta–Mora E, Ugartechea JC, Lozano–González CH. El puntaje de Apgar como predictor de secuelas neurológicas. Bol Med Hosp Infant Mex 1989; 46:554–8. [ Links ]
61. Kramer MS, McLean FH, Eason EL. Maternal nutrition and spontaneous preterm birth. Am J Epidemiol 1992; 136:574–83. [ Links ]
62. Guzick DS, Daikoku NH, Kaltreider DF. Predictability of pregnancy outcome in preterm delivery. Obstet Gynecol 1984; 63:645–50. [ Links ]
63. Hartikainen–Sorri AL, Sorri M. Occupational and socio–medical factors in preterm birth. Obstet Gynecol 1989; 74:13–6. [ Links ]
64. Lin CC, Santolaya–Forgas J. Current concepts of fetal growth restriction: Part 1. Causes, classification and pathophysiology. Obstet Gynecol 1998; 92:1 044–55. [ Links ]
65. Manning FA. Intrauterine growth retardation. In: Manning FA, editor. Fetal medicine. Principle and practice. Norwalk, CT, USA: Appleton and Lange; 1995. pp.307–393. [ Links ]
66. Scott KE, Usher RF et al. Malnutrition: its incidence, causes and effect. Am J Obstet Gynecol 1966; 94:951–63. [ Links ]
67. Lee KS, Khoshnood B, Wall SN, Chang YP, Hsieh HL, Singh JK. Trend in mortality from respiratory distress syndrome in the United States, 1970–1995. J Pediatr 1999; 134:434–40. [ Links ]
68. Yoon JJ, Kohl S, Harper RG. The relationship between maternal hypertensive disease of pregnancy an the incidence of idiopathic RDS. Pediatrics 1980; 65:735–9. [ Links ]
69. Boddy K, Jones C, Mantell C. Changes in plasma ACTH and corticosteroid of the maternal and fetal sheep during hypoxia. Endocrinology 1974; 94:588–91. [ Links ]
70. Gómez–Gómez M. Morbimortalidad en un servicio de prematuros. Bol Med Hosp. Infant Mex 1986; 43:292–9. [ Links ]
71. Corzo–Pineda JAD, Jurado–Hernández VH, Acosta–Rosales A. Factores de riesgo perinatal y correlación con la incidencia de hemorragia penintraventricular temprana en neonatos con peso menor a 1500 g. Ginecol Obstet Mex 1997; 65:465–9. [ Links ]
72. Ruelas–Orozco G, Guzmán J, Malacara HJM. Los factores de riesgo de la mortalidad perinatal en un estudio de casos y controles. Bol Med Hosp Infant Mex 1985 ;42:153–8. [ Links ]
73. Chávez–Rojas G, Lozano–Castañeda VO, Gómez–Gómez M, Peralta–Ramírez MJ, Valdez–Alanis A, Vidal–Balboa S. Correlación de los antecedentes obstétricos con la mortalidad neonatal. Bol Med Hosp Infant Mex 1986; 43:359–63. [ Links ]
74. Flores–Nava G, Joachin–Roy H, López–Padilla MG, Corzo–Pineda JAD, Ramírez–García LA. Factores de riesgo perinatal para mortalidad en el neonato de alto riesgo. Ginecol Obstet Mex 1998; 66:440–3. [ Links ]














