Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.36 no.2 Ensenada jun. 2010
Captura incidental y mortalidad de tortugas marinas en la pesquería industrial de camarones por arrastre en el noreste de Venezuela*
Incidental capture and mortality of sea turtles in the industrial shrimp trawling fishery of northeastern Venezuela
JJ Alió*, LA Marcano, DE Altuve
Ministerio del Poder Popular para la Agricultura y Tierras, Instituto Nacional de Investigaciones Agrícolas (INIA), Centro de Investigaciones Agrícolas de Sucre y Nueva Esparta, Apartado 236, Cumaná, 6101, Estado Sucre, Venezuela. *E–mail: jalio@inia.gob.ve
Received November, 2009
Accepted April, 2010
RESUMEN
La captura incidental de tortugas marinas por parte de la flota industrial de arrastre camaronera en el noreste de Venezuela se documenta, basada en datos recogidos por observadores a bordo desde febrero de 1991 hasta noviembre de 2000. Se realizaron 275 viajes, que totalizaron 55,992 h de arrastre, ya fuera con una o dos redes de 20 m de relinga superior, lo cual equivale a 59,744 h red estd.–1 de 30.5 m de longitud de relinga superior. En total se capturaron 63 tortugas: 20 Eretmochelys imbricata, 20 Chelonia mydas, 15 Caretta caretta y 8 Dermochelys coriacea. Todas las especies mostraron una distribución amplia entre la costa central del Mar Caribe y la costa Atlántica de Venezuela, pero siempre fueron capturadas en áreas cercanas a la costa y no más profundas de 82 m; D. coriacea tuvo una distribución más concentrada hacia la región Atlántica del país. La CPUE estimada para las cuatro especies, utilizando valores no estandarizados de esfuerzo, fue 0.0011 ± 0.0003 tortugas h–1 red estd., lo que sería equivalente a una tortuga por cada 930 ± 11 h de arrastre con red estandár. La variación en las capturas a lo largo del año no fue significativa (χ2 = 1.29; P = 0.73), excepto para D. coriacea, la cual solamente fue capturada entre enero y mayo. No se observó diferencia significativa en la captura de tortugas de día o de noche. La razón de mortalidad directa alcanzó 19 ± 9.7%, desconociéndose la razón real de mortalidad causada por las capturas incidentales. La mayoría de los ejemplares capturados por arrastreros venezolanos fueron juveniles que probablemente usan el área como sitio de alimentación. Considerando un esfuerzo total promedio por la flota de 310,000 h ± 16,500 red estd. año–1, un estimado de la captura general de tortugas, antes de que el uso del dispositivo excluidor de tortugas de las redes se hiciera obligatorio en 1994, sería 330 ± 4 individuos por año, con una mortalidad directa asociada de 63 ± 30 tortugas. Esta tasa de captura sería la más baja entre los países donde se han efectuado evaluaciones similares (Australia, Colombia, Costa Rica y EUA).
Palabras clave: estructura de tallas, CPUE, distribución, Mar Caribe.
ABSTRACT
The incidental capture of sea turtles by industrial shrimp trawlers off eastern Venezuela is documented, based on data gathered by on–board observers from February 1991 through November 2000. A total of 275 trips were made, with a total of 55,992 h of trawling using either one or two normal nets of 20–m headrope length, equivalent to 59,744 h std. net–1 of 30.5 m upper rope length. In total, 63 turtles were captured: 20 Eretmochelys imbricata, 20 Chelonia mydas, 15 Caretta caretta, and 8 Dermochelys coriácea. All these species showed a wide distribution along the central Caribbean Sea and Atlantic coasts of Venezuela, but they were always caught in areas close to shore and not deeper than 82 m; the distribution of D. coriacea was more concentrated towards the Atlantic zone. The estimated CPUE for all four species, using non–standardized effort values, was 0.0011 ± 0.0003 turtles h–1 std. net, equivalent to one turtle per 930 ± 11 h std. net. The variation in captures throughout the year was not significant (χ2 = 1.29; P = 0.73), except for D. coriacea, which was only caught between January and May. No significant difference was observed between the capture of turtles during the day or night. Direct mortality ratio reached 19 ± 9.7%; the actual ratio of mortality caused by incidental capture is not known. Most individuals caught by Venezuelan trawlers were juveniles that most probably use the area as feeding grounds. Considering an average effort by the fleet of 310,000 ± 16,500 h std. net yr–1, an estimate of turtle capture before the use of turtle excluder devices was made mandatory in 1994 would be about 330 ± 4 ind yr–1, with an associated direct mortality of 63 ± 30 turtles. This capture rate would be the lowest among the countries where similar evaluations have been performed (Australia, Colombia, Costa Rica, and USA).
Key words: size structure, CPUE, distribution, Caribbean Sea.
INTRODUCCIÓN
Se reporta que las aguas de Venezuela albergan a cinco especies de tortugas marinas: cabezona, Caretta caretta (Linnaeus 1758); verde, Chelonia mydas (Linnaeus 1758); carey, Eretmochelys imbricada (Linnaeus 1766); caguama, Lepidochelys olivacea (Eschscholtz 1829); y cardón o baula, Dermochelys coriacea (Vandelli 1761) (Pritchard y Trebbau 1984, Guada y Vernet 1992, Quijada 2004). Todas estas especies son consideradas amenazadas de acuerdo a la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN por sus siglas en inglés) y al Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES), que prohibe el comercio internacional de materiales provenientes de estas especies. El gobierno de Venezuela también ha adoptado regulaciones específicas para prohibir el comercio doméstico de tortugas marinas, sus partes o productor derivados (Gaceta Oficial de la República de Venezuela, 1996a, b). También ha promovido la protección de nidos y playas de anidación (Guada y Sole 2000, Quijada y Valladares 2004), y proporcionó protección especial como, por ejemplo, suscribiéndose a la Convención Interamericana para la Protección y Conservación de las Tortugas Marinas (Gaceta Oficial de la República de Venezuela, 1998).
Se ha considerado que la captura incidental en artes de pesca está entre las principales fuentes de daños y mortalidad de tortugas marinas (NRC 1990; FAO 2004a, b; Brazner and McMillan 2008; Shillinger et al. 2008; Tomás et al. 2008). Aunque en Venezuela no existen pesquerías comerciales directamente orientadas hacia las tortugas marinas, estos animales son capturados para consumo propio por comunidades indígenas localizadas en el noroeste del Golfo de Venezuela (Montiel–Villalobos et al. 2007); y son incidentalmente capturadas por pescadores artesanales que usan redes a la deriva (Medina et al. 1987), por la flota industrial camaronera de arrastre (Marcano y Alió 2000) y por las embarcaciones atuneras de palangre (Alió et al. 2007). Los esfuerzos para proteger a las tortugas marinas incluyen limitaciones al comercio interno de estos animales o partes derivadas de ellos, la protección de los nidos y sitios de anidamiento, la incubación de huevos y liberación controlada de juveniles (Guada y Sole 2000), y el empleo de dispositivos excluidores de tortugas (TEDs) en redes de arrastre (Gaceta Oficial de la República de Venezuela, 1993). Un problema fundamental en la evaluación del estado de las poblaciones de tortugas marinas es la dificultad para estimar el tamaño de las poblaciones y su estructura (Gerrodette y Taylor 2000). Las tortugas marinas se observan usualmente cerca de la costa durante los periodos reproductivos, pero los animales así detectados son principalmente individuos sexualmente maduros. Las tortugas atrapadas incidentalmente en las artes de pesca, particularmente en las redes de arrastre o en palangres, pueden proveer una información valiosa para estimar la estructura de la talla poblacional en áreas no reproductivas.
La flota industrial de arrastre en Venezuela, orientada al camarón y otros recursos del fondo marino, operó desde comienzos de los años 1950 hasta marzo 2009. Las áreas de operación se localizaron en las plataformas marinas del occidente y oriente, extendiéndose esta última hacia el delta del río Orinoco. Dicha flota estuvo compuesta por un máximo de 449 embarcaciones en 1991, con esloras de 15–33 m, todas las cuales utilizaron el sistema de pesca tipo Florida: con una red en cada costado del barco (Marcano 1990, Altuve et al. 1999). Durante el periodo de estudio, el número de embarcaciones en la flota oriental varió de 232 en 1991 a 187 en 1996–2000. Los desembarques de esta flota alcanzaron 11,200 t en 2000 e incluyeron un conglomerado de 41 especies, entre las cuales los peces representaron 78% en peso, el camarón 11%, los moluscos 10.8% y los cangrejos 0.2% (INAPESCA–Venezuela 2001). Se estimó que solo se desembarcó entre 35% y 45% del total de la captura, dependiendo de la región de operación; el resto estuvo compuesto principalmente por peces moribundos o muertos con poco o ningún valor comercial y fue descartado en el mar (Marcano et al. 1989, Marcano 1990).
En 1991, los Estados Unidos de Norteamérica comenzó a aplicar un embargo sobre las importaciones de camarón provenientes de países tropicales que no utilizaran redes de arrastre camaroneras equipadas con TEDs. En ese momento, la captura de tortugas marinas en Venezuela, tanto por parte de la flota artesanal como de la industrial, era solamente conocida por observaciones casuales, tales como la devolución de marcas aplicadas a las tortugas que anidaban en otros países, a través de encuestas a pescadores (Medina et al. 1987) y de manera anecdótica. Por ello, se efectuó un estudio para estimar la tasa real de captura de tortugas por la flota de arrastre en aguas venezolanas y se determinaron las variaciones estacionales y geográficas de este parámetro. Este reporte presenta los resultados de la región oriental de Venezuela.
MATERIALES Y MÉTODOS
El estudio incluyó las tres áreas tradicionales de pesca de camarón y recursos del fondo marino en el oriente de Venezuela: la plataforma Píritu–Unare, la costa desde el norte de la Isla de Margarita al norte del estado Sucre, y el suroeste del Golfo de Paria hasta el delta del río Orinoco (fig. 1).
Entre febrero 1991 y noviembre 2000 se colocaron observadores individuales a bordo de 46 embarcaciones comerciales de arrastre, entre una flota de 200 embarcaciones en promedio. Las embarcaciones tenían una disposición de las redes de pesca según el tipo Florida (tal como describen Epperly et al. 2002), la cual incluye una red semi–balón con una relinga superior de 20 m a cada lado de la embarcación. La duración de los arrastres fue de 3 a 5 h, con una duración promedio de 3.5 h; las campañas de pesca tuvieron una duración de 14 días cerca de la plataforma Unare–Píritu y la Isla de Margarita, a 20 días frente al delta del Río Orinoco, promediando unos 17 días. Los observadores registraron, entre otras tareas, la captura de tortugas marinas en 155 viajes de 1991 a 1993, equivalente a 35,118 h de arrastre, o a un estimado de 2.6% del esfuerzo de pesca total en el oriente de Venezuela en esos tres años. Desde que el uso del TED se hizo obligatorio en enero 1994 (Gaceta Oficial de la República de Venezuela, 1993), se efectuaron 120 viajes adicionales de 1994 a 2000, en los cuales una de las dos redes en cada barco tenía instalado un TED rígido pasivo tipo Supershooter (Mitchell et al. 1995). Este tipo de TED fue el más usado en la flota de arrastre venezolana, y tiene forma ovalada, con dimensiones 167 × 114 cm, construido con barras de aluminio de diámetro 1.27 cm. La otra red carecía de algún dispositivo para excluir la captura incidental. Durante el segundo periodo, los datos de los observadores comprendieron un total de 20,874 h de arrastre, que equivale a un estimado de 0.6% del esfuerzo total de la flota en el oriente de Venezuela durante esos siete años. El esfuerzo fue estandarizado a esfuerzo realizado por una sola red con relinga superior de 30.5 m para comparar las tasas de captura con otros estudios (Henwood and Stuntz 1987, Goodman 1988, Poiner et al. 1990, Robins 1995). La fórmula utilizada para calcular el esfuerzo con la red estándar (f) fue:
f = nt (H/30.5 m)
donde n es el número de redes sin TED, t es la duración de las caladas (h) y H es la longitud de la relinga superior (m). De esta manera, la muestra total alcanzó a 55,992 h de arrastre, lo cual equivale a 59,744 h de red estandarizada (46,056 h de arrastre con dos redes de 20 m de relinga superior durante el primer periodo + 13,688 h de arrastre con una red durante el segundo periodo).
El programa de observadores comenzó en 1973 y fue conducido por las estaciones del Instituto Nacional de Investigaciones Agrícolas (INIA) en Cumaná y Punto Fijo, esta última está ubicada al oeste de Venezuela. Se basó en técnicos pesqueros especialmente entrenados, con el propósito de cubrir al menos el 1% del esfuerzo hecho por la flota arrastrera del país. Los observadores fueron asignados a los barcos de acuerdo a las oportunidades que ofrecían las compañías pesqueras para aceptarlos a bordo. Los observadores no intervinieron en la operación de los barcos. Durante cada calada, los observadores registraban la posición del barco al comienzo, hora de inicio, tiempo de arrastre (desde el momento que la red era lanzada hasta el momento en que los portalones salían a la superficie del agua), profundidad al comienzo de la calada, y la cantidad de la captura total que era retenida a bordo o descartada. La única información confiable sobre la distribución geográfica del esfuerzo de la flota fue provista por los observadores a bordo. Los datos provenientes de los cuadernos de pesca proporcionados por los capitanes de los barcos en campañas sin observador, solamente son confiables en cuanto al esfuerzo efectuado por calada y la captura desembarcada. La posición geográfica de las caladas se registró en una serie de cuadrantes de pesca de 30 × 30 millas náuticas (fig. 1). Se consideró que una calada era diurna cuando más del 50% de la misma tenía lugar con luz del sol. Cuando se encontraron tortugas marinas, el observador las identificó hasta especie, según la clave de Fisher (1978), de acuerdo a las características del caparazón y al número de placas apareadas. Los observadores habían sido previamente entrenados en el reconocimiento de la fauna marina de vertebrados e invertebrados, y en el reconocimiento de las especies de tortugas marinas reportadas en aguas venezolanas. El peso de las tortugas fue estimado a bordo de manera burda y la longitud curva del caparazón (CCL), desde la endidura nucal a la zona supracaudal en el margen posterior del caparazón (según Bolten 2000), fue medida usando una cinta métrica con 1 cm de precisión, antes de devolver la tortuga al mar. Si una tortuga llegó comatosa a bordo, fue reanimada de acuerdo a la técnica de Pritchard et al. (1983). La posición geográfica aproximada donde las tortugas marinas fueron capturadas se estimó con base en la profundidad y el cuadrante de pesca de las caladas. La latitud y longitud estimadas fueron luego leídas de una carta náutica.
Para verificar si existían diferencias estacionales en el esfuerzo de pesca o en la tasa de captura de tortugas marinas, los datos se agruparon en segmentos trimestrales. La proporción de tortugas marinas sexualmente maduras en la muestra se estimó con base en todas las tortugas mayores a una CCL determinada para cada especie, de acuerdo a la talla mínima reportada para tortugas que anidan en el Mar Caribe. En este sentido, Moncada et al. (1999) reportaron una talla mínima para E. imbricata de 59 cm longitud recta del caparazón (SCL; equivalente a 66 cm CCL) en playas de anidación en Cuba, mientras Márquez (1990) reportó que la talla de primera madurez para esta especie debía estar en el intervalo 68–80 cm SCL. Gremone y Gómez (1983) reportaron una talla mínima de 90 cm CCL para C. mydas en playas de anidación de Isla de Aves, Venezuela, mientras que Márquez (1990) reportó que la talla mínima registrada en Guyana fue 81.2 cm SCL (cerca de 85 cm CCL). Este ultimo autor indicó que la talla de primera madurez de C. caretta se alcanza a un intervalo de 74–92 cm SCL (83–103 cm CCL) en la costa sureste de los Estados Unidos de Norteamérica. Finalmente, Rondón–Medicci et al. (2010) reportaron una talla mínima de 135 cm CCL para D. coriacea en playas de anidación en la Península de Paria, Venezuela, mientras que Márquez (1990) reportó una talla mínima similar en animales que desovaban en playas de la Guayana Francesa, Trinidad–Tobago y Puerto Rico, y Thome et al. (2007) reportaron una talla mínima de 139 cm CCL para animales que anidaban en la costa norte del estado de Espirito Santo, cerca de la latitud 19°S.
La tasa de captura de todas las especies de tortugas marinas combinadas ( ), expresada como captura por unidad de esfuerzo CPUE, fue estimada de acuerdo a Snedecor y Cochran (1967, p. 536) usando el siguiente procedimiento:
), expresada como captura por unidad de esfuerzo CPUE, fue estimada de acuerdo a Snedecor y Cochran (1967, p. 536) usando el siguiente procedimiento:

y el intervalo de confianza de 95% (CI) =  + 1.96 s(R), donde s(R) es el error estándar de la CPUE estimada y es calculado como sigue:
+ 1.96 s(R), donde s(R) es el error estándar de la CPUE estimada y es calculado como sigue:
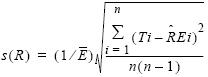
donde  es la CPUE promedio estimada (tortugas marinas/h de red de 30.5 m),
es la CPUE promedio estimada (tortugas marinas/h de red de 30.5 m),  es el tamaño promedio de la unidad de esfuerzo en la muestra (duración promedio de la calada = 3.5 h), Ti es el número de tortugas capturadas en la calada i, Ei es el esfuerzo (duración) de la calada i y n es el tamaño de la muestra (número de caladas evaluadas).
es el tamaño promedio de la unidad de esfuerzo en la muestra (duración promedio de la calada = 3.5 h), Ti es el número de tortugas capturadas en la calada i, Ei es el esfuerzo (duración) de la calada i y n es el tamaño de la muestra (número de caladas evaluadas).
Las CPUE promedio por intervalos de profundidad fueron estimadas como el número total de tortugas capturadas en aguas con un intervalo de profundidad particular, dividido por el esfuerzo efectuado por la flota en dicho intervalo de profundidad. Los errores estándar fueron estimados con base en las CPUE de cada calada por intervalo de profundidad. Se utilizó un procedimiento similar para estimar las CPUE promedio por año y sus errores estándar.
La razón de mortalidad directa (M) y el intervalo de confianza al 95% (CI) fueron estimados como:

donde p es la razón estimada de mortalidad (número de tortugas muertas/n), q = 1 – p, y n es el número total de tortugas marinas capturadas.
Se usó una prueba chi cuadrada (χ2) para verificar la significacia de las diferencias en el esfuerzo y número de tortugas capturadas de día o de noche. De manera similar, esta prueba se usó para verificar si la especie de tortugas estaba relacionada con el hecho de haber llegado viva o muerta a bordo, y para analizar las diferencias en la distribución trimestral del esfuerzo de pesca o en la captura estacional de las tortugas, todas las especies combinadas o por especie para E. imbricata, C. mydas y C. caretta. La prueba t de Student se utilizó para verificar la significancia de las diferencias entre la CPUE antes y después de que el uso del TED se hiciera obligatorio en la flota arrastrera de camarones en Venezuela. La prueba de Kruskal–Wallis fue utilizada para verificar la significancia de las diferencias en la estructura de tallas de los grupos de tortugas de C. mydas, C. caretta o E. imbricata que llegaron a bordo vivas, muertas o comatosas, y para comprobar la significacia de las diferencias en CPUE por año o profundidad. Estas pruebas están descritas en Sokal y Rohlf (1995).
RESULTADOS
Los observadores a bordo registraron durante el estudio una captura total de 2695 t, de la cual los peces representaron 32%, camarones 4.6%, moluscos 8% y los descartes de fauna capturada incidentalmente sin interés comercial 54.6%. Una estimación burda de la biomasa de tortugas marinas sugiere que ésta representó 0.18% de la captura total.
El esfuerzo de la flota de arrastre se distribuyó por la mayor parte de las costas orientales de Venezuela, pero se concentró en cuatro áreas: el nordeste de la Isla de Margarita, al este de la península de Paria, el sur de la Isla de Trinidad (en el área común de pesca de las flotas arrastreras de Trinidad–Tobago y Venezuela), y frente a Boca Grande, la cual es la mayor de las bocas del delta del Río Orinoco (fig. 1). La mayoría de las capturas de tortugas marinas tuvieron lugar en estas áreas de concentración del esfuerzo de pesca, con la excepción del este de la península de Paria donde no se reportaron capturas de tortugas.
Se atrapó un total de 63 tortugas marinas, todas en capturas individuales por calada: 20 E. imbricata, 20 C. mydas, 15 C. caretta y 8 D. coriacea. Una D. coriacea adicional fue capturada ya en estado avanzado de descomposición y se descartó de los análisis. Una tortuga caguama, L. olivacea, fue observada a bordo de una embarcación que llegaba al muelle de Cumaná proveniente del Golfo de Paria durante el primer trimestre de 1992, pero no fue incluida en los análisis por no formar parte del programa de muestreo. No se registraron tortugas capturadas en la red con TED durante los muestreos efectuados en 1994–2000.
El esfuerzo de pesca fue significativamente más elevado durante la noche (30,472 h red estd.) en comparación con el día (29,272 h red estd.; prueba χ2 = 24, P < 0.001), pero no se encontraron diferencias significativas en el número de tortugas capturadas durante el día (33 tortugas) o la noche (27 tortugas), para alguna especie de tortuga o todas las especies combinadas (χ2 = 0.38, P > 0.05; tabla 1).
La mayoría de las tortugas (82.5%) llegaron vivas a bordo y fueron devueltas nuevamente al mar (tabla 1). Las 11 tortugas que murieron fueron identificadas como: 3 E. imbricata, 2 C. caretta y 6 C. mydas. La razón de mortalidad directa (M) se estimó en 17.5 ± 9.5%. No se encontró diferencia significativa en la proporción de especies entre las tortugas que llegaron vivas o muertas a bordo (χ2 = 3.0, P > 0.05). Seis de las tortugas liberadas (1 E. imbricata, 3 C. caretta y 2 C. mydas) requirieron reanimación, porque llegaron en estado comatoso a bordo. No se registraron diferencias significativas en la estructura de tallas de los grupos de C. mydas, C. caretta o E. imbricata que llegaron vivas, muertas o comatosas a bordo (prueba de Kruskal–Wallis, H = 0.44, 0.78, y 2.24 para esas especies, respectivamente; P > 0.05). Si se incluyen los individuos que llegaron en estado comatoso a bordo, dentro del grupo de tortugas muertas, la razón de mortalidad directa sería 27.0 ± 11.0%. La duración de los arrastres en las caladas donde se capturaron tortugas varió poco alrededor de 3 h, por tanto, no se encontró una correlación significativa entre la duración de los arrastres y la presencia de mortalidad en las tortugas.
Las tortugas fueron capturadas en la mayoría de las profundidades donde las embarcaciones operaron (12–82 m; tabla 2). Aunque un pequeño porcentaje del esfuerzo de pesca (1.6%) de la flota arrastrera de camarón se efectuó a profundidades de 83–100 m, no se capturaron tortugas en aguas con profundidad mayor a 82 m. La tasa de captura de tortugas estimada (CPUE) no varió significativamente con la profundidad (H = 3.1, P = 0.67), lo cual sugiere que las tortugas estaban uniformemente distribuidas en el intervalo de profundidades donde se efectuó el estudio.
Todas las especies de tortugas mostraron una amplia distribución geográfica en el oriente de Venezuela, desde la costa sudeste del Mar Caribe hasta la costa Atlántica de Venezuela (fig. 2). La presencia de E. imbricata (fig. 2a), C. caretta (fig. 2b) y C. mydas (fig. 2c) en las capturas fue amplia en el oriente de Venezuela y se superpuso, pero la de la tortuga cardón, D. coriacea, mostró ser una distribución más restringida hacia la zona Atlántica (fig. 2d).
El esfuerzo de pesca evaluado fue mayor durante el primer trimestre del año (χ2 = 403.6, P < 0.001; tabla 3), pero no se encontraron diferencias significativas en la distribución trimestral de las capturas de todas las especies combinadas o por especie para E. imbricata, C. mydas y C. caretta (χ2 = 1.29, P > 0.05). Dermochelys coriacea fue capturada solamente durante los primeros cinco meses del año. Esto sugiere que la densidad de las tortugas marinas parece estar distribuida de manera uniforme a lo largo del año en el área de estudio.
La CCL promedio observada (± DE) para cada especie de tortuga fue: E. Imbricata, 59 ± 19 cm (n = 20, intervalo 28–90 cm); C. mydas, 68 ± 22 cm (20, 28–127 cm); C. caretta, 68 ± 16 cm (15, 47–120 cm) y D. coriacea, 146 ± 26 cm (5, 100–164 cm) (tabla 4). El porcentaje de individuos con tamaño igual o superior a la talla de madurez sexual en la muestra se estimó que alcanzó 85% para D. coriacea, pero fue de 6% a 15% para las otras tres especies.
Las tasas de captura de tortugas marinas (todas las especies combinadas), fueron estimadas para embarcaciones sin TED en las redes, durante los periodos antes y después que el uso de este dispositivo fuera obligatorio (1991–1993 y 1994–2000, respectivamente). No se encontraron diferencias significativas entre las CPUE en ambos periodos  91 –93 = 0.0010 y
91 –93 = 0.0010 y  94–00 = 0.0022 tortugas h–1 red estd. 30.5 m, respectivamente; prueba t Student = 1.05; P > 0.05) (tabla 5). En consecuencia, se estimaron la CPUE de tortugas común para todo el periodo de estudio y el I.C. 95% como
94–00 = 0.0022 tortugas h–1 red estd. 30.5 m, respectivamente; prueba t Student = 1.05; P > 0.05) (tabla 5). En consecuencia, se estimaron la CPUE de tortugas común para todo el periodo de estudio y el I.C. 95% como  = 0.00106 ± 0.00026 tortugas h–1 red estd. 30.5 m, la cual sería equivalente a la captura de una tortuga cada 950 (760–1260) de arrastre con una red estd. de 30.5 m.
= 0.00106 ± 0.00026 tortugas h–1 red estd. 30.5 m, la cual sería equivalente a la captura de una tortuga cada 950 (760–1260) de arrastre con una red estd. de 30.5 m.
El esfuerzo de pesca total promedio, ejecutado anualmente por la flota arrastrera oriental de Venezuela, se estimó en 311,000 ± 520 h de arrastre con una red estándar de 30.5 m (tabla 5). Esto es aproximadamente equivalente al esfuerzo calculado como el número promedio de embarcaciones por año durante el periodo de estudio (123 barcos) multiplicado por el número promedio de horas de operación en cada año (2530 h). Así, la captura estimada de tortugas en el oriente de Venezuela antes de que el uso del TED fuera obligatorio en 1994, habría sido (redondeando) 330 (250–410) animales por año, con una mortalidad directa asociada de al menos 60 (30–90) animales.
DISCUSIÓN
Las tortugas marinas tienen una amplia distribución en la región costera venezolana. Las cinco especies reportadas en aguas venezolanas (Pritchard y Trebbau 1984) se encuentran en las costas al sur del Mar Caribe y en el lado del Océano Atlántico. La superposición de las distribuciones de C. mydas, E. imbricata, C. caretta y D. coriacea es amplia, mientras que la de L. olivacea parece estar restringida principalmente hacia el Océano Atlántico. Todas ellas forrajean y migran en la región; mientras que C. mydas, E. imbricata y D. coriacea también desovan en las costas del Mar Caribe y en el frente Atlántico, C. caretta sólo desova en la primera de estas áreas (Pritchard y Trebbau 1984). Los datos de campo de este estudio muestran que la densidad de tortugas marinas, medida con base en la CPUE, tiene escasa variación durante el año o dentro de un intervalo de profundidades de 10 a 100 m en la zona costera, donde operó la flota industrial de arrastre. Además, se encontró que la composición de especies en las aguas costeras de Venezuela fue 31% E. imbricada y C. mydas, las cuales están similarmente representadas, 23% C. caretta y 14% D. coriacea. Esta representación contrasta con la composición encontrada mar adentro en el Mar Caribe central y Océano Atlántico occidental central, donde opera la flota industrial de barcos atuneros con palangre. La representación de D. coriacea en esta última zona se eleva a 74%, mientras que la de C. caretta, C. mydas y E. imbricata disminuye a 11%, 10% y 5%, respectivamente (Alió et al. 2007).
Todas las capturas de tortugas marinas por la flota arrastrera en el oriente de Venezuela tuvieron lugar mientras se operaba en zonas con profundidades menores a 82 m (tabla 2). Robins (1995) indicó que la mayoría de las embarcaciones de arrastre que operaron en aguas de Queensland, Australia, usan áreas con profundidad menor a 10 m, y que las mayores tasas de captura de tortugas marinas tiene lugar en aguas con profundidad menor de 30 m. Igualmente, Poiner y Harris (1996) y Henwood et al. (1992) reportaron que las flotas de arrastre en los golfos de Carpentaria y México, respectivamente, operan a profundidades menores de 20 m. Por su parte, Epperly et al. (2002) reportaron que la mayor parte del esfuerzo de arrastre en el Golfo de México se efectuó en el estrato mar adentro (18–82 m) durante nueve meses del año (y con similar proporción entre los estratos de la costa y mar adentro en los meses de invierno), mientras que al sur del Atlántico Norte la mayor parte del esfuerzo se hizo en el estrato cercano a la costa. Por otra parte, Gopi et al. (2006) indicaron que la mayoría de las capturas de tortugas caguamas, L. olivacea, en Orissa, India occidental, se registraron en los primeros 5 km de la costa y a profundidades menores a 10 brazas (18.3 m), mientras que Pandav et al. (2006) reportaron que la concentración de tortugas en este intervalo de profundiad es particularmente intensa durante la época de reproducción, cuando ocurren las arribadas. Estos resultados muestran que las aguas costeras son importantes para las tortugas marinas y que hay evidencia de que las embarcaciones de arrastre de camarón capturan más tortugas en estas regiones (Gerosa y Casale 1999, Jamir 1999 en Epperly et al. 2002). De ello deriva la importancia de las restricciones a las operaciones de pesca industrial cerca de la costa, y una vigilancia efectiva, como medidas para proteger a las poblaciones de tortugas marinas.
La tasa de captura de tortugas marinas por la flota de arrastre en el oriente de Venezuela (0.00106 ± 0.00026 tortugas h–1 red estd.) sería la más baja entre las evaluaciones efectuadas en diferentes países (tabla 6), sin descartar la menor densidad de tortugas en aguas venezolanas cuando se compara con otras regiones vecinas. Kotas et al (2004) reportaron una densidad de tortugas marinas mucho mayor al sur de Brasil, con base en una captura de 165 ejemplares en 34 lances de un día durante tres viajes de una embarcación de palangre atunero al sur de Brasil. La tasa de captura de tortugas marinas en el occidente de Venezuela no ha sido estudiada de manera tan intensiva como en el oriente del país. Una estimación preliminar de la CPUE en el Golfo de Venezuela efectuada por Franco y Álvarez 1993 fue de 0.00027 tort. h–1 red estd., equivalente a una tortuga por cada 3700 h de arrastre; este estimado se basó en la captura de una única tortuga luego de 2800 h de arrastre con dos redes de 20 m de relinga superior. Además, Lozada (2010), en un estudio efectuado en la misma área de pesca entre 1994 y 1995, no registró captura de tortugas marinas en 6830 h red estd. Dicho estudio abarcó 25 viajes de pesca utilizando dos redes de 20 m de relinga superior durante 5210 h de arrastre. En consecuencia, no se debe hacer una generalización sobre la CPUE de tortugas marinas por la flota arrastrera de camarones para el país entero basada en los resultados del presente estudio.
La razón estimada de mortalidad directa de tortugas marinas (basada en aquellas que llegaron muertas a bordo, ya que la razón indirecta o post liberación no fue estimada), en la costa nororiental de Australia es muy baja (1%, tabla 6). Por otra parte, las razones estimadas en el Golfo de Carpentaria, Golfo de México, el sudeste de los EUA, la costa del Pacífico en Colombia y Costa Rica (14%, 29%, 21%, 64% y 62%, respectivamente; tabla 6) son más cercanas o superiores a las razones reportadas en el nororiente de Venezuela (19%). Esto está asociado probablemente a la duración de los arrastres, los cuales son menores de 2 h en la costa nororiental de Australia, y cercanos o mayores de 3 h en las otras regiones evaluadas. Estas mortalidades pueden ser subestimaciones de la mortalidad real ya que aun con el uso efectivo del TED, las capturas por arrastre pueden conducir a efectos acumulados subletales cuando las tortugas marinas son capturadas múltiples veces (Lutz y Bentley 1985, Lutcavage y Lutz 1991, Lewison et al. 2003). Sin embargo, Stabenau y Vietti (2003) mostraron que las inmersiones en las redes con TED no afectarían de manera significativa la sobrevivencia potencial de tortugas marinas, siempre y cuando los animales tengan un adecuado intervalo de descanso en la superficie entre sucesivas inmersiones. Gerosa y Casale (1999) explicaron que la mortalidad de tortugas marinas está afectada no sólo por la duración de los arrastres, sino también por el tamaño del animal afectado y la temperatura del agua donde se efectúan los arrastres. Se ha observado que los animales más grandes soportan apneas más prolongadas, y el tiempo máximo de apnea disminuye a medida que la temperatura del agua se eleva. Sin embargo, hay evidencias de que las temperaturas invernales inducen mayores mortalidades de las tortugas marinas atrapadas en las redes de arrastre. Con respecto a lo anterior, Sasso y Epperly (2006) evaluaron nuevamente los datos de Henwood y Stuntz (1987) y concluyeron que las mortalidades durante el invierno fueron consecuencia de apneas más cortas que en el verano.
Entre las medidas adoptadas en Venezuela y otros países para conservar las tortugas marinas, están la protección de los nidos y sitios de anidamiento (Guada y Sole 2000, Quijada y Valladares 2004), y el uso obligatorio del dispositivo para excluir tortugas marinas (TED) en los barcos industriales que emplean redes de arrastre para camarones. También han habido estudios sobre el empleo de anzuelos circulares en las pesquerías con palangre para reducir tanto la tasa de captura de tortugas marinas y otras especies amenazadas (e.g., picudos), como la mortalidad de aquellos ejemplares que sean atrapados en los anzuelos (Largacha et al. 2005, Watson et al. 2005, Sasso and Epperly 2007, Domingo et al. 2009). El uso del TED pudo haber liberado unas 300 tortugas marinas anualmente en la región oriental de Venezuela, suponiendo una tasa de captura de una tortuga cada 930 h de arrastre y que la flota de 123 embarcaciones en promedio efectuaría un esfuerzo anual estimado en 311,000 h de arrastre, y que el TED fuera colocado y bien utilizado.
Debe mencionarse, sin embargo, que el impacto de la utilización del TED sobre el desempeño económico de las flotas de arrastre puede ser severo (Taylor et al. 1985, Watson and Taylor 1991, Rulifson et al. 1992, Griffin and Tolman 1992, Kirubakaran et al. 2002). En Venezuela, Marcano et al. (2000) estimaron una reducción en el peso de la captura de peces de talla comercial hasta en 66% (pérdida promedio de 45% ± 8 DE) en las redes con TED, cuando se las compara con las redes control sin el dispositivo. Watson y Taylor (1991) ya habían estimado en cerca de 50% la reducción de los peces de mayor tamaño en la captura de las redes con el TED, comparada con aquellas sin el dispositivo en flotas operando al norte del Golfo de México. Considerando que cerca del 50% del beneficio neto total de la flota arrastrera en la costa del Pacífico colombiano (Goodman 1988), y 75% en Venezuela (Henríquez 1997), proviene del desembarque de peces, la pérdida de la captura comercial de estos induce a los capitanes a evitar el empleo del TED durante las operaciones costa afuera, donde la vigilancia por parte de las fuerzas armadas es menos intensa. A pesar de estas pérdidas, el empleo del TED puede ser beneficioso para la pesquería en general, ya que grandes masas de peces e invertebrados son liberados vivos de las redes, reduciéndose su razón de mortalidad por pesca y mejorando las capturas potenciales de otras pesquerías orientadas hacia los recursos bentónicos. Además, el uso del TED puede también ser beneficioso para las tripulaciones bajo ciertas circunstancias, ya que no solamente las tortugas son liberadas sino que también lo son otros objetos grandes o pesados, como piedras, troncos, otros residuos, o grandes peces que pueden deteriorar la valiosa captura de camarones, o aguamalas que pueden inducir severas quemaduras a las tripulaciones durante el proceso de selección de la captura comercial en la cubierta, como ha sido referido a los autores por miembros de tripulaciones (ver también Oravetz y Seidel 1984).
Un método sencillo para reducir las pérdidas de captura comercial de peces en las embarcaciones camaroneras de arrastre sería aumentar la separación de las barras en el TED. Una red con un TED del tipo Supershooter con 14 cm de separación en las barras fue evaluada por Hernández (2002) al norte de la Isla de Margarita, Venezuela, obteniendo un incremento de 23% en la captura comercial de peces cuando se compara con una red dotada de un TED con separación de barras a 10 cm. En su estudio no se reportaron capturas de tortugas. La separación de las barras en el TED pudiera establecerse de acuerdo a la estructura de tallas de las poblaciones de tortugas marinas en las diferentes áreas de pesca, tal como recomienda la FAO (1998). En este enfoque, Arauz et al. (2008) indican que desde 2000 los pescadores costarricenses de camarón al arrastre han sido autorizados para usar un TED con separación de las barras a 15.2 cm, siendo este país el único que hasta ahora ha conseguido tal autorización por parte del Departamento de Estado de los EUA. Los autores hemos estimado que un incremento en la separación de las barras en el TED Supershooter en Venezuela de 10 a 15 cm permitiría un escape de todas las tortugas mayores a 40 cm CCL. Tal estimación se basó en las ecuaciones de Epperly y Teas (2002) y Teas (2003) para calcular la altura del cuerpo en función de la longitud recta del caparazón para C. mydas y C. caretta. Las estimaciones de la altura del cuerpo de E. imbricata, se basaron en el promedio de los parámetros de las ecuaciones para C. mydas y C. caretta, mientras que para D. coriacea se utilizó una ecuación estimada de datos de campo aun no publicados (S. Epperly, pers. comm.). Se concluyó que cerca de 80% de las tortugas registradas en el presente estudio (tabla 4) escaparían de una red dotada de un TED con separación de 15 cm entre barras. Así mismo, se concluyó que todos los ejemplares de C. caretta y D. coriacea escaparían de la red con tal separación en las barras del TED, mientras que solamente el 85% de C. mydas y 80% de E. imbricata lo harían.
Una mejora en las operaciones de la flota arrastrera hacia la captura de peces también promovería el uso regular del TED en las redes por parte de las tripulaciones. Entre las diversas flotas pesqueras que pueden tener impacto sobre las tortugas marinas en Venezuela, por ejemplo, la que efectúa arrastres de fondo parece ser la más importante (Alió et al. 2007). Así, la promoción del uso del TED en las redes de las flotas industriales de arrastre en aguas tropicales es fundamental para la conservación de las tortugas marinas. Debe promoverse el reconocimiento por la conservación de estos recursos entre los pescadores en general y agentes gubernamentales a cargo de vigilar el cumplimiento de las medidas de protección adoptadas por los países.
AGRADECIMIENTOS
Este proyecto fue financiado por el Programa de Desarrollo Tecnológico (PRODETEC) suscrito entre el Instituto Nacional de Investigaciones Agrícolas (INIA) y el Banco Interamericano de Desarrollo, y por las Asociaciones de Productores de la Pesca de Arrastre del oriente de Venezuela. Deseamos agradecer la ayuda recibida de J Fermín y E Ganuza en los análisis estadísticos, de S Epperly por compartir algunos de sus datos de campo aun no publicados sobre tallas de tortugas marinas, y las sugerencias de los árbitros anónimos, las cuales mejoraron el texto. Agradecemos también la cooperación de las asociaciones de productores pesqueros de arrastre en Cumaná, Guiria y Puerto La Cruz (PROPESA, ASOPESCA y AVAGUI, respectivamente), y la de los observadores R Antón, RL Antón, E Duarte, J García, R Febres, JJ Fermín, LJ Ortiz, RL Rodríguez, N Romero y C Torrens, cuyo entusiasmo y paciencia contribuyeron al éxito del proyecto. Igualmente, apreciamos la ayuda recibida en el campo y laboratorio de parte de los técnicos A Urbaneja, M Marquéz, R Marcano, G Vizcaino y R Chacón(f), quienes procesaron la información. Esta publicación está dedicada a la memoria de Ramón Sabino Chacón, quien falleció en 2004, y dedicó la mayor parte de su vida a efectuar un trabajo de la más alta calidad como técnico pesquero.
REFERENCIAS
Alió JJ, Marcano LA, Arocha F, Altuve D. Marcano JS. 2007. Interacciones entre las flotas pesqueras industriales de Venezuela y las tortugas marinas. Simposio sobre Interacciones Tortugas Marinas–Pesquerías. Actas 7° Congreso Venezolano de Ecología, Ciudad Guayana, November 2007.http://www.cvecologia.org/_sl/admin/phpresumen_presentar.php?base=viiecologia&cipar=viiecologia.par&Formato=boletin&Mfn=181 (06 June 2009). [ Links ]
Altuve DE, Marcano LA, Alió JJ, Álvarez R. 1999. Venezuela shrimp fisheries in the Atlantic margin of Guyana (revised version with data to 1997). Second CFRAMP/FAO/DANIDA Stock Assessment Workshop on the Shrimp and Groundfish Fisheries of the Brazil–Guianas Shelf. Georgetown, Guyana, 18–29 May 1998. FAO Report on Activities 46 (Suppl. 1): 67–75. [ Links ]
Arauz RM, Vargas R, Naranjo I, Gamboa C. 1997. Analysis of the incidental capture and mortality of sea turtles in the shrimp fleet of Pacific Costa Rica. Proc. 17th Annual Sea Turtle Symp., March 1997, Orlando, Florida. [ Links ]
Arauz RM, Ballestero J, Bolaños A. 2008. Improving TED acceptance among Costa Rican shrimp trawl captains and crews. Proc. 25th Ann. Symp. on Sea Turtle Biology and Conservation, Savannah, Georgia (USA), 18–22 January 2005. NOAA Tech. Mem. NMFS SEFSC 582: 13. [ Links ]
Bolten AB. 2000. Técnicas para la medición de tortugas marinas. In: Eckert KL, Bjorndal KA, Abreu–Grobois FA, Donnelly M (eds.), Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Grupo Especialista en Tortugas Marinas, UICN/CSE, Publ. No. 4, pp. 126–131. [ Links ]
Brazner JC, McMillan J. 2008. Loggerhead turtle (Caretta caretta) bycatch in Canadian pelagic longline fisheries: Relative importance in the western North Atlantic and opportunities for mitigation. Fish. Res. 91: 310–324. [ Links ]
Domingo A, Barceló C, Swimmer Y, Pons M, Miller P. 2009. Anzuelos circulares vs anzuelos j en la flota palangrera uruguaya. Coll. Vol. Sci. Pap. ICCAT 64: 2427–2442. [ Links ]
Epperly SP, Teas WG. 2002. Turtle excluder devices: Are the escape openings large enough? Fish. Bull. 100: 466–474. [ Links ]
Epperly S, Avens L, Garrison L, Henwood T, Hoggard W, Mitchell J, Nance J, Poffenberger J, Sasso C, Scott–Denton E, Yeung C. 2002. Analysis of sea turtle bycatch in the commercial shrimp fisheries of southeast US waters and the Gulf of Mexico. NOAA Tech. Memo. NMFS–SEFSC–490, 88 pp. [ Links ]
FAO 1998. Report of the Expert Consultation on Sustainable Fishing Technologies and Practices. St. John's, Newfoundland, Canada, 1–6 March 1998. FAO Fish. Rep. No. 588, 17 pp. [ Links ]
FAO 2004a. Report of the Expert Consultation on Interactions between Sea Turtles and Fisheries within an Ecosystem Context. Rome, Italy, 9–12 March 2004. FAO Fish. Rep. No. 738, 238 pp. [ Links ]
FAO 2004b. Report of the Technical Consultation on Sea Turtles Conservation and Fisheries. Bangkok, Thailand, 29 November–2 December 2004. FAO Fish. Rep. No. 765, 31 pp. [ Links ]
Fisher W (ed.) 1978. FAO Species Identification Sheets for Fishery Purposes: Western Central Atlantic (Fishing Area 31). Vol. VI, FAO, Rome. [ Links ]
Franco L, Alvarez R. 1993. La pesca de arrastre y la captura incidental de tortugas marinas. FONAIAP DIVULGA 42: 21–22. http://sian.inia.gob.ve/repositorio/revistas_tec/FonaiapDivulga/fd42/texto/pesca.htm (06 June 2009). [ Links ]
Gaceta Oficial de la República de Venezuela 1993. Resolution making mandatory the use of the grid for excluding sea turtles in the nets of shrimp trawl vessels. Resolución MAC – MARNR 67. N° 35.159, Caracas. pp 10–11. http://www.pgr.gob.ve/Recursos/goa2.htm. [ Links ]
Gaceta Oficial de la República de Venezuela 1996a. Decree No. 1.485. List of animal included in Decree No. 1.486, for which hunting is forbidden. No. 36.059, Caracas, pp 1–3. http://www.pgr.gob.ve/Recursos/goa2.htm. [ Links ]
Gaceta Oficial de la República de Venezuela 1996b. Decree No. 1.486. List of endangered species. No. 36.062, Caracas, pp 2–3. http://www.pgr.gob.ve/Recursos/goa2.htm. [ Links ]
Gaceta Oficial de la República de Venezuela 1998. Law that approves the Interamerican Convention for the Protection and Conservation of Marine Turtles. No. 5.24 Extraordinary. Caracas, pp 4–14. http://www.pgr.gob.ve/Recursos/goa2.htm. [ Links ]
Gerosa G, Casale P. 1999. Interaction of Marine Turtles with Fisheries in the Mediterranean. Mediterranean Action Plan. UNEP, Regional Activity Center for Specially Protected Areas, Tunisia, 59 pp. [ Links ]
Gerrodette T, Taylor BL. 2000. Estimación del tamaño de la población. In: Eckert KL, Bjorndal KA, Abreu–Grobois FA, Donnelly M (eds.), Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Grupo Especialista en Tortugas Marinas, UICN/CSE, Publ. No. 4, pp. 78–82. [ Links ]
Goodman FD. 1988. The marine turtles catch by the Colombian Pacific shrimp trawl fleet. Trianea (Bogota) 2: 351–372. [ Links ]
Gopi GV, Pandav B, Choudhury BC. 2006. Incidental capture and mortality of olive ridley turtles (Lepidochelys olivacea) in commercial trawl fisheries in coastal waters of Orissa, India. Chelonian Conserv. Biol. 5: 276–280. [ Links ]
Gremone C, Gómez JL. 1983. Isla de Aves como área de desove de la tortuga verde, Chelonia mydas. FUDENA (Caracas) 59 pp. [ Links ]
Griffin WL, Tolman D. 1992. Economic impacts of TEDs on the shrimp production sector. Soc. Nat. Resour. 6: 291–308. [ Links ]
Guada HJ, Vernet P. 1992. Las tortugas marinas en el Parque Nacional Archipiélago Los Roques. In: Amend T (ed.), Parque Nacional Archipiélago Los Roques (Parques Nacionales y Conservación Ambiental), No. 3. Fundación Polar, INPARQUES, Caracas, pp. 89–107. [ Links ]
Guada HJ, Sole G. 2000. Sea turtle recovery action plan for Venezuela. In: Suarez A (ed.). WIDECAST. PAC Technical Report No. 39. UNEP Caribbean Environmental Programme, Kingston, Jamaica, 112 pp. [ Links ]
Henríquez L. 1997. Evaluation of the trawl industrial sector and its impact on the socioeconomic development of Sucre State, Venezuela, during 1996. MBA thesis, Universidad Bicentenaria de Aragua, Maracay, Venezuela, 80 pp. [ Links ]
Henwood TA, Stuntz WE. 1987. Analysis of sea turtle captures and mortalities during commercial shrimp trawlings. Fish. Bull. 85: 813–817. [ Links ]
Henwood TA, Stuntz WE, Thompson N. 1992. Evaluation of US protective measures under existing TED regulations, including estimates of shrimp trawler related mortality in the wider Caribbean. NOAA Tech. Memo. NMFS–SEFSC–303, 14 pp. [ Links ]
Hernández JA. 2002. Operative comparison between the grid to exclude sea turtles with 14 cm and that of common use of 10 cm, in industrial trawl vessels. Associate degree thesis IUTEMAR, Fundación La Salle de Ciencias Naturales, Punta de Piedras, Margarita Island, Venezuela, 45 pp. [ Links ]
INAPESCA–Venezuela. 2001. Estadísticas Pesqueras de Venezuela 2000. Ministerio de Agricultura y Cría, Instituto Nacional de Pesca y Acuicultura, Caracas, Venezuela. [ Links ]
Kirubakaran P, Neelakandan M, Venkateswaralu N, Verghese CP. 2002. Preliminary observations on the operation of TED in bottom trawl. Fish. Chimes 21: 31–33. [ Links ]
Kotas JE, Gallo BMG, dos Santos S, Barata CR, de Azevedo VG. 2004. Incidental capture of loggerhead (Caretta caretta) and leatherback (Dermochelis coriacea) sea turtles by pelagic long line fishery off southern Brazil. Fish. Bull. 102: 393–399. [ Links ]
Largacha E, Parrales M, Rendón L, Velásquez V, Orozco M, Hall M. 2005. Working with the Ecuadorian fishing community to reduce the mortality of sea turtles in long lines: The first year March 2004–March 2005. Tech. Rep. Western Pacific Regional Fishery Management Council, 57 pp. [ Links ]
Lewison R, Crowder LB, Shaver DJ. 2003. The impact of turtle excluder devices and fisheries closures on loggerhead and Kemp's ridley strandings in the western Gulf of Mexico. Conserv. Biol. 17: 1089–1097. [ Links ]
Lozada RM. 2010. Efectos del dispositivo exclusor de tortugas sobre el volumen, talla y variedad de la captura por pesca camaronera tipo Florida. B.Sc. thesis, Universidad de Oriente, Cumaná, Venezuela, 39 pp. [ Links ]
Lutcavage ME, Lutz PL. 1991. Voluntary diving metabolism and ventilation in the loggerhead sea turtle. J. Exp. Mar. Biol. Ecol. 147: 289–296. [ Links ]
Lutz PL, Bentley TB. 1985. Respiratory physiology of diving in the sea turtle. Copeia 1985: 671–679. [ Links ]
Marcano LA. 1990. Análisis de la situación de la industria de la pesca de arrastre durante el periodo 1985–1989. In: Resultados de Talleres sobre la Pesca en Venezuela. Ministerio de Agricultura y Cría, Dirección General Sectorial de Peca y Acuicultura, Caracas, pp. 25–52. [ Links ]
Marcano LA, Alió JJ. 2000. Incidental capture of marine turtles in the industrial shrimp fishery of eastern Venezuela. In: Abreu–Grobois FA, Briseno–Duenas R, Marquez R, Sarti L (Comp.), Proc. 18th International Sea Turtle Symposium. US Dept. of Commerce. NOAA Tech. Memo. NMFS–SEFSC–436, 107 pp. [ Links ]
Marcano LA, Chacón R, Urbaneja A, Astudillos A. 1989. Yield and composition of the shrimp by–catch in areas near Margarita Island and Sucre State, Venezuela. Mem. III Congreso Latinoamericano de Ciencias del Mar, UDO, Instituto de Oceanografía, Cumaná, Venezuela. [ Links ]
Marcano LA, Alió JJ, Lozada RM. 2000. Impact on captures by the use of the turtle excluder device in the industrial shrimp fishery in Venezuela. In: Abreu–Grobois FA, Briseno–Duenas R, Marquez MR, Sarti L. (Comp.), Proc. 18th International Sea Turtle Symposium. US Dept. of Commerce. NOAA Tech. Memo. NMFS–SEFSC–436, 107 pp. [ Links ]
Márquez MR. 1990. FAO Species Catalogue. Sea Turtles of the World. An annotated and illustrated catalogue of sea turtle species known to date. FAO Fisheries Synopsis No. 125, Vol. 11, Rome, 81 pp. [ Links ]
Medina G, Alvarez B, Buitrago J, Molero H. 1987. Tortugas marinas en la costa caribeña venezolana. Informe para el II Simposio de las Tortugas del Atlántico Occidental (STAO/WATS). FUDENA (Venezuela), 53 pp. [ Links ]
Mitchell JF, Watson JF, Foster DG, Caylor RE. 1995. The turtle excluder device (TED): A guide to better performance. NOAA Tech. Mem. NMFS–SEFSC–366, 38 pp. [ Links ]
Moncada F, Carrillo E, Sáenz A, Nodarse G. 1999. Reproduction and nesting of the hawksbill turtle (Eretmochelys imbricata) in the Cuban Archipelago. Chelonian Conserv. Biol. 3(2): 257–263. [ Links ]
Montiel–Villalobos MG, Barrios–Garrido H, Rodríguez JP, Rodríguez–Clark KM. 2007. Interacciones de la pesquería artesanal con las tortugas marinas en el Golfo de Venezuela: Extracción anual y estadíos más afectados. Simposio sobre Interacciones Tortugas Marinas–Pesquerías. Actas 7° Congreso Venezolano de Ecología, Ciudad Guayana, November 2007. http://www.cvecologia.org/_sl/admin/php/resumen_presentar.php?base=viiecologia&cipar=viiecologia.par&Formato=boletin&Mfn=15 (10 Nov 2008). [ Links ]
NRC, National Research Council. 1990. Decline of the Sea Turtles: Causes and Prevention. National Academy Press, Washington DC, 259 pp. [ Links ]
Oravetz C, Seidel W. 1984. Shrimpers can reduce by catch levels with trawling device. Natl. Fisherman 64(1): 46–67. [ Links ]
Pandav B, Gopi GV, Choudhury BC. 2006. Sea, shrimp, and sea turtles: Case study of a solution approach using TEDs in trawl nets in Orissa. Proc. 23rd Ann. Symp. on Sea Turtle Biology and Conservation, Kuala Lumpur, Malaysia, 17–21 March 2003. NOAA Tech. Memo. NMFS SEFSC No. 536, p. 220. [ Links ]
Poiner IR, Harris ANM. 1996. Incidental capture, direct mortality and delayed mortality of sea turtles in Australia's northern prawn fishery. Mar. Biol. 125: 813–825. [ Links ]
Poiner IR, Buckworth RC, Harris ANM. 1990. Incidental capture and mortality of sea turtles in Australia's northern prawn fishery. Aust. J. Mar. Freshw. Res. 41: 97–110. [ Links ]
Pritchard PCH, Trebbau P. 1984. The Turtles of Venezuela. Society for the Study of Amphibians and Reptiles, 403 pp. [ Links ]
Pritchard P, Bacon P, Berry F, Carr A, Fletmeyer J, Gallagher R, Hopkins S, Lankford R, Márquez MR, Ogren L, Reichart H, Witham R. 1983. A Manual of Sea Turtle Research and Conservation Techniques. 2nd ed. Bjorndal KA, Balazas GH (eds.). Center for Environmental Education, Washington DC, 134 pp. [ Links ]
Quijada A. 2004. Generalidades de las tortugas marinas. In: Babarro R, Sanz Agreda A, Mora Celis B (eds.), Tortugas Marinas de Venezuela. Acciones para su Conservación. Oficina Nacional de Diversidad Biológica, Dirección de Fauna, Ministerio del Ambiente y de los Recursos Naturales, Caracas, 116 pp. [ Links ]
Quijada A, Valladares C. 2004. Conservación de las tortugas marinas en el Golfo de Paria. In: Babarro R, Sanz Agreda A, Mora Celis B (eds.), Tortugas Marinas de Venezuela. Acciones para su Conservación. Oficina Nacional de Diversidad Biológica, Dirección de Fauna, Ministerio del Ambiente y de los Recursos Naturales, Caracas, 116 pp. [ Links ]
Robins JB. 1995. Estimated catch and mortality of sea turtles from the east coast otter trawl fishery of Queensland, Australia. Biol. Conserv. 74: 157–167. [ Links ]
Rondón–Medicci M, Buitrago J, Guada HJ. 2010. Biología reproductiva de la tortuga cardón (Dermochelys coriacea) en playas de la Península de Paria, Venezuela, durante las temporadas de anidación 2000–2006. Interciencia 35(4): 263–270. [ Links ]
Rulifson RA, Murray JD, Bahen JJ. 1992. Finfish catch reduction in South Atlantic shrimp trawls using three designs of by–catch reduction devices. Fisheries 17: 9–20. [ Links ]
Sasso CR, Epperly SP. 2006. Seasonal sea turtle mortality risk from forced submergence in bottom trawls. Fish. Res. 81: 86–88. [ Links ]
Sasso CR, Epperly SP. 2007. Pelagic survival of juvenile loggerhead turtles. J. Wildl. Manage. 71: 1830–1835. [ Links ]
Shillinger GL, Palacios DM, Bailey H, Bograd SJ, Swithenbank AM, Gaspar P, Wallace BP, Spotila JR, Paladino FV, Piedra R, Eckert SA, Block BA. 2008. Persistent leatherback turtle migrations present opportunities for conservation. PLOS Biol. 6: 1–9. [ Links ]
Snedecor GW, Cochran WG. 1967. Statistical Methods. 6th Ed. Iowa State Univ. Press, Ames, 593 pp. [ Links ]
Sokal RR., Rohlf FJ. 1995. Biometry. 3rd ed. W.H. Freeman and Co., NY, 887 pp. [ Links ]
Stabenau EK, Vietti KRN. 2003. The physiological effects of multiple forced submergences in loggerhead sea turtles (Caretta caretta). Fish. Bull. 101: 889–899. [ Links ]
Taylor CW, Serra AF, Mitchell JF, Sawyer RC. 1985. Construction and installation instructions for the trawling efficiency device. NOAA Tech. Memo. NMFS–CEFC–71, 22 pp. [ Links ]
Teas WG. 1993. Species composition and size class distribution of marine turtles stranding on the Gulf of Mexico and southeast United States coast 1985–91. NOAA Tech. Memo. NMFS–SEFSC–315, 43 pp. [ Links ]
Thome JC, Baptistotte C, Morelia LMDP, Scalfoni JT, Ameida AP, Reth DB, Barata PC. 2007. Nesting biology and conservation of the leatherback sea turtle (Dermochelys coriacea) in the state of Espirito Santo, Brazil, 1988–1989 to 2003–2004. Chelonian Conserv. Biol. 6: 15–27. [ Links ]
Tomás J, Gozalbes P, Raga JA, Godley BJ. 2008. Bycatch of loggerhead sea turtles: Insights from 14 years of stranding data. Endang. Spec. Res. 5: 161–169. http://www.int–res.com/abstracts/esr/v5/n2–3/p161–169/. [ Links ]
Watson JW, Taylor CW. 1991. Research on selective shrimp trawl designs for penaeid shrimp in the United States: A review of selective shrimp trawl research in the United States since 1973. Proc. Fisheries Conservation Engineering Workshop, Publ. Rhode Island Sea Grant Coll. Program, pp. 50–59. [ Links ]
Watson JW, Epperly SP, Shah AK, Foster DG. 2005 Fishing methods to reduce sea turtle mortality associated with pelagic longlines. Can. J. Fish. Aquat. Sci. 62: 965–981. [ Links ]
* Descargar versión bilingüe (Inglés–Español) en formato PDF.














