Introducción
La borreliosis de Lyme es una enfermedad infecciosa emergente multisistémica causada por la espiroqueta Borrelia burgdorferi, que se transmite por la mordedura de garrapatas del género Ixodes, vector de la enfermedad1. El Ixodes scapularis, vector más frecuente en EE.UU. y presente en el estado de Texas, también se ha encontrado en zonas de Coahuila2. Además, se han identificado Ixodes en la Baja California, la península de Yucatán, el golfo de México y la zona del noreste de la República Mexicana3-5. El riesgo de contagio está directamente relacionado con la prevalencia de garrapatas y de reservorios infectados, así como la exposición a zonas endémicas6.
En México, los primeros casos de eritema crónico migratorio asociado a borreliosis de Lyme fueron reportados en Sinaloa y Monterrey en 19917,8. Ocho años después, Gordillo, et al. reportaron una prevalencia de infección por B. burgdorferi del 1.1% en la población general de México, mientras que la prevalencia del venado cola blanca del noreste de nuestro país fue del 3%4. Los venados son hospederos finales de los Ixodes adultos y su función primaria es mantener al vector. Otro estudio detectó Borrelia spp en el 16% de los perros residentes del área metropolitana de Monterrey10. Para el año 2003 se había reportado una seroprevalencia de infección por B. burgdorferi del 3.4% en la ciudad de México y del 6.3% en la población general del noreste del país, incluyendo los estados de Nuevo León, Coahuila y Tamaulipas, este último era el de mayor seroprevalencia5. En 2007 se reportaron los primeros casos confirmados de enfermedad cutánea y neurológica procedentes del valle de México y de Quintana Roo11.
La tercera parte de los casos de borreliosis de Lyme se presentan en menores de 18 años, y la edad de mayor riesgo es entre los 5 y los 14 años de edad12. En México, desde 1999 se ha mantenido una vigilancia epidemiológica para identificar casos de borreliosis de Lyme en la infancia13. Hasta el año 2010 se habían estudiado 72 niños, con una edad promedio de 8.5 años, de los cuales, el 55% presentaron manifestaciones cutáneas, el 27%, neurológicas, y 18% presentaron artritis. El 31.9% dieron positivo al estudio por ensayo enzimático inmunoabsorbente (ELISA), y se confirmó enfermedad de Lyme en 28% de ellos por Western blot13. El 75% de estos niños presentaron manifestaciones tempranas de la enfermedad, lo que explica el bajo índice de seropositividad, mientras que el 25% restante presentaron manifestaciones tardías, pero en ninguno de estos casos se identificaron manifestaciones oculares13.
La borreliosis de Lyme puede presentar diversas manifestaciones oftalmológicas que se agrupan en: desórdenes neurooftalmológicos, inflamación ocular externa, inflamación intraocular y desórdenes vasculares de la retina14. La borreliosis ocular de Lyme sigue siendo una enfermedad subdiagnosticada en parte debido al desconocimiento de las manifestaciones oftalmológicas y su falta de inclusión en el diagnóstico diferencial de diversos trastornos inflamatorios oculares, pero también por la dificultad de obtener un diagnóstico serológico definitivo15,16. En el presente reporte presentamos el primer caso de uveítis secundaria a borreliosis de Lyme descrito en México.
Presentación del caso
Paciente femenina de 4 años de edad, originaria de Monclova Coahuila, que fue referida al Servicio de Inmunología y Uveítis de nuestra institución para una segunda opinión por ojo rojo, fotofobia extrema y visión borrosa bilateral de 6 semanas de evolución. La paciente pertenece a una clase socioeconómica media-baja, que tiene como antecedente de importancia haber vivido en la zona semirrural de la ciudad de Longview al noreste de Texas, zona geográfica considerada área endémica de enfermedad de Lyme por el Centro de Control de Enfermedades (CDC) de Atlanta, Georgia, EE.UU., y también en el área suburbana de Monclova, Coahuila, en el noreste de México.
La paciente había sido tratada por panuveítis bilateral con esteroides tópicos y sistémicos durante 20 días, sin mejoría, pero con deterioro de su estado visual e inflamatorio ocular. Al interrogatorio indirecto (padres) por aparatos y sistemas refería mialgias y artralgias en los miembros inferiores y un cuadro similar a infección de las vías respiratorias superiores, manifestado como fiebre, ataque al estado general, rinorrea y erupción cutánea de 8 días de duración, cuadro que se presentó 10 semanas antes de su consulta. Al examen físico, la paciente no presentaba manifestaciones cutáneas, neurológicas o reumáticas evidentes asociadas a enfermedad de Lyme. El examen oftalmológico inicial reveló una agudeza visual mejor corregida de 20/200, presentando miopía (−1.25 dioptrías) y astigmatismo leve (−0.50 dioptrías) en ambos ojos. Al examen externo se encontró inyección ciliar 1+ y a la biomicroscopia se observaron precipitados retroqueráticos endoteliales finos de distribución media-inferior y celularidad de 3+ en la cámara anterior. El iris no presentaba alteraciones patológicas y el cristalino se encontró claro. A la fondoscopia se apreció una vitreítis difusa de 2+, pérdida sutil de los bordes del nervio óptico derecho (Fig. 1), exudados perivasculares segmentarios periféricos de predominancia venular, así como múltiples infiltrados inflamatorios coriorretinianos redondos de aproximadamente 50 mm de diámetro, de color blanco-cremoso en la periferia (Fig. 2). Se diagnosticó coriorretinitis multifocal, papilitis y vasculitis retiniana bilateral. En el abordaje inicial se consideraron dentro del diagnóstico diferencial, además de la artritis idiopática juvenil y el lupus eritematoso sistémico, etiologías infecciosas, como: sífilis, tuberculosis, toxoplasmosis multifocal atípica, bartonelosis y borreliosis de Lyme. Se solicitaron los siguientes estudios: biometría hemática, perfil bioquímico, proteína C-reactiva, velocidad de sedimentación eritrocítica, examen general de orina, anticuerpos antinucleares, determinación serológica de fracciones del complemento C3, C4 y CH50, prueba cutánea de tuberculina (PPD), determinación de anticuerpos fluorinados contra el Treponema Pallidum (FTA-Abs), prueba serológica para la sífilis (VDRL), anticuerpos IgG e IgM contra Toxoplasma gondii, Bartonella henselae y B. burgdorferi (ELISA). Los resultados de las pruebas serológicas fueron negativos, excepto por el análisis serológico diferenciado («2-tiered») para borreliosis de Lyme, el cual dio positivo para anticuerpos IgM (resultado: 1.21; referencia: positivo > 1.09) e IgG (resultado: 1.35; referencia: positivo > 1.09) por ELISA, confirmado por Western-inmunoblot. Este último arrojó positivo para las bandas IgM p41Kd (flagelina), IgM p23Kd (Osp C) e IgG p41Kd, específicas de B. burgdorferi (LabCorp - Laboratory Corporation of America, Burlington, NC. EE.UU.; avalado por el CDC de Atlanta, GA.)
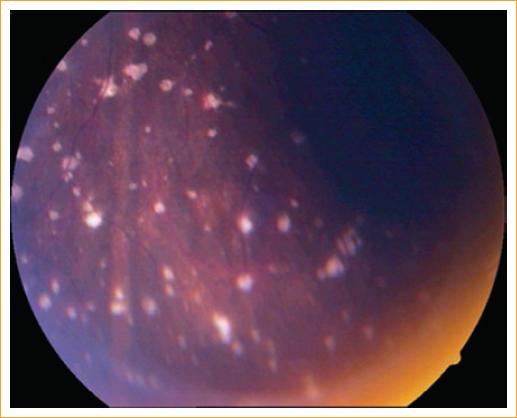
Figura 2 Lesiones multifocales, blanco-cremosas, profundas en la retina y coroides en el cuadrante inferior-temporal del ojo derecho.
Basado en los antecedentes de habitar en una zona suburbana de Coahuila, el viaje y estancia en una zona semirrural al noreste de Texas, la presencia de un cuadro respiratorio agudo con ataque al estado general, mialgias, artralgias, fiebre y erupción cutánea de más de una semana de duración, además de la ausencia de respuesta a esteroides tópicos y sistémicos previos, así como los hallazgos fondoscópicos y la confirmación serológica de B. burgdorferi, se llegó al diagnóstico de uveítis secundaria a borreliosis de Lyme. Se inició tratamiento tópico a base de acetato de fluorometolona al 0.1% cada 4 h y amoxicilina 250 mg cada 8 h (dosis ponderal: 50 mg/kg/día) vía oral durante tres semanas. Al término del tratamiento se observó ausencia de células inflamatorias en la cámara anterior y la cavidad vítrea; los bordes del nervio óptico estaban bien definidos (Figs. 3 A y 3 B); había ausencia de vasculitis retiniana y en la retina periférica las lesiones coriorretinianas estaban atróficas con apariencia «en sacabocado» (Figs. 4 A y 4 B). La agudeza visual mejor corregida era de 20/50 en ojo derecho y 20/40 en ojo izquierdo. En su última visita de seguimiento, 4 meses postratamiento, la paciente se encontró asintomática, sin datos de actividad inflamatoria intraocular y con una agudeza visual estable. Una nueva serología diferenciada para borreliosis de Lyme arrojó resultados negativos para anticuerpos por ELISA y ausencia de bandas específicas para B. burgdorferi por Western-inmunoblot. La paciente acudió 2 años después a revisión por miopía y astigmatismo, se encontraba asintomática y sin datos de uveítis activa.
Discusión
La borreliosis de Lyme es la enfermedad transmitida por vectores más frecuente en EE.UU. y algunos países de Europa17,18. A pesar de ser reportada hasta 6 a 12 veces menos de lo estimado, aproximadamente 30,000 casos son reportados al CDC de EE.UU. cada año18,19. El contexto epidemiológico es muy importante para el diagnóstico temprano de la enfermedad de Lyme. La mordedura por garrapata ocurre con mayor probabilidad en personas que pasan tiempo en hábitats arbolados o con arbustos y pastizales de lugares endémicos, especialmente entre mayo y noviembre19. En el presente caso, los antecedentes de haber vivido en una zona endémica del noreste de Texas, en EE.UU.20, y de vivir en la zona noreste de México, lugar donde se ha reportado la mayor seroprevalencia de infección por B. burgdorferi5, así como la de mayor presencia de la garrapata Ixodes scapularis2,21 y de su hospedero natural, el venado cola blanca4, promovieron la consideración de la borreliosis de Lyme como parte del diagnóstico diferencial.
Las manifestaciones clínicas de la enfermedad de Lyme han sido divididas en tres etapas: localizada, diseminada y persistente1. Las primeras dos etapas son parte de la infección temprana por B. burgdorferi, mientas que la enfermedad persistente es considerada como una infección tardía22. La tabla 1 muestra las principales manifestaciones multisistémicas y oftalmológicas, así como la duración y metodología diagnóstica empleada en las diversas etapas de la enfermedad.
Tabla 1 Características clínicas sistémicas y oculares en las diversas etapas de la borreliosis de Lyme
| Etapa | Manifestaciones multisistémicas | Manifestaciones oftalmológicas | Tiempo de aparición y método diagnóstico |
|---|---|---|---|
| Primera: Temprana localizada | Eritema migratorio (66% casos), inicia 7 días posmordedura de garrapata y persiste por 2-3 semanas. Enfermedad febril indiferenciada (50% casos), inicia 1-7 días posmordedura. Fiebre, escalofríos, malestar general, fatiga, mialgias, artralgias y cefalea. | Conjuntivitis, ojo rojo, fotofobia y lagrimeo. | Inician 1-30 días posinfección. Diagnóstico clínico. No se recomiendan pruebas serológicas (falsos negativos). |
| Segunda: Temprana diseminada | Neurológicas (5-20% casos), parálisis facial, más común, meningitis y radiculopatía (tríada de Lyme), así como encefalopatía y musculo-esqueléticas: poliartritis migratoria que evoluciona a proceso monoarticular (rodilla, tobillo y muñeca). | Diplopía, oftalmoplegia internuclear, parálisis facial, papiledema, visión borrosa, dolor, queratitis, epi y escleritis, uveítis (coriorretinitis multifocal), papilitis, panoftalmitis. | Artritis, inicia 3-10 semanas. y meningitis, 2-10 semanas posinfección. Anticuerpos IgM e IgG contra B. Burgdorferi (ELISA), confirmado por Western-blot. PCR (disponibilidad limitada) |
| Tercera: Tardía o crónica persistente | Reumáticas: artritis de rodilla (90% casos) y neurológicas: encefalopatía subaguda, encefalomielitis crónica progresiva, neuropatía axonal y mielitis (50% casos). Acrodermatitis crónica atropicana en dorso de manos, pies, rodillas y codos (europeos). | Uveítis anterior, intermedia, posterior, panuveítis, vasculitis retiniana, miositis orbitaria, desprendimiento exudativo de retina, obstrucción de vena central y de rama. | Inician meses a años posinfección inicial. Anticuerpos IgG contra B. Burgdorferi (ELISA), confirmado por Western-blot. PCR (disponibilidad limitada) |
ELISA: ensayo enzimático inmuno-absorbente; PCR: reacción en cadena de polimerasas.
Se ha calculado que las manifestaciones oculares ocurren en tan solo el 1% de los casos, y pueden ocurrir en cualquiera de las tres etapas de la enfermedad14,22. Durante la primera etapa, caracterizada por la aparición del eritema migratorio y un cuadro febril indiferenciado, puede observarse conjuntivitis, ojo rojo, fotofobia y lagrimeo23,24. La conjuntivitis es la manifestación más común, reportada en hasta el 11% de los casos y casi siempre se presenta en las primeras semanas de la infección23. En la segunda etapa, dominada por síntomas neurológicos y musculoesqueléticos, puede observarse diplopía, parálisis facial, oftalmoplegia internuclear, visión borrosa y dolor ocular, así como queratitis, epiescleritis, uveítis anterior, coriorretinitis multifocal, papilitis, panoftalmitis, obstrucciones venosas de retina, desprendimiento exudativo de retina y miositis orbitaria14,24,25. En la tercera etapa, caracterizada por síntomas reumatológicos (artritis) y neurológicos, suelen ocurrir todas las manifestaciones oculares descritas en la segunda etapa, pero sobre todo las más severas, como la inflamación intraocular12,16,24,26. La uveítis intermedia es la forma más común, pero también se observa la coriorretinitis multifocal como ocurrió en el presente caso y la vasculitis retiniana14. No se ha establecido si los pacientes en etapa tardía representan una falla al tratamiento antibiótico o persistencia de la borrelia, una nueva infección con otro patógeno transmitido por garrapatas o tal vez un fenómeno de autoinmunidad26.
En el presente reporte, todo hace suponer que la paciente se encontraba en la segunda etapa por el tiempo transcurrido desde el cuadro respiratorio y febril inespecífico hasta la aparición de los síntomas oculares. Aparte del resultado serológico positivo y el tipo de manifestación ocular: coriorretinitis multifocal, vasculitis retiniana y papilitis, que son manifestaciones clínicas concordantes con esta etapa, la paciente no presentó síntomas reumáticos, ni neurológicos.
El eritema migratorio es el indicador diagnóstico clínico de la borreliosis de Lyme; sin embargo, hasta en el 20% de los casos no se observa erupción cutánea27. En áreas endémicas, los pacientes con eritema migratorio y reciente exposición a mordedura por garrapata no requieren de estudios serológicos para el diagnóstico19,27. En estas primeras etapas de la enfermedad, la posibilidad de resultados serológicos falsos negativos es alta y cuando dichas pruebas resultan positivas, no logran distinguir entre una infección activa o pasada28. En este mismo sentido, la sensibilidad del análisis serológico diferenciado («2-tiered») para detectar anticuerpos IgM e IgG contra B. burgdorferi en el suero de pacientes cuando la respuesta inmune humoral se está desarrollando es tan solo del 30-40%28,29. Por tanto, el diagnóstico de borreliosis ocular de Lyme en etapas tempranas es difícil, pues está basado en hallazgos clínicos inespecíficos relacionados con inflamación de la superficie ocular, inflamación intraocular o alteraciones neurooftalmológicas de pacientes en alto riesgo de contagio30. Para la enfermedad de Lyme diseminada, la sensibilidad de las pruebas serológicas se incrementa al 70-100%, mientras que la especificidad es alta (95%) durante todas las etapas de la enfermedad15. Otras pruebas diagnósticas son las directas, específicamente el cultivo y la reacción en cadena de la polimerasa (PCR). El cultivo no está disponible para su realización en forma rutinaria, técnicamente es difícil de realizar y se caracteriza por su baja sensibilidad diagnóstica. Por otra parte, la PCR solo se realiza en forma ordinaria en líquido sinovial de pacientes con artritis sospechosos de padecer la enfermedad, y existen reportes aislados de su utilidad diagnóstica en tejidos oculares, como conjuntiva, humor acuoso o vítreo31,32.
Entonces, el diagnóstico de la uveítis secundaria a borreliosis de Lyme está basado en los antecedentes de exposición a mordedura por garrapata o ambientes de riesgo; en un análisis serológico diferenciado positivo durante las etapas diseminada y persistente; en la resistencia al tratamiento con esteroides, y en la respuesta favorable a la antibióticoterapia, así como en la exclusión de otros diagnósticos probables33,34. En este caso, la paciente tenía antecedentes epidemiológicos de riesgo para desarrollar la borreliosis de Lyme, no había mostrado mejoría al tratamiento con esteroides y la serología para otras causas de uveítis fue negativa. Además, presentó un resultado francamente positivo y confirmatorio de infección con B. burgdorferi en la serología diferenciada. Al respecto, la paciente presentó bandas en la electroforesis proteica de p23Kd y p41Kd para IgM y de p41Kd para IgG contra B. burgdorferi, las cuales son típicas en la enfermedad de Lyme, que se tornaron negativas después del cuarto mes postratamiento27,29. Durante el curso clínico de la borreliosis de Lyme se observa una seroconversión por ELISA y Western-blot, que cambia de positiva a negativa y viceversa sin seguir un patrón regular35.
El diagnóstico diferencial de la borreliosis ocular de Lyme debe incluir cualquiera de las causas probables de las manifestaciones neurooftalmológicas e inflamatorias oculares observadas en estos casos, incluyendo la conjuntivitis viral, infecciones por virus herpes simple y varicela zoster, fiebre de las Montañas Rocosas, síndrome de Horner, sarcoidosis, parálisis facial y troclear, neuritis óptica, sarcoidosis, sífilis, entre otras22,24,36.
En cuanto al manejo, la conjuntivitis de la primera etapa usualmente no requiere tratamiento, al igual que la parálisis facial presente en la segunda etapa, que suele ser autolimitada, pero las complicaciones de la queratitis por exposición requieren terapia de soporte. La epiescleritis y queratitis suelen tratarse con un curso corto de esteroides tópicos25. Por otra parte, en el caso de enfermedad neurooftalmológica con afectación del nervio óptico o uveítis intermedia, posterior y panuveítis, el uso de esteroides sistémicos debe acompañarse de antibiótico-terapia. Para ello, se emplean 2 a 3 semanas de penicilina-G, doxiciclina, cefuroxima, cefotaxima o ceftriaxona en la mayoría de los casos26. En la infancia, el antibiótico oral de primera elección es la amoxicilina (50 mg/kg/día hasta una dosis máxima de 500 mg/día), es por ello que en este caso decidimos emplear dicho antibiótico, aunque también se puede emplear penicilina-V sódica y ceftriaxona37. Una revisión sistemática de la antibiótico-terapia en niños con borreliosis de Lyme no encontró diferencias en la eficacia terapéutica entre los diferentes antibióticos37. Las recurrencias de la borreliosis de Lyme, sobre todo la artritis en tercera etapa se trata con esteroides26.
Nuestra paciente tenía 4 años de edad, se encontraba en la segunda etapa y había recibido esteroides sistémicos durante 3 semanas sin respuesta. Por estos motivos se decidió suspenderlos. En conclusión, la uveítis secundaria a borreliosis de Lyme es una entidad rara y probablemente subdiagnosticada en nuestro país. La escasa información epidemiológica y la falta de un escrutinio serológico a pacientes sospechosos de contraer la enfermedad contribuyen al bajo diagnóstico. En el diagnóstico de cualquier panuveítis bilateral se debe incluir un interrogatorio exhaustivo de aparatos y sistemas que incluya los antecedentes de modo y lugar de vida (zona geográfica), especialmente de hábitats de alto riesgo para el contagio con B. burgdorferi. En nuestro país se deben considerar dichos antecedentes, especialmente en pacientes provenientes de la zona noreste y su franja fronteriza con el estado de Texas, EE.UU. En cualquier paciente sospechoso o en riesgo que presente manifestaciones neurooftalmológicas asociadas a uveítis bilateral en quien se hayan descartado otros procesos infecciosos e inmunes frecuentes y que no respondan a esteroides, se debe tomar en cuenta a la borreliosis de Lyme dentro del diagnóstico diferencial.











 nueva página del texto (beta)
nueva página del texto (beta)





