Antecedentes
La inmunodeficiencia común variable (IDCV) fue descrita en 1953;1 el término comprende diversos trastornos de deficiencia de anticuerpos. La IDCV es el grupo más grande de inmunodeficiencias primarias (IDP) sintomáticas, con una incidencia de 1:10000 y 1:50000. No hay predisposición según el sexo y la edad, el comienzo de los síntomas es por lo general entre la segunda y tercera décadas de la vida y solo un pequeño grupo tiene manifestaciones en la infancia. El diagnóstico se define por la severa reducción de al menos dos isotipos de inmunoglobulina, la mala respuesta a la vacunación, el inicio de manifestaciones después del segundo año de vida y la exclusión de diagnóstico diferencial definido (www.esid.org) (Cuadro 1).2
Con frecuencia se manifiesta por infecciones bacterianas severas, recurrentes y a veces crónicas, principalmente de las mucosas de los tractos gastrointestinal y respiratorio. Las infecciones pueden ser esporádicas y las oportunistas son raras, las cuales deben hacer sospechar de un defecto combinado. En 25 a 50 % de los casos también se presentan procesos autoinmunes (las citopenias son las más comunes), complicaciones inflamatorias, granulomatosas, linfoproliferativas y desarrollo de cáncer.3
Manifestaciones clínicas
Los pacientes con IDCV presentan infecciones respiratorias de repetición especialmente sinusitis, otitis, bronquitis y neumonías; las bacterias encapsuladas (Haemophilus influenzae, Streptococcus pneumoniae y Pseudomona aeruginosa) son las principales responsables. Si los pacientes no son tratados adecuadamente, las infecciones pulmonares de repetición provocan la aparición de complicaciones como bronquiectasias, enfisema y fibrosis pulmonar, que se desarrollan en aproximadamente 20 a 30 % de los pacientes.4
Las manifestaciones gastrointestinales siguen a las respiratorias: la diarrea crónica (aproximadamente en 30 % de los pacientes),5 el síndrome de malabsorción y la intolerancia a la lactosa. Las afecciones más comunes son las enteritis por Salmonella y Giardia lamblia, así como la enfermedad inflamatoria intestinal; la enteropatía no se debe a sensibilidad al gluten. La biopsia intestinal muestra vellosidades atrofiadas e infiltración linfocitaria de la lámina propia, y las lesiones son muy semejantes a las producidas por la enfermedad de Crohn o la colitis ulcerosa.6
La asociación entre enfermedad autoinmune e IDCV es frecuente. Las enfermedades autoinmunes de mayor incidencia son la anemia hemolítica, la púrpura trombocitopenia idiopática y, en menor grado, la neutropenia autoinmune. También se ha descrito relación con artritis reumatoide, lupus eritematoso sistémico, síndrome de Sjögren, hiper e hipotiroidismo y anemia perniciosa7
La enfermedad pulmonar intersticial granulomatosa (10 a 20 %) de causa desconocida es una forma de reacción inflamatoria que ocasiona mayor predisposición a la aparición de fenómenos autoinmunes y va acompañada de infiltración intersticial linfocitaria que evoluciona a lesión pulmonar restrictiva, responsable de mortalidad temprana. A menudo se asocia con esplenomegalia, adenopatía, citopenia autoinmune y enfermedad hepática con tendencia al desarrollo de linfomas8 El diagnóstico es anatómico y patológico.
Puede existir expansión del tejido linfoide a otros órganos y crecimiento de adenopatías cervicales, mediastinales y, a veces, abdominales, con esplenomegalia. Hay aumento en la frecuencia de neoplasias: 31.5 % de linfomas y aumento del riesgo de cáncer gástrico debido a gastritis crónica por Helicobacter pylori. En el Cuadro 2 se resumen las manifestaciones clínicas.
Inmunopatología
El sistema inmune en los pacientes con IDCV ha sido ampliamente investigado y se han descrito diversos fenotipos celulares y anormalidades en la respuesta adaptativa, así como, más recientemente, en el sistema inmune innato. La descripción de una gran cantidad de defectos en diferentes cohortes de pacientes ha dificultado la comprensión de las vías inmunopatogénicas que conducen a un fenotipo de IDCV. Con base en que los defectos más comunes se encuentran en las células T y B, se han introducido varios sistemas de clasificación.
Células B
Un defecto común en los pacientes con IDCV es la formación anómala de anticuerpos. Desde la primera descripción de la IDCV se han realizado múltiples estudios de las células B con el fin de obtener conocimientos nuevos sobre esta enfermedad. Se ha registrado ligera reducción en el número de células B periféricas en 40 a 50 % de los pacientes9 y solo en pocos individuos está elevado, lo cual se asocia con infiltración policlonal de los órganos linfoides y autoinmunidad.10 Se ha descrito que en 10 % de los pacientes, las células B se reducen progresivamente debido al aumento de la severidad de la enfermedad.11 También se ha demostrado agotamiento de las células plasmáticas en los órganos linfoides.12,13,14 Con los estudios histopatológicos de los órganos linfoides secundarios podría determinarse los posibles mecanismos patogénicos, pero la realización de este tipo de exámenes todavía es poco frecuente.
Bryant propuso una primera clasificación de los pacientes con IDCV;15,16 en ella se describe la capacidad de la célula B de secretar IgM, IgG e IgA bajo estimulación in vitro con Staphylococcus aureus Cowan I, adicionando IL12 o antiIgM más IL2. Se establecen tres grupos:
Grupo A, pacientes con falla en la producción de cualquier isotipo de inmunoglobulinas in vitro.
Grupo B, pacientes con producción normal solamente de IgM.
Grupo C, pacientes con producción de cualquier tipo de isotipo de inmunoglobulinas in vitro similar a la de individuos sanos, pero con niveles bajos de inmunoglobulinas in vivo.16
Los actuales conocimientos sobre maduración y diferenciación de las células B han permitido definir otras alteraciones en las subpoblaciones de células B. Las células B vírgenes y las células B de memoria (BM) en humanos pueden identificarse usando una combinación de marcadores que incluyen isotipos de inmunoglobulinas; CD27 se expresa en la mayoría de las BM, entre otros marcadores celulares que ayudan a discriminar entre las diferentes subpoblaciones de células B. En los humanos, las mutaciones en las regiones variables de las inmunoglobulinas correlacionan con la expresión de CD27 en las BM.17 A partir del 2012, en Freiburg y París se clasificó por separado a los pacientes con IDCV según las subpoblaciones de células B.18,19
Utilizando como marcadores de memoria a CD27, CD21 y CD19, Warnatz y colaboradores establecieron en 2002 una nueva clasificación (Cuadro 3). En ella, los pacientes tipo 1a poseen porcentajes muy bajos de BM con cambio de isotipo. El 100 % de los pacientes tipo 1a presenta esplenomegalia y 60 %, citopenia autoinmune, mientras que solo en 7.7 % de los pacientes tipo 1b se asocian otros fenómenos autoinmunes como vitiligo y anemia perniciosa. En esta clasificación se concluyó que los pacientes con IDCV del grupo I pueden tener reacciones irregulares en el centro germinal. Los pacientes con IDCV del grupo II pueden cursar con incremento en la proliferación o decremento en la apoptosis. Si los pacientes tienen un número normal de BM pueden tener una reacción normal del centro germinal, pero falla en la producción de anticuerpos in vivo; la hipogammaglobulinemia puede deberse a anomalías en la diferenciación hacia las células plasmáticas.19

Cuadro 3 Clasificación de los pacientes con IDCV según las clasificaciones de Freiburg, París y la Euroclass
La clasificación propuesta por el grupo de París se basa en la cuantificación de la proporción de subpoblaciones de BM, definidas con base en la expresión de IgD y CD27 y divide a los pacientes en tres grupos (Cuadro 3). Se observó una mayor proporción de manifestaciones linfoproliferativas y granulomatosas en los pacientes con IDCV del grupo BM0 y de esplenomegalia en los pacientes de los grupos BM0 y BM1.18
La última clasificación de los pacientes con IDCV es la de Euroclass Trial, ensayo europeo iniciado para desarrollar un consenso fundamentado en el fenotipo de las células B y en el curso clínico (Cuadro 3). La evaluación clínica de 303 pacientes con IDCV demostró que la reducción severa de las células B de memoria se relacionó con riesgo alto de esplenomegalia y enfermedad granulomatosa.9
Estudios de la activación de las células B con diferentes estímulos que activan el receptor de células B, la proteína de membrana CD40, los receptores de citocinas, así como los receptores tipo Toll (TLR)20,21,22,23 han identificado a pacientes con defecto en la activación de estos receptores; las causas aún se desconoce.
Células T
Según los criterios diagnósticos de la European Society for Immunodeficiency (ESID), los pacientes con IDCV no deberían tener evidencia de deficiencia profunda de células T, que se define como:24,25
Número de células T CD4+ < 300/mm3 en niños de 2 a 6 años, < 250 en niños de 6 a 12 años y < 200 en niños > 12 años o adultos.
Porcentaje de células T CD4+ vírgenes < 25 % en niños de 2 a 6 años, < 20 % en niños de 6 a 16 años y < 10 % en jóvenes > 16 años y adultos.
Proliferación ausente de células T CD4+.
Los pacientes con IDCV que cursan con estos criterios son considerados con inmunodeficiencia combinada.
Desde hace una década se conocen los defectos fenotípicos y funcionales de las células T CD4+; varios estudios muestran que la pérdida de las células T CD4+ vírgenes correlacionan con características clínicas de la IDCV.26,27 Con base en la reducción de las células T CD4+ vírgenes, Giovannetti y colaboradores definieron subgrupos de pacientes con manifestaciones clínicas relevantes. Los pacientes del grupo I mostraron una reducción severa de las células T vírgenes, con señales masivas de activación de células T, asociación con esplenomegalia, apoptosis elevada y curso grave de la enfermedad.26 Otro estudio mostró que los pacientes con IDCV con citopenia autoinmune tienen incremento de las células T activadas, decremento de las células T CD4+ vírgenes y aumento de las células B CD21 bajo.28
Las citocinas desempeñan un papel importante en la orquestación de las respuestas de anticuerpos. Varias investigaciones han tratado de identificar las citocinas responsables de los cambios inflamatorios y manifestaciones clínicas en los pacientes con IDCV29 Según su perfil, las citocinas de las células T cooperadoras se dividen en Th1, Th2, Th9, Th17 y Th foliculares. Las citocinas son cruciales en la respuesta de anticuerpos, regulación inmune y tolerancia, de ahí que su producción anormal puede contribuir a la inmunodeficiencia.30,31,32,33
Recientemente se ha estudiado el equilibrio Th1/ Th2 en pacientes con IDCV. Las células Th1 parecen estar más involucradas en la patogénesis de la enfermedad que las células Th2. Pacientes con hepatomegalias tuvieron una producción alta de IL2 e INFγ.34
En un estudio de nuestro equipo de investigadores se evaluó la producción de citocinas Th1, Th2, Th9, Th17 y Th22 y se correlacionó con la capacidad de expresar células B de memoria, agrupando a los pacientes con la clasificación de Freiburg. Se concluyó que los pacientes del grupo Ia tenían baja producción de IL17 e IL10, sin embargo, los pacientes del grupo Ib tuvieron baja producción de IL2, IL10, IL13, IL17 e IL9, seguida de la estimulación con SEB. El grupo Ib mostró un defecto intrínseco en las células T más pronunciado que el grupo Ia; en el grupo II la producción de citocinas fue igual que en los controles sanos.35
Por su parte, Barbosa y colaboradores reportaron disminución en la frecuencia de las células Th17 en pacientes con IDCV y mostraron una correlación negativa entre las células Th17 y la expansión de las células B CD21 bajo, con deterioro de la función de los centros germinales. En otra investigación se evaluó la expresión de genes específicos de las células Th17, que fue marcadamente reducida comparada con la de individuos sanos.36,37 Sin embargo, los resultados de otras investigaciones son contradictorios, probablemente por las diferencia en el tipo y tamaño de muestra, el estado clínico de los pacientes y las complicaciones asociadas
Varios análisis han demostrado que las células T reguladoras se encuentran reducidas en pacientes con IDCV,38,39,40 con correlación significativa con manifestaciones autoinmune como lesiones granulomatosas y esplenomegalia. Arumagakani y colaboradores registraron baja frecuencia de células T reguladoras y expansión de las células B CD21 bajo.38 La mayoría de los estudios se basa en el aná- lisis fenotípico de las células T reguladoras de sangre periférica. Yu y colaboradores señalan que las células T reguladoras de los pacientes con IDCV con enfermedad autoimune tienen reducida la capacidad de suprimir la producción de células T CD4+ efectoras autólogas en comparación con los pacientes con IDCV sin autoinmunidad.40
Al igual que las células T CD4+, las células T CD8+ están afectadas en los pacientes con IDCV. Se ha reportado que la reducción del conteo de las células T CD8+ fue más significativa en pacientes con IDCV y citopenia autoinmune27 Viallard y colaboradores señalan correlación entre las células T CD8+ HLA-DR+ con un bajo número de células B de memoria (CD19+, CD27+),41 además de que los pacientes con células T CD8+ activadas mostraron reducción en la diversidad del repertorio de su receptor inhibidor de células T (TCR), que era más grave en los pacientes con complicaciones clínicas como autoinmunidad, esplenomegalia, proliferación linfoide y enfermedad granulomatosa.42 Por la dependencia esencial de la función de las células B a las células T, estas últimas son cruciales en la patogénesis de la IDCV.
Respuesta innata
Las células presentadoras de antígeno, como las células dendríticas, tienen una función importante en los órganos linfoides secundarios ya que interactúan con las células T vírgenes en la zona T de los órganos linfoides. Las células T activadas pueden colaborar con las células B y formar la reacción de centro germinal y, por ende, la diferenciación terminal de las células B y la producción de anticuerpos.43 Además, las células dendríticas plasmocitoides pueden inducir diferenciación de las célula B mediante los TLR y las citocinas BAFF (B cell activating factor) y APRIL (proliferation inducing ligand), los ligandos de las proteínas TACI (transmembrane activator and calcium modulator and cyclophilin ligand interactor) y BAFFR (receptor of B cell activating factor), las cuales se expresan en las células B; esta respuesta es independiente del antígeno T.44
Si bien se ha investigado ampliamente el deterioro de la respuesta adaptativa en la IDCV, en los últimos años la atención se ha centrado en los defectos en el sistema inmune innato como posible explicación para la heterogeneidad del fenotipo clínico. Se ha evidenciado la alteración en la distribución de células dendríticas en la sangre periférica, así como la capacidad defectuosa de las células dendríticas para activar a células T después de la estimulación antigénica.45,46,47 Estos resultados se han asociado con disminución de la expresión del complejo mayor de histocompatibilidad clase II y de moléculas coestimuladoras, así como reducción de la producción de IL12. Por otro lado, el aumento de la producción de IL12 por monocitos ha sido también reportado en IDCV.48,49 Cierta evidencia también ha demostrado niveles reducidos en circulación de las células asesinas naturales (NK).50 Más importante, sin embargo, es que las células dendríticas plasmocitoides exhiben respuestas deterioradas a la estimulación con CPG oligodeoxinucleótidos in vitro.21
Es necesaria una comprensión más detallada de la situación de las células de la respuesta innatas tras la activación con diferentes ligandos de TLR para elucidar los defectos específicos de esta respuesta en los pacientes IDCV, que pueden explicar la variabilidad de los síntomas clínicos. La implicación de las vías de los TLR en la patogénesis de la IDCV está apoyada por el hecho de que los defectos genéticos en la señalización de los TLR conducen a mayor susceptibilidad a infecciones bacterianas y a mala respuesta de los anticuerpos.24,51
Etiología
A pesar de las numerosas investigaciones, aún no se conoce la alteración fundamental que da lugar a la IDCV. Una de las características que dificulta su estudio es la heterogeneidad tanto clínica como en el fenotipo celular que presentan los pacientes. Más de 90 % de estos no tiene un diagnóstico molecular definido. La manifestación de la enfermedad en la mayoría enfermos es esporádica y solo 10 a 20 % tiene historia familiar, de herencia autosómica dominante en la mayoría de los casos.52 En las décadas de 1980 y 1990, varios estudios de ligamiento genético se centraron principalmente en la región HLA y demostraron la asociación con deficiencia de IgA.53,54
En los últimos 4 años, las tecnologías de secuenciación de próxima generación han acelerado el descubrimiento de genes de la enfermedad IDCV con patrones de herencia autosómicos recesivos y dominantes. La heterogeneidad clínica, combinada con la edad variable de aparición sugiere que las IDCV son una colección de entidades clínicas causadas por una serie de defectos genéticos distintos, por lo que es posible que tras esta denominación de incluyan distintas enfermedades.
Con los análisis genéticos de los pacientes con un fenotipo IDCV se han identificado deficiencias en proteínas con patrones de herencia recesiva como ICOS (inducible T cell costimulator),55 TACI,56 BAFFR,57 CD19,58 CD20,59 CD21,60 CD27,61 CD81,62 PRKCD (protein kinase C delta),63 LRBA (lipopolysaccharide-responsive beige-like anchor protein),64 RAC2 (ras-related c3 botulinum toxin substrate)65 (Cuadros 4.1 y 5.1) y con rasgos autosómicos dominantes como CTLA- 4 (cytotoxic t lymphocyte-associated antigen 4),66 TWEAK (TNF-like weak inducer of apoptosis),67 PLCG2 (phospholipase C gamma 2),68 PIK3R1 (class IA phosphatidyl-inositol-3-kinase subunit p110δ),69 PIK3CD (class IA phosphatidylinositol- 3-kinase subunit p85α),70 NFKB2 (nuclear factor of kappa light chain B2),71 NFKB1 (nuclear factor of kappa light chain B1),72 Vav1 (Vav guanine nucleotide exchange factor),73 IKAROS,74 BLK (B-lymphoid tyrosine kinase),75 IRF2BP2 (interferon regulatory factor 2 binding protein 2)76 (Cuadros 4.2 y 5.2). La secuenciación completa del exoma (WES) ha demostrado ser una herramienta eficaz para el descubrimiento de las mutaciones en las inmunodeficiencias primarias.77
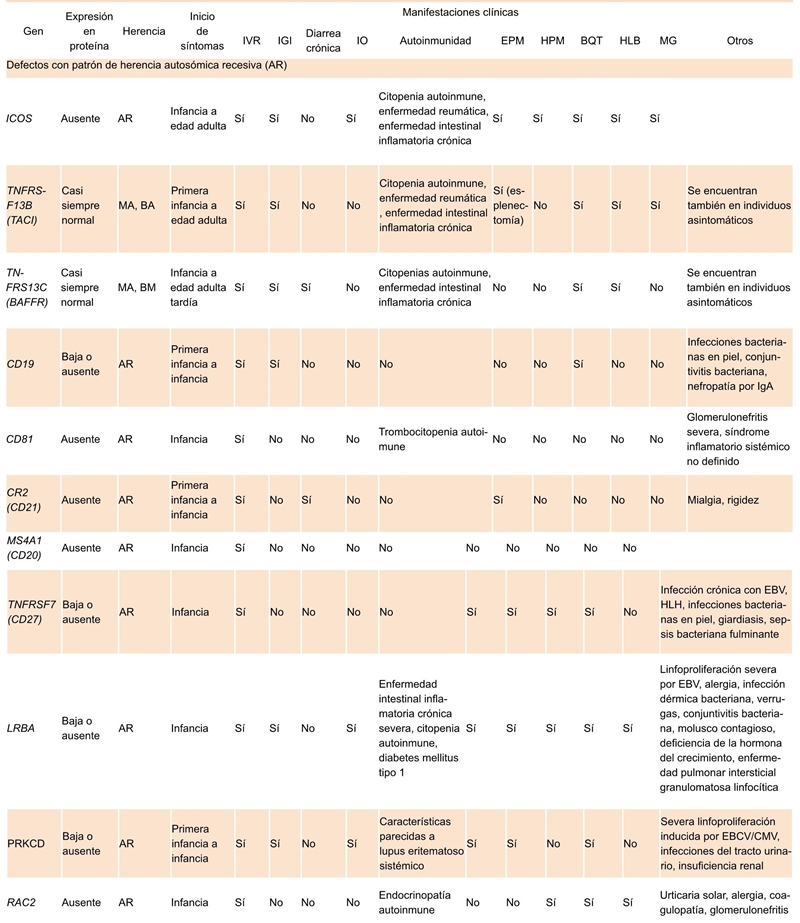
IVR, infección de vías respiratorias; IGI, infección gastrointestinal; IO, infecciones oportunistas; EPM, esplenomegalia; HPM, hepatomegalia; BQT, bronquectasias; HLB, hiperplasia linfoide benigna; ...Continúa de la página anterior MG, malignidad; MA, monoalélica; BA, bialélica AR, autosómica recesiva; EBV, virus de Epstein-Barr; HLH, linfohistiocitosis hemofagocítica; CMV, citomegalovirus
Cuadro 4.1 Manifestaciones clínicas de los defectos en los genes asociados a la IDVC; patrón de herencia autosómica recesiva
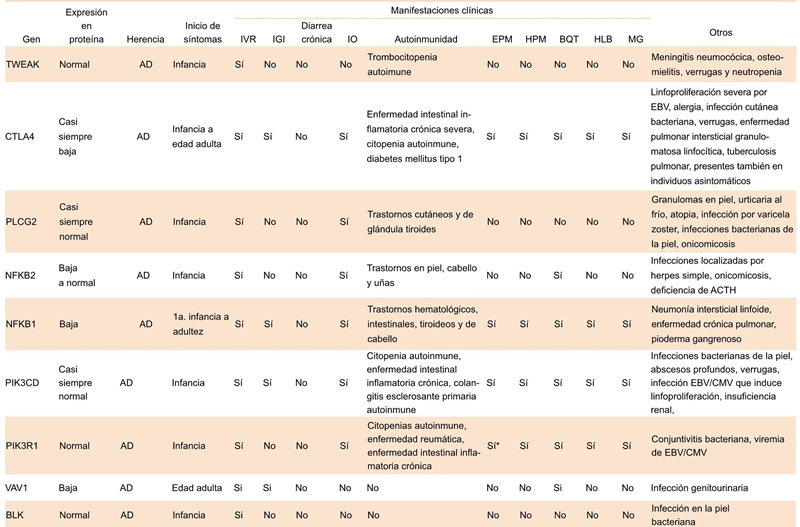
VR, infección de vías respiratorias; IGI, infección gastrointestinal; IO, infecciones oportunistas; EPM, esplenomegalia; HPM, hepatomegalia; BQT, bronquectasias; HLB, hiperplasia linfoide benigna; MG, malignidad; AD, autosó- mica dominante; EBV, virus de Epstein-Barr; HLH, linfohistiocitosis hemofagocítica; CMV, citomegalovirus. *Esplecnectomía
Cuadro 4.2 Manifestaciones clínicas en los defectos en los genes asociados en la IDVC; patrón de herencia autosómica dominante
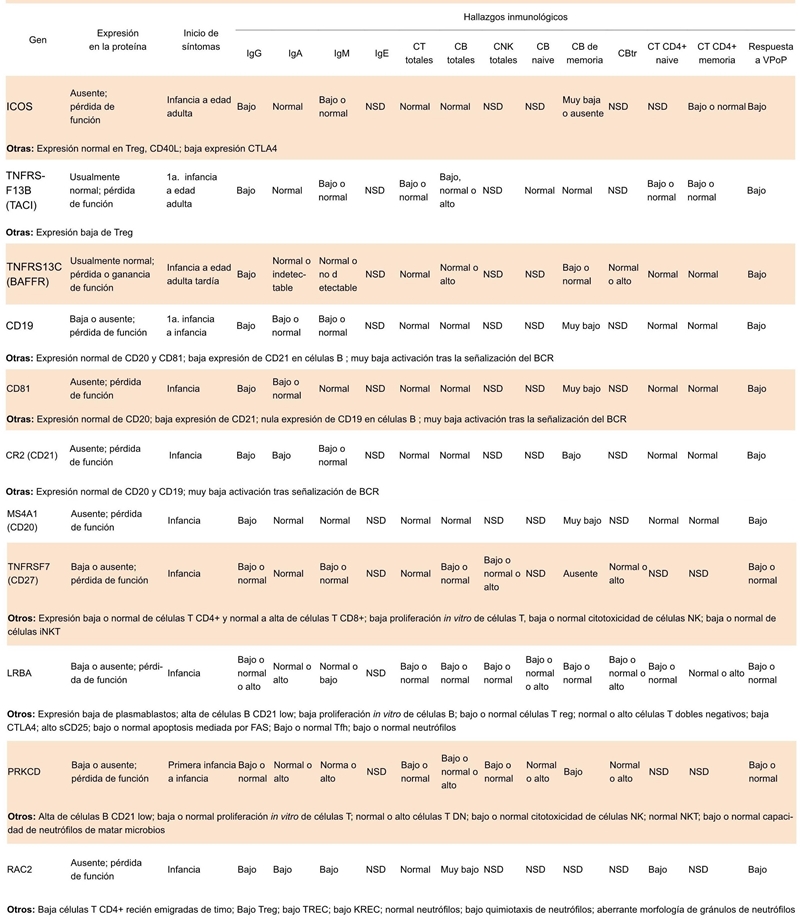
CT, células T; CB, células B; CNK, células NK; CBtr, células beta transicionales, VPoP, vacuna de polisacáridos o proteínas
Cuadro 5.1 Hallazgos inmunológicos en los defectos en los genes asociados en la IDVC; patrón de herencia autosómica recesiva
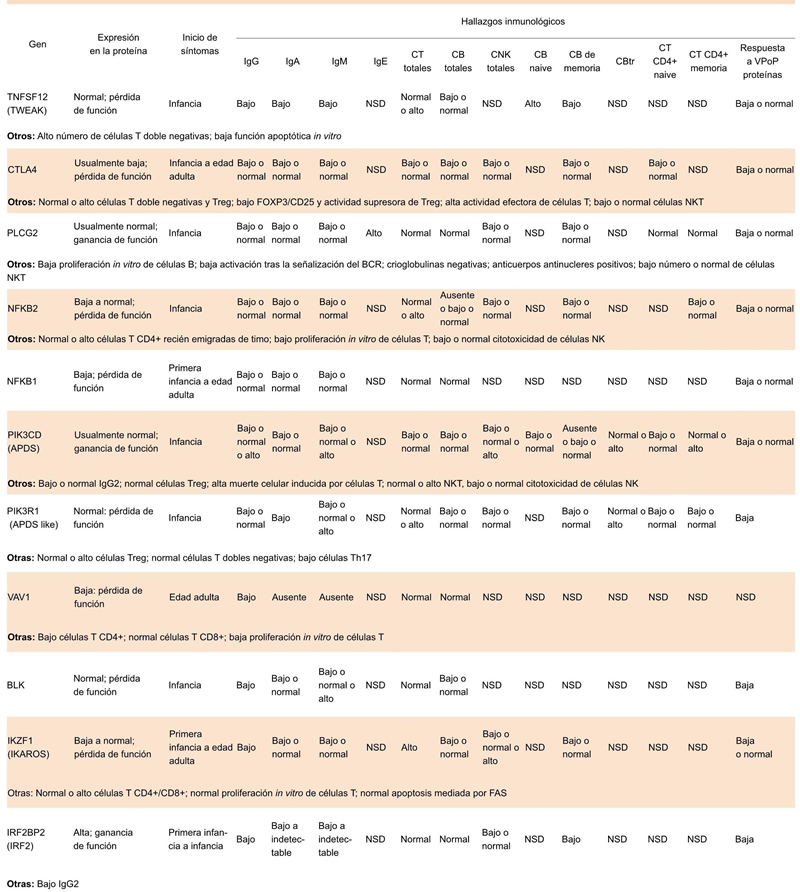
CT, células T; CB, células B; CNK, células NK; CBtr, células beta transicionales, VPoP, vacuna de polisacáridos o proteínas
Cuadro 5.2 Hallazgos inmunológicos en los defectos de los genes asociados a la IDVC; patrón de herencia autosómica dominante
En 2003 se describieron las mutaciones en ICOS, que fue identificada como la primera enfermedad genética que resulta en un fenotipo IDCV.55 La interacción de ICOS, que se expresa en células T activadas, con su ligando ICOSL (el cual se expresa en las células B) es esencial para la formación del centro germinal y la diferenciación terminal de la célula B.55 Los pacientes con deficiencia en ICOS tienen un fenotipo clínico variable, con comienzo en diferentes edades y con diferentes grados de severidad de la enfermedad (Cuadro 4.1 y 5.1).
Se han identificado mutaciones en genes que codifican para las proteínas BAFFR y TACI, las cuales son miembros de las familias de receptores del factor de necrosis tumoral (TNF), importantes en la homeostasis de las células B. Estos receptores se acoplan a sus ligandos: BAFF y APRIL. Los receptores y sus ligandos son necesarios para la óptima activación de varias vías de señalización78 Los pacientes con mutaciones monoalélicas y bialélicas en TACI presentan un fenotipo clínico muy variado (Cuadros 4.1 y 5.1).79 TACI coopera con los TLR, los cuales activan las células B y la producción de anticuerpos, por lo que se ha observado que los pacientes con deficiencia en TACI tienen mala respuesta a TLR7 y TLR9.78 La deficiencia de BAFF-R en los humanos afecta fuertemente el desarrollo y la homeostasis de las células B de memoria, con cambio y sin cambio de isotipo. Esta deficiencia se correlaciona con el cuadro clínico de aparición tardía (Cuadros 4.1 y 5.1).57 En 2013 se identificó a un paciente con IDCV y mutación en el gen TNFSF12, que codifica para la proteína TWEAK, la cual tiene efectos principalmente en las células endoteliales y células de respuesta inhata (Cuadros 4.2 y 5.2).67
También se han encontrado mutaciones en miembros del complejo receptor de células B (CD19, CD21 y CD81) y en el antígeno de diferenciación de las células B CD20.59,60,62 CD19 se expresa junto con CD21, CD81 y CD225 en la superficie de las células B maduras. CD19 y CD21 de las células B son antígenos específicos a diferencia de CD81 y CD225, también presentes en otras células inmunes80 Esta serie de proteínas ayudan a las células B a activarse; CD21 reconoce CD23 de las células dendríticas foliculares; CD19 activa a proteínas cinasas intracitoplasmáticas; la función de CD81 (TAPA-1) se desconoce, pero CD20 participa en el transporte de calcio, importante para la proliferación y diferenciación de las células B.80,81 El fenotipo clínico de los pacientes con estas deficiencias se describe en los Cuadros 4.1 y 5.1.
Una mutación homocigota en el gen TNFRSF7, que codifica para lo proteína CD27, fue identificada en 15 pacientes y 2 pacientes heterocigotos. CD27 es un receptor de linfocitos que interactúa con CD70 y regula la supervivencia, función y diferenciación de las células T, B, NK y células plasmáticas; también se utiliza como marcador de memoria en las células B. El fenotipo de los pacientes con deficiencia de CD27 es variado, pero casi todos sufren infección por el virus de Epstein-Barr (EBV) (Cuadros 4.1 y 5.1).61,82
En 2012 se describieron 5 pacientes de 4 familias consanguíneas no relacionadas con deficiencia inmune humoral y autoinmunidad de inicio en la infancia temprana, consistente con diagnóstico de IDCV y mutación de la LRBA (Cuadros 4.1 y 5.1). Los pacientes presentaron fallas en el desarrollo y defectos en la activación in vitro de las células B, la formación de plasmablastos y la secreción de inmunoglobulinas.64 LRBA es una proteína citosólica localizada en el retículo endoplasmático; se expresa en casi todas las células con funciones efectoras, en el tráfico de vesículas, autofagia y supervivencia celular.64
Dos grupos independientes de investigadores que utilizaron WES junto con el análisis de ligamiento identificaron mutaciones heterocigotas en CTLA-4 en una familia numerosa.66 Muchos pacientes con deficiencia de CTLA-4 fueron clínicamente diagnosticados con IDCV; sin embargo, también se detectaron mutaciones en la familia de CTLA-4 en individuos asintomáticos o con deficiencia de IgA, lo que indica penetrancia incompleta (Cuadros 4.2) y 5.2). Análoga a la deficiencia de LRBA, la deficiencia de CTLA-4 fue descrita por primera vez en pacientes con IDCV, pero actualmente se considera un nuevo síndrome de desregulación inmune. CTLA-4 es un TCR que regula negativamente la respuesta inmune. Se ha demostrado que LRBA está involucrado en la expresión de CTLA-4 en la superficie.83,84
En pacientes con fenotipo clínico de IDCV se han identificado defectos que codifican para las proteínas PKCδ, PLCγ2, NF-κB2, NF-κB1, p110δ (subunidad reguladora de PI3K [class IA phosphatidyl-inositol-3-kinase], p85 (subunidad reguladora de PI3K), Vav1, Rac2, BLK, IKAROS y IRFBP2 8(Cuadros 4 y 5).85
El análisis de las rutas bioquímicas a través de las cuales pasan las señales moleculares desde los receptores de la superficie celular hacia el interior de la célula ha revelado que algunas vías de transducción de señal se utilizan repetidas veces en las respuestas celulares a diferentes ligandos. El resultado final de casi todas estas vías es una alteración del programa de transcripción de la célula, de particular importancia para el sistema inmunitario adaptativo. Cada una de estas vías es desencadenada por la unión del antígeno al receptor y conduce a la activación de una familia de factores de transcripción diferente. A su vez, la generación de estos factores de transcripción activos inicia la regulación ascendente de una cascada de genes que tienen importancia para la respuesta inmunitaria, incluso los que codifican para citocinas, anticuerpos, factores de supervivencia y señales proliferativas.86
En las células B, las vías de señalización empiezan con la activación de los correceptores Igα/ Igβ y CD19 y llevan a la fosforilación de BLK, Vav, Rac y la activación de la isoforma de PLC de célula B, PLCγ2 que da lugar a la generación de DAG (diacilglicerol) e IP3 (inositol triphosphate).86 PKCδ propaga la señalización al núcleo mediante la activación de las vías de NF-κB (nuclear factor kappalight-chain-enhancer of activated B cells). PKCδ es particularmente importante en la célula B para la proliferación de la apoptosis y la tolerancia.63 La vía PI3K activa una multitud de moléculas efectoras y se entrelaza con la vía PLC-PKC, además, está implicada en numerosos aspectos de la homeostasis de células B y T.70
El factor de transcripción NFAT (nuclear factor of activaded T cells) es regulado por la proteína IRF2BP2; aunque su función exacta en las células B se desconoce, se cree que es importante en la diferenciación y supervivencia de las células B de memoria y plasmablastos. En 2016 se describieron 3 pacientes con deficiencia de IRF2BP2 y un fenotipo parecido a IDCV.76 Por último, también en 2016 se identificaron 24 pacientes de 6 familias con mutaciones en el gen IK2F1, que codifica para la proteína IKAROS, regulador importante en la linfopoyesis de la célula B.74
Conclusiones
Con los nuevos métodos en biología molecular se ha abierto el camino para comprender mejor la inmunopatología en la IDCV. Si bien el reemplazo de las gammaglobulinas ha mejorado la calidad de vida de los pacientes, estos siguen requiriendo vigilancia clí- nica permanente. En la actualidad, The United States Immunodeficiency Network (USIDNET), ESID y la Sociedad Latinoamericana de Inmunodeficiencias (LASID) tienen información adicional de la patogé- nesis clínica y molecular de laIDCV;87,88,89 esta información permitirá comprender mejor los mecanismos inmunológicos de la IDCV y a diferenciarla de otras entidades con características clínicas similares.
El uso de la secuenciación de próxima generación se ha vuelto más común, lo que ha posibilitado identificar nuevos defectos moleculares en las IDP,77 si bien los altos costos todavía son una limitante a pesar de que se han reducido.
Debido a que en la mayoría de los pacientes no se ha definido el defecto molecular que causa la enfermedad, será indispensable continuar con las investigaciones para la búsqueda de nuevos genes que contribuyan a entender el fenotipo de la IDCV.











 nueva página del texto (beta)
nueva página del texto (beta)




