Introducción
La recuperación de plomo mediante métodos alternativos a la fundición es una opción que debe ser considerada para la reducción de la demanda energética, los problemas ambientales y de salud pública relacionados con las técnicas tradicionales. Los procesos pirometalúrgicos utilizadas en la recuperación del plomo derivados de la refinación de minerales de zinc y plata requieren altas temperaturas y generan grandes cantidades de gases tóxicos y polvos contaminantes. Estos procesos implican varias fases de purificación, lo que aumenta la complejidad de mismo. Por otro lado, los polvos deben ser tratados de manera exhaustiva para evitar su liberación a la atmósfera y su deposición en aguas utilizadas para el consumo humano. Por estas razones, es importante evaluar métodos alternativos de recuperación del plomo que sean más eficientes y menos perjudiciales para el medio ambiente. Estos métodos alternativos pueden incluir tecnologías para la obtención de plomo a través de procesos hidrometalúrgicos o electrometalúrgicos, los cuales son considerados menos tóxicos y más eficientes para el aprovechamiento del plomo [1].
El plomo es uno de los metales con mayor demanda a nivel mundial [2] y se estima que más del 80% de este metal se aprovecha a partir del reciclaje de piezas y baterías de automóviles que se han desechado [3]; del restante solo se aprovechan minerales como la galena (PbS) y cerusita (PbCO3) mediante procesos pirometalúrgicos donde es necesario el control de algunas variables operativas en la producción y tratamiento de gases peligrosos, así como el tratamiento y confinamiento de los residuos generados [4]. Los minerales de plomo, en algunos casos, se encuentran asociados a la plata, cobre, hierro, zinc, entre otros [5]; este tipo de asociaciones son de interés por sus contenidos de plata, cobre y zinc, dejando al plomo una operación secundaria; donde a partir de la concentración de plomo se decide si se trata o se envía a la presa de jales para su confinamiento. Otra vía de uso del plomo se encuentra en el tratamiento de residuos generados en diversas industrias y etapas de algunos procesos como, escorias de fundición [5] dónde se han reportado concentraciones altas derivado del mal control del proceso, y en el desecho de tubos catódicos que puede ser reprocesados para la recuperación de este metal por tratamientos piro e hidrometalúrgicos [6].
La lixiviación de minerales es un método de disolución acuosa que requiere del control de la concentración de los reactivos químicos, pH y temperatura necesaria para llevar a cabo la disolución selectiva de ciertos elementos de interés a partir de minerales. Para la disolución del plomo en medio acuoso, el uso de agentes orgánicos como el citrato de sodio es una alternativa interesante debido a la formación de complejos estables con el plomo y puede ser usado en el tratamiento de materiales con contenido de este metal. En medio ácido, la lixiviación de cerusita (PbCO3) alcanza el 80% de la disolución del plomo a las seis horas [7]; en medio alcalino [8] los materiales de reciclaje provenientes de baterías de automóviles de desecho, la lixiviación con citrato de sodio y ácido acético para la obtención pastas [9]. Por lo tanto, para la recuperación de metales a partir de minerales sulfurados y materiales refractarios de desecho es necesario la implementación de procesos de lixiviación a condiciones exhaustivas (concentración de reactivos y temperatura) [10]; además de la implementación de una etapa de pretratamiento del material para que el proceso de disolución se lleve a cabo. Este trabajo presenta una alternativa para la recuperación de plomo a través del proceso de lixiviación a temperatura ambiente con citrato a temperatura ambiente con la finalidad de reemplazar los métodos convencionales; la recuperación de plomo se realiza mediante lixiviación de un mineral de galena con alto contenido de plomo usando como lixiviante al citrato de sodio a baja concentración (0.2 M) y evaluar el efecto del pH en medio ácido, neutro y alcalino, asimismo se presenta el efecto del peróxido de hidrógeno (0.1 M) cómo oxidante durante la disolución de plomo.
Experimental
Caracterización del mineral
El trabajo se realizó con un mineral de galena proveniente de una planta de tratamiento de minerales del estado de Zacatecas-México. Este mineral se redujo a una fracción de tamaño en un mortero de ágata. Las especies minerales presentes en la muestra se determinaron por difracción de rayos X (Advance D8), en un intervalo de 2° a 90° para un ángulo de 2θ a la velocidad de 8°/min, y el contenido metálico se determinó por digestión ácida. La muestra se redujo de tamaño menor que 53 µm en un mortero de ágata y una fracción representativa del todo el mineral de 0.1 g se pasó a digestión con agua regia (75% HCl y 25% HNO3), la solución obtenida se analizó en un espectrómetro de absorción atómica (SpectrAA Varian AA220).
Materiales y equipos
Todas las soluciones utilizadas en este trabajo fueron preparadas con reactivos de grado químico, agua desionizada, citrato de sodio (NaH2(C3H5O(COO)3)), peróxido de hidrógeno (H2O2), ácido sulfúrico (H2SO4) e hidróxido de sodio (NaOH), marca Meyer.
Las pruebas se realizaron en un reactor de agitación orbital (SK-300, figura 1) con matraces Erlenmeyer de 250 mL (pyrex), en los cuales se tomaron los datos de pH y ORP; así como las muestras en los tiempos establecidos, estas muestras se filtraron con ayuda de filtro (PTFE 0.22 μm) para su análisis por absorción atómica. Los valores de pH y ORP fueron tomados con ayuda de un medidor multiparámetro Hanna S-5521, para las lecturas del potencial redox relativas al electrodo de hidrógeno estándar, Eh (SHE) se calculó con la lectura del electrodo de platino ORP/Redox (E) y el potencial desarrollado por la parte del electrodo de referencia relativo al SHE (Eref) a 25 °C (Eh = E + Eref).
Para el trabajo se realizaron una serie de pruebas, con el mineral de galena (PbS) y la solución de citrato de sodio a una relación sólido/liquido de 3 g/L, 0.2 M de citrato y se evaluó la presencia del peróxido de hidrógeno como agente oxidante en el sistema a 0.1 M a diferentes valores de pH 5, 6, 7, y, 8 a una velocidad de 250 revoluciones por minuto y temperatura ambiente de 25°C (tabla 1). El tiempo total de las pruebas de lixiviación fue de 10 horas, donde se tomaron muestras a intervalos de 1, 2, 4, 6, 8 y 10 horas, además se realizó el ajuste de condiciones pH con ácido sulfúrico diluido. Todas las pruebas se realizaron en el laboratorio de metalurgia en la Facultad de Ingeniería-Universidad Nacional Autónoma de México y en la Universidad Autónoma Metropolitana-Iztapalapa.
Resultados y discusiones
Caracterización
La muestra proveniente del estado de Zacatecas fue pulverizada a una fracción de tamaño de partícula de -53/+44 μm y fue analizada en un equipo de difracción de rayos X, la figura 2 muestra el difractograma obtenido con la muestra, donde se observa la presencia los picos representativos de la galena (1-01-0880) y ruido asociado al tamaño de partícula; el contenido metálico determinado por digestión ácida se presenta en la tabla 2 donde se tiene un contenido metálico de plomo del 69.87% con pequeñas trazas de hierro (0.19%) y cobre (0.28%).
Lixiviación
Las pruebas de lixiviación se realizaron con la finalidad de evaluar la disolución del mineral de galena en presencia del citrato (0.2 M) a diferentes valores de pH en ausencia y presencia de peróxido de hidrógeno como oxidante.
Para estudio de las condiciones de las pruebas de lixiviación fue necesario la construcción de algunos diagramas de predominancia (Eh-pH, Pourbaix) por lo que se establecieron los equilibrios químicos presentados en la tabla 3.
Tabla 3 Constantes termodinámicas para las reacciones del sistema plomo-citrato at 25°C [11].
| Reacción | Log K | Ecuación |
| 11.21 | (1) | |
| -12.75 | (2) | |
| -14.06 | (3) | |
| -1.96 | (4) |
La figura 3, presenta el diagrama de distribución de especies para el sistema citrato-agua a 25°C, este diagrama permite establecer la zona de estabilidad de las especies de citrato presentes en el sistema evaluado, donde a los valores de pH ensayados en las pruebas de lixiviación (5, 6, 7 y 8) se tienen las especies de HCit2- y Cit3-.
Finalmente, las zonas de predominancia de las especies del sistema citrato (Pb-cit) a 25 °C (figura 4) se determinaron con ayuda de los equilibrios electroquímicos y químicos presentes en el sistema a través de las ecuaciones (5 y 6), donde E y Eo representan el potencial de celda y potencial estándar respectivamente (V), R es la constante de los gases ideales (8.314 J/mol·K), T es la temperatura en grados Kelvin (T, °C + 273.15), n es el número de electrones transferidos en la reacción, F es la constante de Faraday (96,485 C/mol).
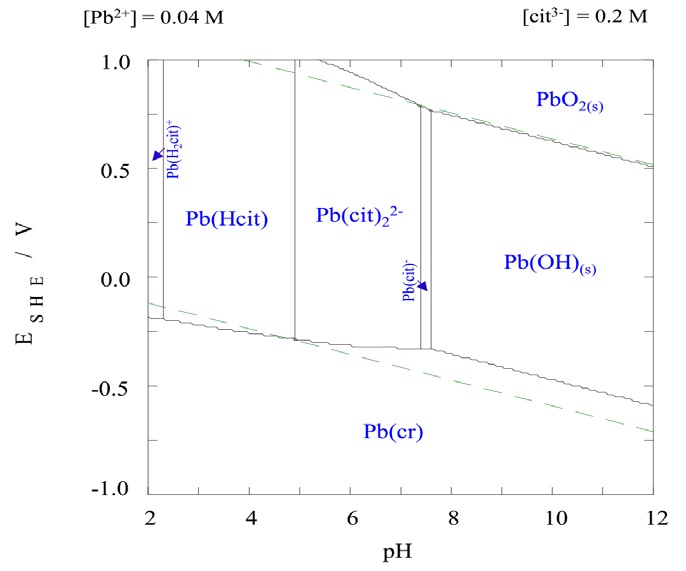
Figura 4 Diagrama de predominancia para el sistema plomo-citrato para 0.04 M Pb y 0.2 M citrato a 25°C [12].
La figura 4, muestra las zonas de predominancia para el sistema plomo-citrato calculados con las constantes presentadas en la tabla 3 y las Ecuaciones 5, 6 y la ecuación de Nernst (Ecuación 7), donde se puede observar que en el rango de pH ensayado se tienen la presencia de la especie Pb(cit)-, por lo que se espera que la disolución del mineral se realice con toda facilidad, para poder obtener el complejo Pb-Cit-.
Efecto del pH y H2O2
La figura 5, presenta los resultados de las pruebas de lixiviación del mineral a diferentes valores de pH y una concentración de 0.2 M de citrato; para estas pruebas, la recuperación de plomo presente en la muestra de galena tiene un comportamiento inestable durante el proceso de lixiviación del plomo contenido en la galena a pesar de la presencia del citrato. La recuperación del plomo es menor que 29%, el citrato tiene la capacidad de formar complejos estables con el plomo a los valores de pH ensayados (figura 4). Es importante mencionar que en estas pruebas no se utilizaron agentes oxidantes o reductores que faciliten el proceso de disolución de la galena.
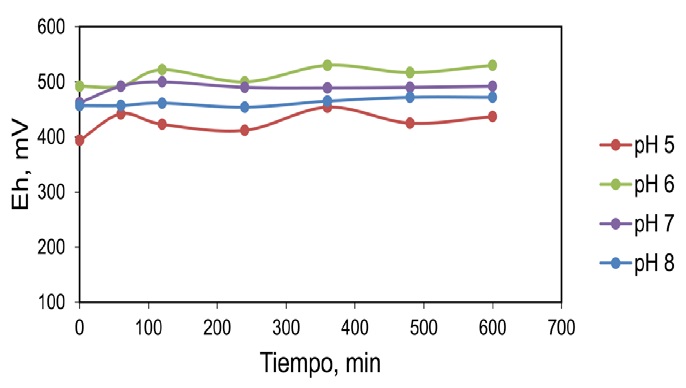
En la figura 5 se obtiene una recuperación de plomo menor que 30% a todos los valores de pH ensayados y un potencial menor que 400 mV (figura 6), este comportamiento confirma la importancia del uso del agente oxidante en el proceso de lixiviación de la galena.
La figura 7, muestra las zonas de predominancia para el sistema PbS-Cit a temperatura ambiente donde la estabilidad de PbS se extiende en todo el rango de pH y varia con respecto al potencial del sistema y el pH en la medida que el pH se incrementa de 6 a 8 la estabilidad de PbS disminuye.
La figura 8, presenta la recuperación de plomo por lixiviación con citrato a diferentes valores de pH, a una concentración de 0.1 M de peróxido (H2O2) como agente oxidante. A estas condiciones en medio neutro y alcalino, pH 6, 7 y 8 se tienen altas disoluciones de plomo alcanzando 95.4, 99.7 y 99.9%, respectivamente; este comportamiento está relacionado a la formación del complejo plomo-citrato (Pb-cit, figura 6) esta zona de estabilidad del complejo se reduce en la medida que disminuye el valor del pH; por lo tanto, se tiene una menor recuperación a pH 6 (41.6 %) a los 600 min. A pH 8 se alcanza una mayor recuperación de plomo a tiempos menores de 60 min; sin embargo, este presenta un descenso en la recuperación de plomo a los 120 min este comportamiento pude estar relacionado a la formación de sólidos causando inestabilidad, en el sistema que a tiempos mayores de 500 min la recuperación de plomo se favorece debido a que se tiene una baja concentración de hierro en el sistema.
El efecto del oxidante (H2O2) juega un rol importante debido a que un incremento del potencial de óxido-reducción (ORP) permite la disolución de PbS, cuando este no está presente en el sistema el valor de potencial es menor que 400 mV vs SHE (figura 6); al adicionar 0.1 M H2O2 el potencial del sistema se incrementa a un valor mayor que 400 mV vs SHE (figura 9). En cuanto a la recuperación de plomo, en presencia del peróxido de hidrógeno se presenta en la (figura 8), donde se tiene una mayor recuperación en el sistema neutro y alcalino (pH 7 a pH 8) con un porcentaje de disolución cercano al 96% a la primera hora de iniciada la prueba; en la medida que se modifica el pH a un medio ácido, el porcentaje de recuperación es de 80% para pH 6 y finalmente a pH 5 la recuperación disminuye a un valor de 40%. De acuerdo a este comportamiento se puede asegurar que el sistema de lixiviación alcalino es el más eficiente para la recuperación del plomo presente en la galena bajo las condiciones ensayadas.
En cuanto al comportamiento de la disolución del hierro se presenta en la tabla 4, la disolución es menor que 2 ppm mostrando un comportamiento inestable por el contenido de la muestra y el valor de pH ensayado.
Tabla 4 Disolución de hierro a diferentes valores de pH y 0.2 M Cit, con 0.1 M H2O2 y sin H2O2 a 25 °C.
| Disolución de hierro (ppm) | ||
| pH | pruebas con peróxido | pruebas sin peróxido |
| 5 | 2.10 | 0.6 |
| 6 | 0.89 | 1.2 |
| 7 | 1.40 | 0.3 |
| 8 | 0.03 | 0.8 |
La figura 10 presenta el diagrama de distribución de especies para el sistema hierro-citrato (Fe-Cit) donde a un pH mayor que 6 se tiene la presencia de Fe2O3 en forma sólida el cual es el posible responsable de la baja disolución del hierro en el sistema y promueve una mayor selectividad del citrato por el plomo. El comportamiento del cobre no forma parte del estudio debido a la baja concentración presente en el mineral.
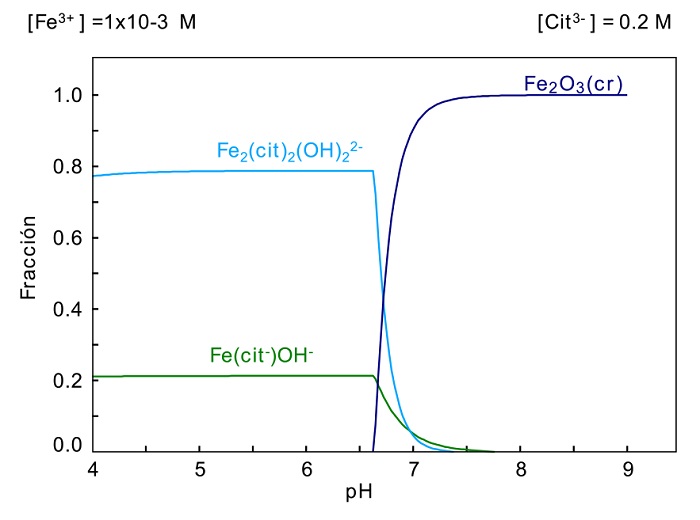
Figura 10 Diagrama de distribución de especies para el sistema Fe-Cit, 1x10-3 Fe3+, 0.2 M Cit a 25°C.
En la figura 11A se puede observar el residuo generado del proceso de disolución de la galena con citrato sin peróxido donde este es incompleto para cualquier valor de pH (5, 6, 7, 8) al final de las pruebas se muestra casi la mitad en relación a la muestra inicial a diferencia la figura 11B muestra los residuos del proceso de lixiviación con oxidante donde disolución del mineral es completa para pH 8 y en medida que baja el valor del pH la disolución se ve afectada hasta llegar a un pH 5 donde queda una mayor cantidad del mineral sin disolver.
Conclusiones
Para el sistema propuesto a pH 5, 6, 7 y 8 a temperatura ambiente 25 °C y a una velocidad de 250 rpm la disolución de plomo se lleva a cabo en presencia de citrato en una concentración de 0.2 M y peróxido de hidrógeno a 0.1 M, en medio alcalino se alcanza una mayor disolución de plomo en presencia del peróxido de hidrógeno, dónde se consiguen resultados favorables para el plomo (99.9%) antes de llegar a la primera hora de lixiviación a pH 8. La disolución de hierro presenta una menor disolución (0.03 ppm) debido al potencial de oxidación alcanzado (mayor que 400 mV vs SHE) donde se propicia a la lixiviación selectiva de la galena. El uso del peróxido es determinante para que se lleve a cabo el proceso de disolución del plomo.
Recomendaciones
Es necesario integrar al proceso de lixiviación de plomo una etapa de recuperación de los valores presentes en la solución por precipitación o electrodeposición tomando en cuenta los resultados mostrados hasta el momento, concentración de citrato y pH, se requiere de un método que no demandé exceso de reactivos, energía y tiempo para que pueda ser adoptado en la industria.











 nueva página del texto (beta)
nueva página del texto (beta)