Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.18 no.1 Chapingo ene./abr. 2012
https://doi.org/10.5154/r.rchscfa.2010.10.092
Acción neuroprotectora y neurorregeneradora de las sales de ácidos resínicos aislados de colofonia de coníferas del accidente de Cuba
Neuroprotective and neuroregenerative action of salts of isolated resin acids of conifers rosin from western Cuba
Yasiel Arteaga-Crespo¶1; Leila Rosa Carballo-Abreu1; Juan Enrique Tacoronte-Morales2; Yanier Nuñez-Figueredo3.
1Universidad de Pinar del Río (UPR), Pinar del Río, Cuba. Correo-e: (¶Autor para correspondencia) yasiel@al.upr.edu.cu .
2Centro de Investigación e Ingeniería Química (CIIQ), Ciudad de La Habana, Cuba.
3Centro de Investigación y Desarrollo de Medicamentos (CIDEM), Ciudad de La Habana, Cuba.
Recibido: 14 de octubre, 2010
Aceptado: 28 de septiembre, 2011
RESUMEN
Las enfermedades neuropsiquiátricas afectan a más de 10 % de la población cubana y alcanzan 25 % a nivel mundial. La mayoría de los fármacos empleados para el tratamiento de trastornos del sistema nervioso central son costosos y generan severas reacciones colaterales. Actualmente, se desarrollan esfuerzos para la aplicación de metabolitos secundarios como fuentes ecológicamente sostenibles para tratamiento de patologías del sistema nervioso -incluyendo isquemias y otras neuropatologías tipo Parkinson, Alzheimer y trastornos motores de Huntington-, que permitan una neuroprotección efectiva, así como una neurorregeneración en cortos periodos, con mínimas secuelas. El objetivo del trabajo fue evaluar la acción neurorregeneradora y neuroprotectora de la sal de sodio de ácidos resínicos aislados de colofonia de coníferas cubanas; los resultados del estudio sugieren que esta sal puede utilizarse en calidad de precursores estructurales de isoanálogos bioisostéricos con acción terapéutica específica tipo neuroprotectora y neurorregeneradora en el tratamiento de patologías isquémicas.
Palabras clave: Colofonia, sistema nervioso central, neuropatologías, neuroprotección, neurorregeneración.
ABSTRACT
Neuropsychiatric diseases affect more than 10 % of the Cuban population and 25 % worldwide. Most drugs used to treat central nervous system disorders are expensive and create severe side reactions. Efforts are currently being developed for the implementation of secondary metabolites such as environmentally sustainable sources for the treatment of nervous system diseases, including stroke and other Parkinson's-type neuropathologies, and Huntington's motor disorders, enabling an effective neuroprotection as well as short periods of neuroregeneration time with minimal sequels. The objective was to evaluate the neuroprotective and neuroregenerative action of sodium salts of isolated resin acids from Cuban conifers. The study results suggest that the sodium salt of resin acids can be used as a structural bioisosteric isoanalogue precursor with specific therapeutic actions such as neuroregeneration and neuroprotection in the treatment of ischemic diseases.
Keywords: Rosin, central nervous system, neuropathologies, neuroprotection, neuroregeneration.
INTRODUCCIÓN
Las enfermedades neuropsiquiátricas afectan a más de 10 % de la población cubana y alcanzan 25 % a nivel mundial (WHO, 2010). Para el tratamiento de las enfermedades psiquiátricas, la farmacología del sistema nervioso central (SNC) comprende dos tipos de fármacos: los estimulantes nerviosos, cuyo mecanismo de acción es la despolarización celular, y los depresores (sedantes) nerviosos, que impiden la despolarización. La mayoría de los fármacos empleados (imipramina, ruboxetina, entre otros) para el tratamiento de trastornos del SNC son costosos y generan severas reacciones colaterales (Millán, 2003; File y Seth, 2003; Carrasco y Van de Kar, 2003). En la actualidad, se desarrollan esfuerzos para la aplicación de metabolitos secundarios como fuentes ecológicamente sostenibles de sintones y nuevas entidades farmacéuticas (NEF) para tratamiento de patologías del SNC, incluyendo isquemias y otras neuropatologías tipo Parkinson, Alzheimer y trastornos motores de Huntington, que permitan una neuroprotección efectiva así como una neurorregeneración en cortos periodos, con mínimas secuelas.
Los cannabinoides son mediadores lipídicos (derivados de la Cannabis sativa), sintéticos y los endocannabinoides o canabinoides endógenos (Cho et al., 2005; Piomelli, 2005), que se destacan por su capacidad para disminuir la producción de citocinas proinflamatorias (Panikashvili et al., 2005) e inhibir la liberación de noradrenalina y dopamina (Millán, 2003), facilitando la recuperación de eventos isquémicos y vascular-neuroencefálicos.
Dada la similitud estructural entre cannabinoides y los ácidos resínicos, se fortalece el diseño de derivados sintéticos a partir de estos precursores naturales ecosostenibles (Figura 1). Se puede aseverar que los ácidos resínicos constituyen potenciales agentes con funciones fisiológicas típicas para canabinoides naturales y sintéticos, como su capacidad para antagonizar los receptores SNC (Chen, 2005), disminuir la producción de citocinas proinflamatorias (Panikashvili, 2005) e inhibir la liberación de noradrenalina y dopamina (Millán, 2003).
También existen numerosos estudios que demuestran la efectividad de los mismos en trastornos de ansiedad (Witkin et al., 2005; Wotjak, 2005; Viveros, 2005), depresión (Ashton et al., 2005) y epilepsia (Bradley, 2004), entre otros. Teniendo en cuenta el desbalance neurobioquímico que se produce en los trastornos emocionales y las propiedades endógenas de los cannabinoides, se apoya la hipótesis de que moléculas precursoras de éstos, con similar estructura química, obtenidas a partir de fuentes naturales o con la introducción de pequeñas modificaciones en su estructura, puedan resultar efectivas para el tratamiento de estados patológicos del SNC.
En los últimos años se ha progresado de forma importante en el conocimiento de sustancias que actúan como neuroprotectores y neurorregeneradores, a partir del estudio en animales de experimentación y ensayos clínicos en el humano (Garcia-Galloway et al., 2003; Cardona et al., 2003). Las investigaciones que se realizan a nivel mundial, en la temática de las enfermedades cerebrovasculares, siguen dos direcciones fundamentales: una dirigida al conocimiento de la fisiopatología de estas enfermedades, y otra que se orienta al desarrollo de agentes y procedimientos terapéuticos para disminuir los índices de mortalidad y discapacidad. En ambas direcciones, el aporte conferido por los modelos animales ha sido decisivo, permitiendo estudiar la seguridad y la eficacia de nuevos agentes terapéuticos, así como el desarrollo de nuevas técnicas de diagnóstico que sirvan para detectar tejido potencialmente salvable. Por último, han mostrado muchas de las alteraciones celulares que tienen lugar durante la isquemia, así como su perfil temporal (Siesjö, 1992; Hossmann, 1994).
El modelo experimental de isquemia unilateral permanente comprende el seguimiento de la incidencia de infarto cerebral histológico y clínico en el periodo agudo, así como el surgimiento de disfunciones cognitivas inducidas por la isquemia en la etapa crónica. En este modelo se produce una disminución del flujo sanguíneo en un hemisferio cerebral que produce la muerte de algunos individuos en los primeros días posteriores a la oclusión de la carótida correspondiente (Kwakkel et al., 2004).
El sector forestal en Cuba procesa alrededor de 500 t de resina por año de especies endémicas de la provincia de Pinar del Río, Pinus caribaea var. caribaea y Pinus tropicalis Morelet (Herrero, 2010), por lo que la búsqueda de nuevas entidades moleculares con acción terapéutica específica, a partir de esta materia prima nacional y renovable, merece la atención. Esto orienta hacia el desarrollo y diseño en el mercado de la industria forestal nacional cubana y sus subproductos no madereros, de nuevos productos generados a partir de colofonias modificadas (Arteaga et al., 2007, 2010).
El objetivo del trabajo fue evaluar la acción neurorregeneradora y neuroprotectora de la sal de sodio de ácidos resínicos aislados de mezcla de colofonia de pináceas cubanas (Pinus caribaea var. caribaea y Pinustropicalis Morelet), haciendo uso de biomodelos experimentales para determinar la actividad de la sal de ácidos resínicos sobre el sistema nervioso central.
MATERIALES Y MÉTODOS
Obtención de la muestras de colofonia
La colofonia se obtuvo por destilación de mezclas de resinas de Pinus caribaea var. caribaea y Pinus tropicalis Morelet procedentes de la planta de destilación de resinas, ciudad Industrial, Pinar del Río, Cuba.
Obtención de ácidos resínicos a partir de colofonia
La colofonia se sometió a un proceso de tratamiento hidrotermal durante dos horas, en un intervalo de temperaturas de 80-85 °C, con agitación de 500 rpm y presencia de atmósfera de nitrógeno; se le adicionaron 25 mL de agua destilada y se mantuvo el proceso calentamiento-agitación hasta que se fundió la masa resinosa, que facilitó la purificación y separación de ácidos resínicos totales. La purificación procedió al adicionar una disolución de hidróxido de sodio al 25 % a la masa de colofonia, se filtró a vacío, se enfrió hasta 10-15 °C y se añadió directamente disolución concentrada de ácido clorhídrico en frío para precipitar la mezcla de ácidos resínicos que se secaron a 100 °C y permitió obtener 92 % de ácidos resínicos totales.
Obtención de mezclas de la sal de sodio de los ácidos resínicos
Se preparó una solución de bicarbonato ácido de sodio (NaHCO3) a 25 %, se calentó a 80 °C y se añadió lentamente a 10 g de ácidos resínicos purificados, hasta su disolución total (35 min, con agitación a 250 rpm y relación molar 1:1). Se mantuvo al sistema durante una hora con agitación y posteriormente se llevó a sequedad con una temperatura de fusión Tf > 325 °C.
Biomodelo experimental para determinar la actividad de la sal de ácidos resínicos sobre el sistema nervioso central
Isquemia por oclusión permanente de la carótida derecha
Actividad exploratoria en animales sometidos a isquemia unilateral permanente.
Se emplearon ratones albinos suizos machos de 25 a 30 g de masa corporal, procedentes de la colonia de la UCTB Control Biológico, del Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Los animales se mantuvieron en un cuarto a temperatura controlada, de 20 ± 2 °C, con un ciclo de luz/oscuridad de 12-12 h. La alimentación consistió en pienso paletizado (CMO 1000) para ratones, procedente del Centro Nacional para la Producción de Animales de Laboratorio (Cuba) y agua a libre demanda. Todos los procedimientos se ejecutaron de acuerdo con las normas éticas dictadas por la Unión Europea para la experimentación animal.
Esquema de tratamiento
El tratamiento consistió en la aplicación oral de sal de sodio de ácidos resínicos de pináceas en las dosis de 100, 200 y 400 mg·kg-1 (Arteaga et al., 2009) y agua destilada tres veces al día, durante dos días, y se comenzó inmediatamente después de la cirugía. La última administración se realizó 16 h antes del sacrificio.
Procedimiento experimental
Oclusión permanente de la arteria carótida derecha en ratones albinos suizos con sacrificio a diferentes tiempos
Los animales se anestesiaron con una dosis de 30 mg·kg-1 de pentobarbital sódico. Los mismos se dividieron en cinco grupos experimentales (n=25 por grupo); cuatro de ellos se sometieron a la oclusión permanente de la carótida derecha, con un procedimiento similar al reportado para los gerbils de Mongolia (Soza y Garcia, 2007); se les realizó una incisión en la parte anterior del cuello y se aisló la carótida derecha; la misma se ligó en dos extremos proximales, para después realizar una arterioctomía entre las dos ligaduras. Posteriormente, los animales se suturaron y mantuvieron a 37ºC hasta su recuperación, y se sacrificaron 48 h después de la inducción del daño; el quinto grupo fue control sham. Inmediatamente antes del sacrificio, a cada animal se le realizó la prueba de actividad exploratoria; cada ratón se colocó en el centro de una caja de actividad exploratoria y se contaron los empinamientos que realizaron los roedores sobre sus patas traseras para explorar, en un intervalo de nueve minutos, divididos en tres tercios de tres minutos cada uno. Seguidamente, los animales se prefundieron transcardialmente, con 10 mL de formaldehído neutro a 10 % y sus cerebros se removieron para analizarlos histopatológicamente (presencia de daño celular, gliosis, necrosis, edema y pérdida neuronal en diferentes zonas cerebrales) mediante una tinción de hematoxilina-eosina.
A los animales pertenecientes al grupo sham, solamente se les practicó la incisión en la parte anterior del cuello, hasta la localización de la arteria carótida derecha, sin ligadura de la misma, y se sometieron a las mismas pruebas conductuales que los animales dañados.
RESULTADOS Y DISCUSIÓN
En la Figura 2 se muestra el comportamiento de la actividad exploratoria en animales sometidos a isquemia unilateral permanente, tratados con la sal sódica. Se obtuvo la sal de sodio para lograr la solubilidad en agua de los ácidos resínicos, que presupone un paso a través de la barrera hematoencefálica (Arteaga et al., 2007, 2009). Los animales asignados al grupo control (tratados con agua destilada) presentaron extensas áreas de necrosis en el hemisferio privado de irrigación sanguínea; este daño se hizo evidente en las zonas del hipocampo, estriado, corteza, gyrus dentado y presencia de interneuronas oscuras en el asta de amons (Persson et al., 1998). Paralelamente, el ensayo de campo abierto mostró una incapacidad de habituación total de estos animales, relacionado con un deterioro de la capacidad cognitiva de éstos (Van der Worp et al., 2005; Tamura et al., 1981).
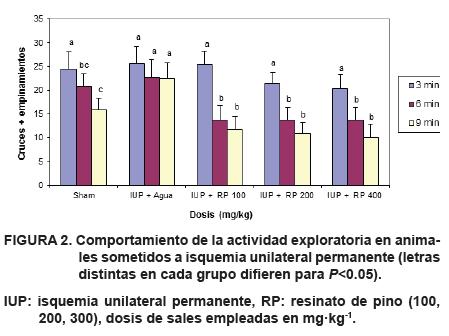
Por otra parte, los animales sometidos a isquemia por oclusión permanente de la carótida derecha y tratados con las diferentes dosis de la sal sódica, mostraron una efectiva protección al daño neuronal frente a este insulto isquémico (Mergenthaler, et al., 2004); los estudios histopatológicos mostraron sólo ligeras alteraciones definidas como gliosis, en 20 % de los animales tratados con la dosis de 100 mg·kg-1; el resto no presentaron alteraciones aparentes con la técnica histológica empleada.
Estos resultados se confirmaron con el ensayo de campo abierto, donde los animales tratados con las diferentes dosis de sal no mostraron disfunciones cognitivas significativas, disminuyendo el número de empinamientos en los últimos tercios de tiempo del ensayo, con respecto al primer tercio. Los resultados mostraron que no existe diferencia significativa en el comportamiento de los animales para seis y nueve minutos de aplicada la dosis. La respuesta de éstos a los tres minutos de aplicadas las dosis disminuyen en la medida que aumenta la concentración de ácidos resínicos.
Estos resultados indican un posible efecto neuroprotector de la sal de sodio de ácidos resínicos frente a daños neuronales inducidos por isquemia, y constituyen una potencial fuente de obtención de nuevas alternativas terapéuticas para el tratamiento de estas patologías.
CONCLUSIONES
La mezcla de sales de sodio de los ácidos resínicos manifestó acción terapéutica específica tipo neuroprotectora y neurorregeneradora, en animales sometidos a daños neuronales inducidos por isquemia unilateral permanente.
AGRADECIMIENTOS
Deseamos expresar nuestro agradecimiento al Centro de Desarrollo de Medicamentos (CIDEM). Ciudad de La Habana, Cuba.
LITERATURA CITADA
Arteaga, Y., Carballo, L., Tiomno, O., Sotolongo, R., Tacoronte, J. E., & Hevia, Y. (2010). Colofonia de pináceas cubanas para el control de enfermedades tropicales transmitidas por moluscos. RevistaChapingo Serie Ciencias Forestales y del Ambiente16(1), 31-36. [ Links ]
Arteaga, Y., Carballo, L., Tiomno, O., Casal, A., Tacoronte, J. E. & Cruz, R. (2007). Resina de pino: química verde y potencialidades biológicas. Revista Cubana de Química19(1), 91-93. [ Links ]
Arteaga, Y., Carballo, L., Tiomno, O., Casal, A., Tacoronte, J. E., & Cruz, R. (2009). Resina de pino: Materia prima renovable para la obtención de productos farmacológicos. CIGET Pinar del Río 11(3), 35-40. [ Links ]
Ashton, CH., Moore, P. B., Gallagher, P., & Young, A. H. (2005). The endocannabinoid system as an emerging target of P pharmacotherapy. Journal Psychopharmacol19(3), 293-300. [ Links ]
Bradley, E. A. (2004). Endocannabinoids and their implications for epilepsy. Epilepsy curr. 4(5), 169-173. [ Links ]
Cardona, G. P., Arango, D. C., Gallego, G. J., Pimienta, H. & García, L. M. (2004). Estrogens inhibit glycogen synthase kinase-3b and modulates the interaction of the microtubule-associated protein Tau with glutamate receptor subunits in post-ischemic hippocampus: implications for hormonal neuroprotective mechanisms. Molecular Brain Research. 25,178-187. [ Links ]
Carrasco, G. A. & Van de Kar, L. (2003). Neuroendocrine pharmacology of stress. Eur. J. Pharmacol. 463, 235-272. [ Links ]
Chen, J., Lee C. T., Errico, S., Deng, X., Cadet, J. L., & Freed, W. J. (2005). Protective effects of delta(9)-tetrahydrocannabinol against N-methyl-d-aspartate-induced AF5 cell death. Molecular Brain Research 4; 134(2), 215-225. [ Links ]
Cho, C. M., Hirsch, R., & Johnstone, S. (2005). General and oral health implications of cannabis use. Australian Dental Journal50(2), 70-74. [ Links ]
File, S. E. & Seth, P. (2003). A review of 25 years of the social interaction test European Journal of Pharmacology463, 35-53. [ Links ]
Garcia-Galloway, E., Arango, C., Pons, S., & Torres-Alemán, I. (2003). Glutamate excitotoxicity attenuates insulin-like growth factor-I prosurvival signaling. Molecular and Cellular Neuroscience24, 1027-1037. [ Links ]
Herrero, J. A. (2010). Tendencias y perspectivas del sector forestal hasta el año 2020. República de Cuba. Ministerio de la Agricultura. Dirección Forestal. [ Links ]
Hossmann, K. A. (1994). Viability thresholds and the penumbra of focal ischemia. Annals of Neurology36, 557-65. [ Links ]
Kwakkel, G., Kollen, B., & Lindeman E. (2004). Understanding the pattern of functional recovery after stroke: Facts and theories. Restorative Neurologyand Neuroscience22, 281-299. [ Links ]
Mergenthaler, P., Dirnagl, U., & Meisel, A. (2004). Pathophysiology of stroke: lessons from animal models. Metabolic Brain Disease19(3/4), 102-112. [ Links ]
Millán, M. J. (2003). The neurobiology and control of anxious states. Progress in Neurobiology70, 83-244. [ Links ]
Soza, T. I. (2007). Neuroprotección en la isquemia cerebral. Experiencias con la eritropoyetina humana recombinante. Revista Ecuatoriana de Neurología. 16(2), 63-75. [ Links ]
Panikashvili, D., Mechoulam, R., Beni, S. M., Alexandrovich, A., & Shohami, E. (2005). CB1 cannabinoid receptors are involved in neuroprotection via NF-B inhibition. Journal ofCerebral Blood Flow&Metabolism25(4), 477-484. [ Links ]
Persson, L., Hårdemark, H. G., Bolander, H. G., Hillered, L., & Olsson, Y. (1998). Neurologic and neuropathologic outcome after middle cerebral artery occlusion in rats. Stroke20, 641-645. [ Links ]
Piomelli, D. (2005). The endocannabinoid system: a drug discovery perspective. Curr Opin Investig Drugs 6(7), 672-679. [ Links ]
Siesjö, B. K. (1992). Pathophysiology and treatment of focal cerebral ischemia. Journal Neurosurgery 77, 169-84. [ Links ]
Tamura, A., Graham, D. I., McCulloch, J. & Teasdale, G. M. (1981). Focal cerebral ischemia in the rat: Description of technique and early neuropathological consequences following middel cerebral artery occlusion. Journal of Cerebral Blood Flow&Metabolism1, 53-60. [ Links ]
Van der Worp, H. B.; Haan, P. de, Morrema, E. & Kalkman C. J. (2005). Methodological quality of animal studies on neuroprotection in focal cerebral ischaemia. Journal Neurology,252, 1108-14. [ Links ]
Viveros, M. P., Marco, E. M., & File, S. E. (2005). Endocannabinoid system and stress and anxiety responses. Pharmacology Biochemistry Behav. 81 (2), 331-42. [ Links ]
Witkin, J. M., Tzavara, E. T., & Nomikos, G. G. (2005). A role for cannabinoid CB1 receptors in mood and anxiety disorders. Behavioural Pharmacology16(5-6), 315-331. [ Links ]
Wotjak, C. T. (2005). Role of endogenous cannabinoids in cognition and emotionality. Mini-Reviews in Medicinal Chemistry5(7) ,659-670. [ Links ]
WHO, (World Health Organization) (2010). Prevention of mental disorders: Effective interventions and policy options: abridged report / a report of the World Health organization. Research Center at the Universities of Nijmegen and Maastricht. [ Links ]














