Introducción
El género Hevea pertenece a la familia Euphorbiaceae e incluye las especies H. brasiliensis (Willd. ex A. Juss.) Müll. Arg., H. spruceana (Benth.) Müll. Arg., H. benthamiana Müll. Arg., H. guianensis Aubl., H. pauciflora (Spruce ex Benth.) Müll. Arg. y H. rigidifolia (Spruce ex Benth.) Müll. Arg. Entre estas, la más importante es H. brasiliensis de la cual se obtiene 99 % de la producción mundial de hule natural (Picón et al., 1997).
En México, el cultivo de hule y producción de látex es una actividad económica importante; durante 2018, se registró una producción total de 75 922 toneladas de látex en los estados de Veracruz, Chiapas, Oaxaca, Tabasco y Puebla. De ellos, Veracruz es el principal productor con 48.7 % de la superficie sembrada y 50 229 toneladas concentradas en las zonas de Uxpanapa, Las Choapas, Hidalgotitlán y Tezonapa, que en conjunto representan 66 % de la producción total nacional (SIAP, 2018).
Las enfermedades en el árbol del hule son una limitante importante que causan anualmente pérdidas considerables, en términos de producción de látex (Jaimes y Rojas, 2011). La mayoría de esas enfermedades son de etiología fungosa que pueden afectar en distintas etapas fenológicas y tipo de tejido del árbol. A nivel mundial, las principales en H. brasiliensis incluyen el “Mal Sudamericano de las hojas” (SALB) ocasionado por Microcyclus ulei (Henn.) Arx; antracnosis por Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. (Castro, 2011); y la muerte descendente o pudrición de tallo por Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (Izquierdo, 2008; Grupo Técnico Procaucho, 2012), entre otras.
Las enfermedades de pudrición que se han identificado en H. barasiliensis incluyen la pudrición mohosa por Ceratocystis fimbriata Ellis & Halst.; en raíces, la pudrición blanca (Rigidoporus sp.), pudrición café (Fomes noxius Corner), pudrición negra (Xylaria thwaitesii Berk. & Cooke) y pudrición roja (Ganoderma pseudoferreum (Wakef.) Overeem & B. A. Steinm.) (Rodríguez, 1993; Izquierdo, 2008).
En México, son escasas las investigaciones que abordan el estudio de las enfermedades del hule en las principales zonas productoras. Durante 2018, en un vivero en el municipio Martínez de la Torre, Veracrus, se detectó una incidencia entre 10 y 15 % de una enfermedad de pudrición, presuntamente de etiología fungosa, con proliferación de micelio blanco-grisáceo en el tejido leñoso de tocones injertados con el clon IAN-873 de hule. Por lo anterior, el objetivo del presente estudio fue identificar morfológica y genéticamente el hongo asociado a la pudrición de tocones de hule.
Materiales y Métodos
Aislamiento de micelio
Se recolectaron muestras de tejido vegetal de tocones de árboles de hule injertados con el clon IAN-873, con síntomas de pudrición en un vivero de Martínez de la Torre (20°05'57.88" N, 97°04'52.3" O), Veracruz, México. Las muestras se colocaron en papel estraza y dentro de bolsas plásticas selladas para su análisis en el Laboratorio de Fitobacteriología del Colegio de Postgraduados, Campus Montecillo.
El aislamiento de micelio se realizó a partir de estructuras fúngicas asociadas al tejido con los síntomas de la enfermedad de pudrición. De cada muestra se cortaron trozos del esporoma de aproximadamente 0.5 cm2 y se desinfestaron con hipoclorito de sodio (NaOH) al 1.5 % por 1 min, seguido de tres lavados con agua destilada estéril. Los trozos desinfestados se sembraron en medio de cultivo Extracto de Malta Agar (MEA) y se incubaron a 28 ± 1 °C por 72 h. Se obtuvo micelio en cultivo axénico y se preservó en tubos inclinados en medio de cultivo MEA y aceite mineral estéril para los estudios posteriores.
Descripción morfológica
Se recoolectaron basidiomas parcialmente desarrollados en tocones de árboles de hule con síntomas de pudrición para la medición microscópica de las estructuras fúngicas, así como de las cultivadas en el medio MEA; la identificación se realizó con las claves taxonómicas elaboradas por Olivo y Herrera (1994) para especies de Schizophyllum.
Caracterización genética
Para la caracterización genética se utilizó una colonia de micelio de un cultivo axénico de ocho días de crecimiento en medio MEA del hongo aislado e identificado en este estudio, con la clave MZVMT_01. La extracción de ADN se llevó a cabo por el método AP modificado (Sambrook y Russell, 2001). Se amplificó la región ITS con los primers universales ITS5 (5 ́-GGAAGTAAAAGTCGTAACAAGG-3 ́) e ITS4 (5 ́-TCCTCCGCTTATTGATATGC-3 ́) (White et al., 1990), que se ubican en las regiones conservadas de los genes 18S y 28S, respectivamente. Las reacciones de PCR se practicaron en un volumen de 25 µL, con 2 µL de ADN a 50 ng µL-1 y 1 µL de cada uno de los iniciadores a una concentración de 10 µM; el amortiguador para PCR tuvo una concentración final de 0.5x; MgCl2 a 1.25 mm; dNTPs a 0.2 mm y 0.1 U µL-1 de Taq DNA Polymerase (Promega). La amplificación se hizo en un termociclador T100 (Biorad) bajo las siguientes condiciones: temperatura inicial de desnaturalización a 94 ºC por 3 minutos, 35 ciclos de 94 °C por 30 segundos, alineamiento de 58 °C por 30 segundos y una extensión de 72 °C por 1 minuto; extensión final a 72 ºC por 7 minutos y conservación a 4 °C. Los fragmentos amplificados se visualizaron por electroforesis en gel de agarosa al 1 %, con 0.4 μL de bromuro de etidio durante 50 minutos a 90 V. Los geles se visualizaron en un fotodocumentador Infinitity-ST5 Vilber Lourmat.
El producto de PCR se purificó con el kit WIZARD ® SV Gel y el PCR Clean-Up System, de acuerdo a las especificaciones del fabricante (Promega Corporation, 1999). Los productos de PCR purificados se secuenciaron en Macrogen Korea en Seúl, República de Corea.
Las secuencias de ADN se editaron y ensamblaron para crear la secuencia consenso de las regiones amplificadas con el programa BioEdit Sequence Alignment Editor versión 7.0.5.3. Los ensambles se utilizaron para realizar una búsqueda de similitud mediante BLAST (Basic Local Alignment Search Tool) en la base de datos de nucleótidos del National Center of Biotechnology Information (http://www.ncbi.nlm.nih.gov/Blast). Para los análisis filogenéticos, las secuencias consenso se alinearon con el método clustal con el programa CLUSTAL OMEGA 1.2.2 (Sievers y Higgins, 2014) y se realizó la búsqueda del mejor modelo de sustitución de nucleótidos para cada una de las especies con el programa ModelTest-NG (Darriba et al., 2019). La reconstrucción filogenética se llevó a cabo con inferencia bayesiana, mediante Markov Chains Monte Carlo (MCMC), implementado en el programa BEAST v1.10.4 (Suchard et al., 2018) con diferentes generaciones, hasta que se estabilizaran las cadenas. Para la anotación del mejor árbol, se descartó 25 % de los árboles producidos y la probabilidad posterior se determinó con los árboles restantes.
Resultados y Discusión
En tocones de H. brasiliensis del vivero de Martínez de la Torre, se observaron basidiomas pequeños, parcialmente desarrollados que no superaban el centímetro en su zona más ancha, con forma de abanico, de color blanquecino grisáceo (Figura 1).

A) Tocones enfermos; B) Cuerpos fructíferos en el tejido.
Figura 1 Síntomas de pudrición y estructuras fúngicas en tocones de hule en Martínez de la Torre.
De los fragmentos de basidioma que se inocularon en el medio MEA, se aislaron cepas puras del hongo que formaron colonias de color blanco-crema, algodonosas y esporomas a los 10 días posteriores a la siembra (Figura 2).
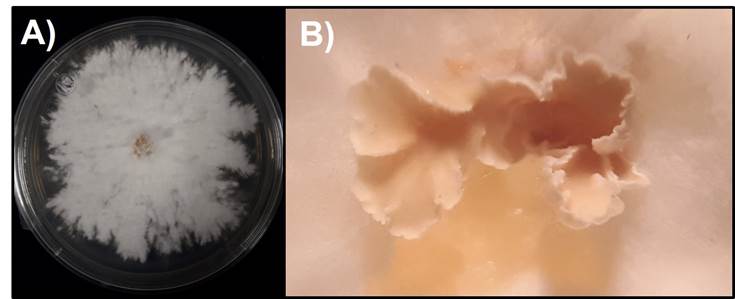
A) Colonia blanco-crema, algodonosas en medio de cultivo MEA; B) Formación de cuerpos fructíferos a los 10 días posteriores a la siembra.
Figura 2 Características morfológicas del aislamiento fungoso de tocones de Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg.
Descripción morfológica
Los esporomas observados en los tocones de H. brasiliensis con pudrición estaban agrupados, de tamaño pequeño, entre 0.5-2 cm de ancho, sin estípite, con forma de irregular a concha, con micelio color blanco a grisáceo. El esporoma era gimnocarpo con la parte esporífera limitada solo a la parte inferior de la tapa y el himenóforo solo en la parte inferior. El cultivo de los esporomas en el medio MEA desarrolló colonias de color blanco a crema, algodonosas, con crecimiento ramificado e irregular, de textura suave y superficie rugosa. A partir del análisis microscópico de los esporomas, se identificó al hongo asociado a la pudrición de tocones de H. brasiliensis como Schizophyllum commune Fries (1815). El último escrutinio taxonómico lo clasifica (Kirk, 2020) como:
Reino: Fungi
Phylum: Basidiomycota
Clase: Agaricomycetes
Orden: Agaricales
Familia: Schizophyllaceae
Género: Schizophyllum
Especie: S. commune
Identificación genética
El análisis genético confirmó la identificación morfológica del hongo asociado a la pudrición de tocones de H. brasiliensis. Los productos de PCR con los primers ITS4 e ITS5 del ADNr amplificaron un fragmento aproximado de 600 pb de la cepa MZVMT_01 identificada morfológicamente como S. commune (Figura 3). Buzina et al. (2001) obtuvieron amplificaciones con estos mismos primers en el intervalo de 660 pb para aislamientos de S. commune (Figura 3).
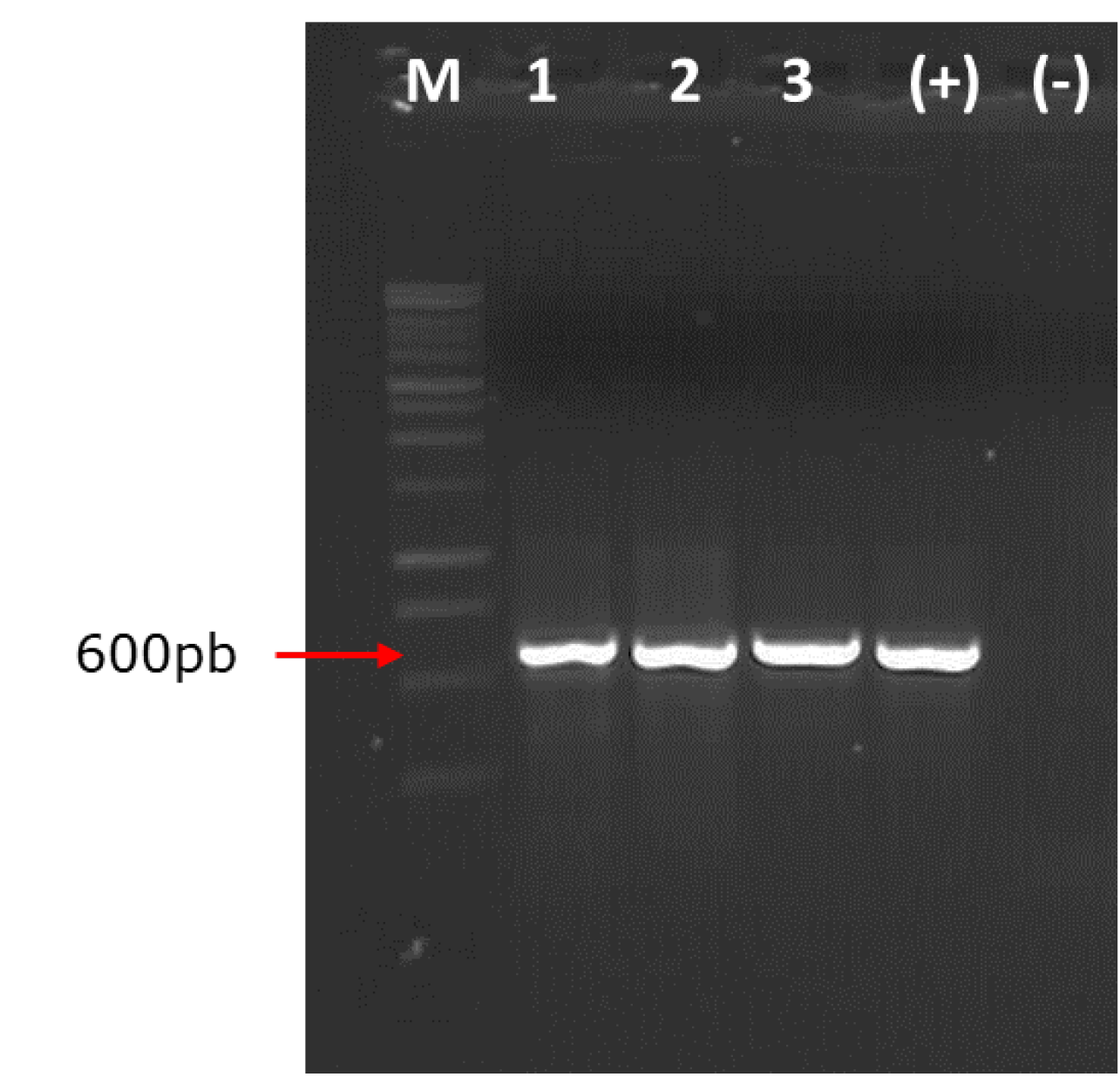
M = Marcador molecular 1kb, carril 1 a 3 muestras de Schizophyllum commune; (+) = Control positivo; (-) = Control negativo (Agua libre de nucleasas).
Figura 3 Amplificación del producto PCR de Schizophyllum commune Fr. asociado a la pudrición de tocones de Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg.
El análisis de búsqueda de similitud mediante BLAST identificó con una máxima identidad de 99.47 % a Schizophyllum commune con secuencias depositadas en el NCBI (número de accesión MN781967 y EU853847).
El árbol filogenético de Schizophyllum commune se generó a partir de 2 000 000 de generaciones. La reconstrucción filogenética mostró que el aislamiento MZVMT_01 se agrupó en el mismo clado con la secuencia MN781967 de S. commune (Figura 4), la cual corresponde a una cepa en un estudio de hongos de descomposición de la madera en bosques del noroeste de Arkansas (Alshammari y Stephenson, 2018).
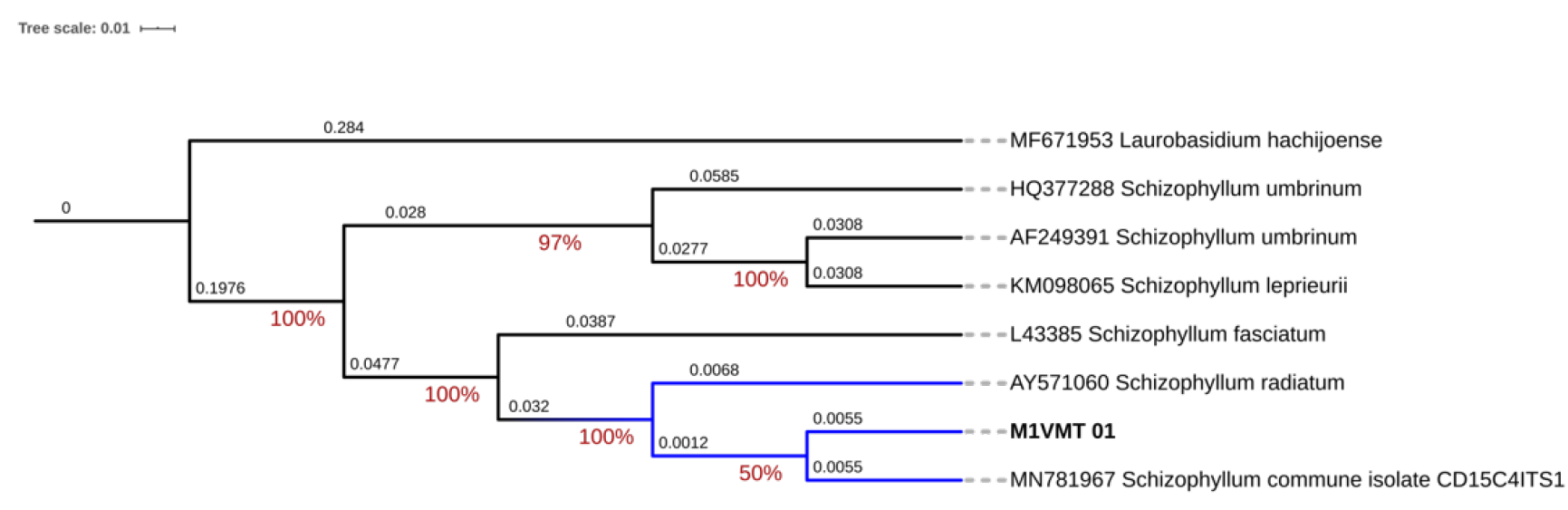
Figura 4 Árbol filogenético de consenso basado en inferencia bayesiana que ilustra la relación de Schizophyllum commune Fr. asociado a la pudrición de tocones de Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg. en México.
S. commune es un hongo cosmopolita, con amplia distribución en todos los continentes y se asocia con la colonización de tejido leñoso y pudrición de la madera. Anteriormente, se consideraba un patógeno débil, y se le consideró como un microorganismo saprófito relacionado con la descomposición de ramas, madera muerta y madera almacenada. Sin embargo, ahora se reconoce como un patógeno emergente importante en plantas (Schmidt y Liese, 1980; Ohm et al., 2010; Takemoto et al., 2010) y humanos (Chowdhary et al., 2013; Saha et al., 2013; Michel et al., 2015).
Esta especie fúngica se incluye en el grupo de patógenos que causan la enfermedad denominada “pudrición blanca”, entre los cuales Schwarze et al. (2000) consignan que albergan a la mayor variedad de mecanismos de degradación. S. commune se considera un patógeno omnívoro que invade tejido vivo y es un basidiomiceto muy agresivo (Takemoto et al., 2010).
Su intervalo de hospedantes incluye al menos 150 géneros de árboles maderables, coníferas, frutales y ornamentales; en Asia, se identifican más de 260 especies en 150 géneros de plantas como hospedantes naturales, y en Japón 32 taxones en 22 géneros de plantas leñosas (De Jong et al., 2006 citado por Ohm et al., 2010; Takemoto et al., 2010). Se ha demostrado la interacción con otros patógenos en árboles jóvenes de manzana (Malus sp.) y material de propagación que causa pudrición blanca en raíces (Havenga et al., 2019).
La secuenciación del genoma de S. commune reveló características únicas y mayor cantidad de genes que otros basidiomicetos que codifican para la producción de enzimas degradadoras de la pectina, celulosa, hemicelulosa y un mecanismo único para degradar la lignina (Ohm et al., 2010). En otros estudios se determinó alta producción de xilanasa, lacasa, celulasa, esterasas y peroxidasa (Schmidt y Liese et al., 1980; Špániková et al., 2007; Hirai et al., 2008;). Asimismo, en 75 basidiomicetos analizados, S. commune presentó mayor actividad pectinolítica por la producción de poligalacturonasas (Xavier et al., 2004). Por lo anterior, se postula que S. commune es capaz de degradar, prácticamente, todos los componentes de la pared celular en células de tejido leñoso (Ohm et al., 2010).
Investigaciones sobre la colonización de S. commune evidencian que invade el tejido leñoso a través de los vasos del lumen, traqueídas, vasos leñosos, fibras y xilema en donde la celulosa, hemicelulosa o pectina se utilizan como fuentes de carbono para su desarrollo y posterior aprovechamiento de la lignina y polisacáridos contenidos en el tejido leñoso (Ohm et al., 2010; Padhiar and Albert, 2011; 2012).
La distribución mundial de S. commune indica que es uno de los hongos adaptado a una gran variedad de condiciones, ya que habita tanto en climas templados como tropicales. Se consigna que el grado de severidad de la pudrición blanca depende de la especie del hospedante, condiciones ambientales y tasa de crecimiento del hongo; la temperatura, alta humedad relativa, calentamiento global y pH se han asociado entre las condiciones ambientales más importantes que influyen en la agresividad de este patógeno (Schmidt y Leise, 1980; Takemoto et al., 2010). Su adaptación a diversas condiciones de clima y hospedantes sugiere la existencia de variabilidad genética; lo anterior se demostró entre poblaciones de S. commune que conformaron diferentes linajes con una estrecha relación con el origen geográfico en Norte América y Europa; y un linaje de más reciente expansión en el Caribe (James et al., 1999; 2001). Lo anterior podría sugerir que también es posible la presencia de diferencias en virulencia y agresividad entre poblaciones del fitopatógeno; sin embargo, aún no hay investigaciones que documenten estas diferencias como patógeno de plantas.
En México, S. commune se registró en el trópico húmedo donde los niveles anuales de lluvia superan los 2 500 mm (Carreño-Ruíz et al., 2019). En Tabasco se ha reconocido en madera caída de Ficus benjamina L., que también produce látex, en los municipios Centro, Huimanguillo, Tacotalpa, Teapa, Tenosique y Macuspana (Olivo y Herrera, 1994; Carreño-Ruíz et al., 2019). Estas condiciones climáticas relacionadas a la presencia de S. commune existen en México en diversas localidades productoras de hule en los estados de Chiapas, Oaxaca, Tabasco, Veracruz y Puebla, cuyos clima corresponde al cálido húmedo con abundantes lluvias en verano o todo el año e intervalos de precipitación anual entre 1 900 y 4 500 mm anuales (INEGI, 2009).
La diseminación de S. commune ocurre, principalmente, por la abundante dispersión de basidiosporas por aire, las cuales colonizan el tejido leñoso, mayoritariamente en árboles jóvenes; las lesiones en el tejido por frío, congelamiento y quemaduras de sol son las principales vías de ingreso e infección (Takemoto et al., 2010). Asimismo, las prácticas de poda, la poda inadecuada, mal manejo en vivero y de la fertilización promueven una alta incidencia de S. commune (Snieðkienë y Juronis, 2001); Badalyan et al. (2002) documentaron la amplia capacidad de dispersión, y prevalencia de S. commune hasta por cuatro años.
En Hevea brasiliensis se ha identificado al basidiomiceto Rigidoporus microporus (Sw.) Overeem (1924) como agente causal de “pudrición blanca” en raíces (Oghenekaro, 2016), pero no a S. commune. En la interacción de Hevea brasiliensis con S. commune, la poca información disponible se limita al estudio de la asociación de este basidiomiceto como parte de la comunidad saprófita en la descomposición de ramas caídas y madera almacenada (Hong, 1982; Seephueak et al., 2011a; 2011b), pero no como parásito y patógeno en plantas. La alta uniformidad genética en el cultivo de hule, el manejo en vivero y las condiciones climáticas podrían ser factores importantes en el establecimiento, dispersión y agresividad de S. commune sobre Hevea brasiliensis en México.
Conclusiones
Schizophyllum commune se identificó en los síntomas de pudrición presentes en el tejido leñoso afectado en tocones injertados con el clon IAN-873 de hule en Martínez de la Torre, Veracruz. Las condiciones climáticas y precipitación anual en los principales estados productores de hule en México se ubican en el intervalo ambiental para el óptimo desarrollo de Schizophyllum commune, por lo que estudios futuros deben profundizar sobre la distribución, virulencia y severidad de este hongo en los diferentes clones utilizados en otros estados productores de hule, para el planteamiento de estrategias eficientes de control.
En México este es el primer registro de Schizophyllum commune asociado a tocones de Hevea brasiliensis con síntomas de pudrición; además, a nivel internacional, no hay literatura que refiera la patogenicidad de Schizophyllum commune en Hevea brasiliensis.











 texto en
texto en 


