Introducción
En las últimas décadas, la investigación científica solo ha confirmado los efectos beneficiosos para la salud de las plantas. Se ha sugerido que su alto contenido en agentes bioactivos, especialmente polifenoles, podrían ser responsables de la prevención de muchas enfermedades y usarse como una alternativa natural a las drogas sintéticas (Nostro et al., 2000). Se estima que los principios activos de las plantas representan alrededor de 25% de los medicamentos recetados. Eso es un total de 120 compuestos naturales de 90 plantas diferentes (Djahra, 2014). Se han publicado varios trabajos científicos sobre los polifenoles para informar y sensibilizar a la población sobre sus intereses. Estas moléculas son reconocidas por sus considerables potenciales antioxidantes, los cuales están directamente relacionados con la salud humana (Bouayed et al., 2008).
Los polifenoles tienen la capacidad de atrapar los radicales libres, generados permanentemente por nuestro cuerpo o formados en respuesta a los ataques de nuestro entorno o en caso de infección. Cuando se ingieren con los alimentos, refuerzan las defensas naturales protegiendo las células y los tejidos frente al estrés oxidativo (Scalbert, 2004). Los flavonoides previenen el daño oxidativo por diferentes mecanismos de acción: ya sea por la captura de radicales hidroxilo, superóxidos y peróxidos (Hodek et al., 2002). Ya sea por quelación de metales (hierro y cobre), que son de gran importancia en el inicio de reacciones radicalarias o la inhibición de las enzimas responsables de la generación de radicales libres resultantes del proceso de infección (Benavente-Garcia et al., 1997).
En cuanto al poder antioxidante de los taninos, esta propiedad es muy destacable debido a sus núcleos fenólicos (Zimmer y Cordesse, 1996). Muchas bacterias han desarrollado resistencia a la mayoría de los antibióticos y constituye un importante problema de salud a escala mundial (Lozniewski y Rabaud, 2010), lo que nos llevó a estudiar la eficacia de las plantas con virtudes terapéuticas con el fin de aislar los principios activos. Los cipreses (Cupressaceae) son coníferas de tamaño mediano, que contienen más de 20 especies distribuidas en la región mediterránea, Asia tropical y América del Norte (Liu et al., 2010). Cyprea se considera un árbol medicinal, muy utilizado en la medicina tradicional, donde sus hojas secas se utilizan para el alivio del dolor de estómago, dolores articulares y musculares, malaria, tos, gota y reumatismo, así como como agente hipoglucemiante (Selim et al., 2014; Lakhdar et al., 2015).
El objetivo de la investigación es identificar los metabolitos secundarios que existen en las escamas de Cupressus sempervirens y Cupressus arizonica después de la molienda (cribado fitoquímico). La molienda permite aumentar la superficie de contacto de la muestra con el solvente y una mejor filtración del solvente dentro del material vegetal, lo que resulta en un aumento en el rendimiento de la extracción. El objetivo de la extracción es liberar los polifenoles presentes en las estructuras vacuolares por rotura del tejido vegetal y por difusión. Estos se extraen por extracción sólido-líquido utilizando diferentes solventes con polaridad creciente, a saber: éter dietílico, cloroformo y metanol acuoso. En el laboratorio se realiza un análisis comparativo de los diferentes extractos para estudiar su efecto bactericida frente a Pseudomons aeruginosa ATCC 9027.
Materiales y métodos
El estudio se lleva a cabo según un modelo experimental en bloques completos al azar.
Material vegetal
Las plantas objeto de estudio fueron elegidas sobre la base de una meticulosa búsqueda bibliográfica que mostró que estas especies de plantas están muy poco estudiadas. Las hojas de Cupressus sempervirens L. y Cupressus arizonica utilizadas en este estudio fueron recolectadas durante el mes de abril de 2021, a nivel del Departamento de Biotecnologías y Agroecología de la Universidad de Blida 1 (Blida-Argelia). La identificación de las dos especies se realiza con la flora de Quezel y Santa (1963). Para no dañar el árbol, hemos elegido hojas muy verdes que aparecen en los extremos de las ramas.
Cepa bacteriana
La cepa bacteriana utilizada en este estudio es Pseudomonas aeruginosa ATCC 9027, bacteria patógena, categoría Gram-negativa, clínicamente aislada, su recolección y aislamiento se realizó de acuerdo con estándares de higiene. La cepa se almacena y cultiva en medio Mueller-Hinton. Forma parte de la colección del laboratorio de investigación en Biotecnología de Producción Vegetal de la Universidad de Blida 1 y fue puesto a nuestra disposición por el director Pr. Sid Ahmed SNOUSSI.
Extracción de polifenoles
Secado
Después de la cosecha, las muestras fueron limpiadas (se limpiaron de escombros) y esparcido en papel. Las partes aéreas de la planta se secaron en la oscuridad a temperatura ambiente. Ventilamos las muestras cada tres días para evitar el crecimiento de moho. El secado duró 30 días en promedio (Debib et al., 2014).
Molienda
Las hojas secas se trituraron, tamizaron y almacenaron en frascos herméticos (temperatura ambiente) protegidos de la humedad y la luz, hasta su uso.
Preparación de extractos crudos
Para la extracción de polifenoles optamos por el uso de tres disolventes: éter de petróleo, cloroformo y metanol-acuoso.
Extracto hidroalcohólico
Se pusieron en contacto 10 g de cada material vegetal con 100 ml de una mezcla de metanol-agua (70/30) (v/v). Después de 24 h de agitación mecánica a temperatura ambiente y protegida de la luz, la mezcla se filtra al vacío con una membrana Millipore de 0.4 μm y se evapora a sequedad a presión reducida mediante un rotavapor (BUCHI R-215) a 45 °C para obtener el extracto hidroalcohólico. Los residuos obtenidos se almacenan a 4 °C hasta su uso (Romani et al, 2006).
Extracto etérico
Primero se maceran 10 g de cada material vegetal en 100 ml de éter de petróleo. Después de 10 min de agitación mecánica a temperatura ambiente y protegido de la luz. La mezcla se filtra al vacío con una membrana Millipore de 0.4 µm y se concentra en un rotavapor a una temperatura de 30 °C para obtener el extracto de éter dietileno. Los residuos obtenidos se almacenan a 4 °C hasta su uso (Drissa et al., 2004).
Extracto cloroformico
Primero se maceran 10 g de cada material vegetal en 100 ml de cloroformo. Después de 10 min de agitación mecánica a temperatura ambiente y protegida de la luz, la mezcla se filtra al vacío con una membrana Millipore de 0.4 μm y se concentra en un rotavapor a 40 °C para obtener un extracto clorofórmico. Los residuos resultantes se almacenan a 4 °C hasta su uso (Drissa et al., 2004). Los residuos secos pesados son captados por los disolventes para el estudio fitoquímico y por Dimetilsulfóxido (DMSO) para la actividad antibacteriana (Debib et al., 2014).
Rendimiento de extracción
El rendimiento de extracción se calcula por la fórmula propuesta por Falleh et al. (2008):
Donde: R= porcentaje de rendimiento %; Mext= masa del extracto después de la evaporación del solvente en g; Mseca= masa seca de la muestra de planta en g.
Cribado fitoquímico
El cribado fitoquímico es una prueba cualitativa que permite resaltar los diferentes grupos químicos contenidos en un órgano vegetal, los resultados se clasifican en reacción muy positiva= +++; reacción positiva= ++; reacción débil= +; reacción negativa= -; se realizaron pruebas fitoquímicas sobre extractos preparados a partir de hojas de Cupressus. La detección de algunos compuestos se logra utilizando los métodos descritos por Harbone, (1973); Trease y Evans (1989); Evans (1996) con algunas modificaciones.
Flavonoides
Prueba de Bate-Smith (prueba de flavan-3.4-dioles)
En un tubo ponemos 1 ml del extracto al que añadimos 250 µl de HCl concentrado. El tubo y se llevó a un baño maria durante 30 min. La aparición de un color rojo indica la presencia de leucoantocianinas que son derivados de flavan-3.4-dioles (Karumi, 2004).
Prueba de Wilstater (pruebas para flavonoles y flavononas)
En tubos separados, se pone 1 ml de cada extracto y se le añade 0.1 g de magnesio (Mg). Se añade una gota de HCl y se deja actuar bajo la campana. La aparición de un color que se torna rojo violáceo (flavonoles) o rojo violáceo (flavononas) confirma la existencia de flavonoides (Karumi, 2004).
Taninos
Se añaden 100 µl de una solución de FeCl3 al 1% a un tubo que contiene 1 ml del extracto. En presencia de taninos, se desarrolla un color verdoso o azul-negro. El color se torna marrón negruzco en presencia de taninos gálicos (taninos hidrolizables) y azul verdoso en presencia de taninos catequéticos (taninos condensados) (Harborne, 1998).
Saponósidos
Ponga 0.5 g de hojas trituradas en 80 ml de agua destilada y revuelva durante unos minutos. La aparición de una espuma en el medio prueba la presencia de saponósidos (Trease y Evans, 2002).
Antraquinonas
En un tubo ponemos 1 ml del extracto al que añadimos 500 µl de KOH. Después de agitar, la presencia de las antraquinonas se confirma volviendo la fase acuosa en rojo (Ribérreau, 1968).
Saponinas
Reacción de Libermann-Burchard: a 5 ml de extractos, agregamos 5 ml de anhídrido acético (C4H6O3) y unas gotas de H2SO4 concentrado. Los esteroides dan un color rojo con esta reacción, mientras que los triterpenos dan un color verde (Bruneton, 1993).
Quinonas libres
La identificación de quinonas libres en nuestros extractos se realiza añadiendo unas gotas de NaOH (1%) a 1 ml del extracto. Su presencia está indicada por la apariencia de color púrpura; amarillo o rojo (Ribérreau, 1968).
Terpenoides
Se mezclaron 5 ml de extracto con 2 ml de cloroformo en un tubo de ensayo. Se añadieron cuidadosamente 3 ml de ácido sulfúrico concentrado a lo largo de la pared del tubo de ensayo para formar una capa. Una interfaz con una coloración marrón rojiza indica la presencia de terpenoides (Bruneton, 1993).
Glucósidos cardíacos
Se vertió 1 ml de ácido sulfúrico concentrado en un tubo de ensayo. Se mezclaron 5 ml de extracto con 2 ml de ácido acético glacial que contenía una gota de cloruro férrico. Esta mezcla se añadió cuidadosamente a 1 ml de ácido sulfúrico concentrado. La presencia de glucósidos cardíacos se detectó mediante la formación de un anillo marrón (Trease y Evans, 2002).
Evaluación de la actividad antibacteriana
La prueba de sensibilidad a las bacterias se realiza mediante el método de difusión en medio de agar, también llamado método de disco (Celiktas et al., 2007; Bssaibis et al., 2009).
Siembra
En placas de Petri estériles (Ø: 90 mm), se vierten 20 ml de agar Mueller-Hinton y se dejan solidificar durante 20 min. En este medio de cultivo se inoculó 1 ml de suspensión bacteriana de 108 UFC ml-1 en toda la superficie utilizando un hisopo, el hisopo se debe pasar por toda la superficie para obtener una inoculación homogénea (Shunying et al., 2005). Se impregnan discos estériles (Liofilchem®) en blanco de 6 mm de diámetro con un volumen de 10 μl de extracto y se colocan sobre la superficie del medio solidificado (Ngameni et al., 2009). Las placas de Petri se incubaron durante 18-24 h, a 37 °C. Para el control positivo se utilizaron los discos antibióticos (Penicilina y Vancomicina (Liofilchem®)), mientras que para el control negativo se empapó el disco blanco estéril con Dimetilsulfóxido (DMSO).
Lectura
La determinación de la actividad antibacteriana se estimó midiendo el diámetro (mm) de la zona de inhibición alrededor de los discos inducida por los extractos. El cálculo se realiza mediante el software de procesamiento y medición Digimizer™. Los resultados están simbolizados por signos que dependen de la sensibilidad de las cepas al extracto (Ponce et al., 2003) (Cuadro 1).
Tratamiento estadístico de datos
El análisis estadístico de los resultados obtenidos se realizó mediante el software SPSS© versión 20.0.0 para Windows™. Los experimentos se repitieron diez veces para verificar la normalidad de la distribución estadística. Los resultados muestran las mismas tendencias. Se realiza un análisis de varianza (Anova) seguido de una prueba de Tukey post-hoc al umbral de 5% y una prueba de Student para ver la existencia de diferencias significativas entre los métodos de extracción según la planta ensayada teniendo en cuenta recuentos el rendimiento de extractos e inhibición del desarrollo de P. aeruginosa ATCC 9027.
Resultados y discusión
Rendimiento de extractos
Para las dos plantas Cupressus sempervirens y Cupressus arizonica, el mejor rendimiento de extracción de los tres solventes utilizados es el cloroformo con un rendimiento de extracción promedio de 61.23% y 52.27% respectivamente, seguido del solvente hidroalcohólico 33.55% y d etérico con 0.39% (Figura 1). Los rendimientos de extracción mostrados en la figura revelan una diferencia significativa (C. sempervirens F= 52.38; p= 0 en C. arizonica: F= 27.24; p= 0) en comparación con el solvente utilizado. La prueba Anova revela tres grupos homogéneos (Cuadro 2 y 3). Estadísticamente y según la prueba t de Student, los tres disolventes (cloroformo, hidroalcohólico, etéreo) difieren significativamente para las dos plantas (Cuadro 4).
Cuadro 2 Distribución del rendimiento de extractos en grupos homogéneos para C. arizonica (prueba de Tukey).
| Extractos | N | Subconjunto para alfa = 0.05 | ||
| 1 | 2 | 3 | ||
| Extracto etérico | 10 | 1.29 | ||
| Extracto hidroalcohólico | 10 | 33.56 | ||
| Extrcto clorofórmico | 10 | 52.28 | ||
| Significado intragrupo | 1 000 | 1 000 | 1 000 | |
Cuadro 3 Distribución del rendimiento de los extractos en grupos homogéneos para C. sempervirens (prueba de Tukey)
| Extractos | N | Subconjunto para alfa = 0.05 | ||
| 1 | 2 | 3 | ||
| Extracto etérico | 10 | 0.4 | ||
| Extracto hidroalcohólico | 10 | 33.23 | ||
| Extracto clorofórmico | 10 | 61.26 | ||
| Significado intragrupo | 1 000 | 1 000 | 1 000 | |
Cuadro 4 Prueba t de Student para la comparación de los extractos según las plantas.
| Extractos | t | ddl | p | Diferencia media | Diferencia de DES |
| Extracto etérico | 83.415 | 1 515 | 0.001 | 0.895 | 0.011 |
| Extracto clorofórmico | 33.212 | 1 312 | 0 | 8.972 | 0.027 |
| Extracto hidroalcohólico | 13.98 | 1 984 | 0.005 | 0.331 | 0.024 |
Las similitudes son comunes en las hojas de los árboles cosechados en el mismo lugar. Las condiciones ambientales tienen una influencia importante en la producción de metabolitos, por lo que se puede esperar que los rendimientos de extracción de plantas que crecen en el mismo lugar sean muy similares (Graglia et al., 1996). Nuestros resultados refutan esta hipótesis y muestran claramente que el rendimiento de las especies no está relacionado con las condiciones ambientales porque los dos árboles están ubicados en la misma área a una distancia de 2.45 m.
Estos resultados se correlacionan con los de Farhat et al. (2009) quienes explican que el rendimiento variable de los extractos se reduce a la solubilidad diferencial de los diversos compuestos fenólicos en los disolventes y que esta solubilidad es función de sus grados de polimerización. La interacción con los demás componentes y la naturaleza y características fisicoquímicas de los disolventes utilizados y en particular, su polaridad. De hecho, la solubilidad de las sustancias contenidas en el material vegetal en un disolvente determinado depende de estas propiedades. Como resultado, los rendimientos de extracción y la composición de los extractos varían de un solvente a otro y de una planta a otra (Falleh et al., 2008).
Cribado fitoquímico
El cribado fitoquímico de C. arizonica y C. simpervirens indica que las dos especies presentan compuestos fenólicos cuya presencia difiere según el tipo de disolvente utilizado (extracto hidroalcohólico; etérico y clorofórmico) (Cuadro 5).
Cuadro 5 Cribado fitoquímico de C. arizonica y C. simpervirens según la naturaleza del disolvente.
| Cupressus arizonica | Cupressus simpervirens | |||||||
| Ext (A) | Ext (E) | Ext (C) | Ext (A) | Ext (E) | Ext (C) | |||
| Saponósidos | + + + | + + + | ||||||
| Flavonoides | Leucoantocianinas | + + | - | - | + + | + | - | |
| Flavonoles | + + | - | - | + + | - | - | ||
| Flavononas | + | - | - | + | - | - | ||
| Antraquinonas | + + | - | - | + + | - | - | ||
| Taninos | Taninos catequéticos | + + | - | - | + + | - | - | |
| Taninos galos | - | - | + + | - | - | + + | ||
| Saponina | Esteroides | + | - | - | + | + | - | |
| Triterpenos | - | + | + | - | + | + | ||
| Glucósidos cardíacos | + | - | - | + + | - | - | ||
| Terpenoides | + | - | - | + | - | + + | ||
| Quinonas libres | + + | - | - | + + | - | - | ||
Ext (A)= extracto hidroalcohólico; Ext (E)= extracto etérico; Ext (C)= extracto clorofórmico; +++= reacción muy positiva; ++= reacción positiva; += reacción débil; -= reacción negativa.
El cloroformo permite la extracción de taninos gálicos mientras que la extracción con alcohol permite la identificación de taninos catequéticos. Los saponósidos están fuertemente presentes en las hojas de C. arizonica y C. simpervirens. La extracción con éter de petróleo de las hojas de C. simpervirens muestra una reacción débil a las leucantocianinas y los esteroides. Por otro lado, el uso de este solvente para las hojas de C. arizonica resulta en una reacción negativa.
Los terpenoides se observan con fuerza cuando se usa el extracto de cloroformo para las hojas de C. simpervirens. Este no es el caso de las hojas de C. arizonica. De estos resultados se desprende que el uso de un solvente hidroalcohólico permite una mejor extracción de los compuestos fenólicos a excepción de los taninos gálicos, que, como se mencionó anteriormente, están disponibles mediante el uso de cloroformo en el proceso de extracción.
Estos resultados corroboran con Azzaz et al. (2019), donde informaron que la composición de los extractos de hojas de C. simpervirens varía según el solvente de extracción y el método utilizado. Además, no se han realizado estudios sobre extractos de C. arizonica; este se realizó por primera vez en C. arizonica con el fin de prospectar los diversos metabolitos secundarios existentes en esta planta. Se sabe que los compuestos como los flavonoides, terpenos, quinonas, taninos y saponinas en las plantas son responsables de la protección contra el estrés biótico y abiótico, la actividad antifúngica y numerosas actividades biológicas (Hiermann et al., 1998; Kanwal et al., 2010).
Efecto de extractos fenólicos de C. sempervirens y C. arizonica en el desarrollo de P. aeruginosa
El cálculo del diámetro de inhibición de P. aeruginosa inducido por los diferentes extractos y por los antibióticos (Penicilina y Vancomicina) se muestra en la Figura 2. P. aeruginosa es extremadamente sensible al control positivo, vancomicina, donde se observa un diámetro de la zona de inhibición de 24.25 mm; lo mismo ocurre con el extracto hidroalcohólico de C. sempervirens donde el organismo de prueba se considera sensible. Con una zona de inhibición del orden de 19.95 mm. Los resultados indican que la extracción hidroalcohólica induce una sensibilidad muy pronunciada de P. aeruginosa con un diámetro de 16.2 mm para C. arizonica. Los extractos etéreos y clorofórmicos inducen una inhibición relativamente débil (Cuadro 6).
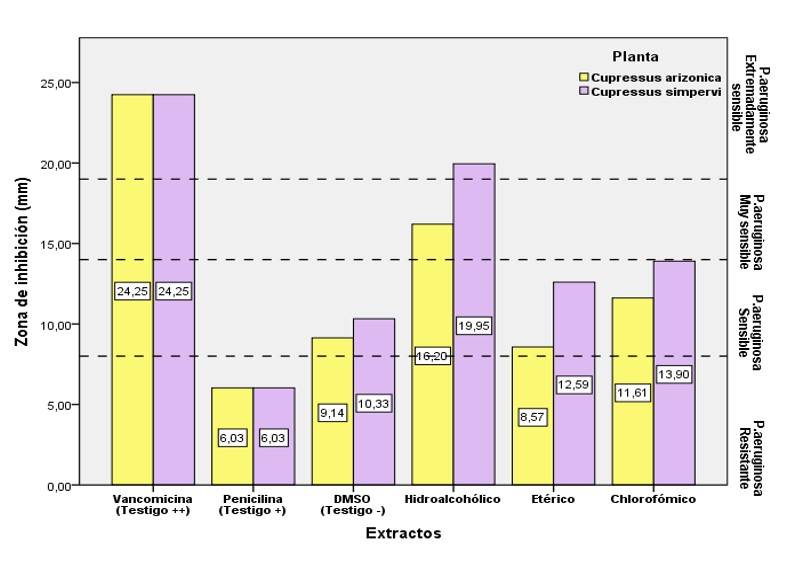
Figura 2 Variación del diámetro de la zona de inhibición (mm) en función de la planta y el disolvente.
Cuadro 6 Sensibilidad de P. aeruginosa a extractos fenólicos de C. sempervirens y C. arizonica.
| Planta | Extracto | Interpretación de la zona de inhibición |
| C. arizonica | Hidroalcohólico | Muy sensible |
| Etérico | Sensible | |
| Clorofórmico | Sensible | |
| C. sempervirens | Hidroalcohólico | Extremadamente sensible |
| Etérico | Sensible | |
| Clorofórmico | Sensible | |
| Testigos | DMSO (testigo -) | Resistente |
| Penicilina (testigo +) | Resistente | |
| Vancomicina (testigo ++) | Extremadamente sensible |
C. arizonica muestra números bajos de la zona de inhibición en comparación con C. sempervirens. La prueba de Student (prueba t) al nivel del 5% indica que esta diferencia no es estadísticamente significativa (p> 5%) (Cuadro 7).
Cuadro 7 Prueba t de Student para la comparación de las zonas de inhibición de los extractos según las plantas.
| Extractos | t | ddl | p | Diferencia media | Diferencia de DES |
| Extracto etérico | -1.962 | 3.752 | 0.13 | -4.02 | 2.05 |
| Extracto clorofórmico | -.597 | 3.701 | 0.58 | -2.29 | 3.84 |
| Extracto hidroalcohólico | -2.284 | 4 | 0.08 | -3.75 | 1.64 |
| DMSO | -.946 | 2.215 | 0.44 | -1.19 | 1.26 |
| Penicilina | 0 | 4 | 1 | 0 | 0.02 |
| Vancomicina | 0 | 4 | 1 | 0 | 1.81 |
Un análisis de varianza mediante Anova al nivel de 5% seguido de un post-hoc de Tukey permite dividir el diámetro de inhibición en grupos homogéneos (F= 24.09; p= 0). En C. arizonica, se observó la distribución de diámetros de inhibición en tres grupos homogéneos. El primero está representado por Penicilina, extracto de éter, DMSO y extracto de cloroformo. El segundo por cloroformo y extracto hidroalcohólico. La vancomicina se aísla en el grupo 03 (Cuadro 8).
Cuadro 8 Distribución de extractos de C. arizonica en grupos homogéneos según sus efectos sobre la inhibición de P. aeruginosa.
| Extractos | N | Subconjunto para alfa= 0.05 | ||
| 1 | 2 | 3 | ||
| Penicilina | 10 | 6.03 | ||
| Extracto etérico | 10 | 8.57 | ||
| DMSO | 10 | 9.14 | ||
| Extracto clorofórmico | 10 | 11.61 | 11.61 | |
| Extracto hidroalcohólico | 10 | 16.2 | ||
| Vancomicina | 10 | 24.25 | ||
| Significado intragrupo | 10 | 0.104 | 0.231 | 1 000 |
La prueba de Tukey muestra 04 grupos homogéneos en C. sempervirens (F= 15,12; p= 0). El primero está representado por penicilina y DMSO. El segundo grupo está representado por DMSO, el extracto etérico. El tercer grupo está representado por extractos etéreos, clorofórmicos e hidroalcohólicos. El efecto del extracto hidroalcohólico es similar al efecto de la vancomicina aislada en el grupo 04 (Cuadro 9).
Cuadro 9 Distribución de extractos de C. sempervirens en grupos homogéneos según sus efectos sobre la inhibición de P. aeruginosa.
| Extractos | N | Subconjunto para alfa = 0.05 | |||
| 1 | 2 | 3 | 4 | ||
| Penicilina | 10 | 6.03 | |||
| DMSO | 10 | 10.32 | 10.32 | ||
| Extracto etérico | 10 | 12.59 | 12.59 | 12.59 | |
| Extracto clorofórmico | 10 | 13.9 | 13.9 | ||
| Extracto hidroalcohólico | 10 | 18.31 | 18.314 | ||
| Vancomicina | 10 | 24.24 | |||
| Significado intragrupo | 0.118 | 0.644 | 0.207 | 0.18 | |
Se desprende de los resultados obtenidos que los diámetros de las zonas de inhibición varían en función del tipo de disolvente estudiado. La actividad antibacteriana de estos extractos se debe principalmente a su perfil químico. Cabe señalar, que la diferencia entre las actividades antimicrobianas de los extractos puede explicarse por la diferencia en los compuestos activos obtenidos. Por tanto, esta actividad está relacionada con la polaridad de las sustancias bioactivas extraídas y los disolventes de extracción (Machiex et al., 2005).
Estos resultados son mejores que los obtenidos por Hayouni et al. (2007) con extractos de cloroformo de frutos de Juniperus phoenicea (Cupressaceae) contra P. aeruginosa ATCC 9027, donde encontraron halos de zonas de inhibición de 3.03 mm ±0.21. El rendimiento variable de los extractos se reduce a la solubilidad diferencial de los diferentes compuestos fenólicos en los disolventes y que esta solubilidad es función de su grado de polimerización, la interacción con los demás constituyentes y el tipo de disolvente utilizado (Falleh et al., 2008; Debib et al., 2014).
Combinando los resultados del cribado fitoquímico pudimos demostrar que la actividad antibacteriana está ligada a la presencia de moléculas fenólicas en las hojas de ambas plantas. Estos metabolitos secundarios son responsables de diversas actividades biológicas. Por lo tanto, se ha prestado gran atención a los productos naturales derivados principalmente de plantas (Chaudhary et al., 2012; Chaitra et al., 2015).
Conclusiones
El presente trabajo muestra que C. sempervirens y C. arizonica contienen metabolitos secundarios de alta calidad, lo que constituye la base científica para el uso terapéutico de las hojas estudiadas. Este estudio es por tanto, una contribución fitoquímica al conocimiento de las dos especies de ciprés de gran interés en el campo de la farmacología. El cribado fitoquímico reveló la presencia de varios metabolitos secundarios: leucoantocianinas, flavonoles, flavononas, antraquinonas, taninos catequicos, taninos galos, saponina (esteroides y triterpenos), glucósidos cardíacos, terpenoides, saponósidos y quinonas libres, que están estrechamente relacionados con la polaridad de los disolventes utilizados.
El mejor rendimiento de extracción de los tres disolventes utilizados es el cloroformo con un rendimiento de extracción promedio de 61.23% (para C. sempervirens) y 52.27% (para C. arizonica). Los resultados indican que la extracción hidroalcohólica induce una sensibilidad muy pronunciada de P. aeruginosa con un diámetro de 16.2 mm para C. arizonica. Sin embargo, el estudio está limitado por la respuesta clínica de la bacteria en un ambiente hospitalario. De hecho, un estudio de casos clínicos podría dar más visibilidad al efecto de los extractos de ciprés en el desarrollo de P. aeruginosa. Además, se debe considerar una formulación adecuada para minimizar la cantidad de hojas y optimizar el efecto bactericida del extracto hidroalcólico de C. simpervirens.











 texto en
texto en 



