Introducción
La producción de café (Coffea arabica L.) tiene un alto valor económico, social y ambiental en los países donde se cultiva (Flores, 2015). Sin embargo, el cultivo es afectado por el ataque de plagas y enfermedades, agravándose debido a las condiciones climáticas (Waller, 1982; SARH, 1993). La afectación va desde la germinación de la planta hasta la etapa productiva, lo que genera grandes pérdidas en la producción y disminución de la calidad del grano (CEPAL y CAC/SICA, 2014; Chemura et al., 2017).
La roya (Hemileia vastatrix Berk. & Br.) es la enfermedad más importante del café (Haddad et al., 2014; Oliveira, et al., 2014; Barka et al., 2017), al utilizar a este cultivo como su principal huésped (Brown y Hovmøller 2002). Generalmente ocasiona la pérdida de hojas hasta de 50% (Avelino et al., 2004; Bonilla, 2018) y 30% del rendimiento en algunas variedades de C. arabica L., lo que significa un gran impacto económico a nivel mundial (Oliveira, et al., 2014; Barka et al., 2017). En el ciclo 2013-2014 la producción en Centroamérica y México fue afectada en 3.3 millones de sacos (Flores, 2015) por lo que en 2016 México implementó el Programa de Vigilancia Epidemiológica Fitosanitaria en los estados de Hidalgo, Jalisco, Estado de México, Nayarit, Querétaro, Chiapas, Veracruz, Puebla, Guerrero, San Luis Potosí y Oaxaca para determinar la incidencia, severidad e implementar acciones preventivas de manejo contra la roya (SENASICA, 2016).
El control de H. vastatrix se da mediante el uso de agroquímicos, fungicidas, biofungicidas, variedades resistentes, control biológico, control cultural y manejo integrado (Obando et al., 2013; Hernández-Martínez y Velázquez-Premio, 2016). Los agroquímicos generan contaminación al ambiente e incrementan los costos de producción (Romero, 2010; Gonza et al., 2013) por ello, se han buscado alternativas viables que garanticen la sostenibilidad en la producción agrícola (Gonza et al., 2013).
Un ejemplo de ello es el uso de los fungicidas cúpricos (oxicloruro de cobre y los caldos minerales) considerados los más eficientes para el control de la roya, puesto que no alteran la biota del agroecosistema (Capucho et al., 2013; Melchor et al., 2018), estos penetran en el tejido de las hojas y tienen efectos curativos (McCook, 2009) atacan al hongo durante el crecimiento miceliar y la formación de pústulas (Duicela y Ponce, 2015) así como el uso de microorganismos como hongos y bacterias (Gómez-De La Cruz et al., 2017), con capacidad de sobrevivir a expensas del hongo (Boosalis, 1964) afectando las estructuras reproductivas del patógeno (Barros et al., 1999).
La incidencia y severidad de la roya se obtiene mediante evaluaciones visuales por personal capacitado (Zambolim, 2016). Sin embargo, es común el uso de escalas logarítmicas con ilustraciones de hojas en diferentes grados de daño, siendo un método para cuantificar la severidad visual (Nascimento et al., 2005; Hernández y Sandoval, 2015). La severidad digitalizada se obtiene con un integrador de área foliar (Chavarria et al., 2015) y uso de software como ImageJ, Image Tool y Adobe Photoshop, permitiendo determinar áreas de imágenes con mayor exactitud y precisión (Sussel et al., 2009; Rincón et al., 2012).
Con base en lo anterior, el objetivo del presente estudio fue evaluar la incidencia y severidad de la roya (Hemileia vastatrix Berk. & Br.) en plántulas de café (Coffea arabica L.) var. Geisha bajo el efecto de diferentes biofungicidas.
Materiales y métodos
El estudio se realizó de febrero a agosto de 2018 en la finca El Nueve, Santa María Huatulco, Oaxaca, localizada en las coordenadas 15o 55’ 56’’ latitud norte y 96o 17’ 08’’ longitud oeste, con rango altitudinal de 1 200 a 1 300 m. El tipo de vegetación es selva mediana subperennifolia (INEGI, 2019). Para conocer el nivel de fertilidad del sustrato en vivero (mezcla de residuos de cosecha y tierra de monte relación 1:1) se realizó un análisis físico-químico acorde a la NOM-021-RECNAT-2000 (SEMARNAT, 2002).
Se utilizaron plántulas de café var. Geisha con tres meses de edad, trasplantadas en bolsas de polietileno de 13 x 20 cm, estandarizadas en cuanto a altura (10 cm) y porte. Se establecieron 24 tratamientos con 10 repeticiones, cada repetición se consideró una plántula. Los productos evaluados fueron: un testigo, con efecto simple, cuatro a base de microorganismos, cuatro a base de minerales, un homeopático y las combinaciones con la misma dosis (Bss+Nr, Bs+Nr, M+Nr, Bfg+Nr, Oc+Nr, Cb+Nr, Cmv+Nr, S+Nr, Bss+Bfg, Bs+Bsg, M+Bfg, Bss+Nr+Bfg, Bs+Nr+Bfg y M+Nr+Bfg) (Cuadro 1).
Cuadro 1 Productos evaluados para su efecto simple y combinado en la incidencia y severidad de H. vastatrix Berk. & Br. en plántulas de C. arabica L. var. Geisha.
| Tratamiento | Composición | *Dosis | |
| T | Testigo | - | Sin aplicación |
| Bss | Baci-Sur subtilis | Bacillus subtilis 5x1020 colonias ml | 0.15 ml + 15 ml agua |
| Bs | Bacit-Sur | Bacillus subtilis 5x1020 colonias ml, Trichoderma spp. 1.3x1012 esporas ha-1 | 0.15 ml + 15 ml agua |
| M | Michoderma | Trichoderma harzianum 1.2x8 g/l/dosis esporas | 0.01 g + 15 ml agua |
| Bfg | Blite Free F-07/Guanobras | Streptomyces spp. 1x10 UFC/ml 60%, glucosamina 1%, MO 3%, ác. húmicos 0.65%, ác fúlvicos 0.15% | 0.2 ml + 0.15 ml + 15 ml agua |
| Oc | Oxicloruro de cobre | Cobre metálico 59% | 0.01 g + 4 ml agua |
| Cb | Caldo Bordelés | Sulfato de cobre, hidróxido de calcio, | 0.04 g CuSO4 + 0.04 g Ca(OH)2 + 4 ml agua |
| Cmv | Caldo mineral visosa | Sulfato de cobre, hidróxido de calcio, sulfato de zinc, sulfato de magnesio, ác. bórico | 0.02 g CuSO4 + 0.02 g Ca(OH)2 + 0.02 g ZnSO4 + 0.02 g MgSO4 + 0.02 g H3BO3 + 4 ml agua |
| S | Sulfocal | Azufre y cal viva | 0.1 ml + 7.5 ml agua |
| Nr | Nat-Rx | Hepar sulphur 15%, Bovista plumbea 5%, extracto vegetal homeopático 10%, agua | 0.7 ml + 30 ml agua |
*= dosis por plántula por aplicación.
Los tratamientos se aplicaron en dos momentos con un mes de separación (15 de febrero y 15 de marzo). Las aplicaciones se realizaron por la mañana y las dosificaciones se ajustaron al 10% de lo que se aplica en campo teniendo como base las recomendaciones emitidas por los fabricantes y que se especificaban en la etiqueta de los productos.
Se evaluó la incidencia de la roya (INR) utilizando la metodología de Samayoa-Juárez y Sánchez-Garita (2000), adaptada al trabajo de investigación que consistió por cada repetición contar el total de hojas enfermas y dividir entre el número total de hojas, multiplicando el resultado por 100. De cada repetición se consideraron las variables: hojas totales (HT), hojas sanas (HS) y hojas dañadas por roya (HDR). Se realizaron cinco evaluaciones cada 30 días después de aplicar los biofungicidas (dda). A 150 dda se determinó la severidad visual (SVR) de las HDR, mediante el uso de la escala logarítmica-diagramática propuesta por el SENASICA (2016) (Figura 1).
Al mismo tiempo se tomaron fotografías a las HDR para determinar la severidad digitalizada (SDR), considerando el área foliar total (AFT), área dañada por roya (ADR) y el área sana (AS), analizando las fotografías con el software Adobe Photoshop® CC 2017. Para ello se midió 1 cm de la imagen estandarizando la escala de medición (370 pixeles= 1 cm), para todas las imágenes. Se utilizó un diseño completamente al azar. A los datos se les aplicaron los supuestos de normalidad y homogeneidad, al no cumplir la prueba aún transformados los datos, se analizaron mediante estadística no paramétrica por la prueba de Kruskal-Wallis mediante el software estadístico SAS/STAT 9.3 (SAS Institute Inc., 2011).
Resultados y discusión
Los resultados del análisis indican que la textura del sustrato es areno francosa (Ac), pH de 6.9, conductividad eléctrica de 0.23 dS m-1 (efectos despreciables de salinidad) materia orgánica de 5.82% (niveles altos), fósforo de 20.86 mg kg-1 (niveles medios), calcio de 0.0011 cmol kg suelo (bajo), magnesio de 0.0016 cmol kg suelo y nitrógeno de 0.38%.
El porcentaje de hojas con roya (PHR) mostró diferencias significativas (0.041) entre biofungicidas hasta los 150 dda, con un valor de p≤ 0.05. Sin embargo, de 30 a 120 dda no hubo respuesta de los biofungicidas sobre la incidencia de H. vastatrix Berk. & Br. En la INR los biofungicidas a base de microorganismos fueron más efectivos. Sobresalen las combinaciones Bacit-Sur + Nat-Rx; Baci-Sur subtilis + Blite Free F-07/Guanobras y Michoderma + Blite Free F-07/Guanobras, los cuales generaron mayor control sobre la INR de H. vastatrix con rangos medios de 93.5 (Figura 2).
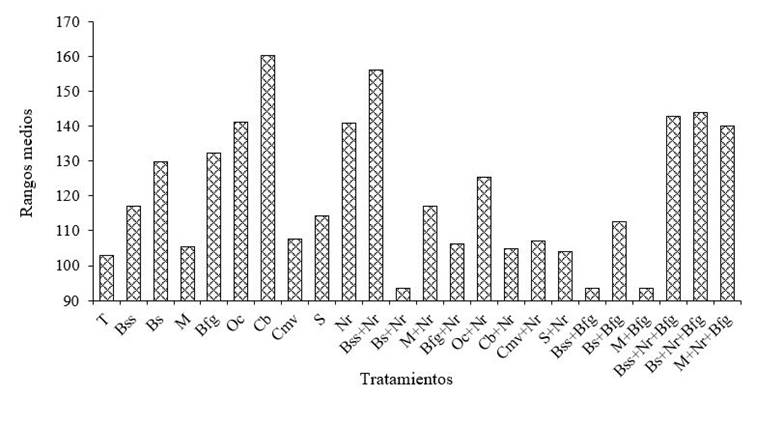
Figura 2 Respuesta de los biofungicidas a la incidencia de H. vastatrix Berk. & Br. en plántulas de C. arabica L. var. Geisha a los 150 dda. Valores bajos de rangos medios equivale a menor incidencia.
De acuerdo con Cacefo et al. (2016) al aplicar B. subtilis en las var. Icatú y Mundo Novo obtuvieron un control de 24 y 17%, respectivamente. Así mismo Dorighello (2013) al usar aislados de B. subtilis QST 713 y AP-3 en el control de la roya de la soya (Phakopsora pachyrhizi), observó una reducción en la germinación de las uredosporas. Li et al. (2013) obtuvieron una reducción significativa de la incidencia de Puccinia striiformis f. sp. tritici (Pst) (roya de la soya) con la aplicación de B. subtilis E1R-j bajo condiciones de invernadero con dos formulaciones diferentes a las 24 y 0 h antes de la inoculación de Pst.
Leonel y Barros (2013) obtuvieron menor incidencia de H. vastatrix usando complejo homeopático, observando mayor vigor vegetativo. Asimismo, Rissato et al. (2016) obtuvieron la menor incidencia del moho blanco del frijol (Sclerotinia sclerotiorum) con aplicaciones de medicamentos homeopáticos. Por su parte, El-Sharkawy et al. (2015) utilizaron Streptomyces viridosporus en combinación con Trichoderma harzianum para el control de la roya del trigo en invernadero (Puccinia triticina), con la que obtuvieron una disminución en el número de pústulas por unidad de superficie (cm2).
Para la SVR y SDR no se presentaron diferencias significativas; sin embargo, numéricamente se observó que las combinaciones de Bs + Nr; Bss + Bfg y M + Bfg generaron mayor control sobre la severidad en ambas variables (Figuras 3a y 3b). Cisneros-Rojas et al. (2017) reportaron mayor crecimiento y desarrollo de plántulas de café aplicando B. subtilis con efecto individual y en combinación con la bacteria Kocuria sp. Cacefo et al. (2016) señalan que B. subtilis estimula a la planta para activar sus mecanismos de defensa para mayor resistencia, mitigando los efectos dañinos de patógenos. De acuerdo con Pérez et al. (2015) el efecto biocontrolador de Trichoderma spp. tiene un modo de acción que regula el desarrollo de los hongos fitopatógenos.

Figura 3 Respuesta de los biofungicidas sobre la severidad visual de H. vastatrix en plántulas de C. arabica L. var. Geisha, a los 150 dda. Valores bajos de rangos medios equivale a menor severidad.

Figura 3b Respuesta de los biofungicidas sobre la severidad digitalizada de H. vastatrix en plántulas de C. arabica L. var. Geisha, a los 150 dda. Valores bajos de rangos medios equivale a menor severidad.
Infante et al. (2009) indican que, durante el proceso de infección, Trichoderma spp., desactiva las enzimas de los hongos fitopatógenos. El-Sharkawy et al. (2015) obtuvieron que Trichoderma harzianum y Streptomyces viridosporus tuvieron los mejores efectos para el control de la severidad de la roya de la hoja del trigo, en comparación con fungicidas químicos. Evangelista-Martínez et al. (2015) mencionan que las bacterias del género Streptomyces son productores de metabolitos secundarios y enzimas que actúan en el control de enfermedades provocadas por hongos en las plantas.
Conclusiones
La escala logarítmica-diagramática facilitó en campo la medición de la severidad en hojas; sin embargo, aunque esta actividad requiera tiempo para evaluar cada una de las hojas con roya, ya que se requiere de una revisión minuciosa de las hojas cuando se presentan lesiones muy pequeñas y asemejar a las imágenes propuestas en la escala. La bacteria B. subtilis es utilizada para el control biológico de la roya el café, pero sus efectos también influyen en el crecimiento y desarrollo de las plántulas. B. subtilis en combinación con Streptomyces sp. y guano de murciélago, este último rico en nutrientes que ayudan a fortalecer las plántulas.
Lo cual, también se ve reflejado al aplicar el hongo Trichoderma harzianum que ayuda a la plántula a inhibir la roya y a capturar nutrientes que se encuentran en el suelo. B. subtilis ha demostrado ser una importante opción en el control biológico, especialmente de enfermedades foliares. Las bacterias que pertenecen al género Bacillus se han usado en el control biológico de hongos fitopatógenos. El uso de la bacteria B. subtilis es una alternativa para el control biológico de la roya del café, además se ha utilizado para el desarrollo de plántulas de café con éxito.











 texto en
texto en 



