Introducción
Fusarium es un género de hongos que incluye una gran cantidad de especies patógenas de plantas. Su alta capacidad coevolutiva con plantas cultivadas le ha conferido mayor variabilidad genética e incrementar su diversidad de especies. Tan solo el grupo de Fusarium oxysporum incluye 120 formas especiales que causan enfermedad en plantas hospedantes específicas (Bentley et al., 1998; Leong, et al., 2010; Benaouali et al., 2014). De estas formas especiales F. oxysporum Schlechtend f. sp cubense (E.F. Smith) Snyd y Hans, fue causa de una de las enfermedades más catastróficos a nivel mundial en plátanos y bananos (Ploetz, 2015).
Se estima que entre 1960 y 1970 en México, cerca de 40 000 hectáreas de plátano de la variedad manzano o Silk (Musa AAB) fueron destruidas por esta enfermedad (Orozco et al., 2009) y la mayoría de los suelos de las zonas productoras de plátano quedaron infestados con F. oxysporum f. sp cubense (Orozco et al., 2009) lo que hizo difícil la producción de variedades susceptibles como Silk o manzano.
Fusarium es un patógeno que forma estructuras de resistencia denominadas clamidosporas que le confieren la capacidad de sobrevivir por largos periodos en el suelo, y sus principales formas de dispersión son por movimiento del suelo infestado y agua de escorrentía (Retana et al., 2018); sin embargo, su abundancia y diversidad en el suelo también depende de otros factores tales como variedad del cultivo, características físico-químicas del suelo, condiciones climáticas y actividad humana (Bateman y Murray 2001; Bernhoft et al., 2012).
Toda esta interacción de factores, hacen necesario el estudio del comportamiento, abundancia y diversidad de las diferentes razas y formas especiales Fusarium oxysporum con el cultivo y especies de Trichoderma, que han mostrado propiedades en su control (Maina et al., 2016), así como el impacto de las prácticas culturales que pueden alterar este comportamiento.
En la actualidad la mayoría de los estudios realizados directamente con diversidad de especies muestran la historia y el potencial evolutivo de una población o infieren en aspectos prácticos como el flujo génico de virulencia hacia otras zonas geográficas tanto de hongos (McDonald y Linde, 2002); sin embargo, pocos trabajos han estudiado el impacto de las prácticas culturales en diferentes épocas del año y condiciones climáticas sobre la abundancia y diversidad genética de especies de Fusarium en el suelo (Bernhoft et al., 2012) y su interacción con especies de Trichoderma, por lo que existe poco entendimiento en éste aspecto (Maina et al., 2016).
Debido a lo anterior, se planteó el presente estudio con el objetivo de conocer el efecto de las labores culturales (barbecho y el control de malezas) y condiciones climáticas (temperatura, humedad relativa y precipitación) en la abundancia y diversidad genética de las poblaciones de Fusarium oxysporum y Trichoderma sp., en el cultivo de plátano AAB, utilizando los medios de cultivo PDA y K2 para su aislamiento y la técnica de reacción en cadena de la polimerasa (PCR) para su identificación.
Materiales y métodos
Localización y muestreo del terreno
Un total de 58 muestras de suelo con un peso de 500 g fueron colectadas en una parcela de plátano manzano o Silk (Musa AAB) en Platanozapan, Municipio de Tlapacoyan Veracruz, México, 29 fueron colectadas en el mes de noviembre de 2017 y el resto en abril de 2018. Para la colecta de muestras fueron georreferenciados sitios de muestreo en la parcela, la cual fue previamente dividida en dos partes, en una se realizó barbecho y control de maleza, mientras que en la otra no se realizó ningún tipo de labor. Cada sitio, fue marcando con estacas de madera a cada cinco metros, y en cada uno de ellos a 0.2 m de profundidad fue tomada una muestra de suelo la cual fue analizada en el laboratorio de la facultad de Ingeniería Agrohidráulica de la Benemérita Universidad Autónoma de Puebla, Méx.
Aislamiento y caracterización morfológica de los géneros Fusarium y Trichoderma
Se tomaron 10 g de suelo de cada muestra los cuales fueron diluidos en 90 mL de Tween 80 al 0.05%, de la dilución obtenida, 1 mL fue depositado en 9 mL de Tween 80 al 0.05% para obtener una segunda dilución. De ambas diluciones 100 μL fueron extendidos con un triángulo de vidrio sobre medio de cultivo Komana (K2) y papa dextrosa y agar (PDA). De cada dilución y medio de cultivo se realizaron tres repeticiones las cuales fueron incubadas a 30 °C por 48 y 72 h en oscuridad. Trascurrido este tiempo todas y cada una de las colonias con características morfológicas de trichoderma y Fusarium fueron contada y aislada en medio nuevo (Chaverri et al., 2003; García-Núñez et al., 2016; Sánchez-López et al., 2012).
Cuantificación de Fusarium y Trichoderma
Cantidad de UFC g-1 de suelo en medio PDA y K2: antes del aislamiento en medio nuevo y para facilitar el conteo Trichoderma sp. y Fusarium oxysporum de cada repetición hecha y por cada medio de cultivo usado (PDA y K2), se dividió cada una de las cajas Petri en 4 partes iguales y en cada cuadrante se contaron las colonias existentes, posteriormente se realizó el cálculo de UFC por caja y evaluó la eficacia de cada uno de los medios.
Cantidad de UFC g-1 de suelo con respecto a las labores culturales: la cantidad de colonias aisladas también se analizó con respecto a las labores culturales hechas (barbecho y control de maleza) contra ninguna labor realizada.
Cantidad de UFC g-1 con respecto a las temporadas de colecta de muestras y las condiciones climáticas: se eligió el mes de diciembre como primera temporada de colecta de muestras y el mes de abril como segunda temporada con la finalidad de comparar el efecto de las condiciones climáticas, precipitación, temperatura, humedad relativa y radiación solar presentes en estas dos temporadas sobre la cantidad de UFC existentes en suelo en cada una de las partes muestreadas de la parcela. Para el análisis de resultados obtenidos de UFC g-1 en cada caso se hizo una prueba de comparación de medias con un análisis de varianza (Anova) usando el paquete estadístico SAS 9.0 para Windows.
Determinación de la presencia de Fusarium oxysporum f. sp. cubense raza 1
Para corroborar la presencia la raza 1 de Fusarium oxysporum, se inocularon plantas de plátano manzano (AAB) por cada aislado con 1X 106 UFC. Las plantas fueron resguardadas en invernadero, 7 días después de infección fueron evaluadas de manera cualitativa en una escala de 1-5 (1= sin daño; 2= puntos aislados en el tejido vascular; 3= decoloración hasta de un tercio del tejido vascular; 4= decoloración mayor a un tercio del tejido; y 5= decoloración total del tejido (Dita et al., 2011), para lo cual se cortó trasversal la base del cormo y observó en la decoloración de los tejidos vasculares.
Identificación molecular y determinación de diversidad de Trichoderma y Fusarium entre especies y dentro de la especie más abundante
Para la identificación, determinar la abundancia y diversidad de los géneros estudiados se inició con la extracción de ADN de los aislados de 14 días de edad, sembrados en disco de celofán sobre medio ADS, e incubados a 30 ºC, el micelio obtenido fue almacenado en tubos eppendorf de 2 mL y liofilizado en un liofilizador Labconco®.
Porciones de 0.05 g de micelio seco liofilizado fueron maceradas con un pistilo en tubos enfriados con nitrógeno líquido. Posteriormente, se procedió de acuerdo con las instrucciones del Kit Dneasy plant mini kit de la marca Qiagen. La calidad de ADN obtenido de cada aislado fue determinada con un nanodrop Thermoscientific, modelo Nanodrop 2000C, visualizado mediante un gel de agarosa en un transiluminador UVP, modelo: 3UV-LMS26 y fue almacenado en un congelador a -7 °C, para la amplificación por PCR.
El ADN obtenido de cada aislado de Fusarium oxysporum y Trichoderma sp. fue amplificado por reacción en cadena de la polimerasa (PCR) para el gen factor de elongación EF1-(. Para el caso de Fusarium oxysporum se usaron los primers: TEF1 y TEF2, con un kit para amplificación de PCR de la marca GoTaq®, Promega Corporation, Madison, WI, USA, para lo cual se utilizaron 9.5 μL de trealosa al 10%, 5 μL de Buffer 5x, 10 mM de dNTPs, 2.5 mM μL-1 de MgCl2, 1 μM de cada primer, 5 U μL-1 de Taq DNA polimerasa y 15 a 20 ng mL-1 de ADN, para un volumen final de mezcla de 25 μL, la cual se amplificó a 1 ciclo de 95 °C por 2 min, 10 ciclos de 94 °C por 30 s, 66 °C (Touchdown -1 °C → 56 °C) 30 s y 72 °C por 1 min, 36 ciclos de 94 °C por 30 s, 56 °C por 36 s y 72 °C por 1 min y un ciclo de 72 °C por 10 min.
Para el caso de Trichoderma sp., se utilizaron los iniciadores EF1-728F y EF1-986R descritos por Carbone y Kohn (1999) utilizando una mezcla similar a la descrita para Fusarium oxysporum, con el programa de amplificación de 1 ciclo de 94 °C por 5 min, 35 ciclos de 94 °C por 30 s, 56 °C por 30 s y 72 °C por 1 min y un ciclo de 72 °C durante 10 min (Sánchez López et al., 2012) Todas las muestras se amplificaron en un termociclador Mastercycler personal (Eppedor®) y sus productos de PCR obtenidos se visualizaron en gel de agarosa al 2%, buffer TAE (1X) más 10 μL de bromuro de etidio el cual fue expuesto a 80 V en una cámara de electroforesis Thermocientific.
Los productos amplificados fueron monitoreados con un marcador de peso molecular de 100 bp DNA Ladder®, Promega Corporation, Madison, WI, USA, purificados y secuenciados por los laboratorios Macrogen Inc. (Geumchen-gu, Seoul, Korea). Las secuencias fueron editadas con el programa BioEdit v 7.1.9 (Hall, 1999). Los árboles filogenéticos fueron generados mediante un análisis de máxima verosimilitud (Máximum Likelihood, ML) y vecino más cercano (Neighbor Joining) usando Mega v.5 (Tamura et al., 2011), seguido por un análisis ‘bootstrap’ con 1 000 repeticiones.
El cálculo de las medias de diversidad interpoblacional así como la intrapoblacional fueron obtenidos con un bootstrap de 1 000 réplicas, incluyendo en el análisis 21 secuencias de nucleótidos para Trichoderma sp. y 20 para Fusarium oxysporum con el programa MEGA v.5. Para tener una aproximación molecular de la variabilidad genética dentro de la especie más abundante (Trichoderma spirale) se midió el polimorfismo de ocho de sus aislados: VB7IT1, VB28IT1, VB2IT2, VB8IT2, VB11IT2, VB24IT2, VB25IT2, VB29IT2, mediante la genotipificación de los marcadores ISSR: (GA)9C, (GA)9T, (CA)8RG, (ACC)9 y (GTG)5, los cuales fueron seleccionadas previamente por su polimorfismo (66 a 100%) de acuerdo a Thangavelu et al. (2013); Nirmaladevi et al. (2016). Los marcadores ISSR fueron sintetizados por Integrated ADN Technologies.
Las amplificaciones fueron realizadas en un volumen final de 25 (L de reacción, conteniendo 1X buffer para PCR, 0.2 mM de dNTPs, 1.5-2.5 mM de MgCl, 0.5 (M de cada primer, 1 unidad de Taq DNA Polimerasa (GoTaq®, Promega Corporation, Madison, WI, USA) con 20 ng de ADN genómico. Las condiciones térmicas de las reacciones fueron 94 ºC por 5 min seguido por 40 ciclos de 30 s de desnaturalización a 94 ºC y de 48 a 64 ºC por 45 s de alineamiento, 1.3 min de extensión a 72 °C y una extensión final a 72 ºC por 7 min. Los productos de PCR fueron separados por electroforesis en un gel de agarosa grado molecular de alta resolución (Sigma-Aldrich®, Sigma-Aldrich Corporation, Inc.) al 3% mas 10 (L de bromuro de etidio a 45 V por 4 h, usando un marcador molecular de 50 bp (HyperLadder®, BioLine USA Inc. Tauton, Ma, USA).
Resultados y discusión
Aislamiento y caracterización morfológica de los géneros Fusarium y Trichoderma
Se lograron obtener 29 aislados en la primera temporada, 16 pertenecientes a Fusarium sp. y 13 pertenecientes a Trichoderma sp., mientras que en la segunda temporada de muestreo se logró un total de 20 aislados, seis pertenecientes a Fusarium sp., y 14 pertenecientes a Trichoderma sp., y una a Hypocrea lixii (Cuadro 3 y 4).
En los aislados de Fusarium oxysporum se observaron clamidosporas aisladas, conidióforos cortos en monofiálides, los macroconidios con tres o cuatro septos trasversales fusiformes o en forma de canoa, microconidios abundantes en micelio aéreo, mientras que para el género Trichoderma conidióforos subglobosos, atenuados en la punta, las clamidosporas unicelulares de forma globosa encontradas en forma intercalar y terminal, conidios de forma elipsoidal y tonalidad verde. Caraterística sque coinciden con las descrita por Chaverri et al., (2003).
Cuantificación de Fusarium y Trichoderma
Cantidad de UFC g-1 de suelo en medio PDA y K2: se observó la presencia de Trichoderma sp. en las muestras tomadas en ambas temporadas y ambos medios; sin embargo, fue difícil su conteo debido a su rápido crecimiento, lo que provocó la pérdida de la forma de la colonia, generando duda si ésta provino de una o más esporas. Al respecto Al-Sadi et al. (2015) afirman que las especies de Trichoderma sp., se caracterizan generalmente por su rápido crecimiento y capacidad para sobrevivir en condiciones ambientales variables, además de variar su diversidad de especies de un sustrato a otro.
Por otra parte, el análisis de varianza mostró diferencias significativas (p< 0.001) entre los promedios obtenidos de los tratamientos. De acuerdo a la prueba de diferencia mínima significativa (LSD) se identificó al PDA como el que mostró mejor resultado en el aislamiento en ambos muestreos (con y sin labor) en comparación con el medio K2 en cuanto a crecimiento y desarrollo de Fusarium oxysporum; es decir, existió un valor promedio mayor a 200 UFC g-1 de suelo, mientras que los tratamientos con medio K2 el promedio fue de entre 50 y 100 UFC g-1 de suelo (65% más alta en PDA que la cantidad encontrada en el medio K2) (Figura 1).
Esto sugiere que el medio PDA proporciona los niveles apropiados de nutrientes, así como las condiciones adecuadas durante el desarrollo de ambos hongos (López et al., 2004), mientras que el K2 a pesar de que cuenta con una gran cantidad de elementos nutrimentales se ve afectado por otros factores tales como pH, fungicidas y antibióticos como lo menciona Komada (1975) limitando su desarrollo.
Sin embargo, aunque autores como Bragulat et al. (2004) mencionan que Fusarium sp., no tiene grandes limitaciones en el crecimiento en medio artificial existen componentes que afectan su esporulación característica (López et al., 2004). En este caso la tonalidad de las colonias de Fusarium obtenidas en PDA fue muy similar entre géneros en las primeras 48 h de emergencia, lo que hizo difícil el conteo de UFC.
Estudios similares fueron obtenidos por Benaouali et al. (2014) al trabajar con Fusarium oxysporum f. sp radicis lycopersici, quienes observaron un mejor crecimiento y pigmentación de esporas en el medio PDA en comparación con otros medios evaluados. De aquí la importancia del rápido crecimiento y esporulación en los medios de cultivo utilizados debido a que favorecen la temprana identificación de los hongos evitando que las UFC se unan.
Aunque en este estudio hubo fluctuación en el número de UFC aisladas por sitio muestreado, ésta se presentó en ambos medios usados durante el proceso de aislamiento. Estos resultados, sugieren que existen otros factores no analizados en el estudio que afectan las cantidades de UFC específicamente por sitio de suelo que no tienen relación alguna con el medio de cultivo. Resultados similares fueron obtenidos por Jiménez-Fernández et al. (2010) quienes al hacer estudios de identificación y cuantificación de Fusarium oxysporum en suelo encontrando que, en muestras obtenidas directamente de suelos de campo, las poblaciones variaron en algunas de sus réplicas de aislamiento comparado con suelos infestados artificialmente.
Cantidad de UFC g-1 de suelo con respecto a las labores culturales: el análisis estadístico mostró diferencias significativas (p= 0.0352) entre los tratamientos, y al menos dos de ellos fueron diferentes (Cuadro 1). El tratamiento sin labor y con medio PDA obtuvo la mayor concentración de UFC g-1 de suelo con una diferencia del 68% mayor al tratamiento cuatro.
Cuadro 1 Análisis del efecto de labores culturales sobre la cantidad de UFC g-1 de suelo.
| Tratamiento | (UFC g-1 de suelo) |
| 1. Sin labor +PDA | 420 a |
| 2. Sin labor +K2 | 270 ab |
| 3. Con labor +PDA | 270 ab |
| 4. Con labor +K2 | 135 b |
| LSD | 176.28 |
Medias con letras iguales no son estadísticamente diferentes, según la prueba LSD.
Sin embargo, aunque la concentración que se obtuvo en los tratamientos varió entre ellos, estadísticamente los tratamientos uno, dos, tres y dos, tres, cuatro fueron similares indicando la falta de valores que muestren la eficacia de las labores culturales. Se observó el efecto de prácticas de manejo agrícola, como reincorporación de residuos de plantas senescentes y aplicación de fungicidas cambiando la estructura y diversidad genética de las comunidades de Fusarium.
Las plantas en descomposición como fuente de nutrientes de Fusarium, el cual puede crecer saprofiticamente generando mayor abundancia y distribución de especies en el suelo. Sin embargo, es necesario mencionar, que en su estudio ellos muestrearon por cinco años estos suelos, a diferencia del presente estudio donde solo se muestrearon dos temporadas en un año, resultando diferencia en los datos obtenidos.
Cantidad de UFC g-1 con respecto a las temporadas de colecta de muestras y las condiciones climáticas: la mayor cantidad de UFC en el suelo se detectó en el muestreo realizado en el mes de diciembre (primera temporada) en comparación del mes de abril donde se observa una disminución drástica de cantidad de UFC, e incluso en ésta última temporada no se encontraron esporas presentes en algunos puntos muestreados (Cuadro 2).
Cuadro 2 Cantidad UFC g-1 presentes en medio PDA y variables climáticas del municipio.
| Características | Diciembre (2017) | Abril (2018) |
| UFC g-1 de suelo (medio PDA) | 1098.62 | 297.93 |
| UFC g-1 de suelo (medio K2) | 180 | 74.48 |
| Precipitación (mm mes-1) | 116.2 | 276.8 |
| Temperatura media (°C) | 19.38 | 24.34 |
| Humedad relativa (%) | 86.09 | 86.83 |
| Radiación (W m-2) | 323.14 | 386.14 |
Estos resultados coinciden con el aumento de la temperatura, precipitación y radiación solar en la segunda temporada de recolección de muestras. La temperatura y precipitación presentes en las temporadas de muestreo pueden tener influencia significativa en la diversidad de especies de hongos en una determinada área.
Al respecto, Benaouali et al. (2014), también recalca la importancia de la temperatura en el óptimo crecimiento de las poblaciones de F. oxysporum f. sp radicis lycopersici en el suelo. No obstante,
Aunque en ambas temporadas de estudio los cambios en la humedad relativa fueron casi nulos se presentó mayor radiación solar en la segunda temporada la cual coincidiendo también con una disminución de la cantidad de UFC, en este contexto Pinkerton (2000) mencionan que la cantidad de radiación solar absorbida reduce la densidad de población de hongos encontrados sobre los 30 cm de la superficie del suelo.
Determinación de la presencia de Fusarium oxysporum f. sp. cubense raza 1
Se observaron tres plantas con los cormos ligeramente necrosados, una de éstas fue inoculada por F. oxisporum f. sp. cubensis, mientras que los dos restantes fueron inoculados con F. oxisporum f. sp. melonis de acuerdo a la identificación resultado de las pruebas PCR de éstos aislados. De acuerdo a Dita et al. (2018) los cultivares susceptibles como el grupo AAB muestran síntomas o daños más graves que las variedades con resistencia intemedia cuando se cultivan en condiciones ambientales similares y dependiendo de la presión del inóculo y las condiciones ambientales la enfermedad en la planta puede ser observada tempranamente.
Identificación molecular y determinación de diversidad genética de Trichoderma y Fusarium entre especies y dentro de la especie más abundante
La amplificación de los productos de PCR permitieron visualizar en el gel de agarosa 700 bp para el género Fusarium sp. y 350 bp para Trichoderma sp. Las secuencias de especies identificadas se registraron en el National Center for Biotechnology Information (BCNI) (Cuadro 3 y 4). Se observó mayor abundancia de especies en la primera temporada a diferencia de la segunda.
Cuadro 3 Aislados obtenidos en la primera temporada de muestreo.
| Muestra | Aislado | Especie | NCBI |
| 1 | VB1IF1 | Fusarium oxysporumvoucher | MK087011 |
| 2 | VB2IF1 | Fusarium oxysporumf. sp.radicis-cucumerinum | MK087012 |
| VB2IIF1 | Fusarium oxysporumf. sp.pisi | MK087013 | |
| 6 | VB6IT1 | Trichoderma spirale | MK086990 |
| 7 | VB7IF1 | Fusarium oxysporumf. sp. | MK087014 |
| VB7IT1 | melonis Trichoderma spirale | MK086984 | |
| 8 | VB8IT1 | Trichoderma longibrachiatum | MK086985 |
| 9 | VB9IT1 | Trichoderma harzianum | MK086986 |
| 10 | VB10IF1 | Fusarium oxysporumf. sp.melonis | MK087015 |
| VB10IT1 | Trichoderma parareesei | MK086987 | |
| 13 | VB13IF1 | Fusarium oxysporumf. sp.melonis | MK087031 |
| 14 | VB14IF1 | Fusarium oxysporumf. sp.radicis-cucumerinum | MK087016 |
| 15 | VB15IF1 | Fusarium oxysporumf. sp.melonis | MK087017 |
| VB15IIF1 | Fusarium oxysporumf. sp.pisi | MK087018 | |
| VB15IT1 | Trichoderma longibrachiatum | MK086988 | |
| 16 | VB16IT1 | Trichoderma longibrachiatum | MK086989 |
| 19 | VB19IF1 | Fusariumsp. | MK087019 |
| 20 | VB20IF1 | Fusariumsp. | MK087020 |
| 21 | VB21IF1 | Fusarium oxysporumf. sp.melonis | MK087021 |
| VB21IT1 | Trichoderma orientale | MK086997 | |
| 22 | VB22IF1 | Fusariumsp | MK087022 |
| VB22IIF1 | Fusarium oxysporumf. sp.melonis | MK087023 | |
| 25 | VB25IT1 | Trichoderma longibrachiatum | MK086998 |
| 26 | VB26IF1 | Fusarium oxysporum | MK087024 |
| VB26IT1 | Fusarium oxysporumf. sp.melonis | MK086991 | |
| 27 | VB27IF1 | Fusarium oxysporumf. sp.radicis-cucumerinum | MK087025 |
| VB27IT1 | Trichoderma longibrachiatum | MK086992 | |
| 28 | VB28IT1 | Trichoderma spirale | MK086999 |
| 29 | VB29IT1 | Trichoderma longibrachiatum | MK086993 |
National Center for Biotechnology Information (BCNI)
Cuadro 4 Aislados obtenidos en la segunda temporada de muestreo.
| Muestra | Aislado | Especie | NCBI |
| 2 | VB2IT2 | Trichoderma spirale | MK087001 |
| VB2IIT2 | Trichoderma spirale | MK087002 | |
| 3 | VB3IF2 | Fusarium oxysporumf. sp.cubense | MK087032 |
| 6 | VB6IF2 | Fusariumsp. | MK087026 |
| VB6IT2 | Hypocrea lixii | MK087033 | |
| 7 | VB7IF2 | Fusarium oxysporumf. sp.vasinfectum | MK087027 |
| 8 | VB8IF2 | Fusariumsp. | MK087028 |
| VB8IT2 | Trichoderma spirale | MK087003 | |
| 9 | VB9IF2 | Fusarium oxysporum | MK087029 |
| 10 | VB10IT2 | Trichoderma parareesei | MK087004 |
| VB10IIT2 | Trichodermasp. | MK087005 | |
| 11 | VB11IT2 | Trichoderma spirale | MK087006 |
| 15 | VB15IT2 | Trichoderma spirale | MK086994 |
| 18 | VB18IT2 | Trichoderma koningiopsis | MK086995 |
| 21 | VB21IT2 | Trichoderma hamatum | MK086996 |
| 22 | VB22IF2 | Fusarium oxysporum | MK087030 |
| VB22IT2 | Trichoderma koningiopsis | MK087007 | |
| 24 | VB24IT2 | Trichoderma spirale | MK087008 |
| 25 | VB25IT2 | Trichoderma spirale | MK087000 |
| 27 | VB27IT2 | Trichoderma spirale | MK087009 |
| 29 | VB29IT2 | Trichoderma spirale | MK087010 |
National Center for Biotechnology Information (BCNI).
La especie que se encontró en mayor abundancia en la primera temporada fue Fusarium oxysporum f. sp. melonis con 20%, mientras que en la segunda no se encontró esta forma especial y solo se obtuvieron cuatro muestras con el género Fusarium, aislándose de una de ellas Fusarium oxysporum. f. sp. cubense (Figura 2 y 3). De acuerdo a Suárez-Estrella (2004), este hongo es capaz de sobrevivir en residuos de cosecha, en este caso se encontró en mayo, y en suelo donde no se realizaron labores de cultivo.
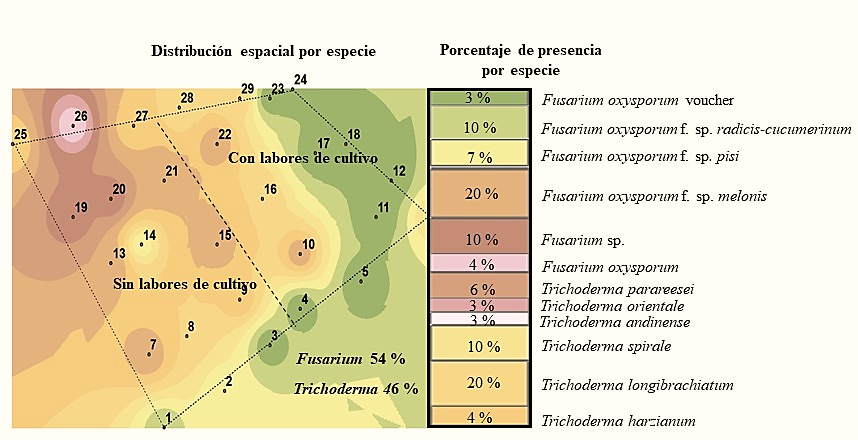
Figura 2 Especies de los géneros Trichoderma y Fusarium detectadas en el suelo en la primera temporada de muestreo.
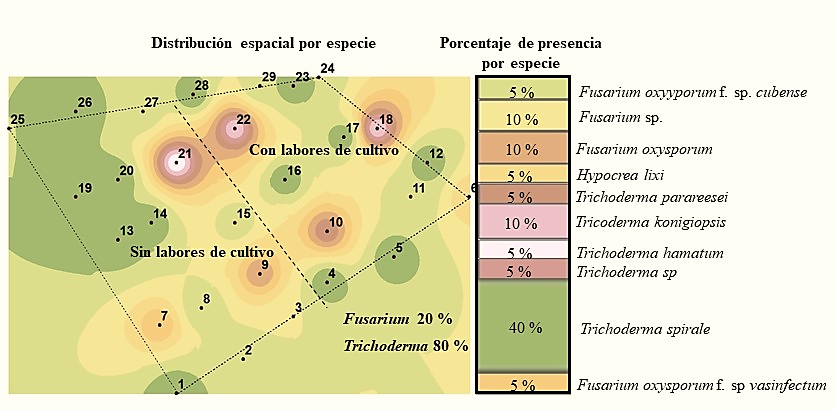
Figura 3 Especies de los géneros Trichoderma y Fusarium detectadas en el suelo en la segunda temporada de muestreo.
Sin embargo, en la segunda temporada de muestreo hubo una reducción tanto del género Fusarium como de las mencionadas especies (Figura 2 y 3) y se observó el mantenimiento de la densidad de población del género Trichoderma con 20% de presencia de Trichoderma longibrachiatum en la primera temporada y 40% de Trichoderma spirale en la segunda; es decir, dos veces más la presencia de ésta última especie. En este contexto, las especies del género Trichoderma tienen una alta capacidad saprofítica mientras que la mayoría de las especies de Fusarium son fitopatógenas por lo que su grado de adaptación es diferente (Maina et al., 2016).
Las secuencias de ADN analizadas para un Bootstrap arriba de 80% inferidas de máxima parsimonia (MP), máxima Likelihood (ML) y Neighbour Joining (NJ) mostraron un arreglo filogenético para ambos géneros (Figura 4 y 5) el cual agrupó secuencias de aislados de ambas temporadas con 99% de similitud; sin embargo, no mostró la relación entre el parentesco y su presencia por temporada o con las labores de cultivo.

Figura 4 Filogenia de especies de Fusarium oxysporum como resultado del análisis de datos de EF1-∝. Valores de bostrap arriba de 80% inferencia de máxima parsimonia (MP), máxima likelihood (ML) y Neighbour Joining (NJ). El círculo azul es el aislado se obtuvo del área con labores de cultivo, mientras que el verde indica que el aislado fue obtenido de suelo sin labores de cultivo.
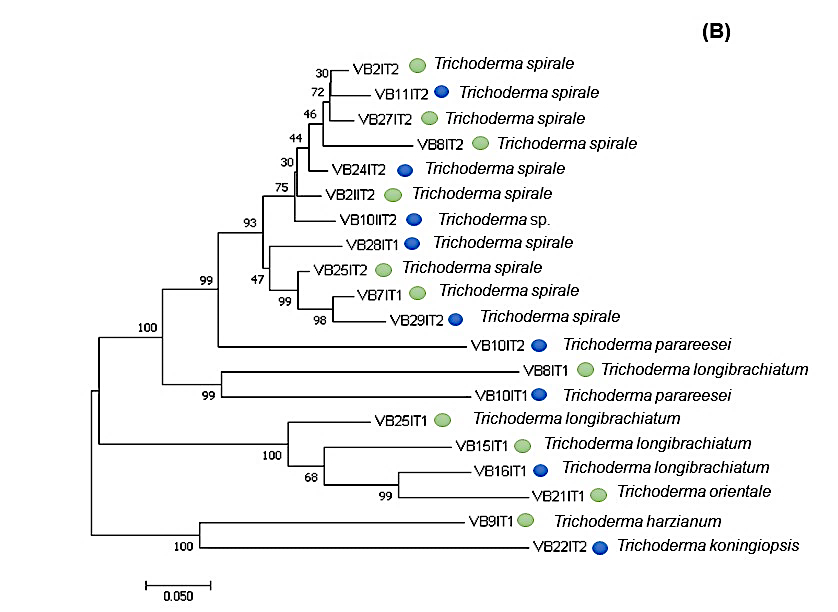
Figura 5 Filogenia de especies de Trichoderma sp. como resultado del análisis de datos de EF1-∝. Valores de bostrap arriba de 80% inferencia de máxima parsimonia (MP), máxima likelihood (ML) y Neighbour Joining (NJ). El círculo azul indica que el aislado se obtuvo de área donde se realizaron labores de cultivo, mientras que el círculo verde indica que el aislado fue obtenido de suelo sin labores de cultivo.
Estos resultados también mostraron una mayor diversidad genética de especies del género Trichoderma con una media de la diversidad interpoblacional de 5.75 obtenidos de 20 secuencias de siete poblaciones del género Trichoderma y un coeficiente de diferenciación de 4.27 obtenidos de un bostrap de 1 000 réplicas. Mientras que para Fusarium la diversidad interpoblacional tuvo una media de 2.14 con un coeficiente de diferenciación de 4.66 obtenido de 21 secuencias de ocho poblaciones pertenecientes al género.
De acuerdo a estudios realizados por Maina et al. (2016) encontraron una correlación negativa entre la ocurrencia y diversidad de Trichoderma sp. y Fusarium sp., en áreas no disturbadas observaron una alta abundancia de Trichoderma sp. y baja ocurrencia de Fusarium y contrariamente en áreas disturbadas donde hubo mayor ocurrencia de Fusarium que Trichoderma sp. En este sentido nosotros observamos una mayor cantidad de especies tanto de Fusarium como de Trichoderma sp. en suelos sin realizar labores de cultivo habiendo una reducción para el género Fusarium al hacer labores de cultivo y poca influencia de esas labores en la cantidad de especies de Trichoderma (Figura 4 y 5).
Los resultados de diversidad de los ocho aislados de Trichoderma spirale, que fue la especie que presentó mayor abundancia mostraron una baja diversidad intrapoblacional observada en la expresión de los locis, debido a que sólo en el aislado VB28IT1 obtenido del sitio 33 se amplificaron bandas las cuales mostraron un tamaño entre 75 a 500 bp.
En esté aislado un total de siete bandas fueron amplificadas de cinco ISSR; una del fragmento GA9T, cinco del fragmento ACC6 y una del GA9C mientras que los fragmentos CA8RG y GTG5 no presentaron amplificación en ninguna de los aislados. Dos poblaciones o más que desciende de un ancestro en común, presentan frecuencias alélicas idénticas a su ancestro. Esto es posible al analizar poblaciones viviendo en espacios medianamente pequeños en los cuales existe poca incidencia de factores o barreras que influyan en la presión de selección genética dentro de la especie.
Conclusiones
En este estudio se reitera la importancia del uso adecuado del medio de cultivo para el aislamiento de especies de los géneros Trichoderma y Fusarium en suelo, debido a que de éste depende en gran medida la veracidad de resultados al hacer estudios de densidad poblacional, así como de abundancia y diversidad de especies. Sin embargo, en estudios a campo abierto el efecto de los factores climáticos, así como el de las labores culturales y las épocas de extracción de muestras, también influyen en este tipo de estudios.
Encontrando en estos resultados una mayor diversidad y abundancia de especies de ambos géneros en suelos donde no se realizan labores de cultivo, además de la escasa influencia de esas labores en la cantidad de especies de género Trichoderma, el cual mostró una sucesión de T. longibrachiatum por T. spirale de la primera a la segunda temporada. Esta sucesión y dominio exponen la actividad de biocontrol, la cual pude mantener la estabilidad de las poblaciones del género Fusarium, especialmente F. oxysporum f. sp. cubense en plátano.











 texto en
texto en 



