Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 no.6 Texcoco ago./sep. 2015
Artículos
Producción del hongo Shiitake (Lentinula edodes Pegler) en bloques sintéticos utilizando residuos agroforestales*
Production of mushroom Shiitake (Lentinula edodes Pegler) in synthetic blocks using agroforestry wastes
Omar Romero-Arenas1, Marco A. Martínez Guerrero†, Miguel A. Damián Huato1§, Benito Ramírez Valverde2 y J. Francisco López-Olguín1
1 Benemérita Universidad Autónoma de Puebla (BUAP). Centro de Agroecología-Instituto de Ciencias. 14 sur 6301. C. U. 72570 Puebla, Pue. Tel: 222 22 95 50. (biol.ora@hotmail.com; damianhuato@hotmail.com; olguin33@hotmail.com).
2 Colegio de Postgraduados Campus Puebla. Carretera Federal México-Puebla km 125.5, 72760, Puebla, Puebla. (bramirez@colpos.mx). §Autor para correspondencia: damianhuato@hotmail.com.
* Recibido: febrero de 2015
Aceptado: junio de 2015
Resumen
El cultivo de hongos comestibles es una alternativa importante para satisfacer las necesidades alimenticias de la población, desarrollo agrícola y formación de agroindustrias en muchos lugares del mundo. Dentro de los hongos comestibles, el Shiitake posee propiedades alimenticias y medicinales importantes para la industria al utilizar los residuos agrícolas y forestales como sustrato para su producción. El objetivo de este estudio fue evaluar las fórmulas C-Agro1, 2 y 3 en la producción del hongo Shiitake, utilizando la cepa CP-CA1 de Lentinula edodes (Pegler) en bloques sintéticos, conformados por residuos agroforestales de la Sierra Norte del estado de Puebla, como es el aserrín de encino (Quercus sp.), restos de tallos y hojas (rastrojo) así mismo, olote triturado de maíz (Zea mays). La cepa CP-CA1 demostró un adecuado crecimiento miceliar sobre los bloques sintéticos, con una tasa de producción de 0.38, 0.33 y 0.31% para C-Agro1, 2 y 3 respectivamente. La mayor eficiencia biológica (EB) se obtuvo en la en la formula C-Agro2 a los 265 días de producción, con 100.50%. La presencia de cuerpos fructíferos fue de 85% de forma regular y con un peso aproximado entre 40 a 70 g por unidad. Los resultados demostraron la factibilidad de cultivar la cepa CP-CA1 de Lentinula edodes sobre residuos agroforestales de la sierra norte del estado de Puebla.
Palabras clave: eficiencia biológica (EB), residuos agroforestales, Shiitake, tasa de producción (TP).
Abstract
The cultivation of edible mushrooms is an important alternative to meet the nutritional needs ofthe population, agricultural development and training of agro-industries in many parts of the world. Within edible mushrooms, the shiitake mushroom has important nutritional and medicinal properties for the industry by using agricultural and forestry wastes substrate for production. The aim of this study was to evaluate the formulas C-Agro1, 2 and 3 in the production of shiitake mushroom, using the strain CP-CA1 of Lentinula edodes (Pegler) in synthetic blocks, made up with agroforestry wastes ofthe Sierra Norte, State Puebla, such as sawdust oak (Quercus sp.), remnants of stalks and leaves (stover) as well as crushed corn cobs (Zea mays). The CP-CA1 strain showed adequate mycelial growth on the synthetic blockes, with a production rate of 0.38, 0.33 and 0.31% for C-Agro1, 2 and 3 respectively. The largest biological efficiency (EB) was obtained in the in the formula C-Agro 2, at 265 days of production, with 100.50%. The presence of fruiting bodies was 85% regularly and weighing approximately 40 to 70 g per unit. The results demonstrated the feasibility of growing the CP-CA1 of Lentinula edodes strain on agroforestry wastes from the northern sierra of Puebla.
Keywords: agroforestry waste, biological efficiency (EB), production rate (TP), Shiitake.
Introducción
El cultivo de hongos comestibles en América Latina ha ido en aumento en los últimos años, datos reportados por Martínez-Carrera et al. (2012) muestran que el período comprendido entre 1995-2001 aumentó la producción en32%; es decir; de 49 975 a 65 951 ton de hongo fresco por año. Dentro de los países más destacados en la producción de hongos comestibles, se encuentran: México con el 58.6%, Chile con 17.6% y Brasil con 10.6% que representan 86.8% del total de la producción de hongos comestibles de América Latina. El cultivo de Lentinula edodes (Pegler), tuvo su origen alrededor de la década de los 80's en Guatemala, Colombia y México (Chen, 2001).
Lentinula edodes pertenece a la familia Tricholomataceae, es originario de Asia, donde Japón y China concentran la mayor producción silvestre de esta seta. Posee propiedades alimenticias y medicinales importantes para el ser humano (Stamets, 1993; Chang and Miles, 2004; Nieto et al., 2012). Se destaca por sus características organolépticas, contiene el doble de proteínas que los vegetales y según Chimara (1993), tiene un componente conocido como lentinan; que ha demostrado ser un agente anti-infeccioso y anti-cancerígeno. Además, presenta glicemia, vitaminas esenciales como B1, B2, B6, B12, riboflavina, niacina, hierro y minerales que son activadores del sistema inmune y reducen el colesterol (Curvetto et al., 2002; Yen et al., 2007; Martínez et al., 2012; Suárez y Jeannette, 2013).
El cultivo del hongo Shiitake presenta ventajas económicas en su producción como: la utilización de residuos agrícolas y forestales, así como el precio en el mercado global, manejado por Japón, Taiwán y China. La explotación industrial y comercial del hongo Shiitake se ha extendido ampliamente en Europa y América, ocupando el tercer lugar en la escala de producción de hongos comestibles y medicinales del mundo (Campbell y Racjan, 1999; Moonmoon et al., 2011).
La producción de Shiitake sigue creciendo en el mundo entero, así como las diversas técnicas de cultivo; un claro ejemplo es el método desarrollado por cultivadores holandeses, quienes pasteurizan el sustrato utilizado en la producción del Shiitake en camas como las setas de botón blanco (Agaricus spp.), por esta razón no existe un método ideal de cultivo, sino más bien, una gran variedad de métodos desarrollados con diferentes limitaciones en la producción (Lou, 1981; Soto et al., 1992).
En México, se han adaptado y modificado las técnicas tradicionales para reducir el ciclo del cultivo y bajar los costos de producción al utilizar como substratos materiales antes no considerados, tales como la viruta y el aserrín de diferentes árboles, como el encino (Quercus sp.), pino (Pinus sp.), palo mulato (Bursera sp.) etc., (Mata et al., 1990; Morales y Martínez, 1990; Morales y Martínez, 1991) y varios residuos agrícolas como el maíz (Zea mays), caña de azúcar (Saccharum sp.) avena (Avena sativa) etc., (Soto et al., 1992; Mata y Guzmán, 1993; Mata y Gaitán, 1994; Ashrafuzzaman et al., 2009). Datos oficiales de 2006, establecen que en México se produjeron 75.73 millones de ton de materia seca proveniente de 20 cultivos, de los cuales 60.13 millones de ton corresponden a residuos primarios, obtenidos al momento de la cosecha, entre los que están: hojas y tallos del maíz, tallos y vaina de sorgo, puntas y hojas de caña de azúcar, paja de trigo, paja de cebada y de frijol, así como cáscara de algodón.
El resto, 15.60 millones de ton corresponden a residuos secundarios obtenidos del procesamiento post-cosecha, entre los que están: bagazo de caña de azúcar, mazorcas y olotes, bagazo de maguey o agave, así como pulpa de café (Valdez-Vázquez et al., 2010). En el estado de Puebla se generan alrededor de 22 200 t de residuos generados por las actividades pesqueras, agrícolas, silvícolas, forestales, avícolas y ganaderas (SSAyOT, 2012). Los residuos agroforestales que se generan en el campo Poblano, como los del maíz, trigo, sorgo, avena, cebada y aserrín proveniente de maderas de pino, encino, sajo, ilite, etc., presentan gran cantidad de nutrientes para los hongos, que son capaces de metabolizarlos eficientemente (Shimomura y Hasebe, 2004).
En este trabajo se presenta un método para la producción del hongo Shiitake en bloques sintéticos conformados por residuos agroforestales más abundantes de la Sierra Norte del estado de Puebla; como es el aserrín de encino, rastrojo y olote triturado de maíz, además de utilizar grano de sorgo como inóculo para la cepa CP-CA1 de Lentinula edades.
Materiales y métodos
El trabajo experimental se realizó en la Fábrica de hongos rural "Nanacatlán" ubicada en calle Huachinango Núm.10, colonia la Paz, C. P. 72160 en la ciudad de Puebla, México.
a) Cepa
La cepa (CP-CA-1) de Lentinula edodes (Pegler) empleada en el estudio, proviene de Hong Kong y se encuentran depositada y mantenida en medio de cultivo PDA (Agar Papa Dextrosa) en el Centro de Recursos Genéticos del Centro de Agroecología del Instituto de Ciencias de la BUAP.
b) Preparación de inóculo de la cepa CP-CA1 de Lentinula edodes Pegler
El medio de cultivo empleado para el desarrollo del micelio es agar de papa y dextrosa (PDA, Bioxon), donde se preparó siguiendo las indicaciones del proveedor. Posteriormente, bajo condiciones asépticas en una cámara de flujo laminar (Vecco, México), el medio de cultivo se vertió en cajas de Petri estériles de plástico de 90 mm de diámetro, cada una con aproximadamente 20 mL de PDA. Las cajas de Petri se inocularon con rodajas de 5 mm diámetro del medio de cultivo previamente colonizado con la cepa CP-CA1 y se incubaron a 28 °C por 10 días (Romero et al., 2010a).
c) Preparación de la semilla madre {Masters)
El inóculo se preparó utilizando 1 kg de semilla de sorgo (Sorghum sp.), se lavó con agua esterilizada hasta eliminar los restos de basura del grano, una vez limpio, se hidrato por 24 h en una bandeja de plástico con capacidad de 3 L. Al término del tiempo de hidratación, se deja escurrir 30 min hasta eliminar el exceso de agua y tener al final una humedad de 50%, la cual fue determinada mediante un higrómetro digital; posteriormente se le adicionaron 20 g de yeso y 5 g de cal comercial, se homogenizaron para alcanzar un pH de 7.5 (Romero, 2007).
Se colocaron 500 g de mezcla final en 2 frascos con capacidad de 1000 mL y se esterilizaron durante 50 minutos a 121 °C. Cuando los frascos se enfriaron (24 h después), se procedió a la inoculación con pequeños trozos de agar de 3 cm de largo x 3 cm de ancho colonizados de la cepa CP-CA1 y se incubaron a temperatura ambiente durante 30 días.
d) Preparación de la semilla secundaria
El inoculo se preparó utilizando 10 kg de grano de sorgo estériles, se usó semilla madre de 30 días para su inoculación en una campana de flujo laminar; los frascos con micelio con textura algodonosa y micelio abundante se agitaron hasta fragmentar la compactación del mismo en los granos de sorgo. Se colocó la cantidad de 100 g de inóculo de semilla madre en el interior de bolsas termo resistente con capacidad de 2 kg, previamente preparadas como se describió anteriormente para obtener el Masters. En general, 1 kg de semilla madre, será suficiente para obtener 10 kg de semilla secundaria en un lapso de 45 días de incubación a temperatura ambiente. Al finalizar este proceso se obtiene el inóculo del sustrato que servirá para la producción de Lentinula edodes.
e) Preparación del sustrato con residuos agroforestales
La formulación experimental C-Agro1, 2 y 3, consistió en una mezcla de residuos agroforestales complementados con yeso comercial, cada formulación estuvo diseñada para preparar 100 kg de sustrato fresco, que sirvió para la producción del hongo Lentinula edodes, como se muestra en el Cuadro 1.

Una vez obteniendo las diferentes formulaciones, se llenaron bolsas de poli papel termo resistentes de 4 kg, se introdujo un tubo distribuidor de calor fabricado de PVC de 2 pulgadas de largo y 2.5 pulgadas de ancho (diámetro), colocando al final del tubo un tapón de espuma que permitió una mejor distribución de vapor en el proceso de esterilización por 60 min a 121 °C. Se dejó reposar por 24 h. Se inoculó en el sustrato, semilla secundaria con 45 días de incubación en una campana de flujo laminar; en proporción de 4 kg de sustrato por 1/2 kg de inóculo, se homogenizo y se incubo a 28 °C durante un periodo de 4 meses en condiciones de oscuridad.
Al término del periodo de incubación, los bloques sintéticos con las diferentes formulaciones se dejaron secar a sombra durante 12 h para ayudar a la compactación y aireación del mismo; una vez trascurrido el tiempo, se estimuló la aparición de cuerpos fructíferos a través de una inducción en frio por 24 h a una temperatura de 5 °C en un refrigerador industrial. Posteriormente las bolsas se trasladaron al cuarto de fructificación, donde se propiciaron condiciones apropiadas de humedad (70-80%), temperatura (26-28 °C), luz diurna indirecta y aeración (extracción de aire por 1 h, cada 8 h), en total se prepararon 75 bloques sintéticos distribuidos en 3 tratamientos, utilizando 300 kg de sustrato freso y 37.5 kg de semilla secundaria de la cepa CP-CA1.
f) Análisis estadístico
Los datos de producción considerados fueron: peso fresco de hongos colectados, así como el número de cosechas alcanzadas. Se evaluó la eficiencia biológica (EB= gramos de hongos frescos * 100 g de substrato seco) (Tschierpe y Hartmann, 1977) y la tasa de producción (TP= EB * tiempo transcurrido desde la inoculación hasta la última cosecha) (Reyes et al., 2004). Para obtener la tasa de biodegradación se aplicó la fórmula: TB= (peso seco del sustrato inicial - el peso seco del sustrato final / por el peso seco del sustrato inicial * 100), la productividad se expresó en términos de gramos de hongos frescos por el número de cosechas totales (Stamets, 1993; Romero et al., 2010b; Martínez et al., 2012). El rendimiento del porcentaje de utilidad, se calcula si se dividen los g totales del peso fresco de hongos entre los K del peso total del sustrato y se multiplican por 100, esto dará el porcentaje útil. Se utilizó el paquete estadístico SPSS Statistics versión 17 (Statistical Package for the Social Sciences), los datos obtenidos se procesaron con el análisis de varianza (ANOVA) y posteriormente se aplicó la prueba de comparaciones múltiples de Tukey (p≤ 0.05) para determinar las diferencias entre los tratamientos.
Resultados y discusión
Producción total de la Fórmula experimental C-Agro
La producción de la cepa CP-CA1 de Lentinula edodes Pegler, en los tratamientos evaluados, se efectuó de acuerdo a la metodología descrita anteriormente y duró entre 265 a 300 días en las diferentes formulaciones; desde la siembra del micelio en cajas de Petri, hasta la obtención de la tercera cosecha. En el Cuadro 2 se puede observar la duración de cada una de las etapas del ciclo de vida del cultivo del hongo Shiitake.

Para cuantificar el peso fresco de los carpóforos producidos, se realizaron tres cosechas en un lapso de 60 a 105 días de fructificación. La mayor producción total obtenida por cada 100 kg de sustrato orgánico en bloques sintéticos, se obtuvo en la formula C-Agro2 con 50.25 kg de hongo fresco, el segundo mejor corte se obtuvo en la formula C-Agro3 con 44.31 kg y la menor producción se observó en la fórmula C-Agro1 con 41.78 kg (Figura 1). Bernabé et al. (2006) obtuvieron una producción de 291.64 g en sustrato elaborado a base de pulpa de café, utilizando la cepa IE-40 de L. edodes y 232.5 g en el sustrato elaborado a base de bagazo de caña de azúcar con la cepa IE-105 de L. edodes, Martínez et al. (2012) obtuvieron 1 836.2 g de hongo fresco de la cepa CP-163 de L. edodes en el sustrato elaborado a base de 70% aserrín de Quercus sp. 10% de maíz, 10% de rastrojo de maíz, 7% de salvado de trigo y 3% de harina de arroz. Valores por debajo a los presentados en esta investigación.

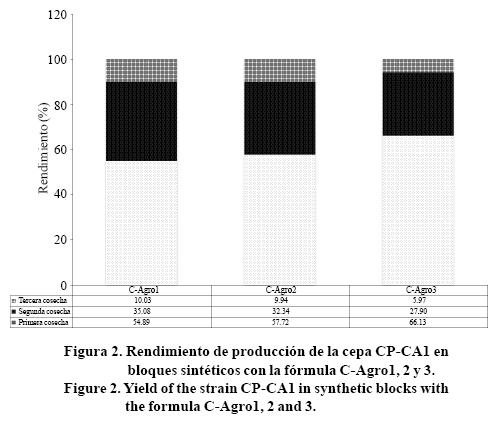
El mayor rendimiento en peso fresco del hongo Shiitake se obtuvo en la primera cosecha con 63.13% (2,762 g/kg) en la formula C-Agro3. En el segundo corte disminuyó para todos los tratamientos, no obstante la formula C-Agro1 presento un rendimiento de 35.08% (1 762 g/kg). Por último, la formulación C-Agro1 del tercer corte obtuvo un rendimiento de 10.03% (5 040 g/kg), del total de la producción (Figura 2), no obstante el mejor rendimiento por los tres cortes del hongo Shiitake se obtuvo en la formula C-Agro2 con 50 025 g de hongos frescos entre 100 kg total de sustrato.
Cuantificación de la eficiencia biológica (EB), tiempo de producción (TP) y tasa de biodegradación (TB).
La presente investigación, obtuvo valores de EB de 100.50, 88.63 y 83.55% en la formula C-Agro2, 3 y 1, respectivamente, superiores a los reportados por Morales y Martínez-Carrera, (1990) que encontraron eficiencias biológicas obtenidas en aserrín suplementado de Quercus sp. y Bursera sp. de 53.8 y 49.9%, con la cepa CP-7. Así mismo Bernabé et al. (2006) reportan eficiencias biológicas de 55.5% en sustrato elaborado a base de pulpa de café, utilizando la cepa IE-40 de L. edodes y 44.2% en el sustrato elaborado a base de bagazo de caña de azúcar utilizando la cepa IE-105 de L. edodes, menores a lo reportado en esta investigación.
La fórmula C-Agro2 presento la eficiencia biológica más alta, valores similares a los reportados por Martínez-Guerrero et al. (2012) donde obtuvieron EB de 103.02% en sustrato elaborado a base de 70% aserrín de Quercus sp., 10% de maíz, 10% de rastrojo de maíz, 7% de salvado de trigo y 3% de harina de arroz. En el Cuadro 3, se presenta la eficiencia biológica (EB) obtenida de la cepa CP-CA-1 de Lentinula edodes para 100 K de sustrato en bloques sintéticos con la fórmula C-Agro1, 2 y 3.
La tasa de producción (TP) obtenida en la presente investigación es de 0.38%, valores inferiores a los reportados por Martínez-Guerrero et al. (2012) donde obtuvieron TP de 1.30% en sustrato elaborado a base de 70% aserrín de Quercus sp., 10% de maíz, 10% de rastrojo de maíz, 7% de salvado de trigo y 3% de harina de arroz. La mayor tasa de biodegradación (TB) se establece en la fórmula C-Agro2 (49.85%), seguido de la fórmula C-Agro1 (49.6 %).
El mayor número de cuerpos fructíferos se encuentran entre 40 a 70 g (G2) representando 60% de la producción en cuanto a la calidad y peso de los hongos en fresco en la formula C-Agro2 (Cuadro 3). Valores similares a los reportados por Bernabé et al. (2006) para la cepa IE-40, donde predominó el G2 (60.2%), seguido por la formula C-Agro1 (55%) superiores a lo reportado por Mata y Hernández, (1994) para la cepa IE-105 (43.0%) y IE-40 (52.3%) obtenidos en la pulpa de café, pero inferiores a lo reportado por Salmones et al. (1999) en bagazo y en las hojas de caña de azúcar, donde predominó el G2 (57 y 63%, respectivamente) y en las brácteas de la corona de piña predominó el G3 (45%) similares para la formula C-Agro1 (40%). Las condiciones rurales de la planta experimental no afectaron la TP, TB y EB de la CP-CA1, ya que se obtuvieron cuerpos fructíferos de calidad de forma regular (85%) y solo 15% representa cuerpos fructíferos irregulares (Cuadro 3), en la formula C-Agro2.
Conclusiones
La fórmula experimental C-Agro2 como sustrato alternativo para la producción del hongo Shiitake (CP-CA1 de L. edodes Pegler) conformada por residuos agroforestales, pueden producir 100.48% de EB en 100 K de sustrato húmedo en 265 días de producción.
La fórmula experimental C-Agro2 a través el cálculo de la tasa de biodegradación indica que la CP-CA-1 de L. edodes, es capaz de convertir hasta 49.85% en alimento para el consumo humano.
La calidad de los hongos en frescos está representada por 60% de la producción total, obteniendo hongos de tamaño mediano entre los 40 y 60 g al utilizar la fórmula experimental C-Agro2. Calidad que busca el mercado local.
Agradecimientos
Los autores agradecen al Instituto de Ciencias por el apoyo brindado para realizar la presente investigación; así mismo, al Centro de Vinculación y Trasferencia de Tecnología de la BUAP por brindar el apoyo y registro en trámite de patente ante el IMPI de la formula C-Agro2, con número de solicitud MX-E-2013-071800, además los autores brinda un reconocimiento al Dr. Marco A. Martínez Guerrero, por su trayectoria en la producción de hongos comestibles a través de la fábrica de hongos rural "Nanacatlán" y ser pionero en el cultivo de Shiitake en Puebla-México, dejando enseñanzas en sus amigos, estudiantes y colaboradores; siempre le recordaremos como investigador y amigo. Descansa en paz Dr. Martínez-Guerrero (2014).
Literatura citada
Ashrafuzzaman, M.; Kamruzzaman,A.; Razi-ismail, M.; Shahidullah, S. and Fakir, S. 2009. Substrate affects growth and yield of shiitake mushroom. Afr. J. Biotechnol. 8(1):2999-3006. [ Links ]
Bernabé, G. T.; Mata, G.; Cayetano, C. and Gutiérrez, R. 2006. Cultivo experimental del hongo Shiitake, Lentinula edodes, sobre dos subproductos agrícolas en Guerrero, México. Rev. Mex. Micol. 23:63-68. [ Links ]
Campbell,A.C. and Racjan, M. 1999. The commercial exploitation of the white rot fungus Lentinula edodes (Shiitake). Int. Bio. Biodeg. 43(3):101-107. [ Links ]
Chang, S. T. and Miles, P. G. 2004. Mushrooms: cultivaation, nutritional value, medicinal effect, and environmental impact (Second Edition). Boca Raton, Fl: CRC Press. 451 p. [ Links ]
Chen, A. 2001. Cultivation of Lentinula edodes on Synthetic Logs. The mushroom growers' Newsletter. 10(4):3-9. [ Links ]
Chimara, G. 1993. Aspectos medico de lentinan aislado de Lentínus edodes (Berk). Singer, en Mushroom Bioiogy, concise Basics and current developments. Primera edición. Miles Philip & Chang Shu-Ting. World Scientific. Singapore. 114-116 pp. [ Links ]
Curvetto, N.; Figlas D. and Delmastro, S. 2002. Sunflower seed hulls as substrate for the cultivation of Shiitake mushrooms. Hort Technol. 12(4):652-655. [ Links ]
Lou, L. 1981. Production of black mushroom (Lentinus edodes). Beijing Agricultural University; Popular Science Publishing House; Beijing- China. 31-37 pp. [ Links ]
Martínez-Carrera, D. 2002. Current development of biotechnology in Latin Mushroom America. Micol. Apl. Int. 14(2):61-74. [ Links ]
Martínez, G. M. A.; Sihuanca, D.; Macías, L. A.; Pérez, L.; Martínez, M. D and López O. 2012. Characterization and production of Shiitake (Lentinula edodes) in Mexico using supplemented sawdust. Afr. J. Biotechnol. 11(46):10582-10588. [ Links ]
Mata, G. and Gaitán-Hernández, R. 1994. Avances en el cultivo del Shiitake en pulpa de café. Revista Iberoamericana de Micología 11:90-91. [ Links ]
Mata, G. and Guzmán, G. 1993. Cultivation of Lentinus boryanus in wood shaving in Mexico. Cryptogamic Bot. 4(1):47-49. [ Links ]
Mata, G.; Salmones, D. and Guzmán, G. 1990. Cultivo del Shiitake japonés, Lentinus edodes, en bolsas con viruta de madera. Rev. Mex. Micol. 6(1):245-251. [ Links ]
Moonmoon, M.; Jahan, N. S.; Asaduzzaman, K. M. D.; Nazim, U.; Hossain, K.; Tania, M. and Ahmed S. 2011. Effects of different levels of wheat bran, rice bran and maize powder supplementation with saw dust on the production of shiitake mushroom (Lentinula edodes (Berk.) Singer). Saudi J. Biol. Sci. 18:323-328. [ Links ]
Morales, P. and Martínez-Carrera. D. 1991. Bursera sawdust as a substrate for shiitake cultivation. Micol. Neotrop. Apl. 4:41-47. [ Links ]
Morales, P. and Martínez-Carrera, D. 1990. Cultivation of Lentinula edodes in Mexico. Micol. Neotrop. Apl. 3:13-17. [ Links ]
Nieto, R. J.; Rocío, R. L. and Suárez, A. C. 2012. Evaluación del estípite de Shiitake como aportante de fibra y bioctivos con miras a su empleo en alimentos funcionales. Vitae. 19(1):S331-S333. [ Links ]
Reyes, G. R.; Abella, A. E.; Eguchi, F.; Iijima, T.; Higaki, M. and Quimio, T. H. 2004. Growing paddy straw mushroom. In: mushroom grower's handbook 1; oyster mushroom cultivation. Mushroom World. Corea. 262-269 pp. [ Links ]
Romero-Arenas O.; Tello, S. I.; Huerta, L.; Damián, H.; García, A.; Parraguirre L.C.; Hernández, T.; Macias, L.; and Juárez, H. 2010a. Preparation of inoculum of Pleurotus ostreatus in laminar flow hood rustic. Sci. Res. Essays . 5(24):992-2248. [ Links ]
Romero-Arenas, O. 2007. Desarrollo tecnológico para controlar el moho verde (Trichoderma spp.) durante el cultivo comercial de los hongos comestibles (Pleurotus y Lentinula) en México. Tesis de Maestría en Ciencias. Colegio de Postgraduados. Campus Puebla. 136 p. [ Links ]
Romero-Arenas, O.; Huerta, L.; Damián H.; Macías, L. A.; Tapia, A.; Parraguirre L. C. and Juárez, H. 2010b. Evaluación de la capacidad productiva de Pleurotus ostreatus con el uso de hoja de plátano (Musa paradisiaca L., cv. Roatan) deshidratada, en relación con otros sustratos Agrícolas. Agron. Costarricense. 34(1):53-63. [ Links ]
Salmones, D.; Mata, G.; Ramos, L. M. and Waliszewski, K. N. 1999. Cultivation of Shiitake mushroom, Lentinula edodes, in several lignocellulosic materials originating from the subtropics. Agronomie. 19:13-19. [ Links ]
Secretaría de Sustentabilidad Ambiental y Ordenamiento Territorial Puebla (2012). Programa de Prevención y Gestión Integral de Residuos para el Estado de Puebla 2011-2017. En www.puebla.gob.mx. 10 p. [ Links ]
Shimomura. N. and Hasebe, K. 2004. Estimation of viability of inner bark tissue of Quercus serrata, a substrate for log cultivation of Lentinula edodes, using the TTC assay method. Mycoscience. 45:362-365. [ Links ]
Soto, V.C.; Fausto, S. and Guzmán-Dávalos, L. 1992. Cultivo del hongo de encino (Lentinus spp.) sobre una mezcla de bagazo de maguey tequilero y bagazo de caña de azúcar. In: Memorias I Congreso Centroamericano de Micología. Guatemala, C. A. [ Links ]
Stamets, P. 1993. Growing gourmet and medicinal mushrooms. Ten Speed Press. Hong Kong. 343-350 pp. [ Links ]
Suárez, A.C. y Jeannette, N. I. 2013. Cultivo biotecnológico de macrohongos comestibles: una alternativa en la obtención de nutracéuticos. El Servier. Rev. Iberoam. Micol. 30(1):1-8. [ Links ]
Tschierpe, H. and Hartmann K. 1977.A comparison of different growing methods. Mushroom J. 60:404-416. [ Links ]
Valdez-Vazquez, I.; Acevedo-Benitez, J. A. and Hernandez-Santiago, C. 2010. Distribution and potential of bioenergy resources from agricultural activities in Mexico. Renew. Sust. Energy Rev. 14:2147-2153. [ Links ]
Yen, Ming-Tsung M.; Jeng-Leun. 2007. Selected physical properties of chitin prepared from Shiitake stipes. El Servier "LWT - Food Sci. Technol. 40(3):558-563. [ Links ]














