Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 no.2 Texcoco feb./mar. 2015
Artículos
Calidad nutrimental y nutraceutica de hoja de moringa proveniente de árboles de diferente altura*
Nutraceutical and nutritional quality of moringa leaf from trees of different height
Salvador Horacio Guzmán-Maldonado1§, Alfredo Zamarripa-Colmenares y Lesly Guadalupe Hernández-Duran3
1 Programa de Biotecnología. Campo Experimental Bajío-INIFAP. Carretera Celaya-San Miguel Allende Celaya km 6.5, Guanajuato. C. P. 38110. México. Tel: 01 461 611 5323. Ext. 183.
2 Programa de Boioenergetios-Campo Experimental Izapa Chiapas. (zamarripa.algredo@inifap.gob.mx).
3 División de Ciencias de la Salud e Ingeniería, Campus Celaya-Salvatierra, Universidad de Guanajuato, Av. Juan Paplo II s/n, Celaya, Guanajuato, México. (lamaiki811@hotmail.com). §Autor para correspondencia: guzman.horacio@inifap.gob.mx.
* Recibido: junio de 2014
Aceptado: noviembre de 2014
Resumen
Recientemente la moringa se ha introdujo en Guanajuato; sin embargo, los arboles no crecen en forma uniforme, hay diferencias de hasta 225 cm. El objetivo fue evaluar la calidad nutrimental y nutracéutica de la hoja de árboles de diferente tamaño. Las hojas se cosecharon en abril de 2013 en la huerta recién introducida por el INIFAP en Celaya, Guanajuato. Se determinó la calidad nutrimental por su composición química y contenido de calcio y hierro y la calidad funcional por el contenido de vitamina C, compuestos fenólicos y capacidad antioxidante. El contenido de proteína de las hojas de los árboles de 100 cm fue mayor (24.7%) que el de los árboles de 25 (21.1%) y 250 cm (22.3%), y menor al de la muestra comercial de Oaxaca (29.3%). Cien gramos de hoja de los árboles de 25, 100 y 250 cm pueden contribuir con el 107, 91.7 y 74%, del requerimiento diario de vitamina C. La hoja de la moringa de los arboles es mejor fuente de calcio y hierro, vitamina C, fenoles, taninos que las muestras comerciales. Lo mismo se aplica para la capacidad antioxidante. La hoja de la moringa presenta mejores propiedades nutracéuticas que el perejil, orégano, tomillo y epazote. Estos resultados demuestran la falta de uniformidad al preparar las mezclas comerciales y que el manejo apropiado puede lograr mejorar la calidad de la hoja de moringa para propósitos comerciales. Este es el primer reporte de la calidad de la hoja de materiales mexicanos de moringa.
Palabras clave: antioxidante, calidad de la hoja, compuestos fenólicos, moringa, nutrimental.
Abstract
Moringa has been recently introduced in Guanajuato; however, the trees do not grow evenly, there are differences of up to 225 cm. The objective was to evaluate the nutritional and nutraceutical quality of leaf from trees of different sizes. The leaves were harvested in April 2013 in the newly-introduced garden by INIFAP in Celaya, Guanajuato. Nutritional quality for its chemical composition and content of calcium and iron and functional quality for vitamin C content, phenolic compounds and antioxidant capacity were determined. The protein content of the leaves from trees of 100 cm was higher (24.7%) than trees of 25 (21.1%) and 250 cm (22.3%), and lower than the commercial sample from Oaxaca (29.3%). One hundred grams of leaf from trees of 25, 100 and 250 cm can contribute with 107, 91.7 and 74% of the daily requirement of vitamin C. Moringa leaf of the tree is a better source of calcium and iron, vitamin C, phenols, tannins than the commercial samples. The same applies for antioxidant capacity. Moringa leafhas better nutraceutical properties than parsley, oregano, thyme and epazote. These results show the lack of uniformity in preparing commercial mixtures and appropriate management can achieve better quality of moringa leaf for commercial purposes. This is the first report on the quality of leaf from Mexican materials of moringa.
Keywords: antioxidant, leaf quality, moringa, nutritional, phenolic compound.
Introducción
El árbol de moringa (Moringa oleífera) es originario del sur de los Himalayas y el noroeste de la India y pertenece a la familia de las Moringaceas. Esta especie crece en zonas tropicales por debajo de los 500 msnm; sin embargo, puede adaptarse a las condiciones edafo-climáticas por arriba de los 1 500 msnm en ausencia de heladas (Olson y Fahey, 2011). Se cree que la especie fue introducida a México por los marineros filipinos que llegaban al puerto de Acapulco y que de ahí se extendió hasta su actual distribución por toda la costa del Pacífico, desde el sur de Sonora hasta Chiapas, incluyendo el sur de la península de Baja California (Olson y Fahey, 2011). La planta es muy versátil pudiéndose aprovechar todas sus partes. Por ejemplo, las semillas se han utilizado en la medicina tradicional, como floculante para purificar agua o para la producción de aceite (Rashid et al, 2008; Del Toro, 2011). Las vainas son utilizadas como alimento y fertilizante y también se le atribuyen propiedades medicinales al igual que las flores, hojas, corteza y raíces (Fahey, 2005).
La hoja de la moringa ha sido utilizada para consumo humano y animal por su alto contenido de proteínas, vitaminas y minerales. Se ha demostrado de aumenta el rendimiento de carne en animales y puede combatir la desnutrición de poblaciones infantiles y maternales desprotegidas (Fahey, 2005; Anwar et al, 2007; Moyo et al, 2011). También se ha reportado que la hoja tienen un efecto antiparasitario y curativo en animales (Anwar et al., 2007). Sin embargo, la variación considerable en las propiedades nutrimentales de la moringa es considerable y depende de factores genéticos, medio ambiente y métodos de cultivo (Brisibe et al, 2009).
En los últimos años la hoja seca de la moringa se ha vuelto muy popular en México y otros países particularmente para preparar infusiones (tés) a los que se les atribuyen propiedades anti escleróticas (Chumarka et al., 2008), antioxidante (Verma et al, 2009) y para bajar de peso (dicho popular). A la hoja de la moringa y los tés se le atribuyen otras propiedades benéficas como antimicrobiana, antibacteriana, antiviral, antiparasitaria, contra el cáncer, anti anémica, antidiabética y antidiurética, entre otras características (Fahey, 2005).
El cultivo de la hoja de la moringa fue introducido por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) en el estado de Guanajuato en 2012. Sin embargo, se ha observado que el crecimiento de los árboles no es uniforme, presentando un rango muy amplio en su altura. Este comportamiento no se observa en los trópicos donde las condiciones climáticas son óptimas y los arboles presentan un crecimiento y en consecuencia, un estado fenológico, uniforme. Dado que las hojas de estos árboles se cosechan para ser procesadas y comercializadas en el mismo estado fenológico, la calidad nutrimental y nutracéutica debe ser uniforme y de calidad aceptable. Por el contrario, la hoja del estado de Guanajuato se cosecha de árboles que van de 25 y 250 cm de alto. La mezcla de hojas proveniente de árboles en estados fenológicos tan opuestos pudiera afectar la calidad de los productos a ofrecer al consumidor.
Se desconoce si la composición nutrimental y nutracéutica se ve afectada cuando se mezclan hojas de árboles con diferente estado fenológico. Esta información permitiría conocer la calidad de los productos de la moringa provenientes de Guanajuato que se ofrecen al consumidor. El objetivo de este trabajo fue evaluar el efecto del tamaño del árbol sobre la calidad nutrimental y nutracéutica de la hoja de moringa. Los resultados podrán ser utilizados por los programas de mejoramiento de la especie así como los productores de hoja de moringa que tengan la intención de introducir el cultivo fuera de las zonas tropicales.
Materiales y métodos
Material biológico
Los árboles de la huerta localizada en Celaya, Guanajuato, se separaron por su altura en tres grupos: 25, 100 y 250 cm. Por otro lado, la huerta se dividió en seis áreas para abarcar todo el plantío. En cada una de las seis áreas se cosecho hoja por separado de acuerdo a la altura de los árboles. La hoja fue cosechada en el mes de abril de 2013 a primera hora de la mañana. Inmediatamente después de la cosecha la hoja se trasladó al laboratorio para secarse a la sombra hasta una humedad de 5% y se almacenó a -20 °C hasta su análisis. Después de secarse, las hojas se mezclaron perfectamente por separado según la altura de los árboles haciendo un total de seis repeticiones (n= 6). Con fines comparativos se tomaron seis muestras de un lote de hojas previamente preparadas por los encargados de la huerta que será identificada como MPH (muestra preparada en la huerta). Este lote de hojas de moringa se preparó con hojas cosechadas indiscriminadamente de diferente tamaño de árbol, inclusive de hojas de cosechas anteriores que no salieron al mercado. También se adquirió una muestra comercial proveniente de la zona tropical del sur de Oaxaca.
Calidad nutrimental
El contenido de nitrógeno (ref. 960.52), extracto etéreo (ref. 920.85) y ceniza (ref. 923.03) fue determinado con métodos aprobados por la AOAC (2000). La fibra dietaria fue determinado por el método de Prosky et al. (1988). El porcentaje restante se consideró que representaba a los carbohidratos. El factor de conversión de nitrógeno a proteína total fue de 6.25 (N x 6.25). El hierro y calcio se determinaron después de someter la hoja de moringa a una digestión con HClO4/HNO3, con un equipo de emisión atómica (3000SC, Perkin Elmer, Wellesley, MA, USA).
Calidad funcional
Vitamina C
La vitamina C fue determinada por cromatografía líquida de alta resolución (HPLC) de acuerdo con el procedimiento descrito por Corral-Aguayo et al. (2008). Brevemente, a una muestra de hoja (1 g) se le añadieron 10 mL de una solución de extracción (ácido cítrico 0.1 M y 0.05% de EDTA a pH 2.35-2.4), se agitó, centrifugó (5000 rpm, 10 min) y se recuperó el sobrenadante. Posteriormente se tomaron 1.5 ml del extracto y se le adicionó 0.5 ml de 1, 2-fenilendiamina preparada en metanol/agua (5:95 v/v) y se incubó por 37 min en la oscuridad. Transcurrido este tiempo, la muestra se filtró a través de una membrana de nylon de 0.45 μm y se inyectó al equipo de HPLC. Se utilizó una columna SB-C-18 marca Zorbax (150 X 4.6 mm) y cetrimida (5 mM) (hexadecyltrimethylammonium bromide) y KH2PO4 50mM (metanol/agua, 1:9, v/v, pH 4.6) como fase movil. El flujo fue de 1.5 ml/min. El ácido ascórbico fue monitoreado a 261 nm y el dehidroascórbico a 348. Para la determinación se realizaron curvas de calibración para cada uno de los estándares. El contenido de vitamina C se reporta como la suma del ácido ascórbico y el dehidro ascórbico en mg/100 g de muestra seca. Comparando con el tiempo de retención y el espectro de estándares comerciales (SIGMA).
Fenoles solubles totales
Para la determinación de los fenoles solubles totales se utilizó el método de Folin-Ciocalteu (Singlenton et al, 1999). El extracto crudo se obtuvo añadiendo a 50 mg de hoja 20 ml de metanol (30%) en agua desionizada. Posteriormente la muestra se agitó por 10 minutos a 8 000 rpm; transcurrido este tiempo, se centrifugó por10 min (5 000 rpm) y el sobrenadante se recuperó. Se tomó una alícuota de 125 μL del extracto crudo y se le adicionaron 500 μL de agua desionizada y se volvió a agitar unos segundo (3 000 rpm). Posteriormente se le añadieron 125 μL de reactivo de Folin-Ciocalteu. La muestra se dejó reposar en la obscuridad por 6 min y luego se le agregaron 1.25 ml de Na2CO3 (7% en agua) y 1 ml de agua desionizada. La muestra se volvió a brevemente y se dejó reposar en la obscuridad durante 90 min. Después del reposo, se leyó la absorbancia a 750 nm en un espectrofotómetro (JENWAY 6405, UV/Vis). Junto con la muestra se preparó un blanco con la misma cantidad de reactivo, pero sin el extracto crudo y el reactivo de Folin. Las lecturas de las muestras se compararon con una curva estándar de ácido gálico y se reportaron como miligramos equivalentes de ácido gálico por 100 gramos de muestra seca (mg EAG/100 g, bs).
Taninos condensados
Estos compuestos fueron determinados con el método de la vainillina a partir de un extracto crudo obtenido a partir de 1 g de hoja seca a la cual se le añadieron 10 ml de metanol absoluto (Deshpande y Cheryan 1985). La muestra se agitó (8 000 rpm, 20 min), se adicionó 1 g de carbón activado, se centrifugó (5 000 rpm, 10 min) y se recuperó el sobrenadante. Los taninos condensados se determinaron en 1 ml del extracto crudo al que se le adicionaron 5 ml de reactivo de vainillina recién preparado (vainillina 1% en metanol y ácido clorhídrico 8% en metanol 1:1). Se dejó reposar en baño María durante 20 min a 30 °C. Inmediatamente después se leyó la absorbancia de la muestra a 500 nm en un espectrofotómetro. Al mismo tiempo se preparó un factor de corrección con 1 ml del extracto crudo al que se le añadieron 5 ml de ácido clorhídrico (4%) en metanol en lugar del reactivo de vainillina. Los taninos condensados se cuantificaron comparando las lecturas con una curva estándar de catequina y se reportaron como mg equivalentes de catequina (mg EC)/100 g de muestra seca.
Compuestos fenólicos simples
El análisis de HPLC de los compuestos fenólicos se efectuó con una separación en fase reversa que se llevó a cabo en una columna Zorbax octadecilsilano (ODS)-C18 (tamaño de partícula de 5 μm, 15 cm * 4.6 mm i.d.). Además de la columna se usó también una precolumna Zorbax ODS-C18. Las condiciones de la fase móvil fueron idénticas a las empleadas por Ramamurthy et al. (1992): la fase móvil corrió a 1.5 ml min-1 y consistió en: solvente A: ácido acético/agua (2:98 v/v) y solvente B: ácido acético /acetonitrilo/agua (2:30:68 v/v). Durante el análisis, el gradiente del solvente fue programado de 10 a 100% de B en A en 30 minutos. El detector UV se programó a 280 nm y el volumen de inyección fue de 20 μL. Todos los solventes utilizados fueron filtrados a través de membranas de 0.45 μm. Los distintos ácidos fenólicos se cuantificaron de acuerdo a sus equivalentes en comparación con el tiempo de retención y espectros de absorción de estándares de compuestos fenólicos comerciales (SIMGA) y se reportaron como mg/100 g de muestra seca.
Capacidad antioxidante
ORAC. El extracto crudo (EC) para determinar la capacidad antioxidante contra radicales de oxígeno se obtuvo con 50 mg de muestra seca a la que se le adicionaron 5 ml de acetona:agua (1:1 v/v). La muestra se sonicó por 10 min, se agitar, centrifugó (5 000 rpm, 10 min) y se recuperó el sobrenadante (EC) que se almacenó en frasco ámbar a 4 °C. Para estandarizar al EC, se diluyeron 15 μL del mismo con 1985 μL de una solución amortiguadora de fosfatos (SAF) (71 mL de fosfato de sodio monobásico 0.2 M, 304 mL de fosfato de sodio bibásico 0.2 M, aforados a 900 ml, pH 7.4) (extracto crudo diluido, ECD). Se comprobó que la capacidad antioxidante del ECD decayera en un lapso de tiempo menor a un estándar de Trolox a 40 μM y en un tiempo mayor a un estándar de Trolox a 10 μM (Ou et al, 2001). Cuando no se lograron estas condiciones, se modificó la proporción del EC y la SAF. Para determinar la capacidad antioxidante del ECD, se tomaron 1.5 ml de una solución de fluoresceína (7.7 μL de solución madre de fluoresceína 0.5315 mM en 50 ml de la SAF) y se colocaron en una celda de cuarzo.
En la misma celda se agregaron 0.75 ml del ECD. La celda se colocó en baño María por 5 min a 37 °C; a continuación se agregaron 0.75 ml de solución de AAPH (2,2'-azobis (2-amidinopropano) HCL); 0.415 g de AAPH en 10 ml de la SAF) recién preparado y se agitó perfectamente. Se tomó la primera lectura en el fluorómetro (λexcitación= 493 y λemisión= 515) y la muestra se regresó al baño María. La muestra se continuó leyendo cada minuto hasta que el valor de la lectura correspondió a 10% del valor inicial. Se corrió un blanco de la misma forma pero sin la muestra problema. Se cuantifico la capacidad antioxidante comparando con una curva de calibración de Trolox y los resultados se expresaron en micro moles equivalentes de Trolox por gramo de muestra seca μmol ET/g, bs) de acuerdo con las siguientes fórmulas:
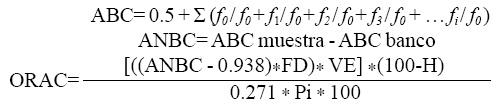
Donde: ABC= área bajo la curva; ANBC= área neta bajo la curva, f0 = fluorescencia al tiempo 0; fi = fluorescencia al tiempo i; ORAC= capacidad antioxidante; FD= factor de dilución; VE= volumen de extracción; H= humedad; Pi= peso inicial de la muestra.
TEAC. Para la obtención del extracto crudo (EC) para la determinación de la capacidad antioxidante equivalente a Trolox, se pesaron 20 mg de hoja molida, se adicionaron 5 mL de acetona:agua (1:1 v/v), se sonicó por 10 min y se centrifugó a 5 000 rpm por 5 min. El sobrenadante (EC) se recuperó y almacenó en un frasco ámbar. El radical ABTS+ se preparó disolviendo 0.0038 g de ABTS en 1 ml de persulfato de potasio 2.45 Mm en agua desionizada. Ésta solución se preparó 12 h antes de ser usada y se almacenó a 4° C en frasco ambar. Para determinar la capacidad antioxidante, se tomaron 0.15 ml de la solución del radical ABTS+ y se diluyo con 14 ml de solución amortiguadora de fosfato (8 g de NaCl, 0.2 g de KCl, 1.44 g de N2HPO4 y 0.24 g de KH2PO4 en 1 litro de agua destilada, pH 7.4), con una absorbancia de 0.7 a 734 nm. Por otro lado, a 990 μL de la solución del radical ABTS+ se le midió la absorbancia (ABS) (t= 0M) e inmediatamente se añadieron 100 μL del EC y se tomó la lectura a los seis min a 734 nm (t= 6M). Se corrió un blanco bajo las mismas condiciones pero sin el EC y se midió la ABS al tiempo 0 (t= 0S) y a los 6 min (t= 6S). La capacidad antioxidante de las muestras se calculó comparando con una curva de Trolox y se reportó como μmol ET/g, bs con base en las siguientes fórmulas (Van den Berg et al., 1999):
Absorvancia neta (AN)= (ABS a t= 0M -ABAa t= 6M) - (ABS a t= 0S - ABS a t= 6S)
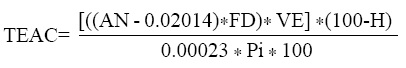
Análisis estadístico
Los datos de todas las pruebas fue el resultado de la media de seis repeticiones (n= 6). Se obtuvieron los análisis de varianza (Anova) y las pruebas de comparaciones de medias (Tukey) con un nivel de significancia de P < 0.05, utilizando el programa SAS para Windows versión 9.1.
Resultados y discusión
Composición química. El contenido de proteína de las hojas de moringa aquí analizadas es menor al reportado para muestras de Pakistan (27.1%) (Dhakar et al, 2011), África (30.3%) (Moyo et al, 2011) y Nicaragua (25.1%) (Makkar y Becker, 1996). Mientras que el contenido de aceite fue igual al reportado por Makkar y Becker (1996) (5.4%) pero menor al reportado por Dhakar et al. (2011) (2.3%) y la fibra de los materiales aquí analizados fue mayor a muestras de Pakistan (19.2%) (Dhakar et al, 2011) y de África (25.8%) (Moyo et al., 2011). Por otro lado, el contenido de proteína de las hojas de los arboles con una altura de 100 cm fue mayor en comparación con el contenido de las hojas de los árboles de 25 y 250 cm, pero menor al de la muestra comercial proveniente de Oaxaca (Cuadro 1). Este comportamiento no se observó en el contenido de fibra dietaria, extracto etéreo y ceniza que se incrementa con la altura del árbol. La muestra previamente preparada en la huerta MPH (ver materiales y métodos) presentó un menor contenido de todos los componentes químicos analizados. Estos resultados demuestran la falta de uniformidad al preparar las mezclas en la huerta. También sugiere que con un manejo cuidadoso se pueden tener lotes de mejor calidad para su comercialización.
Con respeto al contenido de proteína y fibra de la muestra comercial (MC), su contenido fue mayor en comparación con el resto de las muestras. Con base en estos resultados y las diferencias en la composición química en la hoja de moringa de otros países, aparentemente hay un efecto de la localidad sobre la proteína y la fibra. Sin embargo, los resultados aquí reportados no permiten concluir lo anterior. Sería deseable llevar a cabo un estudio al respecto para el mejoramiento de la especie. Por otro lado, no obstante las diferencias en la composición nutrimental de las hojas de moringa reportadas en este trabajo, cualquiera de las muestras contiene en promedio 9.4 veces más proteína y fibra que la espinaca (2.86 y 2.2%, respectivamente), col (1.28 y 2.5%, respectivamente), acelga (1.8 y 1.6%, respectivamente) y alcachofa (3.27 y 5.4%, respectivamente) (USDA, 2007).
Es importante resaltar el alto contenido de aceite de la hoja de la moringa en comparación con otras hojas comestibles como la acelga, espinaca y alcachofa que no es mayor a 0.5% (USDA, 2007). Es deseable determinar el perfil de ácidos grasos de los materiales Mexicanos aquí analizados para conocer el aporte de ácidos grasos omega, sobre todo porque se ha reportado que el aceite de la hoja de la moringa es rico en ácido α-linolenico (44.6%) el cual tiene un efecto positivo importante sobre la salud (Moyo et al, 2011).
Contenido de minerales. El contenido de calcio encontrado en las hojas de la moringa cosechadas en los arboles con las tres alturas diferentes y en la muestra MH fue mayor al reportado para hoja de moringa de Ghana (166-2200 de calcio mg/100 g bs (de Saint Sauveur y Broin, 2010); mientras que la hoja del árbol de 100 cm fue mayor en el contenido de hierro que muestras de Ghana (18-23 mg/100 g, bs). Por otro lado, el contenido de calcio y hierro en las hojas de los árboles de 100 cm de altura fue mayor que en el resto de las muestras (Cuadro 2). Lo cual confirma que puede producirse lotes de alta calidad nutrimental que pueden ser ofertadas por estas características.

Para el calcio y hierro, se volvió a observar el mismo comportamiento ya discutido en la composición proximal, es decir, la hoja de la muestra MPH presentó el menor contenido de estos minerales en comparación con la hoja proveniente de los árboles de 25, 100 y 250 cm, lo que demuestra una menor calidad de este producto (Cuadro 2). Por otro lado, en general, todas las muestras producidas en Guanajuato presentan más del doble del contenido de calcio en comparación con la muestra proveniente de Oaxaca. Con respecto al contenido de hierro de las hojas de los árboles de 100 y 250 cm, estas presentan hasta 2.6 más hierro que las hojas provenientes de Oaxaca. Estas diferencias podrían atribuirse al contenido de calcio, hierro y otros minerales presentes en el suelo donde se cultiva la moringa en Guanajuato; sin embargo, no se tienen información sobre el contenido de minerales para el suelo donde está sembrada la moringa utilizada en este estudio. No obstante, se ha reportado que el calcio y hierro entre otros minerales, así como diversas condiciones del suelo afectan la acumulación de calcio, hierro y zinc (Frossad et al, 2000).
Desde el punto de vista de la nutrición, el contenido de calcio en 25 g de hoja del árbol de 100 cm cubre el requerimiento diario de este mineral que es de 1 000 mg (Anderson y Allen, 1999). Sin embargo, se sabe que el calcio puede llegar a inhibir la biodisponibilidad del hierro cuando está presente en dosis de hasta 300 mg (Hurrell y Egli, 2010); los niveles de calcio presentes en 100 g de hoja de moringa pueden inhibir hasta en un 83% de la biodisponibilidad del hierro, no obstante este alto nivel de inhibición, 100 g de la hoja proveniente del árbol de 100 cm de altura podría cubrir 33% del requerimiento diario de hierro que es de 15 mg (Anderson y Allen, 1999), contemplada la inhibición por el alto contenido de calcio. Esto es de suma importancia para adultos o niños que viven en áreas rurales y cuya dieta está basada principalmente en plantas y productos derivados de estas, que los pone en riesgo de padecer deficiencias en su crecimiento y desarrollo.
Vitamina C. El ácido L-dehidro ascórbico presenta actividad biológica y puede ser convertido fácilmente a ácido L-ascórbico por los humanos, la suma de ácido ascórbico y L-dehidro ascórbico se toma como el contenido de vitamina C (Corral-Aguayo et al, 2008). El contenido de ácido ascórbico y dehidro ascórbico disminuyo en las hojas de los árboles conforme aumenta la altura (Cuadro 3). Sin embargo, en todos los casos el contenido de vitamina C (ascórbico + dehidro ascórbico) fue mayor en la hoja de los árboles de 25, 100 y 250 cm en comparación con la muestra MPH y la MC. Se sabe que la vitamina C es muy sensible a la temperatura por lo que es muy probable que el manejo controlado de la hoja de los árboles de diferente altura que se tuvo en preparación de este trabajo (cosechada por la mañana y traída inmediatamente al laboratorio para secarse a la sombre) haya contribuido a evitar la pérdida de esta vitamina. Por el contrario, los datos sugieren que el secado o el manejo de la hoja pos cosecha de las muestras MPH y MC no fue adecuado presentándose pedidas importantes en esta vitamina.
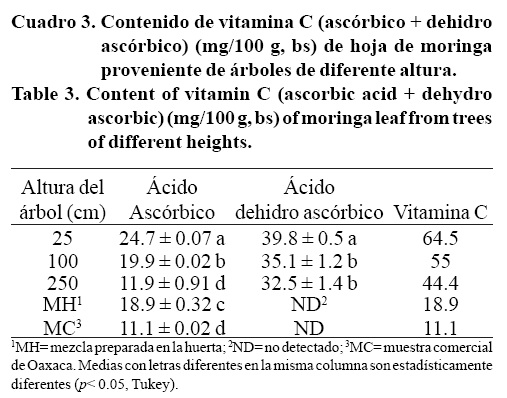
El contenido de vitamina C reportado en este trabajo fue menor al reportado para hoja de Ghana (120 mg/100 g) (de Saint Sauveur y Broin, 2010); este comportamiento se deba muy probablemente a la diferencia en el sitio de siembra, los ecotipos analizados y el manejo poscosecha. Nutricionalmente hablando, el requerimiento mínimo recomendado de vitamina C para un adulto es de 60 mg (Padh, 1994); por lo tanto, 100 g de hoja proveniente de los árboles de 25, 100 y 250 cm pueden contribuir con el 107, 91.7 y 74%, respectivamente, del requerimiento diario de esta vitamina. Además, se ha reportado que la vitamina C incrementa la biodisponibilidad del hierro siendo antagónico al efecto inhibitorio que el calcio, polifenoles y ácido fítico tienen sobre el hierro (Hurrell y Egli, 2010). A pesar de que no se ha definido la cantidad de vitamina C que debe estar presente para anular este efecto, el alto contenido de vitamina C en la hoja de la moringa es importante en la nutrición y puede contribuir a mantener una buena salud.
Contenido de fenoles totales y taninos condensados. El contenido de fenoles totales y taninos condensados en la hoja de moringa se incrementó con la altura del árbol de 2.9 a 4.7 g EAG/100 g (bs) y de 21.9 a 31.7 mg EC/100 g bs, respectivamente (Cuadro 4). El contenido de fenoles totales de la hoja de la moringa son casi el doble al reportado para perejil (Petroselinum crispum) (1.89 g EAG/100 g, bs) orégano (Origanum vulgare) (1.75 g EAG/100 g, bs) hierbabuena (Mentha spicata) (1.41 g EAG/100 g, bs) y albahaca (Ocimum basilicum) (0.56 g EAG/100 g, bs) (Rodríguez et al, 2006). Este alto contenido de fenoles totales se puede explicar dado que estos metabolitos secundarios se sintetizan en las plantas básicamente como un mecanismo de protección contra patógenos y predadores (Bravo, 1999); el alto contenido de proteína, aceite y otros compuestos causan que la moringa sea particularmente susceptible al ataque de enfermedades y animales como ardillas y topos así como de hormigas.
Los niveles de fenoles totales reportados en este trabajo son similares a los reportados por Gupta et al. (1989); mientras que el relativamente bajo contenido de taninos reportados aquí concuerda con lo reportado por Gupta et al. (1989) y Makkar y Becker (1997). Por otro lado, las hojas de las muestras MPH y MC presentaron menor contenido de fenoles totales y taninos condensados que las hojas de los árboles de 100 y 250 cm que demuestra que bajo condiciones controladas se pueden generar lotes de hojas de mejor calidad desde el punto de vista de la salud. En este sentido, se ha demostrado que los fenoles totales en particular y los taninos condensados presentan una alta capacidad antioxidante, característica altamente deseable en alimentos nutracéuticos que pueden contribuir a mejorar la salud (Balasundram et al., 2006).
Capacidad antioxidante. La capacidad antioxidante TEAC y ORAC presentaron una correlación altamente significativa con el contenido de fenoles totales y taninos condensados ((r= 0.9944, p< 0.001; r= 0.8567, p< 0.001, respectivamente). Lo que demuestra que los compuestos fenólicos juegan un papel importante en las propiedades benéficas de la hoja de la moringa. Estos resultados son de interés desde el punto de vista de la salud, ya que la capacidad antioxidante de un alimento está relacionada con mecanismos intracelulares antioxidantes y enzimas antioxidantes que están involucradas en la prevención de enfermedades crónicas que resultan del estrés oxidativo. En este sentido, el método de ORAC medir la capacidad de la hoja de la moringa de inhibir radicales de oxigeno altamente reactivos y los más abundantes en el cuerpo humano y por lo tanto fuente de muchos desordenes fisiológicos.
La alta capacidad antioxidante ORAC de la hoja de la moringa en comparación con la hoja del orégano (25 μmol ET/g, bs) y del tomillo (222.5 μmol ET/g, bs) (Mercado et al, 2013) permite concluir que la hoja de la moringa presenta propiedades nutracéutica de mucho interés y puede contribuir en la prevención de enfermedades crónico degenerativas. Igualmente, la alta capacidad antioxidante TEAC, que mide la capacidad de los fenoles de donar electrones para apagar compuestos antioxidantes, en comparación con el epazote (31.5 μmol ET/g, bs), Ginko biloba (438.4 μmol ET/g, bs), perejil (60 μmol ET/g, bs) y perejil (380 μmol ET/g, bs) (Mercado et al, 2013), contribuye a las propiedades benéficas de la hoja de la moringa en relación con la salud.
Debe subrayarse la baja calidad nutracéutica de la muestra comercial de hoja de moringa proveniente de Oaxaca, la cual presenta los menores contenidos de fenoles totales, taninos condensados y menores niveles de capacidad antioxidante ORAC en comparación con el resto de las muestras.
Conclusiones
Este es el primer reporte de la calidad de la hoja de moringa de material introducido a un área geográfica no especificada para su cultivo. Igualmente, existen pocos o ningún trabajo que reporte la calidad nutrimental y nutracéutica de la hoja de moringa de materiales mexicanos. Comparando con los resultados reportados para la hoja de moringa de otros países y la muestra comercial de Oaxaca, los materiales analizados en este trabajo presentan menor contenido de proteína, pero mayor contenido de fibra, hierro, calcio y compuestos fenólicos, particularmente en los árboles de 100 cm de altura. Lo que demuestra que la hoja de Guanajuato puede competir ventajosamente en el mercado.
Los lotes producidos por la huerta pueden ser de mejor calidad en sus propiedades nutrimentales y nutracéuticas si se aplican buenas prácticas de cosecha. Lo que podría darle ventajas en su comercialización.
Literatura citada
Anwar, F.; Muhammad, A. S. L. and Anwarul, H. G. 2007. Moringa oleífera: a food plant with multiple medicinal uses. Phytother. Res. 21:17-25. [ Links ]
Anderson, J. J. B. and Allen, J. C. 1999. Nutrition of macro elements and trace elements. In: Golberg I, (Ed.). Functional foods: designer foods, pharmafood, nutraceuticals. New York: Chapman & Hall. 323-54 pp. [ Links ]
AOAC (The Association of Official Analytical Chemists). 2000. Official methods, Assoc. Off. Anal. Chem. Int. (AOAC), Arlington, VA, U.S.A., 2000. [ Links ]
Balasundram, N.; Sudram, K. and Samman, S. 2006. Phenolic compounds in plants and agri-industrial by-products: Antioxidant activity, occurrence, and potential uses. Food Chem. 99:191-203. [ Links ]
Bravo, L. 1999. Polyphenols: chemistry, dietary sources, metabolism, and nutritional significance. Nutrition Rev. 56:317-333. [ Links ]
Brisibe, E. A.; Umoren, U. E.; Brisibe, F.; Magalhaes, P. M.; Ferreira, J. F. S.; Luthria, D.; Wu, X. and Prior, R. L. 2009. Nutritional characterization and antioxidant capacity of different tissues of Artemisia annua L. Food Chem. 115:1240-1246. [ Links ]
Chumarka, P.; Khunawat, P.; Sanvarinda Y.; Phornchirasilp, S.; Morales, N. P.; Phivthong-Ngam, L.; Ratanachamnong, P.; Srisawat, S. and Pongrapeeporn, K. S. 2008. The in vitro and ex vivo antioxidant properties, hypolipidaemic and antiatherosclerotic activities of water extract of Moringa oleifera Lam. Leaves. J. Ethnopharmacol. 116:439-446. [ Links ]
Corral-Aguayo, R. D.; Yahia, E. M.; Carrillo-Lopez, A. and González-Aguilar, G. 2008. Correlation between some nutritional components and the total antioxidant capacity measured with six different assays in eight horticultural crops. J. Agric. Food Chem. 56(22):10498-10504. [ Links ]
de Saint Sauveur,A. and Broin, M. 2010. Growing and processing moringa leaves. Moringanews / Moringa Association of Ghana. www.anancy.net/documents/file/moringawebEN.p [ Links ]
Del Toro, M. J. 2011. Valoración de las propiedades nutricionales de Moringa oleifera en el departamento de Bolívar. Rev. Cienc. 1:23-30. [ Links ]
Deshpande, S. S. and Chetyan, M. 1985. Evaluation of vainillin assay for tannin analysis of dry beans. J. Food Sci. 50:905-916. [ Links ]
Dhakar, R. C.; Maurya, S. D.; Pooniya, B. K.; Bairwa, N. and Sanwarmal, M. G. 2011. Moringa: the herbal gold to combat malnutrition. Chron. Young Scient. 2(3):119-125. [ Links ]
Fahey, J. W. 2005. Moringa oleifera: a review of the medical evidence for its nutritional, therapeutic and prophylactic properties. Part 1. Trees life J. http://www.tfljournal.org/article.php/20051201124931586. [ Links ]
Frossad, E.; Bucher, M.; Macher, F.; Mozafar, A. and Rchard, H. 2000. Potential for increasing the content and bioavailability of Fe, Zn and Ca in plants for human nutrition. J. Sci. Food Agric. 80:861-879. [ Links ]
Gupta, K.; Barat, G. K.; Wagle, D. S. and Chawla, H. K. L. 1989. Nutrient contents and antinutritional factors in conventional and non-conventional leafy vegetables. Food Chem. 31:105-116. [ Links ]
Hurrell, R. and Egli, I. 2010. Iron bioavailability and dietary reference values. Am. J. Clin. Nutr. 91(5):14615-14675. [ Links ]
Makkar, H. P. S. and Becker, K. 1996. Nutrional value and whole and ethanol antinutritional components of extracted Moringa oleifera leaves. Animal Feed Sci Technol. 63:211-228. [ Links ]
Makkar, H. P. S. and Becker, K. 1997. Nutrients and antiquality factors in different morphological parts of the Moringa oleifera tree. JAgric. Sci. 128:311-322. [ Links ]
Mercado, M. G.; Carrillo, R. L.; Wall, M. A.; López, D. J. y Álvarez, P. E. 2013. Compuestos polifenólicos y capacidad antioxidante de especias típicas consumidas en México. Nutrición Hospitalaria. 28(1): 36-46. [ Links ]
Moyo, B.; Masika, P. J.; Hugo, A. and Muchenje, V. 2011. Nutritional characterization of Moringa (Moringa oleifera Lam.) leaves. Afr. J. Biotechnol. 10(60):12925-12933. [ Links ]
Olson, M. E. and Fahey, J. W. 2011.Moringa oleifera: un árbol multiusos para las zonas tropicales secas. Rev. Mex. Biod. 82:1071-1082. [ Links ]
Ou, B.; Hampsh-Woodill, M. and Prior, R. 2001. Development and validation of an improved oxygen radical absortion capacity assay using fluorescein as a fluorescent probe. J. Agric. Food Chem. 49:4619-4626. [ Links ]
Padh, H. 1994. Vitamins for optimal health. In: Golberg, I. (Ed.). Functional foods, designed foods, pharmafood, nutraceuticals. New York: Chapman and Hall. 261-293 pp. [ Links ]
Prosky, L.; Asp, N. G.; Schweizer, T. F.; DeVries, J. W. and Furda I. 1988. Determination of insoluble, soluble, and total dietary fiber in foods and food products, J. Assoc. Off. Anal. Chem. Int. 71:1017-1023. [ Links ]
Ramamurthy, M. S.; Maiti, B.; Thomas, P. and Nair, M. 1992. High performance liquid chromatography determination of phenolic acids in potato tubers (Solanum tuberosum) during wound healing. J. Agric. Food Chem. 40:569-572. [ Links ]
Rashid, U.; Anwar, F.; Moser, B. R. and Knothe, G. 2008. Moringa oleifera oil: apossible source of biodiesel. Biores. Technol. 99:8175-8179. [ Links ]
Rodríguez, J. L.; Valdés, O. y Alemán, A. 2006. Evaluación de la actividad antioxidante de cinco hierbas aromáticas. Ciencia Tecnol. Alimentos. 16(1):30-36. [ Links ]
Singlenton, V.; Orthofer, R. and Lamuela-Raventos, R. M. 1999. Analysis of total phenols and other oxidation substrates and antioxidants by jeans of Folin-Ciocalteu reagent. Metods Enzimol. 152-178. [ Links ]
United Stated Department of Agricultura (USDA) 2007. National agricultural library. National nutrient database for standard reference. Food and Nutrition Information Center. http://ndb.nal.usda.gov/ndb/search/list. [ Links ]
Verma, A. R.; Vijayakumar M.; Mathela, C. S. and Rao, C. V. 2009. In vitro and in vivo antioxidant properties of different fractions of Moringa oleifera leaves. Food Chem. Toxicol. 47:2196-2201. [ Links ]
Van den Berg, R.; Haenen, G.R.M. Van den Berg, H. and Bast, A. 1999. Applicability of an improved Trolox equivalent antioxidant capacity (TEAC) assay for evaluation of antioxidant capacity measurements of mixtures. Food Chem. 66:511-517. [ Links ]














