Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.2 no.spe3 Texcoco nov./dic. 2011
Artículos
Efecto de rayos gamma 60Co en nardo (Polianthes tuberosa L.)*
Effect of 60Co gamma rays in tuberose (Polianthes tuberosa L.)
Jorge Adán Estrada-Basaldua1§, Martha Elena Pedraza-Santos1, Eulogio de la Cruz-Torres2, Alejandro Martínez-Palacios3, Cuauhtémoc Sáenz-Romero3 y José Luciano Morales-García1
1 Facultad de Agrobiología Presidente Juárez. Universidad Michoacana de San Nicolás de Hidalgo. Paseo Lázaro Cárdenas esq. con Berlín. Uruapan, Michoacán, México. C. P. 60090. Tel. 01 452 5236474. (marelpesa@yahoo.com.mx), (jluciano@prodigy.net.mx). §Autor para correspondencia: joradesb@gmail.com.
2 Instituto Nacional de Investigaciones Nucleares. Carretera México-Toluca s/n. La Marquesa, Ocoyoacac, México. C. P. 52750. Tel. 01 55 53297200. (eulogio.delacruz@inin.gob.mx).
3 Instituto de Investigaciones Agropecuarias y Forestales. Universidad Michoacana de San Nicolás de Hidalgo. Carretera Morelia-Zinapécuaro, km 9.5. Tarímbaro, Michoacán, México. C. P. 58880. Tel. 01 443 3340475. Ext. 119. (aplalacios56@gmail.com), (csaenz@umich.mx).
* Recibido: febrero de 2011
Aceptado: septiembre de 2011
Resumen
Las plantas que se reproducen asexualmente como el nardo (Polianthes tuberosa L.), presentan poca variabilidad genética, ésta puede ser inducida por la técnica de la mutagénesis. Los objetivos del presente trabajo de investigación son: inducir variabilidad mediante el uso de radiación gamma 60Co y establecer la curva de radiosensibilidad en tubérculos y plantas in vitro de nardo. En el Instituto Nacional de Investigaciones Nucleares (ININ), se irradiaron tubérculos de nardo con siete dosis de radiación gamma 60Co (0 a 30 Gy), con intervalos de 5 Gy entre tratamientos. De los tubérculos irradiados (con 2 a 21 bulbos laterales), se extrajeron los bulbos sin daños mecánicos y se establecieron in vitro en un medio de cultivo Murashige y Skoog (MS), con 1 mg L-1 de benciladenina (BA) y 0.5 mg L-1 de ácido naftalenacético (ANA), los bulbos restantes se sembraron en una mezcla de sustrato (suelo, tierra de hojas y tezontle en una proporción de 1:1:1). Los nardos irradiados con altas dosis, el desarrollo de las plantas se vio disminuido; presentando una mayor variación en el largo y ancho de las hojas; comparadas con las plantas irradiadas, además se presentaron hojas deformes, brotes arrosetados, y estos se resecaban repentinamente. Las plantas procedentes de brotes aclimatados de nardo presentaron una LD50 (9.09 Gy), menor a la de los tubérculos establecidos in vivo (LD50 de 25.91 Gy), en donde la dosis de 30 Gy fue letal para todas las plantas después de cinco meses de cultivo.
Palabras clave: Polianthes tuberosa, cultivo in vitro, radiosensibilidad, variabilidad genética.
Abstract
The plants that are asexually reproduced like the tuberose (Polianthes tuberosa L.), have little genetic variability; this can be induced by the mutagenesis technique. The objectives of this paper are: to induce variability by using 60Co gamma radiation and, to establish the radiosensitivity curve in tubers and in vitro plants. At the National Institute for Nuclear Research (ININ by its Spanish acronym), tuberose's tubers were irradiated with seven doses of 60Co gamma radiation (0 to 30 Gy) with 5 Gy intervals between treatments. Of irradiated tubers (with 2 to 21 side bulbs), the bulbs were extracted without mechanical damage and established in vitro in a Murashige and Skoog (MS) culture medium with 1 mg L-1 of benzyladenine (BA) and 0.5 mg L-1 of naphthaleneacetic acid (NAA), the remaining bulbs were planted in a substrate mixture (soil, leaf mold and volcanic rock at a ratio of 1:1:1). In the tuberoses irradiated with high doses, the plant growth decreased, showing a greater variation in the length and width of the leaves; compared to the irradiated plants, deformed leaves also appeared, rosette-shaped buds, these were suddenly desiccated. The plants from acclimatized tuberose's buds had an LD50 (9.09 Gy), lower than tubers established in vivo (LD50 of 25.91 Gy), where the dose of 30 Gy was lethal to all plants after five months of cultivation.
Key words: Polianthes tuberosa, genetic variability, in vitro cultivation, radiosensitivity.
INTRODUCCIÓN
La mutagénesis es una herramienta importante en el mejoramiento genético de los cultivos, ampliamente utilizada para generar variación genética y nuevas variedades de las plantas cultivadas, además de que está libre de las restricciones y regulaciones impuestas a los organismos genéticamente modificados (Waugh et al., 2006; Shu y Lagoda, 2007; Parry et al., 2009). Hasta 2007 aproximadamente 2 300 variedades se desarrollaron a partir de mutagénesis, estas fueron liberadas y registradas oficialmente en la base de datos de variedades mutantes de la Organización para la Agricultura y Alimentación-Agencia Internacional de Energía Atómica (FAO-IAEA) (Toker et al., 2007).
Las mutaciones pueden ser inducidas por mutágenos físicos y químicos, que se pueden aplicar a todas las especies de plantas y animales. Los mutágenos físicos consisten en radiaciones no-ionizantes (rayos UV) o ionizantes (rayos X y gamma, alfa, beta y neutrones rápidos y lentos), mientras que algunos de los mutágenos químicos más ampliamente utilizados en las plantas, incluyen etilmetano sulfonato (EMS), metilmetano sulfonato (MMS), floruro de hidrógeno (HF), azida de sodio, N-metil-N-nitrosourea (MNU) e hidroxilamina (Parry et al., 2009).
El uso de la radiación ionizante como los rayos X, rayos gamma y neutrones, así como los mutágenos químicos para inducir variación está bien establecido (Ahloowalia y Maluszynski, 2001), debido a la gran cantidad de trabajos en el área de la mutagénesis convencional y en varios cultivos como en tomate (Solanum lycopersicum L.) (Matsukura et al., 2007; Watanabe et al., 2007), oyamel [Abies religiosa (Kunth) Schltd. et Cham.] (Iglesias-Andreu et al., 2010), chícharo de vaca [Vigna unguiculata (L.) Walp] (Kumar y Verma, 2011), tabaco (Nicotiana tabacum L.) (Kazama et al., 2008), trigo sarraceno perene (Fagopyrum dibotrys Hara) (Jia y Li, 2008), maíz (Zea mays L.) (Carrera y Cervantes, 2007), arroz (Oryza sativa L.) (Fu et al., 2008; Yamaguchi et al., 2009; Babaei et al., 2010) y comino negro (Nigella sativa L.) (Kumar y Gupta, 2007).
El efecto de la mutación en plantas ornamentales es muy visible, por lo que la selección para cambios en el color de la flor, forma y tamaño es fácil; sin embargo, estos cambios no siempre presentan novedades con valor (Maluszynski et al., 1995). En las plantas de propagación vegetativa se utilizan los órganos de multiplicación como yemas, rizomas, bulbos, tubérculos, estacas enraizadas y segmentos de hojas; sin embargo, estos órganos son multicelulares por lo que el desarrollo de sectores mutados o genotípicamente diferentes conocidos como quimeras es complejo y pueden sufrir los efectos tóxicos de los mutágenos químicos, además la aplicación homogénea de estos es difícil, por lo que las radiaciones ionizantes con un gran poder de penetración como los rayos X y gamma, son la opción para el desarrollo de variedades mejoradas a partir de la inducción de mutaciones en las plantas de propagación vegetativa (Prina et al., 2010).
La combinación entre las técnicas de inducción de mutantes y de cultivo in vitro, pueden ofrecer muchas ventajas como la separación quimeras, la capacidad de producir grandes poblaciones en poco tiempo y la posibilidad de obtener clones de un sólo brote (Van Harten, 1998). La dosis de radiación es un factor clave para lograr mutaciones en material vegetal. En el caso de las plantas cultivadas in vitro, sólo unos miligramos de tejido son irradiados por lo que se requieren dosis bajas (Ahoowalia y Maluszynski, 2001).
Existen varios trabajos en los que se realizó la inducción de mutaciones in vitro en plantas, como caña de azúcar (Saccharum officinarum L.) (García et al., 2001; Suprasana et al., 2008), cacahuate (Arachis hypogaea L.) (Muthusamy et al., 2007), papa (Solanum tuberosum L.) (Li et al., 2005), henequén (Agave fourcroydes) (González et al., 2007), camote (Ipomoea batatas L.) (Luan et al., 2007), crisantemo (Chrysanthemum morifolium) (Yamaguchi et al., 2008; Yamaguchi et al., 2009), violeta africana (Saintpaulia sp.) (González et al., 2005), ciclamen (Cyclamen persicum) (Kondo et al., 2009; Sugiyama et al., 2008), torenia (Torenia fournieri Lind) (Sasaki et al., 2008), lirio sapo [Tricyrtis hirta (Thund.) Hook] (Nakano et al., 2010) y petunia (Petunia hybrida) (Hase et al., 2010).
El nardo (Polianthes tuberosa L.) presenta poca variabilidad genética porque sólo se propaga a través de tubérculos (Shillo, 1992), situación que dificulta su mejoramiento genético. Existen pocos trabajos donde se estudie el efecto de las radiaciones gamma en la inducción de variación genética en nardo y en ninguno se estudia el efecto de cultivar tejidos irradiados in vitro, por lo que se justifica el desarrollo de técnicas que permitan incrementos en la variabilidad genética de esta especie, como la mutagénesis causada por la exposición de tejidos vivos a radiaciones gamma o la combinación de cultivo in vitro y radiaciones gamma, que generen alteraciones en las flores como el color, forma y hábitos de crecimiento (enanos o rastreros) que podrían ser seleccionados en programas de mejoramiento genético.
La presente investigación se realizó con los siguientes objetivos: 1) inducir variabilidad mediante el uso de radiación gamma 60Co en tubérculos y tejidos cultivados in vitro; y 2) establecer la curva de radiosensibilidad en tubérculos y plantas in vitro de nardo.
MATERIALES Y MÉTODOS
El material vegetal que se utilizó en esta investigación, son tubérculos de nardo (primera generación) de San Andrés, Municipio de Zumpahuacán, Estado de México. El experimento se realizó de julio de 2009 a julio de 2010, durante los ciclos otoño-invierno y primavera-verano. Los tubérculos con 2 a 21 bulbos pequeños (diámetro de 0.7 a 3 cm y longitud de 1 a 3.4 cm), se dejaron secar a la sombra esparcidos en una superficie plana dentro de una habitación por 30 días y posteriormente se clasificaron por tamaños de mayor a menor, se colocaron cinco o seis tubérculos en sobres de papel tamaño carta y se identificaron según su tratamiento. El trabajo de investigación se llevó a cabo en el departamento del irradiador gamma del Instituto Nacional de Investigaciones Nucleares (ININ), con un irradiador Gammacell 220. Se establecieron seis dosis de radiación de 60Co (5, 10, 15, 20, 25 y 30 Gy) que generaron seis tratamientos y su respectivo testigo sin irradiar.
Cultivo in vitro de bulbos laterales
De los tubérculos irradiados se extrajeron los bulbos laterales sin daños mecánicos visibles para su cultivo in vitro, éstos se separaron por tratamientos y posteriormente se lavaron con agua del grifo y detergente, después se sumergieron durante tres horas en una solución compuesta por los fungicidas Tecto 60® (Tiabendazol 60% i. a.) (1 g L-1), Switch® (Cyprodinil 37.5 y Fludioxonil 25% i. a.) (1 g L-1) y Cercobin M® (Tiofanato metílico 70% i. a.) (2 g L-1). La desinfección se efectuó con una solución de hipoclorito de sodio comercial a 70% v/v (6% de cloro activo) durante 20 min.
En una campana de flujo laminar se retiró la solución con cloro y se enjuagaron los explantes de cuatro a cinco veces con agua estéril. Se colocaron tres bulbos en frascos con un volumen de 100 mL, adicionándole 15 mL de medio de cultivo líquido que contenía las sales minerales de Murashige y Skoog (1962) (MS) a 100% y suplementados con benciladenina (BA) (1 mg L-1), ácido naftalenacético (ANA) (0.2 mg L-1) y el fungicida Switch® (1 g L-1). Los frascos con los explantes se incubaron con un fotoperiodo de 16:8 (luz: oscuridad) blanca fría fluorescente de 75 W y una radiación fotosintéticamente activa de 45 µEm-2s-1
Los bulbos se distribuyeron en un diseño experimental completamente al azar con 27 repeticiones por tratamiento. A los siete días y cuando los explantes estaban incubándose en medio con fungicida, se midieron las siguientes variables número de explantes con brotes y porcentaje de contaminación. Después de subcultivarlos a un medio sin fungicida y se midió la altura de los brotes; los brotes se aclimataron transfiriéndolos a macetas de 113.4 g conturba (Peat moss®) como sustrato y se colocaron en contenedores de plástico herméticos dentro de un invernadero por 3 0 días, después se quitó la tapa.
Los brotes de nardo que sobrevivieron a la contaminación y aclimatación, se distribuyeron en un diseño estadístico de bloques al azar con 15 bloques y una repetición por bloque; después se trasplantaron a vasos de poliestireno expandido (unicel) con 226.8 g de un sustrato conformado por suelo (extraído de tierras de cultivo) y turba (Peat moss®) en proporción 1:1. Un mes después se trasplantaron nuevamente a recipientes con capacidad de un litro y utilizando suelo como sustrato. Los brotes de nardo aclimatados recibieron dos riegos por semana con solución nutritiva Steiner al 75% (Steiner 1984), durante los dos primeros meses después de ser aclimatados y cuatro veces se fertilizaron con 2-3 g de fórmula especial jardín 12-24-12® una vez al mes. A los cuatro meses después de la aclimatación de los brotes de nardo, se tomaron los datos de las variables largo y ancho de hojas. Un mes después se contó el número de plantas aclimatadas supervivientes.
Cultivo de tubérculos en invernadero
Los tubérculos que quedaron después de la extracción de explantes para cultivar in vitro, se sembraron en recipientes de poliestireno expandido (unicel) de 2 L de capacidad con sustrato conformado por suelo, tierra de hojas y tezontle en una proporción de 1:1:1, y se distribuyeron en un diseño bloques al azar con cinco bloques y una repetición por bloque. Posteriormente se tomaron los datos de inicio y final de la brotación de tubérculos y porcentaje de bulbos que brotaron por tubérculos por dosis de radiación. A los dos meses, cuando terminó la brotación, se midieron las variables número de brotes por maceta, número de hojas por brote, largo y ancho de hojas. A los cuatro meses de la siembra se tomaron nuevamente los datos de las variables largo y ancho de hojas, un mes después se contó el número de plantas supervivientes.
Los tubérculos se fertilizaron con 2 a 3 g del mismo fertilizante, que se utilizó en los brotes de nardo aclimatados; al quinto mes se adicionó de 4 a 5 g de sulfato de magnesio® al fertilizante. Todos los nardos recibieron un ataque severo por araña roja (Tetranychus urticae Koch), que se controló con aplicaciones de Supresor® (Naleb 58%) (1.25 ml L-1), Talstar 100 CE® (Bifentrina 12.15%) (0.4 ml L-1) y Avalanch® (Abamectina 1.8%) (0.25 ml L-1), por lo menos una vez cada 15 días, sin repetir el mismo insecticida acaricida dos veces seguidas para evitar aparición de resistencia.
Todas las variables registradas se sometieron a análisis de varianza (ANOVA) con el procedimiento PROC GLM y prueba de comparación de medias de Tukey con el procedimiento Tukey lines utilizando el programa SAS versión 9 (SAS, 2004). Con el número de plantas de nardo sobrevivientes se obtuvieron los porcentajes de supervivencia y se realizaron pruebas de regresión lineal. Además se calculó el error estándar y coeficientes de variación con el comando Distribution del menú Analyze del programa JMP versión 8 (SAS, 2008).
RESULTADOS Y DISCUSIÓN
Todas las variables evaluadas en las plántulas in vitro derivadas de tubérculos irradiados, presentaron diferencias estadísticas significativas (porcentaje de explantes con brotes p= 0.00001, porcentaje de explantes contaminados p= 0.0001 y altura de brotes p= 0.0001), por lo que se puede afirmar que las diferentes dosis de radiación empleadas influyeron en la brotación de yemas y desarrollo de las plántulas. El desarrollo de brotes inició a los tres días después de la siembra in vitro y terminó a los siete días. Las plantas tratadas con la radiación gamma de 5 Gy, presentaron un desarrollo de brotes igual al tratamiento testigo (100%) y esta variable disminuyó conforme se aumentó la dosis de radiación (Cuadro 1).
Resultados similares fueron reportados para la regeneración in vitro de brotes adventicios, a partir de secciones internodales de clavel (Dianthus gratianopolitanus Vill.), donde el desarrollo de brotes se redujo de 1.1 a 0.1 brotes por explante, al aumentar las dosis de radiación gamma de 5 a 30 Gy, en intervalos de 5 Gy (Jerzy y Zalewska, 2000) y a la regeneración de plántulas de lirio sapo [Tricyrtis hirta (Thunb.) Hook] a partir de callos irradiados, donde los tratamientos expuestos a 5 y 10 Gy, fue similar al tratamiento no irradiado y disminuyo al aumentar las dosis de radiación (Nakano et al., 2010). En el presente estudio la contaminación de explantes fue mayor en el tratamiento expuesto a la dosis de 5 Gy (85.3%).
Las plántulas expuestas a 5 y 10 Gy presentaron una altura superior (2.63 y 2.66 cm respectivamente) al tratamiento testigo (1.87 cm), probablemente por el efecto estimulante de bajas dosis de radiación, similar a lo observado en plantas de (Lactuca sativa L.) (González et al., 2004), resultado que es similar al obtenido en plántulas in vitro de papa de la variedad Atlantic, que desarrollaron con la dosis de 4 Gy 23.2% más de micro tubérculos que el tratamiento testigo (Li et al., 2005), aunque también es opuesto al obtenido en ápices de henequén (Agave fourcroides Lem.), expuestos a dosis de radiación gamma 60Co de 0 a 50 Gy con intervalos de 10 Gy, ninguno de los tratamientos expuestos a radiación pudo superar al testigo (3.5 brotes por explante) (González et al., 2007).
Sin embargo, es similar al obtenido en brotes in vitro de las variedades de uva (Vitis vinifera L.) 3309, Helwani y Cabernet Franc expuestos a una dosis de radiación gamma de 7 Gy produjeron una longitud de brote (LB) (5.33, 4.11 y 7.46 cm) y número de hojas (NH) (14.66, 10 y 8.66 respectivamente) que superaron a los tratamientos testigo (brotes de 5.03, 1.4 y 2.9 cm de longitud y 8.33, 5 y 2.66 hojas, respectivamente) (Charbaji y Nabulsi, 1999).
En el caso de los tubérculos irradiados que se establecieron in vivo, sólo se presentaron diferencias estadísticas significativas en el largo y ancho de las hojas de los brotes obtenidos (p= 0.0001 y p= 0.0001, respectivamente). Al igual que en las plántulas in vitro, las plantas in vivo expuestas a una dosis de radiación gamma de 5 Gy, presentaron un desarrollo muy similar al tratamiento testigo y el desarrollo de las plantas pareció disminuir al aumentar las dosis de radiación (Cuadro 2).
Resultados similares fueron observados en plantas de comino negro (Nigella sativa L), donde la altura de las plantas derivadas de semillas disminuyó de 54.86 ±0.45 a 36. 84 ±0.29 cm, con el incremento de la radiación gamma de 0 a 3 00 Gy en intervalos de 5 0 Gy (Kumar y Gupta, 2007) y en plántulas de oyamel [Abies religiosa (Kunth) Schltd. et Cham.], generadas a partir de semillas expuestas a dosis de radiación gamma de 0 a 20 Gy con intervalos de 5 Gy entre tratamientos, en donde la altura de las plántulas y número de hojas primarias, disminuyó conforme aumentaban las dosis de radiación (Iglesias-Andreu et al., 2010). El desarrollo de brotes de nardo inició a los cinco días de la siembra y terminó a los dos meses.
Las diferencias estadísticas que se encontraron en los tubérculos establecidos in vivo después de la brotación, se conservaron después de cuatro meses de cultivo (Cuadro 3). Por otra parte, los brotes que fueron aclimatados también presentaron diferencias estadísticas significativas (p< 0.01), después de un periodo de cultivo igual al de los tubérculos establecidos in vivo. En los brotes aclimatados, la dosis que presentó una variación más elevada en las variables largo y ancho de hojas (51.37 y 26.80 CV, respectivamente) fue de 25 Gy (Cuadro 3), similarmente en los tubérculos establecidos in vivo, la mayor variación en el largo de hojas (51.14 CV) se presentó en la dosis de 25 Gy, aunque la mayor variación en el ancho de hojas (25.56 CV) se presentó en la dosis de 5 Gy.
En forma similar a los resultados del presente estudio brotes in vitro de pera (Pyrus communis L.), irradiados con rayos gama (3.5 Gy), presentaron frecuencias de variación de 0.81 y 3.64% en rasgos de la fruta para las variedades Doyenné d'Hiver y Passe Crassane, en comparación con las plantas no irradiadas (Predieri y Zimmerman, 2001). Al comparar la variación en las variables ya mencionadas entre los tratamientos testigo, muestran que los brotes aclimatados (31.76 y 26.04 CV), presentan mayor variación que los tubérculos establecidos in vivo (27.12 y 18.93 CV); sin embargo, tal vez se debe que no todos los brotes desarrollaron raíces antes de ser aclimatados, por lo que no presentaron un desarrollo uniforme en el sustrato. En un caso opuesto a los resultados obtenidos en la presente investigación el cultivo in vitro, redujo la variación en el desarrollo de plantas silvestres de (Yucca valida Brandegee) de 39.46 a 9.11 CV (Arce-Montoya et al., 2006).
En los brotes aclimatados los valores promedio de las variables estudiadas, disminuyeron conforme aumentaban las dosis de radiación; sin embargo, los brotes expuestos a 30 Gy, presentaron hojas con un largo y ancho (12.16 ±0.63 y 1.12 ±0.04 cm), comparable con los obtenidos con las dosis de 5 y 10 Gy(12.44 ±0.69 y 1.27 ±0.04, y 10.22 ±0.78 y 1.04 ±0.03 cm respectivamente); mientras que, en los tubérculos establecidos in vivo las dosis de 5, 10 y 15 Gy, presentaron hojas más anchas (1.48 ±0.04, 1.56 ±0.03 y 1.49 ±0.03 cm) que el testigo (1.43 ±0.03 cm), este resultado es similar al obtenido en plantas de cacahuate Arachis hypogaea L., germinadas a partir de embriones somáticos desarrollados en callos embriogénicos irradiados de las variedades Co. 5 y Co. 7, que presentaron en las dosis de 10, 20 y 3 0 Gy una altura en condiciones de campo (37.2, 38.5 y 45.2 cm para Co. 5 y 37.4, 39.4 y 40.4 cm para Co. 7), superiores a los tratamientos testigo (35.8 y 36.4 cm) (Muthusamy et al., 2007).
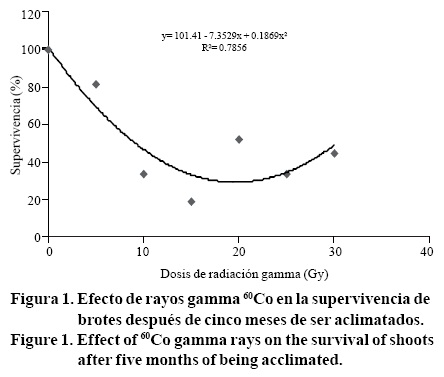
Aunque los brotes aclimatados generaron algunas plantas muy vigorosas con la dosis de 30 Gy, éstos presentaron una LD50 de 9.09 Gy, obtenida con la fórmula de regresión y= 101.41 - 7.3529x + 0.1869x2 (Figura 1), un resultado similar se presentó en callos irradiados de papa (Solanum tuberosum L.) de la variedad Desirée, donde se obtuvo una LD50 de 12.51 Gy (Veitía et al., 2007). Es necesario tomar en cuenta que otros factores ajenos al efecto de la radiación, como la contaminación in vitro y daños mecánicos ocurridos durante la etapa de aclimatación, pueden influir negativamente en la supervivencia de las plántulas y causar una LD50 menor a la que se obtendría solo con la radiación. Por otra parte, la presencia de plantas vigorosas con la dosis de 30 Gy observadas en esta investigación, es opuesta a los resultados obtenidos en brotes in vitro de crisantemo, donde la dosis de 16 Gy fue letal (Yamaguchi et al., 2009).
En el caso de los tubérculos establecidos in vivo se obtuvo una LD50 de 25.91 Gy, con la fórmula de regresión y= 93.81 + 3x - 0.18 1x2 (Figura 2), resultado cercano a la dosis que alcanzó la mayor variación en el largo y ancho de las hojas (25 Gy) y es menor a otras plantas como el henequén (Agave fourcroides Lem.), donde se presentó una DL50 de 30 Gy (González et al. 2007), o las DL50 de 28 y 27 Gy calculadas para las variedades de aguacate (Persea americana Mill.) Duke y Hass (Fuentes et al., 2004); en los tubérculos establecidos in vivo la dosis de 30 Gy fue letal después de cinco meses de cultivo.

En los materiales establecidos in vivo, las plantas expuestas a 30 Gy murieron porque sus tubérculos no desarrollaron raíces; así que estas plantas sobrevivieron hasta que agotaron sus reservas, mientras que las plantas aclimatadas expuestas a 30 Gy sobrevivieron, por que desarrollaron raíces viables como un posible efecto de la exposición de tejidos irradiados a reguladores del crecimiento vegetal (ANA BA), presentes en el medio de cultivo durante la etapa de desarrollo in vitro. Por otra parte, también se presentaron deformaciones en las hojas (hojas torcidas o muy delgadas), brotes que surgían muy rosetados y brotes que se secaban repentinamente, a 11 meses de la siembra de los tubérculos establecidos in vivo, una planta expuesta a una dosis de 10 Gy empezó a desarrollar una inflorescencia, a tres semanas de este hecho otra planta expuesta a 15 Gy también inició el desarrollo de una inflorescencia.
En la Figura 3 se muestra el efecto de la radiación gamma sobre las plantas de nardo: A= disminución del vigor de plantas de nardo al aumentar la dosis de radiación; B= brote aclimatado expuesto a 30 Gy; C= tubérculo de nardo necrosado de una planta expuesta a 30 Gy; D= planta expuesta a 30 Gy antes de morir, E y F= brote aclimatado plantas in vivo con deformaciones en hojas; G= plantas rosetadas, H e I= inflorescencias que se desarrollaron en una plantas expuestas a 15 y 10 Gy respectivamente; J= planta con un brote muerto repentinamente; ht= hoja torcida; hd= hoja delgada; bm= brote muerto.

De forma similar a las observaciones realizadas en este estudio otras plantas expuestas a radiación gamma, también presentan deformaciones como hojas pálidas, hojas y frutos de color verde amarillento similares a las plantas silvestres, también con frutos de color rosa en plantas de tomate (Solanum lycopersicum L.) miniatura var. Micro-Tom expuestas a radiación gamma (300 Gy) (Matsukura et al., 2007), flores con un pétalo extra en comino negro (Nigella sativa L.) (Kumar y Gupta, 2007), o alteraciones en la forma y color de los pétalos de ciclamen (Cyclamen persicum) (Sugiyama et al., 2008; Kondo et al., 2009), petunia (Petunia hybrida) (Hase et al., 2010) y torenia (Torenia fournieri Lind.) (Sasaki et al., 2008).
En el presente estudio, las deformaciones observadas en las plantas que se desarrollaron a partir de los tubérculos irradiados, sugieren el desarrollo de quimeras que junto con el aumento en los coeficientes de variación de estas plantas con respecto a las plantas del tratamiento testigo no irradiado, indican que la radiación gamma posiblemente si afectó variación genética en los nardos.
CONCLUSIONES
Al aumentar la dosis de radiación disminuye el desarrollo de las plantas de nardo, tanto en plantas desarrolladas a partir de brotes aclimatados, como en las desarrolladas a partir de tubérculos establecidos in vivo. Las plantas irradiadas presentan mayor variación en el largo y ancho de hojas que las plantas no irradiadas. La LD50 de las plantas desarrolladas a partir de brotes aclimatados (9.09 Gy), fue menor a la LD50 de plantas desarrolladas a partir de tubérculos establecidos in vivo (25.91 Gy). La dosis de radiación de 30 Gy fue letal para las plantas desarrolladas a partir de tubérculos establecidos in vivo.
LITERATURA CITADA
Ahloowalia, B. S. and Maluszynski, M. 2001. Induced mutations-a new paradigm in plant breeding. Euphytica. 118:167-173. [ Links ]
Arce-Montoya, M.; Rodríguez-Áglvarez, M.; Hernández-González, J. A. and Robert, M. L. 2006. Micropropagation and field performance of Yucca valida. Plant Cell Reports. 25:777-783. [ Links ]
Babaei, A.; Nematzadeh, G. A.; Avagyan, V. and Hashemi-Petrodi, S. H. 2010. Radio sensitivity studies of morpho-physiological characteristics in some Iranian rice varieties (Oryza sativa L.) in M1 generation. African J. Res. 5(16):2124-2130. [ Links ]
Carrera, V. J. A. y Cervantes, S. T. 2007. Comportamiento de cruzas de maíz obtenidas por irradiación y selección. Rev. Fitotec. Mex. 30(2): 173-180. [ Links ]
Charbaji, T. and Nabulsi, I. 1999. Effect of low doses of gamma irradiation on in vitro growth of grapevine. Plant Cell, Tissue and Organ Culture. 57:129-132. [ Links ]
Fu, H. W.; Li, Y. F. and Shu, Q. Y. 2008. A revisit of mutation induction by gamma rays in rice (Oryza sativa L.): implications of microsatellite markers for quality control. Mol. Breed. 22:281-288. [ Links ]
Fuentes, J. L.; Santiago, L.; Valdés, Y.; Guerra, M.; Ramírez, I. M.; Prieto, E. F.; Rodríguez, N. N. and Velázquez, B. 2004. Mutation induction in zygotic embryos of avocado (Persea americana Mill). Biotecnología Aplicada. 21(2):82-84. [ Links ]
García, R. L.; Orellana, P. P; García, R. L.; Pérez, P. J. N.; Veitía, R. N.; Bermúdez, C. I.; Clavero, G. J. and Romero, Q. C. 2001. Empleo de la mutagénesis en la mejora al grosor del tallo del somaclón IBP 89-169 de caña de azúcar. Biotecnología Vegetal. 1(2):71-75. [ Links ]
González, L. M.; Ramírez, R.; Licea, L.; Porra, E. and García, B. 2004. Acción estimulante de las dosis bajas de rayos X en plantas Lactuca sativa. Universidad y Ciencia. 20(39): 1-6. [ Links ]
González, M. C.; Fuentes, J. L.; Cortes, S. y Sam, O. 2005. "Delia", nueva variedad de violeta africana (Saintpaulia sp.) obtenida a partir del empleo de técnicas biotecnológicas y nucleares. Cultivos Tropicales. 26:67-68. [ Links ]
González, O. G.; Alemán, G. S.; Garriga, M.; Ortiz, R. and De La Fe, C. 2007. Radiosensitivity to gamma rays (60Co) in shoot tips of henequen. Biotecnología Vegetal. 7(2): 115-117. [ Links ]
Hase, Y.; Okamura, M.; Takeshita, D.; Narumi, I. and Tanaka, A. 2010. Efficient induction of flower-color mutants by ion beam irradiation in petunia seedlings treated with high sucrose concentration. Plant Biotechnol. 27:99-103. [ Links ]
Iglesias-Andreu, L. G.; Sánchez-Velásquez, L. R.; Tivo-Fernández, Y.; Luna-Rodríguez, M.; Flores-Estévez, N.; Noa-Carranzana, J. C.; Ruiz-Bello, C. and Moreno-Martínez, J. L. 2010.Efecto de radiaciones gamma en Abies religiosa (Kunth) Schltd. et. Cham. Revista Chapingo. Serie Ciencias Forestales y del Ambiente. 16(1):5-12. [ Links ]
Jerzy, M. and Zalewska, M. 2000. Effect of X and gamma rays on in vitro adventitious bud production of pot carnation (Dianthus gratianopolitanus Vill.). Revista Chapingo. Serie Horticultura. 6(1):49-52. [ Links ]
Jia, C. F. and Li, A. L. 2008. Effect of gamma radiation on mutant induction of Fogopyrum dibotrys Hara. Photosynthetica. 46(3):363-369. [ Links ]
Kazama, Y; Saito, H.; Miyagai, M.; Takehisa, H.; Ichida, H.; Miyazawa, Y; Mishiba, K.; Kanaya, T.; Suzuki, K.; Bae, C. H.; Miyoshi, K.; Mii, M. and Abe, T. 2008. Effect of heavy ion-beam irradiation on plant growth and mutation induction in Nicotiana tabacum. Plant Biotechnol. 25:105- 111. [ Links ]
Kondo, E.; Nakayama, M.; Kameari, N.; Tanikawa, N.; Morita, Y.; Akita, Y.; Hase, Y.; Tanaka, A. and Ishizaka, H. 2009. Red-purple flower due to delphinidin 3,5-diglucoside, a novel pigment for Cyclamen spp., generated by ion-beam irradiation. Plant Biotechnol. 26:565-569. [ Links ]
Kumar, G. and Gupta, P. 2007. Mutagenic efficiency of lower doses of gamma rays in black cumin (Nigella sativa L.). Cytologia. 72(4):435-440. [ Links ]
Kumar, G. and Verma, S. 2011. Comparative effect of individual and sequential treatment of gamma rays and sodium azide in Vigna unguiculata. Chromosome Botany. 6:33-36. [ Links ]
Li, H. Z.; Zhou, W. J.; Zhang, Z. J.; Gu, H. H.; Takeuchi, Y. and Yoneyama, K. 2005. Effect of y-radiation on development, yield and quality of microtubers in vitro in Solanum tuberosum L. Biol. Plant. 49(4): 625-628. [ Links ]
Luan, Y.; Zhang, J.; Gao, X. and An, L. 2007. Mutation induced by ethylmethanesulphonate (EMS), in vitro screening for salt tolerance and plant regeneration of sweet potato (Ipomoea batatas L.). Plant Cell Tissue Organ Cult. 88:77-81. [ Links ]
Maluszynski, M.; Ahloowalia, B. S. and Sigurbjörnsson, B. 1995. Application of in vivo and in vitro mutation techniques for crop improvement. Euphytica. 85:303-315. [ Links ]
Matsukura, C.; Yamaguchi, I.; Inamura, M.; Ban, Y.; Kobayashi, Y.; Yin, Y.; Saito, T.; Kuwata, C.; Imanishi, S. and Nishimura, S. 2007. Generation of gamma irradiation-induced mutant lines of the miniature tomato (Solanum lycopersicum L.) cultivar 'Micro-Tom'. Plant Biotechnol. 24:39-44. [ Links ]
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol. Plant. 15:473-497. [ Links ]
Muthusamy,A.; Vasanth, K.; Sivasankari, D.; Chandrasekar, B. R. and Jayabalan, N. 2007. Effects of mutagens on somatic embryogenesis and plant regeneration in groundnut. Biol. Plant. 51(3):430-435. [ Links ]
Nakano, M.; Amano, J.; Watanabe, Y.; Nomizu, T.; Suzuki, M.; Mizunashi, K.; Mori, S.; Kuwayama, S.; Han, D-C.; Saito, H.; Ryuto, H.; Fukunishi, N. and Abe, T. 2010. Morphological variation in Tricyrtis hirta plants regenerated from heavy ion beam-irradiated embryogenic calluses. Plant Biotechnol. 27:155-160. [ Links ]
Parry, M. A. J.; Madgwick, P. J.; Bayon, C.; Tearall, K.; Hernández-López, A.; Baudo, M.; Rakszegi, M.; Hamada, W.; Al-Yassin, A.; Ouabbou, H.; Labhilili, M. and Phillips, A. L. 2009. Mutation discovery for crop improvement. J. Expe. Bot. 60(10):2817-2825. [ Links ]
Predieri, S. and Zimmerman, R. H. 2001. Pear mutagenesis: In vitro treatment with gamma-rays and field selection for productivity and fruit traits . Euphytica. 117:217-227. [ Links ]
Prina, A.; Landau, A.; Pacheco, M. G. y Hopp, E. H. 2010. Mutagénesis, TILLING y EcoTILLING. In: Levitus, G.; Echenique, V.; Rubinstein, C.; Hopp, E. y Mroginski, L. (Eds.) Biotecnología y mejoramiento vegetal II. Editorial INTA. Segunda edicion. Argentina. 217-228 pp. [ Links ]
Sasaki, K.; Aida, R.; Niki, T.; Yamaguchi, H.; Narumi, T.; Nishijima, T.; Hayashi, Y.; Ryuto, H.; Fukunishi, N.; Abe, T. and Ohtsubo, N. 2008. High-efficiency improvement of transgenic torenia flowers by ion beam irradiation. Plant Biotechnol. 25:81-89. [ Links ]
Statistical Analysis System (SAS Institute). 2004. SAS/STAT User's Guide. Release 9 Edition. Cary, NC. USA. [ Links ]
Statistical Analysis System (SAS Institute). 2008. JMP User's Guide. Release 8 Edition. Cary, NC. USA. [ Links ]
Shillo, R. 1992. The cuber community holds the answer to flowering problems in polianthes tuberose. Acta Hortic. 325:139-364. [ Links ]
Shu, Q. Y. and Lagoda, P. J. L. 2007. Mutation techniques for gene discovery and crop improvement. Mol. Plant Breed. 5:193-195. [ Links ]
Steiner, A. A. 1984. The universal nutrient solution. ISOSC. In: Proceedings 6th International Congress on Soilless Culture. Lunteren. The Netherlands 633-649 pp. [ Links ]
Sugiyama, M.; Saito, H.; Ichida, H.; Hayashi, Y.; Ryuto, H.; Fukunishi, N.; Terakawa, T. and Abe, T. 2008. Biological effects of heavy-ion beam irradiation on cyclamen. Plant Biotechnol. 25:101-104. [ Links ]
Suprasanna, P.; Rupali, C.; Desai, N. S. and Bapat, V. A. 2008. Partial desiccation augments plant regeneration from irradiated embryogenic cultures of sugarcane. Plant Cell Tissue Organ Cult. 92:101-105. [ Links ]
Toker, C.; Yadav, S. S. and Solanki, I. S. 2007. Mutation breeding. In: Yadav, S. S. (eds.) Lentil: An ancient crop for modern times. Springer. 209-224 pp. [ Links ]
Van Harten, A. M. 1998. Mutation breeding: theory and practical applications. Cambridge University Press, Cambridge, UK. 353 pp. [ Links ]
Veitía, N.; García, L. R.; Bermúdez-Caraballoso, I.; Orellana, P.; Padrón, Y. and Torres, D. 2007. Efecto de las radiaciones gamma sobre callos de papa var. 'Desirée'. Biotecnología Vegetal. 7(1):57-61. [ Links ]
Watanabe, S.; Mizoguchi, T.; Aoki, K.; Kubo, Y.; Mori, H.; Imanishi, S.; Yamazaki, Y.; Shibata, D. and Ezura, H. 2007. Ethylmethanesulfonate (EMS) mutagenesis of Solanum lycopersicum cv. Micro-Tom for large-scale mutant screens. Plant Biotechnol. 24:33-38. [ Links ]
Waugh, R.; Leader, D. J.; McCallum, N. and Caldwell, D. 2006. Harvesting the potential of induced biological diversity. Trends Plant Sci. 11(2):71-79. [ Links ]
Yamaguchi, H.; Shimizu, A.; Degi, K. and Morishita, T. 2008. Effects of dose and dose rate of gamma ray irradiation on mutation induction and nuclear DNA content in chrysanthemum. Breed. Sci. 58:331-335. [ Links ]
Yamaguchi, H.; Hase, Y.; Tanaka, A.; Shikazono, N.; Degi, K.; Shimizu, A. and Morishita, T. 2009. Mutagenic effects of ion beam irradiation on rice. Breed Sci. 59:169-177. [ Links ]
Yamaguchi, H.; Shimizu, A.; Hase, Y.; Degi, K.; Tanaka, A. and Morishita, T. 2009. Mutation induction with ion beam irradiation of lateral buds of chrysanthemum and analysis of chimeric structure of induced mutants. Euphytica. 165:97-103. [ Links ]














