Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nova scientia
versión On-line ISSN 2007-0705
Nova scientia vol.6 no.12 León oct. 2014
Ciencias Naturales e Ingenierías
Caracterización bioquímica de AmiJ33, una amilasa de Bacillus amyloliquefaciens aislada de suelos cultivados con caña de azúcar en la región del Papaloapan
Biochemical characterization of AmiJ33 an amylase from Bacillus amyloliquefaciens isolated of sugarcane soils at the Papaloapan region
J. J. Montor-Antonio1, C. Olvera-Carranza2, D. Reyes-Duarte3, B. Sachman-Ruiz2, L. Ramírez-Coutiño1 y S. Del Moral1
1Instituto de Biotecnología, Universidad del Papaloapan, Tuxtepec, Oaxaca
2Instituto de Biotecnología, Universidad Nacional Autónoma de México, Cuernavaca, Morelos
3Universidad Autónoma Metropolitana, Unidad Cuajimalpa. Depto. de Procesos y Tecnología, México DF, México
Sandra del Moral. E-mail: smoral@unpa.edu.mx , sandra_ibt79@hotmail.com
Recepción: 05-09-2013
Aceptación: 29-11-2013
Resumen
La amilasa (E.C. 3.2.1.1) de Bacillus amyloliquefaciens JJC33M (AmiJ33) fue producida por fermentación sumergida. Se probó el efecto de peptona, extracto de levadura, Ca+2 y glicina en la producción de AmiJ33. El extracto de levadura y Ca+2 tuvieron un efecto positivo sobre la síntesis de AmiJ33. La enzima fue recuperada mediante precipitación a saturación al 60% con (NH4)2SO4. El peso molecular aproximado de la enzima purificada fue de 50 kDa. Así mismo, se evaluó el efecto del pH y la temperatura sobre la actividad enzimática, concluyendo que los valores más altos de actividad se observaron a pH 6.0 y 80°C, respectivamente. En condiciones ligeramente ácidas (pH 4.0 y 5.0), AmiJ33 mantuvo el 72% de su actividad. AmiJ33 fue estable por 3 h a 40°C, y por 30 min a 45 y 50°C, conservando el 88 y 82% de actividad residual. A 60°C, la actividad disminuyó 40%. La actividad de AmiJ33 se incrementó 50.27% con β-mercaptoetanol, no fue inhibida por EDTA y se inhibió totalmente con SDS.
Palabras Clave: suelos, α-amilasa, Bacillus amyloliquefaciens, producción enzimática.
Abstract
Amylase (EC 3.2.1.1) from Bacillus amyloliquefaciens JJC33M (AmiJ33) was produced by submerged fermentation. Peptone, yeast extract, Ca+2 and the glycine effect over AmiJ33 production was analyzed shown that yeast extract and Ca+2 concentration increased in 2.5 times the AmiJ33 production. By mean precipitation using (NH4)2SO4, the enzyme was recovered and the protein was identified by SDS-PAGE demonstrating that AmiJ33 has a molecular weight of 50 kDa. Temperature and pH optimus were determined, the highest values of activity were observed at pH 6.0 and 80° C, however, using slightly acid conditions (pH 4.0 and 5.0) AmiJ33 kept 72% of activity. AmiJ33 was stable for 3 h at 40°C, and 30 min at 45-50° C, retaining 88 and 82% of residual activity respectively. At 60°C, the enzyme activity decreased 40%. The divalent ions increased slightly AmiJ33 activity, however EDTA did not inhibit its activity, while SDS inhibited it completely.
Keywords: soils, α-amylase, Bacillus amyloliquefaciens, enzyme production.
Introducción
Las α-amilasas (E.C. 3.2.1.1) son enzimas que catalizan la hidrólisis de enlaces glucosídicos α-(1-4) con retención de la configuración del carbono anomérico, a partir de polímeros de glucosa, como el almidón y glucógeno. Tienen aplicaciones en diversos sectores: textil, papel, panificación, fermentación, producción de energéticos, preparación de ayudantes digestivos y farmacéuticos. Su principal aplicación es la producción de jarabes de glucosa, maltosa, maltotriosa, dextrina y/o fructosa (van der Maarel et al., 2002, 137). Biotecnológicamente, son las enzimas más importantes, sus ventas en el 2010 se estimaron en $480 millones de dólares, lo que es equivalente al 30% del mercado mundial de enzimas (Quintero et al., 2010, 31).
Las α-amilasas provenientes de hongos y bacterias son las más utilizadas en el sector industrial por sus múltiples ventajas: fácil disponibilidad, volumen de producción, estabilidad de operación, modificación y optimización del proceso. Las α-amilasas bacterianas del género Bacillus como B. subtilis, B. stearothermophilus, B. licheniformis y B. amyloliquefaciens, han encontrado una extensa aplicación en diversos procesos industriales debido a sus amplios rangos de operación de temperatura (25-90°C), resistencia a pH extremos (1.0-11.5) y altos niveles de expresión (Pandey et al., 2000, 135; Quintero et al., 2010, 31).
Generalmente, los niveles de expresión enzimática en los microorganismos son bajos, por lo que es necesario incrementarlos para su producción a nivel industrial. El crecimiento del microorganismo y la expresión enzimática están fuertemente influenciados por la composición del medio de cultivo, principalmente por la fuente de carbono y nitrógeno (Vijayabaskar et al., 2012, 4918; Premila and Dhandayuthapani 2013, 17; Zar et al., 2013, 120). En el caso de las amilasas de Bacillus sp. el uso de fuentes de nitrógeno orgánicas como extracto de levadura, peptona y triptona es determinante para aumentar su producción.
Debido a la creciente demanda de amilasas a nivel industrial, es muy importante el descubrimiento de nuevas cepas bacterianas con actividad amilasa con propiedades diferentes o únicas de nichos ambientales poco explorados.
En este trabajo se describe el aislamiento e identificación de bacterias productoras de amilasas a partir de suelos cultivados con caña de azúcar en la región de la Cuenca del Papaloapan, México. Se seleccionó la cepa B. amyloliquefaciens JJC33M debido a su no-patogenicidad y fácil detección visual de la actividad amilasa en placa. Se evaluaron tres fuentes de nitrógeno y la inclusión de Ca+2 en la producción enzimática. Se caracterizó bioquímicamente la amilasa seleccionada, evaluando el efecto del pH, la temperatura, sales metálicas sobre la actividad enzimática y la termoestabilidad de 40-60°C.
Método
Aislamiento y selección de bacterias.
Las muestras de suelo se colectaron de cultivos de caña en la región del Papaloapan en el estado de Oaxaca (18° 7' Norte, 96° 17'.577 Oeste, altitud 50 m). Las muestras (500 g) se tomaron a una profundidad de 0-15 cm, se colocaron en bolsas de nylon y se almacenaron a 4°C. Tras su homogenización, se tomó 1 g de muestra y se resuspendió en 1 L de peptona 1% (P/V). Posteriormente, se realizaron diluciones seriales hasta 10-6, inoculando 100 μl de cada dilución sobre cajas Petri con agar nutritivo, las cuales se incubaron a 37°C por 48 h. Después, las cepas fueron resembradas en agar nutritivo con almidón 1% (P/V) incubándose a 37°C por 48 h, a continuación las cajas se inundaron con lugol. Las cepas con actividad amilasa mostraron halos transparentes alrededor de la colonia, éstas se resembraron por punción en agar nutritivo y almidón 1% (P/V) por triplicado para medir la relación diámetro del halo/diámetro de colonia (DH/DC) (Vaseekaran et al., 2010, 1). Las cepas con mayor cociente de DH/DC fueron seleccionadas para experimentos posteriores.
Caracterización molecular de las cepas aisladas
Los aislados se caracterizaron molecularmente mediante el análisis del gen 16s DNA. El ADN genómico se extrajo de 1.5 ml de cultivo incubado por 16 h a 37°C utilizando el kit DNA microbial isolation (MOBIO). El gen 16S DNA fue amplificado por PCR usando los oligonucleótidos fD1 y rD1 bajo las condiciones establecidas por Weisburg et al. (1991, 697). Los amplicones fueron purificados y secuenciados por Macrogen, Inc. El análisis filogenético se obtuvo por máxima verosimilitud, bajo un modelo de sustitución de tres parámetros Tamura Nei y con 1500 réplicas de Bootstrap, con el software MEGA V.5.
Selección de la fuente de nitrógeno
La selección de la fuente de nitrógeno se realizó en cajas Petri en medio sólido usando el medio basal (MB) (g/L): 5.0 (NH4)22SO4, 0.5 citrato de sodio, 6.0 K2HPO4, 3.0 KH2PO4, 0.2 MgSO4, 0.01 MnSO4, 0.01 FeSO4, 0.001 ZnSO4 y 10 de almidón, cambiando o adicionando (g/L): 5 extracto de levadura, 10 peptona, 1.0 glicina y 0.1 CaCl2. Todos los experimentos se realizaron por triplicado. La fuente de nitrógeno se seleccionó mediante la relación DH/DC del aislado Bacillus sp. JJC33M. Las cajas se incubaron a 37°C, 24 h y la actividad amilasa se reveló con lugol.
Análisis estadístico
Se realizó un diseño unifactorial de las combinaciones de las fuentes de nitrógeno y Ca2+ mediante MINITAB V14 realizando un ANOVA (α=0.05) de las medias de la relación DH/DC y seleccionando la prueba de Tukey (α=0.05) para identificar la media significativamente más alta. Se empleó la misma prueba estadística para evaluar el efecto de los iones sobre la actividad de AmiJ33.
Producción enzimática
Bacillus sp. JJC33M, se cultivó en medio líquido compuesto por (g/L): 10 almidón, 5.0 (NH4)2SO4, 0.5 citrato de sodio, 6.0 K2HPO4, 3.0 KH2PO4, 0.2 MgSO4, 0.01 MnSO4, 0.01 FeSO4, 0.001 ZnSO4, 5 extracto de levadura y 0.1 CaCl2, a 37°C, 180 rpm por 24h. Las células se centrifugaron a 5000g por 15 min a 4°C. El sobrenadante se precipitó con (NH4)2SO4 60%, se concentró 100 veces con ultrafiltros de 10 kDa. El extracto enzimático crudo (ExC) se utilizó para posteriores mediciones enzimáticas.
Determinación de la actividad enzimática
La velocidad inicial de reacción se midió a 37°C en amortiguador de fosfatos (AP) 50 mM, pH 7.0, almidón 1% (P/V), cuantificando los azúcares reductores liberados mediante el método del ácido 3,5-dinitrosalicílico (DNS) a 540 nm (Miller 1959, 426). Una unidad de actividad (U) se definió como la cantidad de enzima que produce un micromol de glucosa por minuto.
Electroforesis de proteínas
Las proteínas se separaron por electroforesis en geles SDS-PAGE 10% en condiciones desnaturalizantes (Laemmli 1970, 680). El gel fue teñido con azul de Coomassie.
Efecto de pH, temperatura, termoestabilidad, agentes iónicos y desnaturalizantes en la actividad amilasa.
El efecto del pH sobre la actividad amilasa se midió incubando 1 U/mL del ExC con CaCl2 1 mM y almidón 10 g/L en AP 50 mM (pH de 4-6) y en amortiguador de acetato de sodio 50 mM (pH de 7-8), a 37°C por 15 min. El efecto de la temperatura sobre la actividad amilasa se determinó a pH 6 en AP 50 mM incubando 1 U/mL del ExC con CaCl2 1 mM y almidón 10 g/L en el intervalo de 40-100°C. La actividad amilasa fue determinada por la técnica del DNS. La termoestabilidad de la enzima se determinó a 40, 45, 50 y 60°C, midiendo su actividad residual a 37°C, con CaCl2 1 mM, almidón 10 g/L en AP 50 mM pH 6. Todos los ensayos se realizaron por triplicado.
La influencia de agentes iónicos (1 mM) sobre la actividad amilasa se investigó usando CaCl2, FeSO4, ZnSO4, MgSO4, KH2PO4, MnSO4 y NaCl. Se evaluó el efecto de SDS (10% v/v), β-mercaptoetanol (10% v/v) y EDTA (1, 5 y 10 mM) preincubando la enzima a 37°C por 1 h, posteriormente se adicionó almidón 10 g/L para determinar la actividad residual por medio de la técnica del DNS a 37°C. El control fue cuantificado en ausencia de iones y de agentes quelantes. Todos los ensayos se realizaron por triplicado.
Resultados y discusión
Aislamiento e identificación de los aislados bacterianos
Se obtuvieron 12 aislados con actividad amilolítica que se analizaron filogenéticamente mediante el gen 16S DNA. Se identificaron cepas principalmente del género Bacillus, Lysinibacillus y Pseudomonas (fig. 1). NM2 y NM24 comparten un 97% de cobertura y 93% de identidad con Bacillus subtilis y B. amyloliquefaciens; mientras que JJ31, JJ33M y JJ33N presentan 100% de cobertura y 99% de identidad con esas mismas especies. Los aislados NM33, NM19 y NM35 presentan 99% de cobertura e identidad con B. pumillus. El aislado NM21 presenta 100% de identidad con B. cereus. Por otro lado, NM25 tiene 99% de identidad con Lysinibacillus sphaericus. NM31 presentó 99% de identidad con Pseudomonas sp. mientras que NM17 solo presentó 91% de identidad con esta misma especie, lo cual sugiere que podría representar una especie o género nuevo, sin embargo es necesario realizar estudios moleculares complementarios como el análisis del marcador 23S para una adecuada clasificación (Xu and Coté, 2003). La cepa JJC33M fue seleccionada para la producción de amilasa ya que presentó la mayor relación DH/DC en medio sólido (datos no mostrados) además de ser GRAS. Diversos autores han demostrado que existe una relación lineal entre el tamaño del halo de degradación en medio sólido y la actividad enzimática (Alves et al., 2002, 325; Vaseekaran et al., 2010, 1, Juwon et al., 2012, 57), por lo que se utilizó este procedimiento para seleccionar la cepa.
Caracterización de Bacillus amyloliquefaciens JJC33M
B. amyloliquefaciens JJC33M es un bacilo, Gram positivo, catalasa positiva e indol negativo, fermenta glucosa, sacarosa y manitol. Produce y excreta otras enzimas como β-glucosidasas y proteasas.
Selección del medio de cultivo para la producción de la amilasa de Bacillus amyloliquefaciens JJC33M
La producción de amilasas en el género Bacillus está relacionada con la complejidad, naturaleza y concentración de la fuente de nitrógeno, regulándola de manera positiva o negativa (Premila and Dhandayuthapani 2013, 17; Thippeswamy et al., 2006, 295). Las fuentes de nitrógeno complejas más estudiadas para la producción de α-amilasas en especies de Bacillus son extracto de levadura (EL) y peptona (P), aunque la utilización de aminoácidos y Ca+2 en el medio de cultivo puede incrementar la producción (Zhang et al., 1983, 293). En este estudio se probaron quince medios de cultivo en caja, donde se combinaron EL, P, CaCl2 (Ca+2) y G (fig. 2). El ANOVA mostró que la combinación de las fuentes de nitrógeno y Ca2+ tienen un efecto significativo sobre la relación DH/DC, lo cual fue determinado por el valor de P < 0.05. Mediante la prueba de Tukey (α=0.05) se determinó que las combinaciones de EL-Ca+2 y EL-G fueron los mejores tratamientos, aumentando la DH/DC 2.25 veces con respecto al control. La P sola tuvo el mismo efecto que el EL, siendo el segundo mejor tratamiento, sin embargo cuando la P se combinó con Ca+2 y G tuvo un efecto incipiente sobre la producción de amilasas (α=0.05) (fig. 2). Del mismo modo, la combinación G-Ca+2 no favoreció la producción de amilasas, mostrando casi el mismo nivel de producción que el control. En los casos donde se combinaron G-P-EL, G-P-Ca+2, el exceso de nutrientes favoreció la producción de biomasa, en detrimento de la producción de amilasa. Resumiendo, el EL en combinación con Ca+2 y G fue la mejor fuente de nitrógeno para la producción de amilasa, por su alto contenido de minerales, vitaminas, coenzimas y componentes nitrogenados (Vijayabaskar et al., 2012, 4918).
Estos resultados coinciden con la bibliografía. En el caso de Bacillus stearothermophilus KDP la mejor fuente de nitrógeno fue EL 1% (Premila and Dhandayuthapani 2013, 17). B. amyloliquefaciens IIB-14 mostró la máxima producción de amilasa con EL 1% en conjunto con NH4NO3 1% (Zar et al., 2013, 120). Sin embargo, para B. licheniformis ATCC 12759 la actividad se vio favorecida en presencia de caseína y sales orgánicas, observando solo el 50% de actividad máxima con EL (Akcan 2011, 6833). Bacillus sp aumentó su actividad amilasa cuando se combinó Ca+2(10 mM), P (1%) y EL (0.5%) (Teodoro and Martins 2000, 298). Thippeswamy et al., (2006, 295) observaron que Bacillus sp. solo produjo amilasa en presencia de fuentes de nitrógeno complejas, produciendo la máxima actividad con P, seguida de EL, triptona y extracto de carne. El uso de aminoácidos ha tenido efecto en la producción de amilasa, en el caso de B. licheniformis ATCC 12759 la utilización de L-cisteína incrementó la producción en 36%, sin embargo la G la decrementó en 25% (Akcan 2011, 6833), es decir su incorporación regula la síntesis y excreción de la enzima (Gupta et al., 2003, 1599). En este estudio la G no tuvo un efecto importante en la producción de la enzima, solo en sinergia con EL.
Producción de la amilasa de Bacillus amyloliquefaciens JJC33M
La amilasa de B. amyloliquefaciens JJC33M fue producida en medio líquido MB con almidón 10 g/L, EL 5 g/L y Ca+2 (10 mM) a 180 rpm, 37°C, ya que ésta última se ha reportado como la temperatura de producción óptima de amilasas en diversas cepas de Bacillus (Gangadharan et al., 2006, 269; Aygan et al., 2008, 547; Devi et al., 2010, 2534). Durante el cultivo de B. amyloliquefaciens JJC33M se observó un aumento en la producción de azúcares reductores en correlación con el crecimiento, ratificando su cuantificación como método de determinación de actividad amilasa. Cuando el cultivo alcanzó la fase estacionaria se obtuvo la mayor cantidad de azúcares reductores (18 h), indicando la etapa de mayor producción enzimática (fig. 3). Se ha reportado que durante la fase estacionaria se obtiene la mayor producción de amilasas en diversas cepas de Bacillus (Roychoudhary et al., 1989, 197; Malhotra et al., 2000, 378; Gangadharan et al., 2006, 269; Ray et al., 2008, 234; Aygan et al., 2008, 547; Vaseekaran et al., 2010, 1).
Purificación y determinación del peso molecular de la amilasa de Bacillus amyloliquefaciens JJC33M
La amilasa fue purificada a partir del ExC de B. amyloliquefaciens JJC33M mediante precipitación con sulfato de amonio. La fracción del 60% presentó actividad amilasa. Diversos autores han reportado la recuperación de amilasas de Bacillus sp. saturando con sulfato de amonio al 40% (Quintero et al., 2010, 31; Bano et al., 2011, 255), 50 y 80% (Shaw et al., 1995, 195), 70 y 80% (Aygan et al., 2008, 547; Gangadharan et al., 2009, 653).
La fracción ultrafiltrada, nombrada como AmiJ33, se analizó por medio de SDS-PAGE, estimando el peso molecular en 50 kDa (fig. 4). Los pesos moleculares reportados para amilasas producidas por Bacillus varían, 56 kDa para B. subtilis HAS (Bano et al., 2011, 255), 58 kDa para B. amyloliquefaciens (Gangadharan et al., 2009, 653) y 66 kDa para Bacillus sp. (Aygan et al., 2008, 547) cuando las muestras migran en condiciones desnaturalizantes.
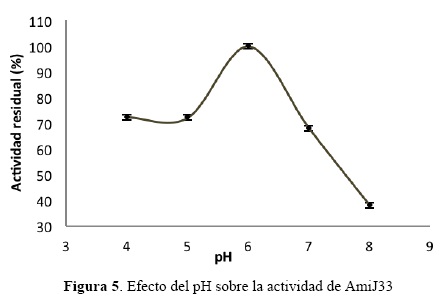
Efecto del pH sobre la actividad amilasa.
La actividad de AmiJ33 se evaluó en un intervalo de pH de 4.0-8.0. La mayor actividad se registró a pH 6.0 (fig. 5). Entre pH 4.0 y 5.0 la enzima mostró el 72% de la actividad, mientras que a pH 7.0 y 8.0, mantuvo el 68 y 38% de la actividad respectivamente. La mayoría de las amilasas que se conocen presentan mayor actividad a valores de pH neutro o ligeramente ácidos, también se sabe que la actividad disminuye rápidamente a pH alcalino (Bessler et al., 2003, 2141; Goyal et al., 2005, 723; Teodoro and Martins 2000, 298; Gupta et al., 2003, 1599). Sin embargo, AmiJ33 presenta una ventaja sobre las amilasas conocidas, ya que a pH 4.0 mantiene el 72% de la actividad, por lo que podría emplearse en procesos industriales bajo estas condiciones.
Efecto de la temperatura en la actividad y la estabilidad térmica.
El efecto de la temperatura sobre la actividad de AmiJ33 se evaluó de 40-100°C (fig. 6). Se observó un aumento de la actividad desde los 50°C hasta los 80°C, alcanzándose la máxima actividad a 80°C (13.056 U/ml). Posteriormente, la actividad disminuyó drásticamente con el aumento de la temperatura, indicando que entre los 90 y 100°C AmiJ33 ya no es activa. A 70°C AmiJ33 presentó el 76% de la actividad. La mayoría de las amilasas producidas por especies de Bacillus muestran su temperatura óptima entre 50-80°C (Vihinen and Mantsala 1989, 329; Wind et al., 1994, 155; Rasooli et al., 2008, 591), las amilasas con temperatura óptima a 90ºC pertenecen a B. licheniformis (Krishnan and Chandra 1983, 430).

El efecto de la temperatura en la estabilidad se examinó entre 40-70°C. AmiJ33 mantuvo el 100% de su actividad a 40°C después de 3 h de incubación, cuando se incubó a 45 y 50°C por 1 h, la actividad residual disminuyó ligeramente, mostrando 88 y 82% de las actividades iniciales, respectivamente (fig. 7). Al incubarse a 60°C durante 1 h, la actividad residual fue de 60%. Como muchas amilasas, AmiJ33 presenta una temperatura óptima alta (80°C), sin embargo no es estable a temperaturas elevadas, como la amilasa de Bacillus sp. I-3 que tiene una temperatura óptima de 70°C, pero incubada por 30 min solo mantiene el 30% de actividad inicial (Goyal et al., 2005, 723). En el mismo sentido, la α-amilasa de B. subtilis AX20 mostró estabilidad a 50°C por 45 min (Najafi et al., 2005, 349). Asimismo, la amilasa de B. amyloliquefaciens fue menos estable que AmiJ33, ya que después de haberse incubado 30 min a diferentes temperaturas 40, 50, 60,70 y 80°C mostró 85, 62, 55 y 20% de actividad residual, respectivamente (Gangadharan et al., 2009, 653).

Efecto de diferentes agentes iónicos, quelantes y surfactantes sobre la actividad amilasa
En algunos casos, la actividad amilasa es afectada por iones metálicos. Se evaluaron iones monovalentes, divalentes y compuestos más complejos con actividad reductora o quelante (fig. 8). Los resultados se evaluaron mediante una prueba de medias de Tukey (α=0.05). La inclusión
de β-mercaptoetanol al 10% en el medio de reacción incrementó la actividad enzimática de AmiJ33 en 50.27%, mostrando estadísticamente la media más alta (fig. 8). Se ha observado, de manera limitada, el efecto positivo sobre la actividad de agentes reductores como el DTT y el β-mercaptoetanol en otras amilasas (Ballschmiter et al., 2006, 2206; Aygan et al., 2008, 547). Si AmiJ33 contiene puentes disulfuro, es posible que éstos no sean determinantes para la actividad y por lo tanto su reducción podría conferirle mayor flexibilidad y con ello aumentar la interacción con el sustrato (Carugo et al., 2003, 637). Por otro lado, el SDS al mismo porcentaje inhibió por completo la actividad. Los resultados anteriores parecen indicar que esta enzima no posee puentes disulfuro intra o intermoleculares, que se vean afectados y desestabilicen la estructura de la enzima por este compuesto. Soportando esto, se tiene el estudio de Alikhajeh et al (2010, 121), donde en la estructura cristalina de la amilasa BAA de B. amyloliquefaciens, interacciona el residuo Asn222 de la cadena A con el grupo carbonilo de la cadena B vía puentes de hidrógeno. Los resultados obtenidos suponen la factibilidad de aplicación de AmiJ33 en un medio con β-mercaptoetanol, por ejemplo en procesos de óxido-reducción. Por lo que respecta al EDTA, éste no tuvo efecto significativo sobre la actividad (α=0.05), incluso a concentraciones elevadas (10 mM) y largos periodos de incubación (hasta 24 h), lo que indicaría que AmiJ33 no es una metaloenzima.
Por otra parte, de los iones monovalentes empleados, sólo el Na+ tuvo un efecto benéfico al incrementar la actividad de AmiJ33 en un 15%. Los iones divalentes Ca+2, Fe+2 y Zn+2 incrementaron la actividad de la enzima, obteniéndose el mayor aumento porcentual de la actividad (21.72%) al incorporar Zn+2 en el medio de reacción. Es posible, que la presencia de iones Zn+2, Fe+2, Ca+2 y Na+ tengan un papel de estabilización estructural, aunque no de manera crucial.
Posiblemente la baja estabilidad térmica de AmiJ33 se deba a la carencia de Ca+2 estructural, se ha observado que aquellas amilasas que presentan cuatro iones Ca+2 por cada subunidad, ubicados dos de ellos al sitio activo, son termoestables, incluso a temperaturas mayores a 70ºC (Alikhajeh et al., 2010, 121).
Conclusiones
AmiJ33 a diferencia de las amilasas producidas por otras cepas de B. amyloliquefaciens, no es una metaloenzima, lo que le da una ventaja en la producción de jarabes fructosados previa sacarificación del almidón. Asimismo AmiJ33 podría aplicarse en el sector de panificación, ya que es estable a 40°C y se inactiva a temperaturas altas. También su estabilidad frente al β-mercaptoetanol y su pH de actividad posibilita su aplicación en reacciones de óxido-reducción.
Agradecimientos
Este trabajo fue financiado por PROMEP 2009-02 103.5/11/6149 y CONACyT 154683. A Brenda Valderrama Blanco por el financiamiento inicial.
Referencias
Akcan, Nurullah. (2011). High level production of extracellular α-amylase from Bacillus licheniformis ATCC 12759 in submerged fermentation. Romanian Biotechnological Letters 16:6833-6840. [ Links ]
Alikhajeh, Jahan, Khosro Khajeh, Ranjbar Bijan, Naderi-Manesh Hossein, Yi-Hung Lin, Enhung Liu, Hong-Hsiang Guan, Yin-Cheng Hsieh, Phimonphan Chuankhayan, Yen-Chieh Huang, Jeyakanthan Jeyaraman, Ming-Yih Liua, y Chun-Jung Chena. (2010). Structure of Bacillus amyloliquefaciens a-amylase at high resolution: implications for thermal stability. Acta Crystallographica Section F Structural Biology and Crystallization Communications. F66, 121–129 [ Links ]
Alves, Maria Helena, Campos-Takaki, Galba M., Figueiredo-Porto, Ana Lúcia y Milanez, Ivo Milanez. (2002). Screening of Mucor spp. for the production of amylase, lipase, polygalacturonaseand protease. Brazilian Journal of Microbiology 33:325-330. [ Links ]
Aygan, Ashabil, Arikan Burhan, Korkmaz Hatice, Dinçer Sadik y Çolak Ömer. (2008). Highly thermostable and alkaline α-amylase from a halotolerant alkaliphilic Bacillus sp. AB68. Brazilian Journal of Microbiology 39: 547-553. [ Links ]
Ballschmiter, Meike, Futterer, Ole, Wolfgang Liebl (2006) Identification and characterization of a novel intracellular alkaline-amylase from the hyperthermophilic bacterium Thermotoga maritima MSB8. Applied and Environmental Microbiology 72: 2206–2211 [ Links ]
Bano, Saeeda, Qader, Shah, Ali Ul, Aman Afsheen, Syed, Muhammad Noman y Azhar, Abid. (2011). Purification and characterizationof novel α-amylase from Bacillus subtilis KIBGE HAS. AAPS Pharmscitech. 12:255-264. [ Links ]
Bessler, Cornelius, Schmitt, Jutta, Maurer, Karl Heinz y Schmid, Rolf D. (2003). Directed evolution of a bacterial -amylase: toward enhanced pH performance and higher specific activity. Protein Science 12:2141–2149. [ Links ]
Devi, Lamabam Sophiya, Khaund, Polashree y Joshi, S. R. (2010). Thermostable amylase from natural variants of Bacillus spp. prevalent in eastern Himalayan Range. African Journal of Microbiology Research 23:2534-2542. [ Links ]
Gangadharan, Dhanya, Sivaramakrishnan, Swetha, Nampoothiri, K. Madhavan y Pandey, Ashok. (2006). Biochemical characterization of raw-starch-digesting alpha-amylase purified from Bacillus amyloliquefaciens. Food Technology and Biotechnology 2:269–274 [ Links ]
Gangadharan, Dhanya, Nampoothiri, K. Madhavan, Sivaramakrishnan, Swetha y Pandey, Ashok. (2009). Biochemical characterization of raw-starch-digesting alpha amylase purified from Bacillus amyloliquefaciens. Applied Biochemistry and Biotechnology 158:653–662. [ Links ]
Goyal, Nidhi, Gupta, J.K. y Soni, S.K. (2005). A novel raw starch digesting thermostable α-amylase from Bacillus sp. I-3 and itsuse in the direct hydrolysis of raw potato starch. Enzyme and Microbial Technology 37:723–734. [ Links ]
Gupta, Rani, Gigras, Paresh, Mohapatra, Harapriya, Goswami, Vineet Kumar y Chauhan, Bhavna. (2003). Microbial α-amylases: a biotechnological perspective. Process Biochemistry 38:1599-1616. [ Links ]
Juwon, Arotupin Daniel y Emanuel, Ogunmalu Funso. (2012). Screening of fungal isolates from nigerian tar sand deposit in ondo state for novel biocatalysts. Journal of Biological Sciences 12:57-61 [ Links ]
Krishnan, T., y Chandra, A. K. (1983). Purification and characterization of α-amylase from Bacillus licheniformis CUMC305. Applied and Environmental Microbiology 46:430-437. [ Links ]
Laemmli U.K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227:680-684. [ Links ]
Malhotra, R., y Noorwez S. M, Satyanarayana T. (2000). Production and partial characterization of thermostable and calcium independent α-amylase of extreme thermophile Bacillus thermooleovorans NP54. Letters in Applied Microbiology 31:378–384. [ Links ]
Miller Gail Lorenz. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry. 31: 426–428 [ Links ]
Najafi, Mohsen Fathi, Deobagkar, Dileep, y Deobagkar, Deepti. (2005). Purification and characterization of an extracellular alpha-amylase from Bacillus subtilis AX20. Protein Expresion and Purification. 2:349-354. [ Links ]
Pandey, Ashok, Nigam Poonam, Soccol Carlos R., Soccol Vanete T., Singh Dalel y Mohan, Radjiskumar. (2000). Advances in microbial amylases. Biotechnology Applied Biochemistry 31: 135-152 [ Links ]
Premila, Sasi J., y Dhandayuthapani, K. (2013). Optimization of α-amylase production of Bacillus stearothermophilus KDP from Sago Industry Waste. Int. Journal Applied BioResearch 16:17-21 [ Links ]
Quintero, Moreno Mónica, Montoya, Campuzano Olga Inés, y Gutiérrez, Sánchez Pablo. A. (2010). Purification and characterization of a α-amylase produced by Bacillus sp. BBM1. Dyna 77: 31-38. [ Links ]
Rasooli, Iraj, Astaneh, Shakiba Darvish Alipoor, Borna, Hojjat y Barchini, Kamal Azizi. (2008). A thermostable a-amylase producing natural variant of Bacillus spp. isolated from soil in Iran. American Journal of Agricultural and Biological Sciences 3: 591-596 [ Links ]
Ray, R. C., Kar, S, Nayak S., y Swain, M. R. (2008). Extracellular α-amylase production by Bacillus brevis MTCC 7521. Food Biotechnology 22: 234–246 [ Links ]
Roychoudhary, Siddhartha, Parulekar, Satish J., y Weigand, William A. (1989). Cell growth and α-amylase production characteristics of Bacillus amyloliquefaciens. Biotechnology and Bioengineering 33: 197–206. [ Links ]
Shaw, Jei-Fu, Lin Fu-Pang, Chen Su-Chiu y Chen Hasing-Chen. (1995). Purification and properties of an extracellular α-amylase from Thermus sp. Botanical Bulletin of Academia Sinica 36:195-200. [ Links ]
Teodoro, Carlos Eduardo de Souza y Martins, Meire Lelis Leal. (2000). Culture conditions for the production of thermostable amylase by Bacillus sp. Brazilian Journal of Microbiology 31:298-302. [ Links ]
Thippeswamy S., Girigowda K., y Mulimani V. H. (2006). Isolation and identification of amylase producing Bacillus sp. from dhal industry waste. Indian Journal of Biochemistry and Biophysics 43:295-298 [ Links ]
van der Maarel, Marc J.E.C., van der Veen, Bart, Uitdehaag, Joost C.M., Leemhuis, Hans, y Dijkhuizen, L. (2002). Properties and applications of starch converting enzymes of the α-amylase family. Journal of Biotechnology 94:137–155. [ Links ]
Vaseekaran S., Balakumar S., y Arasaratnam V. (2010). Isolation and identification of a bacterial strain producing thermostable α-amylase. Tropical Agricultural Research 1:1-11 [ Links ]
Vihinen, Mauno y Mantsala, Pekka. (1989). Microbial amylolytic enzymes. Critical Reviews in Biochemistry and Molecular Biology 24:329-418. [ Links ]
Vijayabaskar, P., Jayalakshmi D., y Shankar, T. (2012). Amylase production by moderately halophilic Bacillus cereus in solid state fermentation. African Journal of Microbiology Research 23:4918-4926. [ Links ]
Weisburg, William G., Barns Susan M., Pelletier, Dale A., y Lane, David J. (1991). 16S Ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology. 173:697-703. [ Links ]
Wind, R. D., Buitelaar, R. M., Eggink, G., Huizing, H. J., Dijkhuizen, L. (1994). Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable a-amylase producing strain. Applied Microbiology and Biotechnology 41:155-162. [ Links ]
Xu D, Coté J. C. (2003) Phylogenetic relationships between Bacillus species and related genera inferred from comparison of 3' end 16S rDNA and 5' end 16S 23S ITS nucleotide sequences. Inter. Journal System and Evolutinary Microbiology 53: 695-704. [ Links ]
Zar, Mian Sahib, Ali, Sikander y Shahid, Ahmad Ali. (2013). The influence of carbon and nitrogen supplementation on alpha amylase productivity of Bacillus amyloliquefaciens IIB-14 using fuzzy-logic and two-factorial designs. African Journal of Microbiology Research. 2:120-129, [ Links ]
Zhang, Qixian, Tsukagoshi, Norihiro, Miyashiro, Shigeyoshi y Udaka, Shigezo. (1983). Increased production of α-amylase by Bacillus amyloliquefaciens in the presence of glycine. Applied and Environmental Microbiology 46:293-295. [ Links ]














