Introducción
La nutria neotropical Lontra longicaudis annectens es un depredador generalista ubicado en el nivel trófico más elevado. Su amplia distribución geográfica abarca desde el norte de México hasta la zona central de Argentina, a lo largo de la cual ocupa diversos hábitats acuáticos (Gallo, 1989, Spínola y Vaughan, 1995). La nutria vive en áreas con ciertos requisitos del paisaje: una amplia vegetación ribereña, suficiente alimento y buena cobertura de vegetación para facilitar su escape (Botello, 2004, Colares y Waldemarin, 2000, Gori et al., 2003), ya que en los márgenes del cauce es donde realizan actividades como descanso, marcaje de territorio, acicalamiento y cría de cachorros (Chanin, 1985, Kruuk, 1995).
Su alimentación se basa en peces, pero ocasionalmente comen crustáceos, moluscos, anfibios, reptiles, insectos, aves e incluso pequeños mamíferos. En general, son animales oportunistas y su dieta varía de acuerdo a la región geográfica donde se encuentren (Chanin, 1985).
Algunos autores exponen que las nutrias son los principales depredadores capaces de mantener un equilibrio en la estructura de la comunidad y la densidad de sus presas en los ecosistemas acuáticos (Anoop y Hussein, 2005). Los estudios sobre la dieta son importantes en la ecología de los vertebrados, en particular de mamíferos carnívoros (Gittleman, 1989, Monroy-Vilchis et al., 2009). En los carnívoros, el alimento puede condicionar la organización social, el uso de hábitat y las tasas de reproducción (Braña, Naves y Palomero, 1987). La dieta en los carnívoros es un aspecto biológico ampliamente estudiado, cuyo objetivo tradicional ha sido entender las interacciones que tienen con su medio y en particular con las especies presa (Casariego-Madorell et al., 2006, Guerrero et al., 2002, Monroy-Vilchis et al., 2009, Servín y Huxley, 1991).
Actualmente en México, la nutria se encuentra como «amenazada» de acuerdo a la NOM-059-SEMARNAT-2010 (Semarnat, 2010). Además, se encuentra en el apéndice i de CITES (CITES, 2016) y en la lista roja de especies amenazadas la podemos encontrar en la categoría de casi amenazada (Rheingantz y Trinca, 2015). En Durango, existen pocos estudios documentados sobre la presencia de la nutria y más escasos aun sobre la dieta de esta especie, por lo que el objetivo del presente trabajo fue identificar los grupos taxonómicos que componen la dieta de la nutria en la parte alta del río San Diego en Pueblo Nuevo, Durango, información que coadyuvará a la conservación de esta especie.
Materiales y métodos
El estudio se llevó a cabo en el ejido Adolfo Ruiz Cortínez (sic), municipio de Pueblo Nuevo, Durango, México, el cual se ubica en: 23°44’08” N, 105°17’52” O (Fig. 1), en la región suroeste del estado de Durango, en las estribaciones de la Sierra Madre Occidental, en la subprovincia Cañones Duranguenses, a 20 km al sureste de la ciudad de El Salto, Pueblo Nuevo, Durango (AFAE, 2007). El área se encuentra en la región hidrológica 11 (Presidio-San Pedro) y comprende a las cuencas B (río Acaponeta) que incluye la subcuenca d (Q. San Vicente) (Inegi, 2016). Específicamente el estudio se realizó en la parte que comprende el río San Diego, en la quebrada de Galindo. En esta área el río se encuentra encañonado, solo se tienen partes abiertas al principio y al final del tramo muestreado. En las partes altas, la vegetación está compuesta por bosque de Pinus y Quercus principalmente, y en la parte baja a las orillas del río se observa vegetación ribereña conformada por los géneros: Salix, Populos, Bursera, Lysiloma y Pithecellobium, entre otros. Según la clasificación climática de Köppen adaptada para México por García (1981), los climas presentes en el predio son: C(W2)-templado subhúmedo y C(E)(W2)-semifrío subhúmedo.
Se muestrearon 8 km del río divididos en 3 segmentos de 2.6 km aproximadamente, considerando diferencias fisiográficas: profundidad del río, ancho del cauce, tipo de flujo, encañonado o abierto y presencia de chorros de agua caliente. Se realizaron recorridos por la ribera del río en cada estación del año (de 2012 a 2013). Los recorridos se efectuaron caminando por la orilla del río. Las heces encontradas durante el recorrido se colocaron en bolsas de papel, rotuladas con la fecha y la posición geográfica (Monroy-Vilchis y Mundo, 2009). La identificación de las heces se realizó considerando: forma de la excreta y olor de la misma (siempre presentan un olor almizclado; Macías-Sánchez, 2003). Se procesaron en el Laboratorio de Ornitología de la Universidad Autónoma de Nuevo León, donde se lavaron en agua corriente y posteriormente fueron secadas a temperatura ambiente. Los componentes fueron separados con ayuda de pinzas y agujas de disección (Macías-Sánchez y Aranda, 1999). Para la determinación específica de los restos óseos de mamíferos (mandíbulas, dientes y extremidades) se hizo una comparación con ejemplares de laboratorio y la guía de pelos de guardia de Monroy-Vilchis y Rubio-Rodríguez (2003). En el caso de los peces y anfibios, mediante la comparación de ejemplares colectados en campo usando la identificación de vértebras, espinas, escamas, cráneos, dientes faríngeos y otolitos. Para insectos, se utilizaron guías taxonómicas de identificación (Fierros-López, 2003); en cuanto a la vegetación ingerida, el reconocimiento se realizó mediante la comparación con ejemplares del laboratorio de botánica y con ayuda de especialistas del Instituto Tecnológico de El Salto, Pueblo Nuevo, Durango. El material fue identificado hasta el nivel taxonómico posible (Monroy-Vilchis y Mundo, 2009).
Para determinar las especies más importantes en la dieta se utilizaron 2 índices (Helder y de Andrade, 1997): 1) la frecuencia de aparición de cada especie presa en las muestras; FA = fi/N*100 donde: fi es el número de heces en los que aparece la especie i y N es el número total de heces; 2) la proporción de aparición de cada especie presa en las muestras; PA = fi/F*100 donde: fi es el número de heces en las que aparece la especie i y F el número total de apariciones de todas las especies en todas las heces, que se obtienen sumando las fi.
Se obtuvieron los índices de diversidad de Shannon (1948) por segmento del río muestreado para las 4 estaciones del año (primavera, verano, otoño e invierno) y para las temporadas de secas y de lluvias.
donde: k es el número de categorías, pi es la proporción de las observaciones encontradas en la categoría i. Denota n para ser tamaño de la muestra y fi para ser el número de observaciones en la categoría i. Entonces pi = fi/n.
Posteriormente se realizó la comparación entre los índices de diversidad, para las temporadas secas y lluvias. Se aplicó una prueba «T» de student para ver si existía diferencia significativa. Las estaciones del año se compararon mediante un análisis de varianza completamente al azar de un factor (Zar, 1999), y para conocer si existían diferencias entre los 3 segmentos del río, se realizaron curvas de rarefacción, las cuales nos permiten hacer comparaciones de riqueza de especies o diversidad de Shannon en este caso entre comunidades, cuando el tamaño de las muestras no es igual (Moreno, 2001).
Resultados
Se recolectaron 116 y 150 heces durante el 2012 y 2013 respectivamente, de las cuales se identificaron 7 grupos alimenticios: los invertebrados (insectos, arácnidos, diplópodos y gastrópodos) fueron los de mayor porcentaje de aparición total para los 2 años de muestreo, con un 39.45%, seguido de peces (34.86%), plantas (8.26%), anfibios (8.07%), mamíferos (2.20%), aves (1.83%) y reptiles (0.37%), el 4.95% restante fueron grupos no identificados.
El segmento 2 presentó un mayor número de ítems alimenticios por grupo para los 2 años de muestreo, seguido del segmento 3, destacando los invertebrados y peces con mayor porcentaje de frecuencia en ambos segmentos, y aunque en el segmento 1 los valores de frecuencia fueron más bajos que para los otros 2, igualmente destacan estos 2 grupos alimenticios como los más frecuentes (Fig. 2).
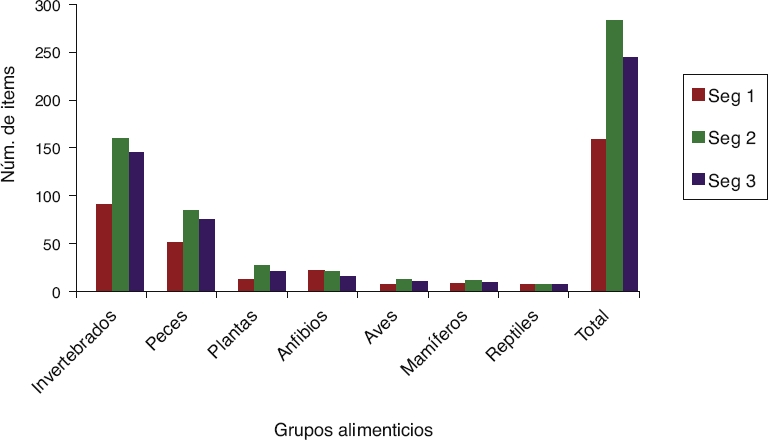
Figura 2 Total de ítems por segmento incluyendo los 2 años de muestreo. Seg 1 (aguas arriba), seg 2 (intermedio), seg 3 (aguas abajo).
La única estación del año en la que se encontraron ítems de todos los grupos alimenticios fue en la primavera. Peces, invertebrados, anfibios y plantas estuvieron presentes en todas las estaciones del año, los demás solo se observaron en una ó 2 estaciones, como las aves y reptiles que únicamente se encontraron para el periodo de primavera (Fig. 3).
El pez Gila conspersa presentó los valores más altos de frecuencia de aparición y de porcentaje de aparición para ambos años (FA1 = 56.03; PA1 = 25.69 y FA2 = 83.33; PA2 = 30.12), seguido de los insectos Corydalus texanus (FA1 = 27.59; PA1 = 12.65 y FA2 = 61.33; PA2 = 22.17) y Abedus sp. (FA1 = 18.97; PA1 = 8.70 y FA2 = 53.33; PA2 = 19.28). Estas mismas especies fueron las más consumidas por la nutria en general para todo el periodo de muestreo (F = 190, F = 124 y F = 102, respectivamente). Por otra parte, las especies menos consumidas fueron ítems del grupo de las plantas las cuales no pudieron ser identificadas (Tabla 1).
Tabla 1 Contenido de muestras fecales de la nutria, frecuencia (F), frecuencia de aparición (FA) y porcentaje de aparición (PA) en los dos años de muestreo.
| Morfo | Nombre del ítem | F 2012 (n = 116) | FA1 | PA1 | F 2013 (n = 150) | FA2 | PA2 |
|---|---|---|---|---|---|---|---|
| 1 | Peces | ||||||
| Gila conspersa | 65 | 56.03 | 25.69 | 125 | 83.33 | 30.12 | |
| 2 | Insectos | ||||||
| Corydalus texanus | 32 | 27.59 | 12.65 | 92 | 61.33 | 22.17 | |
| 3 | Ladona sp. | 22 | 18.97 | 8.70 | 61 | 40.67 | 14.70 |
| 4 | Abedus sp. | 22 | 18.97 | 8.70 | 80 | 53.33 | 19.28 |
| 5 | Lethocerus sp. | 17 | 14.66 | 6.72 | 12 | 8.00 | 2.89 |
| 6 | Ambrysus sp. | 4 | 3.45 | 1.58 | 1 | 0.67 | 0.24 |
| 7 | Orden: Orthoptera | 5 | 4.31 | 1.98 | 2 | 1.33 | 0.48 |
| 8 | Orden: Coleoptera | 3 | 2.59 | 1.19 | 0 | 0 | 0 |
| 9 | Orden: Coleoptera | 11 | 9.48 | 4.35 | 0 | 0 | 0 |
| 10 | Arácnidos | ||||||
| Mastigoproctus giganteus | 4 | 3.45 | 1.58 | 0 | 0 | 0 | |
| Diplópodos | |||||||
| 11 | Clase: Diplopoda | 5 | 4.31 | 1.98 | 0 | 0 | 0 |
| Gastrópodos | |||||||
| 12 | Clase: Gastropoda Plantas | 9 | 7.76 | 3.56 | 1 | 0.67 | 0.24 |
| 13 | Juniperus sp. | 15 | 12.93 | 5.93 | 2 | 1.33 | 0.48 |
| 14 | Planta 1 (no identificada) | 1 | 0.86 | 0.40 | 0 | 0 | 0 |
| 15 | Arbutus sp. | 8 | 6.90 | 3.16 | 0 | 0 | 0 |
| 16 | Planta 2 (no identificada) | 3 | 2.59 | 1.19 | 2 | 1.33 | 0.48 |
| 17 | Planta 3 (no identificada) | 5 | 4.31 | 1.98 | 5 | 3.33 | 1.20 |
| 18 | Planta 4 (no identificada) | 3 | 2.59 | 1.19 | 0 | 0 | 0 |
| 19 | Planta 5 (no identificada) | 1 | 0.86 | 0.40 | 0 | 0 | 0 |
| 20 | Mamíferos | ||||||
| Orden: Rodentia | 6 | 5.17 | 2.37 | 0 | 0 | 0 | |
| 21 | Aves | ||||||
| Clase: Aves | 1 | 0.86 | 0.40 | 2 | 1.33 | 0.48 | |
| 22 | Reptiles | ||||||
| Thamnophis validus | 0 | 0.00 | 0.00 | 2 | 1.33 | 0.48 | |
| 23 | Anfibios | ||||||
| Hyla arenicolor | 11 | 9.48 | 4.35 | 28 | 18.67 | 6.75 |
La diversidad de Shannon del total de los ítems alimenticios presentó diferencias significativas (t = 2.09; p = 0.03) entre la temporada de secas (Hí = 2.5) y de lluvias (Hí = 2.3) para el año 2012, mientras que para el año 2013 no hubo diferencias significativas (t = 1.31; p = 0.19) entre estas 2 temporadas (H'secas = 1.7; Hílluvias = 1.6). Considerando todo el periodo de muestreo, los resultados mostraron diferencias altamente significativas (t = 9.86; p = 4.87E-21) entre el 2012 y 2013 (Hí2012 = 2.5; Hí2013 = 1.7). El índice de diversidad Shannon fue más alto para las 4 estaciones del año en el 2012, que para las mismas estaciones en el 2013; igualmente para los segmentos por año, fueron más bajos los valores para el 2013 que para el 2012 (Tabla 2).
Tabla 2 Índice de diversidad de Shannon por segmento del río, temporadas y estaciones del año.
| Año | Temporada | Estación | Segmento | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Secas | Lluvias | Primavera | Verano | Otoño | Invierno | 1 | 2 | 3 | |||
| 2012 | 2.55 | 2.3 | 2.36 | 2.24 | 2.25 | 2.4 | 2.17 | 2.59 | 2.52 | ||
| 2013 | 1.78 | 1.68 | 1.78 | 1.59 | 1.6 | 1.67 | 1.67 | 1.73 | 1.81 | ||
Comparando las 4 estaciones del año, no se encontraron diferencias significativas en los valores de diversidad de la dieta para el periodo de muestreo (Fig. 4). En las curvas de rarefacción de la diversidad de Shannon (Fig. 5) se observa que los intervalos de confianza para los 3 segmentos se interponen entre sí, lo que indica que no existen diferencias significativas entre ninguno de estos.
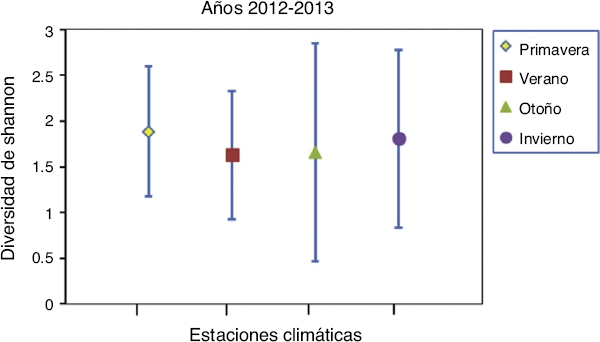
Figura 4 Comparación de los índices de diversidad en la dieta entre las 4 estaciones climáticas para todo el periodo de muestreo.
Discusión
Lontra longicaudis annectens es un depredador tope en las redes tróficas acuáticas y es reconocida como una especie ictiófaga (Espitia et al., 2006, González et al., 2004). No obstante, también consume otros organismos asociados a los cuerpo de agua, como insectos, reptiles y cangrejos (Arcila, 2003), lo que concuerda con los resultados de este estudio, ya que a pesar de consumir mayormente peces, insectos y otros invertebrados, la nutria ocasionalmente se alimentó de anfibios, plantas, mamíferos, aves y reptiles. Gallo (1989) registró estos mismos grupos taxonómicos en la dieta de la nutria excepto por las plantas. El grupo de los crustáceos no fue observado, aunque sí ha sido reportado como parte primordial de la dieta para otras regiones del país (Gallo, 1989, Macías-Sánchez y Aranda, 1999, Spínola y Vaughan, 1995), posiblemente porque las condiciones ambientales y geográficas de la región no favorecen el desarrollo de estos organismos, como por ejemplo, las especies del género Macrobrachium características de áreas tropicales, subtropicales y templadas, con temperatura anual mínima de 16 °C y máxima de 32 °C, encontrándose desde el nivel del mar hasta los 1,500 m snm. (Vega-Villasante, Martínez-López, Espinosa-Chaurand, Cortés-Lara y Nolasco-Soria, 2011); que comparado con el área muestreada, esta se encuentra por arriba de los 1,500 m snm, con climas templado subhúmedo y semifrío subhúmedo con temperaturas menores a los 5 °C. Kasper, Feldens, Salvi y Zanardi-Grillo (2004) y Gallo (1989) mencionan que los peces son la principal fuente de alimentación de la nutria para Brasil y el norte de México, respectivamente, lo que concuerda con los resultados obtenidos de este trabajo. El pez Gila conspersa fue la especie más consumida, aunque por grupo de alimentación, los invertebrados fueron los de mayor frecuencia. El último autor menciona que los reptiles y los anfibios, en especial las ranas (Rana sp., Hyla sp., Smilisca baudini, etc.), son comúnmente consumidas por las nutrias; a pesar de que las tortugas y las serpientes son abundantes en su hábitat, pocas veces son consumidas. Resultados similares fueron encontrados en este trabajo, donde Hyla arenicolor fue consumida en la mayoría de los meses, excepto en septiembre y diciembre. No se encontraron restos de tortugas, solo se observaron de la culebra (Thamnophis validus) en 2 heces durante la primavera del 2013. Macías-Sánchez (1998) menciona a Basiliscus vittatus (F = 88; n = 474) como la única especie de reptil observada en su estudio.
Los mamíferos han sido registrados en una baja incidencia en la dieta de la nutria neotropical (Rangel y Gallo, 2013, Restrepo y Botero-Botero, 2012), coincidiendo con lo encontrado en este trabajo, ya que solo se observó la presencia de este grupo en 6 heces en el 2012. Franco y Soto-Gamboa (2011) encontraron restos de mamíferos en una hez para L. provocax en Chile. Greer (1955) obtuvo un 6.1% de restos de mamíferos en un total de 1,374 heces para L. canadensis en Montana, EE. UU. El grupo de las aves, al igual que el de mamíferos y reptiles fue poco representativo (1.83%), con solo una presencia para el 2012 y 3 para el 2013; porcentajes similares reportados en Oaxaca con un 1.77% en 161 heces (Duque-Dávila, Martínez, Botello y Sánchez, 2013), un 3.2% en un río de Jalisco (Díaz-Gallardo, Íñiguez-Dávalos y Santana, 2007) y un 1.4% en Veracruz (Macías-Sánchez y Aranda, 1999; aunque el estudio de Gallo-Reynoso, Ramos-Rosas y Rangel-Aguilar (2008) en el río Yaqui denota una especialización en la depredación local de aves, debida a su abundancia; estos autores mencionan que las aves encontradas eran especies asociadas al ambiente acuático y ribereño.
Las semillas o restos de plantas son poco observadas en la mayoría de los trabajos sobre dieta en la nutria neotropical. En esta investigación, los resultados muestran 7 tipos de material vegetal en 45 heces, 42 para el 2012 y solo 3 para el 2013; no se observaron restos de hojas o tallos, todos fueron semillas. Algunos restos se identificaron hasta género como el caso de Juniperus y Arbutus. Gallo-Reynoso y Casariego (2005) señalan que las nutrias pueden ser consideradas excelentes dispersores de semillas por efecto del consumo de frutos; Díaz-Gallardo et al. (2007) también mencionan que encontraron semillas (1%) en las heces colectadas en el río Ayuquila, Jalisco; Briones-Salas, Peralta-Pérez y Arellanes (2013) reportan 1.06% de plantas para la costa de Oaxaca, mientras que Monroy-Vilchis y Mundo (2009) encuentran un porcentaje de aparición del 1.7% en la cuenca del río Balsas en el Estado de México; como se puede ver, la incidencia de este grupo es poco significativa en la dieta de la nutria.
Los invertebrados que formaron parte de la dieta de la nutria fueron insectos, arácnidos, diplópodos y gasterópodos, de los cuales, Corydalus texanus (etapa larvaria), Abedus sp. y Lethocerus sp. (hemípteros), Ladona sp. (odonato) fueron consumidos con mayor frecuencia en los 2 años de muestreo. Gallo (1989) hace una división en los insectos, mencionando libélulas con un 2.6%, Lethocerus sp. con un 8% y a otros insectos del orden Hemiptera con un 11%. En este estudio igualmente se encontraron taxones del orden Hemiptera, tal es el caso de los géneros: Abedus, Ambrysus y Lethocerus. Mientras que el género Corydalus, es reportado por Briones-Salas et al. (2013) con un porcentaje de aparición de 0.022 para el río Zimatán en Oaxaca; Restrepo y Botero-Botero (2012) también registran este género con un 15% en el Alto Cauca, Colombia, y Mayor-Victoria y Botero-Botero (2010) con un 9% en el río Roble en Colombia. Gallo (1989) menciona que los moluscos de agua dulce como almejas y caracoles se han reportado como parte de la dieta de otras especies de nutria, pero su frecuencia es baja pudiendo ser comidos accidentalmente o apareciendo solamente como parte de la dieta de la presa. En este estudio, los restos de caracoles se encontraron en 10 heces, 9 en el 2012 y una en el 2013. Se observaron restos de Mastigoproctus giganteus (Arachnida) en 4 heces recolectadas en el 2012. Charre-Medellín, López-González, Lozano y Guzmán (2011) mencionan la presencia de un arácnido en heces recolectadas en la cuenca del río Mezquital-San Pedro. Por otra parte, Gallo-Reynoso et al. (2008) observaron restos del arácnido Philodromus en heces recolectadas en el río Yaqui, en Sonora. Morales, Lizana y Acera (2004) reportan arácnidos con un porcentaje de aparición del 1.08% en la dieta de Lutra lutra en el río Francia en Salamanca, España; así como material perteneciente a la clase Diplopoda (mil pies) con 0.43% de aparición. En este trabajo se registró la presencia de este grupo en 5 heces en el año 2012.
Monroy-Vilchis y Mundo (2009) no encontraron diferencias significativas entre temporada de secas y de lluvias en la dieta de la nutria; mientras que Macías-Sánchez (1998) observó que para la temporada de secas los crustáceos presentaron mayor porcentaje de aparición, seguido de los peces, y para la época de lluvias, este grupo fue el más consumido, obteniendo un valor de amplitud del nicho trófico mayor en temporada de secas (0.72) que de lluvias (0.46). A pesar de que la amplitud de nicho trófico no se calculó en este trabajo, sí se encontraron diferencias significativas en los valores de diversidad de Shannon entre la temporada de secas y de lluvias para el año 2012; no así para estas mismas temporadas en el 2013, siendo la temporada de secas la que presentó un valor mayor en este índice para ambos años. Otros autores no encontraron diferencias significativas en el consumo de las presas entre temporadas (Casariego-Madorell, List y Ceballos, 2008).
En cuanto a investigaciones realizadas sobre la dieta de la nutria neotropical analizada para las 4 estaciones climáticas, no existen estudios documentados que hagan referencia a esta división. Sin embargo, Toca (2000) comparó la dieta de Lutra lutra entre las estaciones del año y encontró diferencias significativas entre primavera y verano, primavera y otoño, verano e invierno y otoño e invierno.
Entre los 3 segmentos del río, no hay diferencias significativas en la dieta, aunque el segmento 1 tuvo un menor solapamiento. Morales, Díez y Lizana (2010) no encontraron diferencias en la dieta de la nutria entre las localidades de muestreo debido al cambio continuo de las condiciones del río y a la disponibilidad de presas entre las zonas bajas y altas; las dietas se solapan más en localidades más próximas. Comparando estos datos con lo obtenido en este estudio, hay coincidencias en un mayor traslape en los intervalos de confianza entre los segmentos próximos (2 y 3) aguas abajo. Además, se ha indicado que el mayor número de especies presentes en las partes bajas de los ríos es resultado de la presencia de ambientes más estables, con menores fluctuaciones ambientales, en comparación con las partes más altas, donde existe mayor variabilidad ambiental (Rodríguez-Pérez y Contreras, 2012).
En este trabajo, todos los valores de diversidad en la dieta fueron más altos en el 2012 que en el 2013, lo que podría explicarse por el efecto del estrés ambiental hacia los grupos presa primordiales de la nutria (peces e insectos acuáticos), que podrían estarse desplazando aguas abajo, por búsqueda de alimento o por su baja reproducción, orillando a la nutria a consumir otras especies. En esta región en particular, el año 2012 fue un año seco, con una precipitación de 798 mm, además de que venía arrastrando un déficit de lluvias desde el año 2011 con una precipitación de 573 mm, en comparación con el año 2013 cuya precipitación fue de 975 mm el cual fue mucho más húmedo.
Durante el periodo de sequía ocurre una contracción del medio acuático, por lo que se restringe enormemente el aporte de alimento alóctono para los peces, el cual se origina en los ecosistemas terrestres circundantes y termina siendo aportado al medio acuático disminuyendo la productividad acuática por el de cremento de la carga de nutrientes del río (Galvis et al., 2006). La mayoría de las poblaciones de peces no pueden sobrevivir, o sufren importantes pérdidas durante las sequías prolongadas (Merron, Brutonand y la Hausse-de Lalouviere, 1993). Cuando una población de plantas o de animales es interferida en alguna de sus funciones vitales por alteraciones significativas de los pulsos, tarde o temprano será desplazada o eliminada del sistema. Esta alteración estructural ocurre en la naturaleza en forma temporal como consecuencia de sequías o inundaciones extraordinarias. De hecho, muchos organismos de vida larga (árboles y peces) atraviesan periodos adversos en los cuales no se reproducen o no crecen por estas alteraciones (Neiff, 1999). Además, los insectos de la familia Belostomatidae que fueron consumidos con mayor frecuencia por la nutria, a pesar de ser eminentemente acuáticos, suelen abandonar temporalmente su medio natural, debido a su gran capacidad para el vuelo (Schnack, 1976). Según De Carlo (1938), esto generalmente ocurre cuando se extinguen los cuerpos de agua que habitan, fenómeno que obedece a factores climáticos. La temporada climática es un parámetro abiótico con gran influencia en los cambios de las comunidades macrobentónicas (Robinson y Minshall, 1986). En los arroyos tropicales, la precipitación desempeña esta importante función en los cambios en la estructura de la comunidad bentónica.
Debido a lo anterior, se plantea que las nutrias no se movieron de lugar o incrementaron el tamaño de su territorio, sino que buscaron una mayor diversidad de especies presa (plantas, anfibios, aves, reptiles y mamíferos) para compensar la falta de dieta primordial (peces e insectos acuáticos).











 nueva página del texto (beta)
nueva página del texto (beta)





