Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.81 supl.oct México oct. 2010
Crustáceos asociados a sustrato duro en la zona intermareal de Montepío, Veracruz, México
Crustaceans associated to hard substrate in the intertidal zone of Montepío, Veracruz, Mexico
Carmen Hernández*, Fernando Álvarez y José Luis Villalobos
Colección Nacional, de Crustáceos, Instituto de Biología, Universidad Nacional Autónoma de México. Apartado postal 70–153, 04510 México, D.F., México. *Correspondencia: cha30mx@yahoo.com.mx
Recibido: 07 diciembre 2009
Aceptado: 26 abril 2010
Resumen
La zona intermareal rocosa ofrece residencia a numerosas especies por su alta heterogeneidad espacial. Este estudio da a conocer la riqueza específica de los crustáceos de Montepío, recolectados mediante muestreos mensuales de febrero 1996 a febrero 1997 y bimestralmente de julio 2004 a julio 2005, depositados en la Colección Nacional de Crustáceos, del Instituto de Biología, UNAM. Se identificaron 4 437 organismos, agrupados en 19 familias, 36 géneros y 60 especies. Las familias con mayor riqueza son Alpheidae con 11 especies, Porcellanidae con 7, Gammaridae con 6, y el resto de las familias representan el 60%. En cuanto a densidad, las especies mejor representadas fueron: Tetraclita stalactifera floridana (457 org/l), Megabalanus tintinnabulum (318 org/l), Elasmopus sp. 1 (280 org/l) y Neopisosoma angustifrons (267 org/l). Mediante el análisis de Olmstead–Tükey, se percibió que el 65% de las especies fueron ocasionales, 12% dominantes, 20% comunes y 3% indicadoras. La riqueza de especies en Montepío resulta menor que la de otras zonas con sustratos rocosos, tanto en el golfo de México como del Pacífico.
Palabras clave: Crustacea, zona intermareal, sustrato rocoso, criptofauna, Veracruz, golfo de México.
Abstract
The rocky intertidal zone is the habitat of a number of species due to its spatial heterogeneity. In this study the crustacean species richness at Montepio is presented based on samples obtained monthly from February 1996 to February 1997, and bimonthly from July 2004 to July 2005, and deposited in the National Crustacean Collection, Instituto de Biología, UNAM. A total of 4 437 organisms was identified, grouped in 19 families, 36 genera and 60 species. The families with the highest number of species were Alpheidae with 11 species, Porcellanidae with 7, Gammaridae with 6, the rest of the families contributed with the remaining 60% of the species. Regarding the density, the following species had the highest values: Tetraclita stalactifera floridana (457 org/l), Megabalanus tintinnabulum (318 org/l), Elasmopus sp. 1 (280 org/l) and Neopisosoma angustifrons (267 org/l). It was determined through an Olmstead–Tükey analysis that 65% of the species were occasional, 12% dominant, 20% common and 3% indicator. Species richness in Montepio is lower than those for other areas in the Gulf of Mexico and the Pacific coast with rocky substrates.
Key words: Crustacea, rocky intertidal shore, cryptofauna, Veracruz, Gulf of Mexico.
Introducción
La zona intermareal con sustrato duro alberga numerosas especies por su alta heterogeneidad espacial. Los factores abióticos, como la amplitud de mareas, acción del oleaje, temperatura, luz, salinidad y concentración de oxígeno disuelto, determinan la estructura de la comunidad. La riqueza de especies, diversidad, biomasa y abundancia son variables relevantes que cambian de acuerdo con las condiciones ambientales asociadas a los ciclos de mareas (Abele, 1974; Brusca, 1980; Ruesink, 2007). La riqueza específica y abundancia de organismos en sustratos duros se utiliza para conocer ciclos de perturbación y regeneración, el estado de salud de la comunidad, así como para identificar zonas de diversidad alta (Moran y Reaka, 1988, 1991; Benedetti–Cecchi, 2006; Duffy y Stachowicz, 2006; Ieno et al., 2006; Raffaelli, 2006; Stachowicz y Byrnes, 2006; Zhuang, 2006).
La diversidad biológica de la criptofauna de sustratos duros en la zona intermareal se debe a las interacciones de competencia, depredación y herbivoría, que se establecen en la estructura y dinámica de la comunidad. Menge (1976) estableció que las hipótesis de organización de la comunidad y la diversidad de especies son complementarias a la competencia y depredación, lo que se aprecia claramente en los diferentes niveles tróficos. Chapman (1992) mencionó que la presencia de vegetación en la zona rocosa favorece el incremento del número de especies y con ello el hábitat se vuelve complejo y diverso. Spencer y Tanner (2008) aseguran que el estudio de la competencia puede ayudar a realizar predicciones de la dinámica de poblaciones o de comunidades de organismos sésiles. Todos estos y otros acercamientos teóricos y experimentales realizados para conocer la estructura y funcionamiento de la comunidad intermareal dependen en gran medida del conocimiento que se tenga sobre las especies que la componen. Esta tarea resulta difícil en los sistemas tropicales donde el número de especies es mucho mayor que en latitudes templadas y frías. Este estudio se presenta como un primer paso para entender el funcionamiento de una comunidad intermareal atípica que se establece sobre un sustrato rocoso en el suroeste del golfo de México, al proveer un análisis de la diversidad de especies de crustáceos basada en muestreos realizados durante los últimos 13 años.
En estudios previos del área se registró que la comunidad intermareal asociada al sustrato rocoso está compuesta por especies de afinidad tropical. Al mismo tiempo se describe que la composición de especies cambia continuamente, con un promedio del 39% de especies ocasionales en cada muestreo, lo que sugiere que los cambios estacionales promueven un intenso recambio de especies; además, la comunidad está dominada por especies raras que aparecen 1 o 2 veces al año (Hernández, 2002, 2009; Hernández y Álvarez, 2007).
Materiales y métodos
Área de estudio. En el golfo de México las zonas que presentan sustrato duro se diferencian de acuerdo con su origen y han sido clasificadas como: a) formaciones de piedra caliza, comunes a lo largo de la costa de la península de Yucatán; b) arrecifes de coral, de los cuales, los de mayor importancia son isla Lobos, el puerto de Veracruz, Antón Lizardo y cayo Arcas; c) derrames de lava asociados a sierras de costa, como en la región de Los Tuxtlas, y d) estructuras construidas por el hombre como muelles, puertos, escolleras y plataformas, numerosas en áreas portuarias (Britton y Morton, 1988).
Montepío se ubica en el municipio de San Andrés Tuxtla, Veracruz (18°28'31" N, 95°17'58" O) (Fig. 1). Presenta un clima tropical y su régimen térmico es cálido–regular con temperatura media anual de 24.6 °C con gran precipitación pluvial (Andrle, 1964; Soto, 1976). Desde el punto de vista meteorológico, el área se encuentra bajo la influencia de disturbios cíclicos provocados por la época de nortes que ocasionan un oleaje de mayor intensidad, así como la resuspensión del sedimento, lo que genera diferente grado de estrés en los organismos que ahí habitan.

Los estudios geológicos describen los materiales más antiguos en la zona como arcillas, tobáceas y areniscas, de grano mediano a grueso, con altos porcentajes de material volcánico, provenientes del Oligoceno (Ríos–Macbeth, 1952). Las formas recientes se crearon por derrames basálticos del Pleistoceno. La zona presenta 7 principales centros de erupción entre los que destacan los volcanes de San Martín Pajapan, Santa Marta y San Martín Tuxtla. Debido a esto, el área de Los Tuxtlas presenta un relieve rocoso provocado por la actividad volcánica que se refleja en el litoral, donde se observan las playas bajas con cordones de dunas interrumpidas por acantilados de roca basáltica. El litoral rocoso se extiende desde el área costera, situado al norte del volcán San Martín, hasta la zona del cerro Pelón–Pajapan, o de punta Puntilla a punta San Juan. Sin embargo, existen playas de diferentes dimensiones creadas por las corrientes fluviales que interrumpen los acantilados basálticos (Andrle, 1964).
El material de este estudio se obtuvo mediante una serie de muestreos mensuales, de febrero 1996 a febrero 1997; bimestrales, de julio 2004 a julio 2005, y de muestras depositadas en la Colección Nacional de Crustáceos (CNCR) del Instituto de Biología de la Universidad Nacional Autónoma de México. La colecta fue manual, con 3 réplicas por muestra; cada trozo de roca de aproximadamente 4 kg se fragmentó hasta obtener el total de crustáceos asociados a ellas. Los organismos se identificaron al nivel específico con el uso de literatura especializada (Rathbun, 1930; Provenzano, 1959; Barnard, 1969; Gosner, 1971; Chace, 1972; Bousfield, 1973; Gore y Abele, 1976; Barnard y Barnard, 1983; Menzies y Kruczynski, 1983; Dardeau, 1984; Williams, 1984; Abele y Kim, 1986; Kensley y Schotte, 1989).
El análisis de la estructura comunitaria consistió en determinar la riqueza específica global mediante la curva acumulativa de especies. Se identificaron las de mayor densidad (org/l), para lo cual en cada muestreo se midió el volumen desplazado por réplica, con el fin de obtener la relación de organismos por litro y así comparar las densidades. También se determinó la dominancia de las especies que integran la comunidad intermareal mediante la prueba de asociación no paramétrica de Olmstead–Tükey (Sokal y Rohlf, 1981), que estimó la importancia relativa de cada especie, al graficar porcentualmente la frecuencia de aparición contra la abundancia (log n+1) y evaluar la media aritmética para ambos ejes.
Resultados
Se revisaron 4 437 organismos del subphylum Crustacea representado por 4 órdenes, 19 familias, 36 géneros y 60 especies, los cuales se listan en el Cuadro 1.
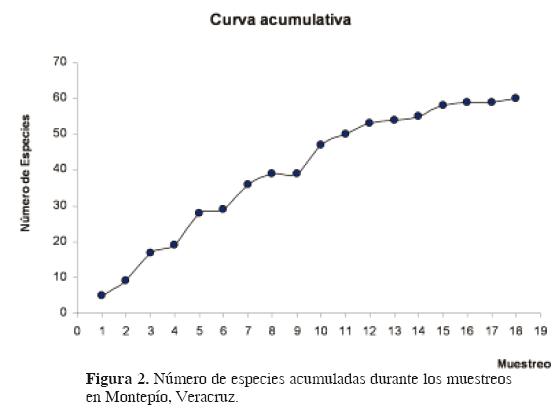
Riqueza específica. La curva acumulativa de especies muestra un incremento con el tiempo, se observa una tendencia logarítmica con periodos asintóticos; en la última fase, sólo se incrementó una especie por mes (Fig. 2). Es muy probable que el número de especies por registrar no llegue a 70.
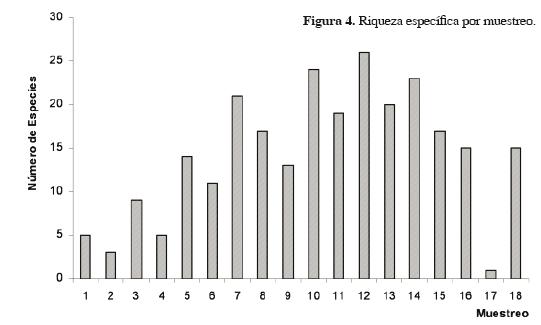
El patrón general en la estructura de la comunidad carcinológica manifiesta que las familias con mayor riqueza específica fueron: Alpheidae (11), Porcellanidae (7), Cirolanidae y Melitidae (6), con una riqueza intermedia Hyalidae y Mennipidae (5) y Corophidae (4); las 13 familias restantes presentaron una riqueza de 3 o menos especies (Fig. 3). La variación de riqueza específica a través del tiempo mostró que se recolectó un máximo de 27 especies y un mínimo de 1, con un promedio de 14 (Fig. 4).

En Montepío destacaron por su densidad 4 especies: Tetraclita stalactifera floridana (457 org/l), Megabalanus tintinnabulum (319 org/l), Neopisosoma angustifrons (169 org/l), Balanus sp. (162 org/l) y Elasmopus sp. 1 (143 org/l). Un segundo grupo lo conformaron Pachygrapsus transversus (53 org/l), Eriphia gonagra (49 org/l), Hyale sp. 1 (43 org/l), Clastotoechus nodosus (31 org/l) y Plagusia depressa (21 org/l). Las 50 especies restantes presentaron densidades menores a 12 org/l (Fig. 5).
Dominancia. El análisis de Olmstead–Tükey mostró que de las 60 especies identificadas el 65% son ocasionales, 12% dominantes, 20% comunes y 3% indicadoras. El porcentaje de estos grupos en la estructura de la comunidad varió en el tiempo. Las especies que dominaron fueron Neopisosoma angustifrons, Balanus sp. 1, Elasmopus sp. 1, Hyale sp. 1, Pachygrapsus transversus, Eriphia gonagra y Clastotoechus nodosus (Cuadro 2). En las categorías de especies dominantes, comunes y ocasionales se observa que está presente una mezcla de todos los órdenes de crustáceos y en la categoría de especies indicadoras, que se caracterizan por presentarse en densidades elevadas por breves periodos, se ubicaron los balanos Tetraclita stalactifera floridana y Megabalanus tintinnabulum.
Discusión
La comunidad intermareal de Montepío mostró cambios en la composición carcinológica respecto a la riqueza de especies y densidad. Esta zona representa un parche de sustrato duro en un ambiente donde domina el sustrato arenoso. Montepío se caracteriza por establecerse sobre un derrame de roca que posee alta heterogeneidad espacial donde se establecen macroalgas, corales, esponjas, sipuncúlidos y poliquetos, que favorecen la creación de microhábitats que albergan otros invertebrados como moluscos, equinodermos y crustáceos.
En las costas mexicanas del golfo de México se han registrado 40 especies de cirripedios (Celis y Álvarez, 2008) y 1 021 especies de crustáceos decápodos y estomatópodos (Hernández–Aguilera et al., 1996; Felder et al., 2009). En el estado de Quintana Roo se tiene conocimiento de la presencia de 309 especies de crustáceos en aguas costeras (Markham et al., 1990). En Veracruz se registran 276 especies de decápodos marinos de aguas someras y arrecifales (Corpi, 1986; Álvarez y Villalobos, 1997; Álvarez et al., 1999; Hermoso y Arvizu, 2007). En la zona de Montepío ahora se reconocen 60 especies, de las cuales 5 son cirripedios, 17 anfípodos, 8 isópodos y 30 decápodos (Hernández y Álvarez, 2007; Hernández, 2009). Estas referencias indican que en Montepío se tiene el 12.5% de las especies de cirripedios y el 11% de las especies de decápodos registrados para Veracruz. Resulta interesante que un área intermareal tan reducida y sujeta a fuertes perturbaciones mantenga esta diversidad.
El análisis de la curva acumulativa de especies indica que en cada muestreo se incrementó el número de especies; aunque en las últimas colectas fueron pocas las que se agregaron, debe considerarse la probabilidad de que las especies ocasionales se sigan sumando a este listado. Las asíntotas que se presentaron en las curvas se justifican con la presencia de fenómenos meteorológicos que afectan a la comunidad, por lo que las lluvias y marejadas que se presentaron en la zona probablemente desplazan especies ocasionales y sólo se capturan las dominantes, es decir, durante los periodos de perturbaciones intensas no hay reclutamiento de nuevas especies, sino que se registran únicamente aquellas muy resistentes que soportan las perturbaciones. Hay que recordar que para obtener una curva parecida a la del modelo teórico, es importante considerar que el incremento en la intensidad de muestreo es proporcional al número de individuos a capturarse (Ugland y Gray, 2004).
La densidad de cada especie es proporcional al tamaño de nicho disponible, aunque este espacio está condicionado a las relaciones de competencia de la comunidad. En ambientes que se apartan de condiciones generalizadas o que son fluctuantes y por ello rigurosos (Margalef, 1974), como es el caso de Montepío, el número de especies tiende a ser bajo y la abundancia de cada una alta. Sin embargo, en Montepío también se encuentran especies raras que aparecen en bajo número y se establecen por periodos cortos.
Las familias Gammaridae, Tetraclitidae, Hyalidae y Porcellanidae presentaron las mayores densidades, dominando esta comunidad. Con respecto a la densidad por especies, Tetraclita stalactifera floridana, Megabalanus tintinnabulum, Neopisosoma angustifrons, Balanus sp. y Elasmopus sp. 1, constituyen el 80% en la densidad de especies, siendo las 55 especies restantes sólo el 20% del total. Las especies con alta densidad se espera que sean el grupo dominante por poseer un amplio intervalo de distribución y alta fecundidad, como ocurre con Tetraclita stalactifera floridana y Megabalanus tintinnabulum que tienen áreas de distribución circumtropicales (Celis, 2009), y Pachygrapsus transversus y Neopisosoma angustifrons que tienen también grandes áreas de distribución y un alto potencial de dispersión (Cuesta y Schubart, 1998; Armendáriz, 2008).
Respecto a la categorización por presencia y abundancia se encontró que del total de especies el 12% son dominantes, 20% comunes, 3% indicadoras y 65% ocasionales. El patrón es similar al que se presenta en otras comunidades donde las especies ocasionales conforman cerca del 50% (Escobar, 1984; Villalobos, 2000; Hernández, 2002). Las especies indicadoras y comunes no se presentan en todos los meses, ya que cuando las condiciones ambientales fluctúan, estos complejos se minimizan o incluso desaparecen de la comunidad durante un periodo breve. Este recambio de especies en un ciclo anual se ha descrito para sistemas costeros del golfo de México; ejemplo de ello son los trabajos realizados en los sistemas lagunares de Laguna de Términos (Escobar, 1984; Román–Contreras, 1986, 1988), Laguna Madre (Barba, 1992), Laguna de Alvarado (Raz–Guzman et al., 1992) y Laguna de Tamiahua (Raz–Guzman y Sánchez, 1996). También este patrón se presentó en la comunidad intermareal rocosa de Montepío, por lo que se puede definir como una comunidad donde son pocas las especies dominantes, pero en realidad la comunidad está caracterizada por un 50% o más de especies raras u ocasionales.
Agradecimientos
Agradecemos el apoyo brindado por la Unidad de Información sobre Biodiversidad (UNIBIO) del Instituto de Biología, UNAM. El segundo autor agradece al programa PAPIIT, DGAPA–UNAM, los fondos recibidos a través del proyecto IN208702.
Literatura citada
Abele, L. G. 1974. Species diversity of decapod crustaceans in marine habitats. Ecology 55:156–161. [ Links ]
Abele, L. G. y W. Kim. 1986. An illustrated guide to the marine decapod crustaceans of Florida. State of Florida, Department of Environmental Regulation Technical series 8:1–760. [ Links ]
Álvarez F. y J. L. Villalobos. 1997. Decapoda. In Historia Natural de Los Tuxtlas, E. González, R. Dirzo y R. C. Vogt (eds.). Instituto de Biología, UNAM /Insituto de Ecología, UNAM, México, D.F. p. 433–438. [ Links ]
Álvarez, F., J. L. Villalobos, Y. Rojas y R. Robles. 1999. Lista completa de los crustáceos decápodos de Veracruz. Anales del Instituto de Biología, Universidad Nacional Autónoma de México 70:1–27. [ Links ]
Andrle, R. F. 1964. A biogeographical investigation of the Sierra of Los Tuxtlas in Veracruz, México. Ph. D. Dissertation, Louisiana State University, Baton Rouge. [ Links ]
Armendáriz, G. Y. 2008. Fecundidad de Neopisosoma angustifrons (Benedict, 1901) (Crustacea: Decapoda: Porcellanidae) Veracruz, México. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 65 p. [ Links ]
Barba, M. E. 1992. Comunidad de crustáceos y peces de la Laguna Madre, Tamaulipas. I. Crustáceos epibénticos y peces juveniles de la región sur–central. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 55 p. [ Links ]
Barnard, J. L. 1969. The families and genera of marine gammaridean Amphipoda. United States National Museum, Washington, D.C. 271:1–535. [ Links ]
Barnard, J. L. y C. M. Barnard. 1983. Freshwater Amphipoda of the world, I. Evolutionary patterns, II. Mt Vernon, Hayfield Associates, Virginia. 830 p. [ Links ]
Benedetti–Cecchi, L. 2006. Understanding the consequences of changing biodiversity on rocky shores: How much have we learned from past experiments? Journal of Experimental Marine Biology and Ecology 338:193–204. [ Links ]
Bousfield, E. L. 1973. Shallow–water gammaridean Amphipoda of New England. Comstock, London. 312 p. [ Links ]
Britton, J. C. y B. Morton. 1988. Shore ecology of the Gulf of Mexico. University of Texas Press, Austin. p. 41–104. [ Links ]
Brusca, R. C. 1980. Common intertidal invertebrates of the Gulf of California. The University of Arizona Press, Tucson. 513 p. [ Links ]
Celis, A. 2009. Análisis panbiogeográfico y taxonómico de los cirripedios (Crustacea) de México. Tesis doctorado, Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México. 286 p. [ Links ]
Celis, A. y F. Álvarez . 2008. Listado taxonómico de los cirripedios del sur del Golfo de México. In Crustáceos de México: estado actual de su conocimiento, F. Álvarez y G. Rodríguez–Almaraz (eds.). Universidad Autónoma de Nuevo León, Monterrey. p. 1–16. [ Links ]
Chace, F. A., Jr. 1972. The shrimp of the Smithsonian–Bredin Caribbean Expedition with a summary of the West Indian shallow–water species (Crustacea: Decapoda: Natantia). Smithsonian Contributions to Zoology 98:1–179. [ Links ]
Chapman, A. R. O. 1992. Vegetation ecology of rocky shore. In Coastal plant communities of Latin America, U. Seelinger (ed.). Academic, London. p. 13–30. [ Links ]
Corpi, L. R. 1986. Crustáceos decápodos y estomatópodos litorales y costeros de la región de Coatzacoalcos, Veracruz, México. Tesis, Universidad Veracruzana, Xalapa, Veracruz. 68 p. [ Links ]
Cuesta, J. A. y C. D. Schubart. 1998. Morphological and molecular differentiation between three allopatric populations of the littoral crab Pachygrapsus transversus (Gibbes, 1850) (Brachyura, Grapsidae). Journal of Natural History 32:1499–1508. [ Links ]
Dardeau, M. R. 1984. Synalpheus shrimps (Crustacea: Decapoda: Alpheidae). I The Gambarelloidae group with a description of a new species. Memoirs of the Hourglass Cruises 7:1–125. [ Links ]
Duffy, J. E. y J. J. Stachowicz. 2006. Why biodiversity is important to oceanography: potential roles of genetic, species, and trophic diversity in pelagic ecosystem processes. Marine Ecology Progress Series 311:179–189. [ Links ]
Escobar–Briones, E. 1984. Comunidades de macroinvertebrados bentónicos en Laguna de Términos, Campeche: composición y estructura. Tesis maestría, Unidad Académica de los ciclos profesionales y posgrado (UACP)–Colegio de Ciencias y Humanidades (CCH), Universidad Nacional Autónoma de México, México, D.F. p. 191. [ Links ]
Felder, D. L., F. Álvarez, J. W. Goy y R. Lemaitre. 2009. Decapoda (Crustacea) of the Gulf of Mexico, with comments on the Amphionidacea. In Gulf of Mexico – Its origins, waters, and biota, biodiversity, D. L. Felder y D. K. Camp (eds.), TAMU, College Station, Texas. p. 1019–1104. [ Links ]
Gore, R. H. y L. G. Abele. 1976. Shallow water porcelain crabs from the Pacific coast of Panama and adjacent Caribbean waters (Crustacea: Anomura: Porcellanidae). Smithsonian Contributions to Zoology 237:1–30. [ Links ]
Gosner, K. 1971. Guide to identification of marine and estuarine invertebrates. Wiley–Interscience, New York. 693 p. [ Links ]
Hermoso, A. M. y K. Arvizu. 2007. Los estomatópodos y decápodos del Parque Nacional Sistema Arrecifal Veracruzano, In Investigaciones científicas en el Sistema Arrecifal Veracruzano, A. Granados–Barba, L. G. Abarca–Arenas y J. M. Vargas–Hernández (eds.). Universidad Autónoma de Campeche. Campeche. p. 101–112. [ Links ]
Hernández–Aguilera, J. L., R. E. Toral–Almazán y J. A. Ruíz Nuño. 1996. Especies catalogadas de crustáceos estomatópodos y decápodos para el golfo de México, Río Bravo, Tamps. a Progreso, Yuc. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad / Dirección General de Oceanografía Naval, Secretaría de Marina, México, D.F. 132 p. [ Links ]
Hernández, C. 2002. Variabilidad estacional de la comunidad de crustáceos de la facie rocosa intermareal, en Montepío, Veracruz. Tesis maestría Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F 70 p. [ Links ]
Hernández, C. 2009. Estructura de la comunidad carcinológica y reclutamiento en sustrato duro, en Veracruz, México. Tesis doctorado, Posgrado de Ciencias Biológicas, Universidad Nacional Autónoma de México. 112 p. [ Links ]
Hernández, C. y F. Álvarez . 2007. Changes in the crustacean community of a tropical rocky intertidal shore: Is there a pattern? Hidrobiológica 17:25–34. [ Links ]
Ieno, E. N., M. Sloan, P. Batty y G. J. Pierce. 2006. How biodiversity affects ecosystem functioning: role of infaunal species richness, identity and density in the marine benthos. Marine Ecology Progress Series 311:263–271. [ Links ]
Kensley, B. y M. Schotte. 1989. Guide to the marine isopod crustaceans of the Caribbean. Smithsonian Institution Press, Washington, D.C. 293 p. [ Links ]
Margalef, R. 1974. Ecología. Omega, Barcelona. 951 p. [ Links ]
Markham, J. C., F. E. Donath–Hernández, J. L. Villalobos–Hiriart y A. Cantú. 1990. Notes on the shallow–water marine Crustacea of the Caribbean coast of Quintana Roo, Mexico. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología 61:405–446. [ Links ]
Menge, B. A. 1976. Organization of the New England rocky intertidial community: role of predation, competition and environmental heterogeneity. Ecological Monographs 46:355–393. [ Links ]
Menzies, R. J. y W. L. Kruczynski. 1983. Isopod Crustacea (exclusive of Epicaridea). Florida Department of Natural Resources, Marine Research Laboratory 6:1–126. [ Links ]
Moran, D. P. y M. L. Reaka. 1988. Bioerosion and availability of shelter for benthic reef organisms. Marine Ecology Progress Series 44:249–263. [ Links ]
Moran, D. P. y M. L. Reaka–Kudla. 1991. Effects of disturbance: disruption and enhancement of coral reef cryptofaunal populations by hurricanes. Coral Reefs 9:215–224. [ Links ]
Provenzano, A. J. 1959. The shallow–water hermit crabs of Florida. Bulletin of Marine Science of the Gulf and Caribbean 9:349–420. [ Links ]
Raffaelli, D. 2006. Biodiversity and ecosystem functioning: issues of scale and trophic complexity. Marine Ecology Progress Series 3 1:285–294. [ Links ]
Rathbun, M. J. 1930. The cancroid crabs of America of the families Euryalidae, Portunidae,Atelecyclidae, Cancridae and Xanthidae. Bulletin of the Smithsonian Institution, United States National Museum 152:1–609. [ Links ]
Raz–Guzman, A. y A. Sánchez. 1996. Catálogo ilustrado de cangrejos braquiuros (Crustacea) de la Laguna de Tamiahua, Veracruz, México. Cuaderno 31. Instituto de Biología, Universidad Nacional Autónoma de México. 52 p. [ Links ]
Raz–Guzman, A., A. Sánchez y L.A. Soto. 1992. Catálogo ilustrado de cangrejos braquiuros y anomuros (Crustacea) de Laguna de Alvarado, Veracruz, México. Cuaderno 14. Instituto de Biología, UNAM, México D.F., 51 p. [ Links ]
Ríos–Macbeth, F. 1952. Estudios geológicos de la región de Los Tuxtlas, Veracruz. Boletín de la Sociedad Mexicana de Geología y Petrología 4:325–376. [ Links ]
Román–Contreras, R. 1986. Comportamiento nictimeral de crustáceos decápodos en la boca de Estero Pargo, Laguna de Términos, Campeche, México. Anales Instituto Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México 13: 149–158. [ Links ]
Román–Contreras, R. 1988. Características ecológicas de los crustáceos decápodos de la Laguna de Términos. In Ecología de los ecosistemas costeros en el sur del golfo de o: la región de Laguna de Términos, A. Yánez–Arancibia y J. W. Day, Jr. (eds.). Instituto de Ciencias del Mar y Limnología, UNAM/ OEA, México, D.F. p. 305–322. [ Links ]
Ruesink, J. L. 2007. Biotic resistance and facilitation of a non–native oyster on rocky shores. Marine Ecology Progress Series 331:1–9. [ Links ]
Sokal, R. R. y J. F. Rohlf. 1981. Biometry. Freeman, San Francisco, California. 976 p. [ Links ]
Soto, E. M. 1976. Algunos aspectos climáticos de la región de Los Tuxtlas, Veracruz. In Investigaciones sobre la regeneración de selvas altas en Veracruz, A. Gómez–Pompa, S. del Amo, C. Vázquez–Yanes y A. Butanda (eds.). CECSA, México, D.F. p. 70–111. [ Links ]
Spencer, M. y J. E. Tanner. 2008. Lotka–Volterra competition models for sessile organisms. Ecology 89:1134–1143. [ Links ]
Stachowicz, J. J. y J. E. Byrnes. 2006. Species diversity, invasion success, and ecosystem functioning: disentangling the influence of resource competition, facilitation, and extrinsic factors. Marine Ecology Progress Series 311:251–262. [ Links ]
Ugland, K. I. y J. S. Gray. 2004. Estimation of species richness: analysis of the methods developed by Chao and Karakassis. Marine Ecology Progress Series 284:1–8. [ Links ]
Villalobos, J. L. 2000. Estudio monográfico de los crustáceos decápodos no braquiuros de la zona intermareal de las islas del golfo de California, México. Tesis maestría Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 312 p. [ Links ]
Williams, A. B. 1984. Shrimps, lobsters and crabs of the Atlantic coast of the eastern United States, Marine to Florida. Smithsonian Institution Press. Washington, D.C. 550 p. [ Links ]
Zhuang, S. 2006. Species richness, biomass and diversity of macroalgal assemblages in tide pools of different sizes. Marine Ecology Progress Series 309:67–73. [ Links ]














