Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.2 Ciudad de México abr./jun. 2011
Trabajos científicos
Eficacia y seguridad de clindamicina/clotrimazol, crema vaginal en pacientes mexicanas con cervicovaginitis
Efficacy and safety of clindamycin/clotrimazole, vaginal cream in Mexican patients with cervicovaginitis
Geannyne Villegas Rivera1,2, Karla López Castellanos1, Jóse Casillas Magaña1, Rafael Cortés Zárate1'2, Eduardo Bishop Montoya3, Silvia Romero Medina3, Amador Covarrubias Pinedo1
1 Instituto de Investigación Clínica de Occidente S.A. de C.V.
2 Centro Universitario de Ciencias de la Salud.
3 Productos Maver S.A de C.V.
Correspondencia
Dr. Amador Covarrubias Pinedo
Avenida Ludwig Van Beethoven #5674, Col. La Estancia,
C.P. 45030, Zapopan, Jalisco.
Tel. 3629 8485 Ext. 109 y 111
Fax 3629 1142
e–mail: amadorc1964@gmail.com
Fecha de recepción: 10 de diciembre de 2010.
Fecha de recepción de modificaciones: 20 de abril de 2011.
Fecha de aceptación: 8 de junio de 2011.
Resumen
La cervicovaginitis es un síndrome caracterizado por flujo, prurito y mal olor. Los principales microorganismos implicados son: Gardnerella vaginalis, Candida y Trichomonas vaginalis. El tratamiento debe incluir antibióticos y antifúngicos, por lo que en este estudio se evaluó la eficacia y seguridad de la combinación de la crema Co–Tenescan® (fosfato de clindamicina 2 g más clotrimazol 1 g). Se realizó un ensayo clínico exploratorio en 30 pacientes con diagnóstico de cervicovaginitis, las cuales se aplicaron la crema vaginal durante tres noches consecutivas. Las evaluaciones realizadas en los días 0 y 10 incluyeron historia clínica, exploración ginecológica y estudios microbiológicos. El porcentaje de curación que se alcanzó para Gardnerella vaginalis fue de 86.7%, Candida 33.3% y Trichomonas vaginalis 100%. El 43% de las pacientes presentaron eventos adversos leves.
Palabras clave: cervicovaginitis, fosfato de clindamicina, clotrimazol.
Abstract
Cervicovaginitis is a syndrome whose symptoms include discharge, itching and odor. The microorganisms involved are: Gardnerella vaginalis, Candida and Trichomona vaginalis. Treatment should include antibiotics and antifungal agents, so in this study we assessed the efficacy and safety of the vaginal cream Co–Tenescan® (clindamycin phosphate 2 g plus clotrimazole 1 g). We performed an exploratory clinical trial in 30 patients with cervicovaginitis, whom applied vaginal cream for three nights. Assessments made on days 0 and 10 included medical history, pelvic examination and microbiological studies. The cure rate achieved for Gardnerella vaginalis was 86.7%, Candida 33.3% and Trichomonas vaginalis 100%. The drug was well tolerated and only 43% of the patients had mild adverse events.
Key words: cervicovaginitis, clindamycin phosphate, clotrimazole.
Introducción
La cervicovaginitis es una enfermedad prevalente en México que ocurre en el 30% de la población femenina. El Centro de Información Integral para la Salud, en 2004 la situó en el decimotercer lugar de los principales motivos de consulta en las clínicas de primer nivel de atención médica del Instituto Mexicano del Seguro Social.1
La cervicovaginitis se define como un síndrome caracterizado por uno o más de los siguientes signos y síntomas: aumento en la cantidad de secreción vaginal (flujo), prurito, ardor, irritación, disuria, dispareunia y fetidez o mal olor vaginal; secundario a la presencia de microorganismos patógenos.2
Las enfermedades que se asocian con descarga vaginal con mayor frecuencia son: a) Vaginosis Bacteriana (VB), por sobrecrecimiento de microorganismos anaeróbios, mycoplasmas y Gardnerella vaginalis, b) Candidiasis Vulvovaginal (CV), usualmente causada por Candida albicans y c) tricomoniasis por Trichomonas vaginalis.3
De estos microorganismos, los que se aíslan con mayor frecuencia en mujeres mexicanas son: Gardnerella vaginalis (22.6%), Candida spp (19.1%), Candida albicans (7.8%) y Trichomonas vaginalis (1.5%).1
El diagnóstico presuntivo puede realizarse a través del interrogatorio y la exploración vaginal; sin embargo, se requieren estudios complementarios. Entre los métodos que han mostrado tener mayor sensibilidad se encuentran: microscopía en fresco, tinción de Gram, cultivos, prueba de aminas y la medición del pH.4
No se recomienda iniciar tratamiento empírico sin la identificación del microorganismo causal.5 El manejo oportuno, puede reducir el riesgo de adquirir otras enfermedades de transmisión sexual como el Virus de la Inmunodeficiencia Humana (VIH); es por esta razón que varios autores sugieren dar tratamiento a todas las mujeres con o sin síntomas.6
Los agentes antimicrobianos tópicos aplicados en la vagina son ampliamente usados en mujeres con infección del tracto genital inferior. Los tratamientos tópicos pueden ser prescritos para infecciones vaginales causadas por: bacterias (VB, vaginitis aeróbica y Staphylococcus aureus o streptococcos del grupo A), hongos (CV), virus (condiloma acuminata y hérpes simple) y protozoarios (Trichomonas vaginalis).
Ya que en las pacientes con cervicovagintis pueden coexistir dos o más microorganismos patógenos, terapias combinadas encaminadas a erradicar los más frecuentes representan una excelente opción. Actualmente, el conjuntar antibióticos y azoles son una de las mejores opciones disponibles.8,9
Clindamicina
La clindamicina es una lincosamida, pertenece a la clase de los antimicrobianos la cual inhibe la síntesis proteica del ribosoma de la bacteria. Para la administración vaginal se prefiere la crema de fosfato de clindamicina al 2%. Aproximadamente el 5% de la dosis administrada se absorbe sistémicamente.7,10
La eficacia de clindamicina ha sido evaluada en múltiples estudios clínicos aleatorizados con grupos control, en los que se ha observado que al ser aplicada en múltiples esquemas (1, 3 y 7 días) es efectiva y bien tolerada.11,12,13 Actualmente se prefiere el régimen de 3 días porque mejora el apego al tratamiento.14
El uso de clindamicina administrada por vía oral o vaginal tiene una tasa elevada de curación (70 a 80 % a las cuatro semanas de seguimiento). A pesar de que los fármacos orales son más convenientes se han asociado con mayor número de efectos adversos en comparación con los de administración vaginal.15
Clotrimazol
El clotrimazol es un azol, pertenece al grupo de antifúngicos, el cual altera la permeabilidad de la membrana celular del hongo al parecer por la unión con fosfolípidos.16 Los azoles tópicos han reemplazado casi por completo a la nistatina por su actividad en contra de Candida albicans.7,17 Tras su administración tópica parece ser mínimamente obsorbido.18 En México, se han realizado estudios que evalúan la eficacia de la combinación de distintos agentes antibióticos y antifúngicos para el manejo de cervicovaginitis.19 Sin embargo, no existe ninguna publicación con la combinación de fosfato de clindamicina y clotrimazol, por lo que en el presente estudio evaluamos la eficacia y seguridad de la crema vaginal de fosfato de clindamicina 2 g más clotrimazol 1 g, durante tres días consecutivos en el tratamiento de cervicovaginitis.
Material y método
Estudio clínico fase II, realizado en la Unidad de Investigación Médica del Instituto de Investigación Clínica de Occidente en colaboración con el Centro Universitario de Ciencias de la Salud de la Universidad de Guadalajara. El estudio se llevó a cabo en 30 pacientes mexicanas de 18 a 45 años de edad con diagnóstico de cervicovaginitis por clínica y corroborado por estudios microbiológicos. No se incluyeron: pacientes con prueba de embarazo positiva, bajo tratamiento para CV al momento de la inclusión o un mes previo, perimenopausia o menopausia, tratamiento hormonal, diabetes mellitus tipo 2, enfermedad hepática o renal, VIH, Chlamydia, hipersensibilidad o alergia a los componentes de la crema vaginal o con citología vaginal con datos sugestivos de malignidad.
Posterior a la firma del consentimiento informado se realizó historia clínica completa en la que se profundizó en los antecedentes gineco–obstétricos, anamnesis de la cervicovaginitis y manejo hasta ese momento; así mismo, se realizó exploración ginecológica instrumentada en la que se tomaron muestras basales para los estudios microbiológicos y citológicos; se pidió una muestra de orina para detección de fracción β.
A cada paciente se le proporcionó tratamiento completo, el cual constó de un tubo con 20 g de crema vaginal Co–Tenescan® (fosfato de clindamicina 2 g más clotrimazol 1 g) y tres aplicadores. Se les explicó que la administración tenía que ser por la noche antes de acostarse durante tres noches consecutivas y regresar el envase en su próxima visita. Las pacientes acudieron a su visita final 10 días posteriores al inicio del tratamiento. Se solicitó que se abstuvieran de tener relaciones sexuales y usar productos para higiene vaginal durante el tiempo que duró el estudio.
En la visita final se evaluó la mejoría de los síntomas, actividad sexual, medicamentos concomitantes, dificultades o bondades de la aplicación del fármaco y eventos adversos de acuerdo a la NOM–220–SSA1–2002 y el algoritmo de Naranjo.20,21 Posteriormente, se realizó exploración vaginal y toma de muestras finales para estudios microbiológicos.
Las pruebas que se realizaron fueron: microscopía en fresco con la técnica de contraste de fases con objetivo 40X para la observación del número de células epiteliales, leucocitos, eritrocitos por campo, bacterias, células clave, Trichomonas vaginalis y/o levaduras; tinción de Gram y observación en microscopía de campo claro para registrar la forma y tipo de las bacterias, así como la presencia de morfotipos bacterianos y evaluación mediante los criterios de Nugent;22 la identificación de G. vaginalis se realizó mediante tinción de Gram, considerándose positiva cuando se observaron mayor o igual a 20% de células clave. Se realizaron cultivos en agar Sabouraud para el aislamiento de levaduras; la identificación de especie se realizó mediante la evaluación de su capacidad para formar tubo germinativo (o pseudohifas) y auxonograma utilizando el sistema de identificación manual API 20C AUX (bioMérieux).
El tamaño de muestra se calculó con la fórmula para ensayos clínicos;23 con un nivel de significancia del 0.05, poder estadístico del 80%, valor de hipótesis nula de 0.6224 y alterna de 0.83, lo que dio por resultado 29 pacientes.
Los datos de respuesta fueron evaluados como provenientes de una distribución normal. Las variables cualitativas fueron transformadas al porcentaje de respuesta y fueron evaluadas antes y después del tratamiento, comparadas por medio de pruebas Chi2; se consideró que hubo diferencias significativas cuando p fue menor a 0.05.
Este protocolo se apegó a la Declaración de Helsinki, las guías de la Conferencia Internacional sobre Armonización de Requisitos Técnicos para el Registro de Productos Farmacéuticos para Uso Humano, a las Buenas Prácticas Clínicas y a la Ley General de Salud en Materia de Investigación en el apartado de los Aspectos Éticos de la Investigación en Seres Humanos.25,26 El estudio fue aprobado por el Comité Mixto de Investigación y Bioética del Instituto de Investigación Clínica de Occidente. Previo a su inclusión, todas las pacientes firmaron el consentimiento informado.
Resultados
S e evaluaron 41 pacientes con diagnóstico clínico de cervicovaginitis de las cuales solo en 30 se corroboró por microbiología. El promedio de edad fue 28.3 ± 6.5 años. En cuanto a la ocupación se observó que 40% (n=12) eran empleadas.
Cinco pacientes tuvieron un episodio previo de cervicovaginitis. El inicio de la vida sexual activa fue a los 17.7 ± 2.3 años con 2.7 ± 1.7 parejas sexuales promedio. El 77% (n=20) habían tenido al menos un embarazo. Los métodos de planificación familiar usados se describen en la Tabla 1.

En la exploración ginecológica se registró la presencia de flujo vaginal, características del mismo (cantidad, consistencia, color y olor), estado del cérvix (congestión y puntilleo) y determinación del pH, tanto en la visita basal como en la final (Tabla 2).

De las 30 pacientes en el estudio sólo 18 manifestaron prurito. Este síntoma se quitó por completo tras la administración del medicamento en el 50% (n=9) y el 50% (n=9) restante refirió mejoría.
Los microorganismos que se identificaron con mayor frecuencia fueron: Gardnerella vaginalis, Candida y Trichomonas vaginalis (Tabla 3). Con la tinción de Gram se realizó la valoración de los morfotipos para diagnóstico de VB y estimación de los criterios de Nugent en 28 de las 30 pacientes (Tabla 4). Con los datos que se obtuvieron de la exploración vaginal, la tinción de Gram y el pH se calcularon los criterios de Amsel27 para el diagnóstico de VB (Tabla 5).
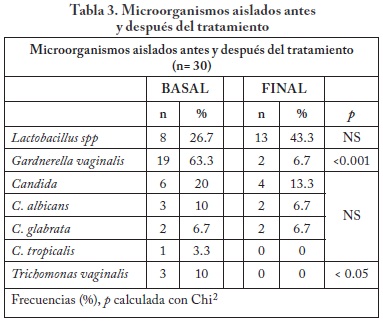


El porcentaje de curación que se alcanzó fue 86.7%, para VB (3 de 4 criterios de Amsel), 33.3% para CV y 100% tricomoniasis. La seguridad fue evaluada mediante el monitoreo de eventos adversos. Se reportaron un total de 22 en 43% (n=13) de las pacientes, todos ellos de intensidad leve (Tabla 6).

Discusión
La combinación de agentes farmacológicos con distintos mecanismos de acción repercute positivamente en la recuperación de mujeres con cervicovaginitis.28,29,30 El porcentaje de curación que se alcanzó para VB en este estudio con la crema de fosfato de clindamicina y clotrimazol fue similar al reportado por otros autores que usaron exclusivamente clindamicina.13,24,31
A pesar de que existen reportes del desarrollo de vaginitis fúngica secundaria con el uso de antibióticos orales o vaginales, es importante resaltar que ninguna de las pacientes con VB desarrolló secundariamente candidiasis, debido probablemente al uso de clotrimazol.
Por otro lado, la tasa de cultivos negativos para CV posterior al tratamiento fue baja. Dos de las especies aisladas (C. glabrata y C. tropicalis) tienen reportes previos de resistencia a imidazoles como el clotrimazol, lo cual pudiera explicar su persistencia a pesar del tratamiento.32,33
Dentro del estudio se diagnosticaron tres pacientes con Trichomonas vaginalis, mismas que después de recibir el tratamiento mostraron remisión; sin embargo, los fármacos del estudio no son de primera línea en el tratamiento de esta parasitosis. Existen antecedentes de la actividad tricomonicida del clotrimazol en los casos resistentes a metronidazol, no obstante, se requieren futuros estudios para recomendar su uso.34,35
La tasa de eventos adversos con el uso de agentes tópicos en el tratamiento de trastornos vaginales no complicados es baja.36 En cuanto a la presencia de poliuria transitoria esta ya se había descrito también con la combinación de ketoconazol/ clindamicina.19 Los demás eventos adversos que se presentaron, fueron similares a los que se han reportado con los componentes de la crema por separado.37,38
Conclusiones
Con los resultados obtenidos en este estudio podemos concluir que la crema vaginal Co–Tenescan® (fosfato de clindamicina 2 g más clotrimazol 1 g) es eficaz en el tratamiento de cervicovaginitis por Gardenerella vaginalis y evita la candidiasis secundaria con un mínimo de reacciones adversas.
Agradecimientos
Agradecemos a Productos Maver, S.A. de C.V por su apoyo en la realización de este estudio. Dra. Elisa María Vázquez Rochín y Dr. Manuel Alejandro Saucedo Rodríguez.
Referencias
1. Martínez–Ojeda M, Saldaña–González J, Sánchez–Hernández M. Criterios para el diagnóstico de cervicovaginitis aplicados en el primer nivel de atención. Correlación con la norma oficial mexicana. Rev Med Inst Mex Seguro Soc. 2007;45(3):249–254. [ Links ]
2. Guía de Práctica Clínica. Diagnóstico y Tratamiento de la Vaginitis Infecciosa en Mujeres en edad reproductiva, en el primer nivel de atención. México: Secretaria de Salud 2008. [ Links ]
3. CDC 2006. Sexually transmitted diseases. Treatment Guidelines. Atlanta, GA: US Department. MMWR. 2006;55(RR–11):1–94. [ Links ]
4. Pavletic A, Hawes S, Geske J, Bringe K y Polack S. Experience with routine vaginal pH testing in a family practice setting. Infect Dis Obstet Gynecol. 2004;12:63–68. [ Links ]
5. Guía de Práctica Clínica. Guía de Referencia Rápida. Diagnóstico y Tratamiento de la Vaginitis Infecciosa en Mujeres en edad reproductiva, en el primer nivel de atención. México: Secretaria de Salud 2008. [ Links ]
6. Myer L, Denny L, Telerant R, Souza M, Wright TC Jr, Kuhn L. Bacterial vaginosis and susceptibility to HIV infection in South African women: a nested case–control study. J Infect Dis. 2005;192(8):1372. [ Links ]
7. Frey B. Antimicrobial topical agents used in the vagina. Curr Probl Dermatol. Basel, Karger. 2011;40:36–47. [ Links ]
8. Donders G, Bellen G, Ausma J, Verguts L, Vaneldere J, Hinoul P, Borgers M, Janssens D. The effect of antifungal treatment on the vaginal flora of women with vulvo–vaginal yeast infection with or without bacterial vaginosis. Eur J Clin Microbiol Infect Dis. 2011;30(1):59–63. [ Links ]
9. Villagrana–Zesati R, Reyna–Figueroa J y Ortiz–Ibarra J. Short–term therapy for mixed vaginal infections. Int J Gynaecol Obstet. 2006; 92:149–150. [ Links ]
10. Sweetman SC. Clindamicina. En: Martindale. Guía completa de consulta farmacoterapéutica. 2a ed. Barcelona, Pharma Editores; 2006:299–301. [ Links ]
11. Livengood CH 3rd, Thomason JL, Hill GB. Bacterial vaginosis: treatment with topical intravaginal clindamycin phosphate. Obstet Gynecol. 1990;76(1):118. [ Links ]
12. Joesoef MR, Schmid GP, Hillier SL. Bacterial vaginosis: review of treatment options and potential clinical indications for therapy. Clin Infect Dis. 1999;28(Suppl 1):S57. [ Links ]
13. Faro S, y Campbell K. The efficacy and safety of a single dose of Clindesse vaginal cream versus a seven–dose regimen of Cleocin vaginal cream in patients with bacterial vaginosis. Infect Dis Obstet Gynecol. 2005;13(3):155–160. [ Links ]
14. Ahmed–Jushuf IH, Shahmanesh M, Arya OP. The treatment of bacterial vaginosis with a 3 day course of 2% clindamycin cream: results of a multicenter, double blind, placebo controlled trial. B V Investigators Group. Genitourin Med. 1995;71(4):254. [ Links ]
15. Oduyebo OO, Anorlu RI, Ogunsola FT. The effects of antimicrobial therapy on bacterial vaginosis in non–pregnant women. Cochrane Database Syst Rev. 2009. [ Links ]
16. Brunton L. Inhibidores de la síntesis de proteína y antibacterianos diversos. En: Goodman Gilman. Manual de farmacología y terapéutica. 1a ed. México. MacGraw–Hill Interamericana Editores; 2009:777–778. [ Links ]
17. Neves J, Pinto E, Teixeira B, Dias G, Rocha P, Cunha T, Santos B, Amaral M y Bahia M. Local treatment of vulvovaginal candidosis. General and practical considerations. Drugs. 2008;68(13):1787–1802. [ Links ]
18. Sweetman SC. Clotrimazol. En: Martindale. Guía completa de consulta fármaco–terapéutica. 2a ed. Barcelona. Pharma Editores;2006:574. [ Links ]
19. Gómez–Bravo E y Garibay–Valencia M. Evaluación de la eficacia de la combinación de ketoconazol/clindamicina comparada con metronidazol/nistatina en vaginitis candidiásica y vaginosis bacteriana. Ginecol Obstet Mex. 2004;72:575–580. [ Links ]
20. NORMA Oficial Mexicana NOM–220–SSA1–2002, Instalación y operación de la farmacovigilancia. http://www.salud.gob.mx/unidades/cdi/nom/220ssa102.html. Acceso 7 Abril 2011. [ Links ]
21. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, Janecek E, Domecq C, Greenblatt DJ. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30:239–245. [ Links ]
22. Nugent RP, Krohn MA y Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method ofgram stain interpretation. J Clin Microbiol. 1991;29(2):297–301. [ Links ]
23. Dennis–Verano RJ y Pérez–Medina A. Cálculo del tamaño muestral. En: Álvaro–Ruíz M y Morillo Z. Epidemiología Clínica. Investigación clínica aplicada. 1a ed. Colombia. Editorial Médica Panamericana; 2004:154–159. [ Links ]
24. Sobel J, Peipert J, McGregor J, Livengood C, Martin M, Robbins J y Wajszczuk C. Efficacy of clindamycin vaginal ovule (3–day treatment) vs. clindamycin vaginal cream (7–day treatment) in bacterial vaginosis. Infect Dis Obstet Gynecol. 2001;9:9–15. [ Links ]
25. ICH Guidelines. ICH Secretariat Switzerland. http://www.ich.org. Acceso 22 Enero 2010. [ Links ]
26. Ley General de Salud. Ultimas reformas publicadas en el Diario Oficial de la Federación. http://www.diputados.gob.mx/LeyesBiblio/pdf. Acceso 27 Abril 2010. [ Links ]
27. Amsel R, Totten PA, Spiegel CA, et al. Nonespecific vaginitis. Diagnostic criteria and microbian and epidemiologic associations. Am J Med 1983;74:14–22. [ Links ]
28. Bornstein J y Zarfati. A universal combination treatment for vaginitis. Obstet Gynecol Surv. 2008;63(9):570–571. [ Links ]
29. Mendling W, Kraussn C y Flaudung B. A clinical multicenter study comparing efficacy and tolerability of topical combination therapy with clotrimazole (Canesten®, two formats) with oral single dose fluconazole (Diflucan®) in vulvovaginal mycoses. Mycoses. 2004;47:136–142. [ Links ]
30. Sharma J, Mittal S, Raina y Chanana. Comparative efficacy of two regimens in syndromeic management of genital infections. Arch Gynecol Obstet. 2006;273:232–235. [ Links ]
31. National Guideline for the Management of Bacterial Vaginosis 2006. Clinical Effectiviness Group. British Association for Sexual Health and HIV. [ Links ]
32. Ogunshe AA, Adepoju AA, Oladimeji ME. Clinical efficacy and health implications of inconsistency in different production batches of antimycotic drugs in a developing country. J Pharm Bioallied Sci. 2011;3(1):158–164. [ Links ]
33. Chong PP, Abdul Hadi SR, Lee YL, Phan CL, Tan BC, Ng KP, Seow HF. Genotyping and drug resistance profile of Candida spp. in recurrent and one–off vaginitis, and high association of non–albicans species with non–pregnant status. Infect Genet Evol. 2007;7(4):449–456. [ Links ]
34. Mammen–Tobin A y Wilson JD. Management of metronidazole –resistant Trichomonas vaginalis– a new approach. Int J STD AIDS. 2005;16(7):488–490. [ Links ]
35. Aggarwal A y Shier RM. Recalcitrant Trichomonas vaginalis infections successfully treated with vaginal acidification. J Obstet Gynaecol Can 2008. 30(1):55–58. [ Links ]
36. Hope KH. Current evaluation and management of vulvovaginitis. Clinical Obstetrics and Gynecology 1999;42(2):184–195. [ Links ]
37. Ries AJ. Treatment of vaginal infections: Candidiasis, bacterial vaginosis, and trichomoniasis. J American Pharmaceutical Association 1997:563–569. [ Links ]
38. Dhar J, Arya O, Timmins DJ, Moss S, Mukembo S, Alawattegama A y Williams O. Treatment of bacterial vaginosis with a three–day course of 2g clindamycin vaginal cream: a pilot study. Genitourin Med. 1994;70:121–123. [ Links ]














